有机化学_第7章_自由基反应汇总
了解有机化学中的自由基聚合反应反应机制和应用

了解有机化学中的自由基聚合反应反应机制和应用自由基聚合反应是有机化学中非常重要的一种反应类型,它在合成高分子材料、制备聚合物以及药物研发等领域都具有广泛的应用。
本文将深入探讨自由基聚合反应的机理和应用。
一、自由基聚合反应的机制自由基聚合反应是一种通过自由基的自由基反应形成聚合物链的过程。
该反应包括三个关键步骤:起始、传递和终止。
1. 起始自由基聚合反应的起始是通过引入一种起始剂,使之发生自由基解离,生成两个自由基。
常用的起始剂有过氧化物、硝酸酯和过氧硫酸铵等。
起始剂的解离会产生两个自由基,从而引发聚合链的生成。
2. 传递传递是自由基聚合反应的核心步骤,主要是自由基与单体分子之间的反应。
在传递过程中,自由基会与单体发生加成反应,生成一个新的自由基和一个共价键。
新生成的自由基会继续参与到传递反应中,进一步延长聚合链。
3. 终止自由基聚合反应的终止过程会导致聚合链的停止,从而形成聚合物。
终止反应可以分为两种类型:链传递终止和自由基自身的消失。
链传递终止是指两个自由基之间的反应,例如两个聚合链相遇并发生反应。
自由基自身的消失则是指自由基与其他物质发生反应或自由基的自发消失。
二、自由基聚合反应的应用自由基聚合反应的机理和特点使其在许多领域中得到广泛应用。
1. 聚合物合成自由基聚合反应是合成聚合物的主要方法之一。
通过选择不同的单体和起始剂,可以合成出具有不同结构和性能的聚合物。
聚合物的种类包括聚乙烯、聚苯乙烯、聚丙烯等广泛应用的工程塑料。
2. 化学药品合成自由基聚合反应在药物合成过程中也起到重要作用。
许多药物合成的关键步骤利用了自由基聚合反应的特点,通过选择不同的单体和反应条件,实现对目标化合物的构建。
3. 材料科学自由基聚合反应在材料科学领域有丰富的应用。
通过控制反应条件和单体的选择,可以制备出具有特定结构和性能的高分子材料,如塑料、橡胶和纤维。
4. 生物医学工程自由基聚合反应在生物医学工程领域中也得到广泛应用。
有机化学基础知识点整理有机分子的自由基反应与机制

有机化学基础知识点整理有机分子的自由基反应与机制有机化学基础知识点整理—有机分子的自由基反应与机制自由基反应是有机化学中一类重要的反应类型,它涉及到自由基的产生、转化以及参与反应。
自由基反应对于有机合成、药物合成等领域具有重要的意义。
本文将整理和探讨一些有机分子的自由基反应与机制的基础知识点。
一、自由基的生成自由基是指电子个数不满足八个原子或离子,具有自由不稳定电子的中间体。
有机分子中的自由基通常是通过化学反应或者一些物理条件来生成的。
1. 光照作用在光照作用下,许多有机分子可以发生光解反应,生成自由基。
例如,溴化物可以在紫外光照射下发生光解反应,产生溴自由基。
2. 热解反应一些有机化合物在高温下也能发生热解反应,产生自由基。
例如,过氧化氢在高温下分解为氧气和氢自由基。
3. 氧化反应有些有机分子在氧化反应中会产生自由基。
例如,过氧化苯甲酸通过氧化过程生成苯甲酸自由基。
二、自由基的反应类型自由基反应可以分为三个主要类型:取代反应、消除反应和加成反应。
1. 取代反应取代反应是指一个原子或者一个基团替换掉有机分子中的一个原子或者一个基团的反应。
常见的取代反应包括氢原子的取代、卤原子的取代等。
2. 消除反应消除反应是指在有机分子中两个相邻的原子或者两个相邻的基团发生脱离的反应。
通常会生成一个双键和一个小分子(如水、氨等)。
3. 加成反应加成反应是指两个分子中的原子或者基团结合成为一个分子的反应。
例如,烯烃与自由基结合形成新的化合物。
三、自由基反应的机制自由基反应的机制可以分为三个步骤:自由基的生成、反应过程和产物生成。
1. 自由基的生成自由基的生成通常通过断裂化学键或者电子转移来实现。
在断裂化学键的反应中,一个化学键被打断,生成两个自由基;而在电子转移的反应中,一个原子或者一个基团上的一个电子被转移到另一个原子或者另一个基团上。
2. 反应过程自由基反应的反应过程一般包括自由基的引发、传递和终止三个阶段。
自由基反应机理

自由基反应机理引言自由基反应是有机化学中一种重要的反应类型,自由基可以通过化学键的断裂来生成,并且具有高度的活性。
自由基反应机理复杂多样,涉及多种反应类型和步骤。
本文将对自由基反应机理进行全面深入的探讨。
自由基的生成自由基是有一个未成对电子的化学物质,具有独立的存在能力。
自由基可以通过多种途径生成,包括光解反应、热解反应、电离反应等。
其中,光解反应是最常见的一种方法。
在光解反应中,有机物分子受到光的激发,键断裂形成自由基。
自由基反应的特点自由基反应具有以下特点:1.高反应活性:自由基具有未成对电子,具有较高的反应活性,可以与其他分子迅速发生反应。
2.反应选择性:自由基反应在分子的特定位置发生,可以选择性地引发特定的反应。
3.自由基链反应:自由基反应通常是自由基链反应,包括起始步骤、传递步骤和终止步骤三个阶段。
4.反应速度受控:自由基反应的速率受到反应物的浓度、温度和反应物排列的影响。
自由基反应的机理自由基反应的机理可以分为以下几个步骤:1.起始步骤:自由基反应的起始步骤通常涉及光解反应或热解反应,生成自由基。
例如,在溴乙烷中,可以通过热解反应生成溴自由基。
2.传递步骤:自由基与其他分子发生反应,将自由基的反应活性传递给其他分子。
这个步骤会反复进行,形成自由基链反应。
例如,溴自由基可以与甲烷反应生成甲基自由基和溴化氢。
3.终止步骤:自由基反应的终止步骤是指自由基链反应中的自由基被消耗完的过程。
通常是两个自由基相遇并结合形成稳定的产物。
自由基反应的应用自由基反应在有机化学合成中有广泛的应用。
以下是几个典型的例子:1.自由基取代反应:通过引入自由基取代剂,可以使有机物中的氢原子被取代为其他基团,从而实现有机合成的目的。
2.氧化反应:自由基反应可以用于氧化反应,例如将醇氧化为酮或醛的反应。
3.重排反应:自由基重排反应是一种重要的有机反应类型,可以产生不同的结构异构体。
4.光化学反应:自由基反应在光化学反应中起着重要的作用,例如光合作用中的光解反应。
有机合成中常见的自由基反应
有机合成中常见的自由基反应
旧文重发,温故知新
具有未成对电子的原子或分子被称为自由基,大多数自由基是活泼的反应中间体,不能稳定存在,但也存在着某些稳定的自由基,如O2分子。
自由基反应机理包括三步:引发、传递和终止。
自由基反应的速率取决于自由基浓度,而自由基浓度主要取决于引发剂的浓度,在动力学上为一级半反应。
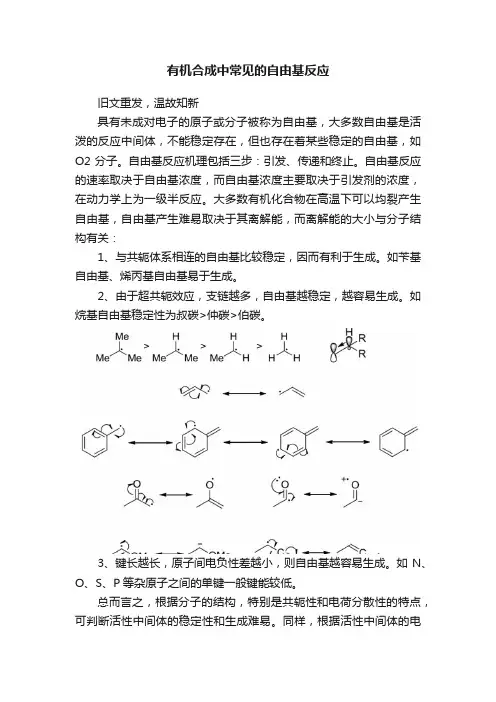
大多数有机化合物在高温下可以均裂产生自由基,自由基产生难易取决于其离解能,而离解能的大小与分子结构有关:
1、与共轭体系相连的自由基比较稳定,因而有利于生成。
如苄基自由基、烯丙基自由基易于生成。
2、由于超共轭效应,支链越多,自由基越稳定,越容易生成。
如烷基自由基稳定性为叔碳>仲碳>伯碳。
3、键长越长,原子间电负性差越小,则自由基越容易生成。
如N、O、S、P等杂原子之间的单键一般键能较低。
总而言之,根据分子的结构,特别是共轭性和电荷分散性的特点,可判断活性中间体的稳定性和生成难易。
同样,根据活性中间体的电
荷分布状态可判断其不同机理的化学反应活性。
第七章自由基与光化学反应总结

共价键异裂时,一对电子保留给其中的一个原子 分别形成一个正离子和一个负离子,这种断裂方 式称为异裂(Heterolytic Cleavage)。
自由基的发现: 实验一、
自由基的产生举例:
1、热均裂反应(热解)
热诱导共价键发生均裂 1)二烷基过氧化物
CH3
H3C C CH3 O O CH3 C CH3 CH3 CH3 2 H3C
S0,放热,系内转化(IC),或发出荧光; T1,系间窜跃(ISC); S0,或发生化学反应,或在反应前发出磷光。
T1相对较稳定,多数光化学反应通过三线态进行。
能量的转移
激发态分子能量失活可以在分子内,也可以在分子间。
hv D (S0)
D (T1)
D (T1) + A (S0)
D (S0)
+ A (T1)
对于给定的烯,多卤代烷活性次序:
CBr4 > CBrCl3 > CCl4>CH2Cl2>CH3Cl
3)醛醇等对烯烃的加成
醛羰基上的氢在自由基进攻下被夺去形成酰基自由基, 与烯烃加成生成酮。
醇的α -H易被自由基夺取形成RCHOH自由基,反应得 到链增长的的醇。
3、分子内自由基反应
1)分子内取代
0
ψ1S1ψ2
(S0
S1)
电子状态多重性M=2[(+1/2)+(-1/2)]+1=1
三线态激发态:ψ1ψ2 对乙烯,ψ1 对苯,ψ3
(1) S1 (2) S1 (3) T1
ψ1ψ2 (S1
T1)
电子状态多重性M=2[(+1/2)+(+1/2)]+1=3
ψ2 ,吸收200nm光,π π* ψ4 ,吸收250-280nm光,π π*
有机化学中的自由基反应反应机制和应用

有机化学中的自由基反应反应机制和应用自由基反应是有机化学中一类重要而特殊的反应类型。
自由基反应的反应机制与传统的架构力学反应机制不同,其具有独特的特点和应用价值。
本文将就有机化学中的自由基反应的基本概念、反应机制以及应用进行探讨。
一、自由基的概念在有机化学中,自由基是指具有不成对电子的分子或离子。
自由基由于电子不成对的存在,其具有较高的化学活性。
自由基的形成有多种途径,比如热解、辐射和化学反应等。
二、自由基反应的基本特点自由基反应具有以下几个基本特点:1. 引发链反应:自由基反应往往会引发连锁反应,其中自由基的生成与消耗是连续进行的。
这种链反应能够加速反应速率,使得反应能在较低的温度和压力条件下进行。
2. 对副反应选择性低:自由基对反应物的选择性较低,容易与不同的反应物发生反应。
这种选择性低的特点使得自由基反应具有较高的官能团多样性,为有机合成提供了更多的可能性。
3. 环境影响:自由基反应对环境的影响较大,容易出现副反应及生成有毒废物。
因此,在实际应用中,需要注意对自由基反应的控制和选择合适的条件。
三、自由基反应的反应机制自由基反应的反应机制可以分为以下几个步骤:1. 自由基的生成:一般情况下,自由基的生成是通过光解、热解或者化学反应等途径实现的。
这些过程会打断键合,使得电子成为自由态,形成具有不成对电子的自由基。
2. 传递和扩散:自由基会通过传递和扩散的方式影响周围的分子,从而引发连锁反应。
传递和扩散是自由基反应中的关键步骤,直接影响着反应速率和产物生成情况。
3. 反应的链终止:自由基链反应在一定的条件下会终止,这可能是由于两个自由基的结合或者由于其他反应的竞争导致。
终止步骤的选择性影响着反应的效果和产物的选择。
四、自由基反应的应用自由基反应在有机合成领域具有广泛的应用价值,主要体现在以下几个方面:1. 引发反应的起始剂:自由基可以作为引发剂来引发一系列的有机反应,如聚合反应、氧化反应和取代反应等。
高等有机化学 第7章_分子重排反应
CH2 N(CH3)2 H CH2
CH3 CH2N(CH3)2
CH2 S CH3 CH3
+
NaOH H2O
CH2 S+CH3 CH2
CH2 H CH2 SCH3
CH2 CH2 SCH3
(4)魏悌息(Wittig)重排
PhCH2 O
CH3
PhLi PhCH CH 3 + H O
H+ O PhCH CH3 OH
C2H5 ONH3
CH3
-卤代酮在碱 作用下加热的 重排反应
=O
C NH2
=O
C
重排机理
=O
C2H5O(CH3)2C Br
从哪一侧打开环,取决于开环 后所生成的负碳离子的稳定性
=O
CH3 C CH2
-
(CH3 )2C Br
C
CH3 CH3
=O
RO-
SN2 O- RO CH3 CH3 CH3 CH3 CH3 C CH3 C CH2CH3
CH3 C6H5
酮肟
C N
OH
反式迁移
H+ CH3 C C6H5 N O+H2 -H2O C6H5 CH3 C NH C6H5 CH3 C N +
CH3 C + N
C6H5
CH3 H2O C OH N
C6H5
◆ 重排范围:酮肟 ◆ 催化剂:浓硫酸、五氯化磷(脱去水,形成正N中心) ◆ 重排立体化学:和羟基处于反式的基团进行迁移 ◆合成上应用:合成取代酰胺。例合成已内酰胺(尼龙-66 中间体)。
3. 频哪醇重排
CH3 CH3 CH3 C OH CH-CH3 OH
H +
有机化学_第7章_自由基反应
2015-6-1
9
2015-6-1
10
CH2 > CH2
苯甲基自由基
CHCH2 > (CH3)3C > (CH3)2CH
三级丁基自由基 异丙基自由基
烯丙基自由基
> CH3CH2 > CH3
乙基自由基
2015-6-1
>
苯基自由基
11
甲基自由基
Question: List in order of decreasing stability all of radicals that can be obtained by abstraction of a hydrogen atom from 2-methylbutane.
2015-6-1
29
Chain Initiation
R O O R 2R O
△
2R O R OH Br
CH3CHCH2 Br CH3CHCH2 ① ②
HBr
Br Chain Propagation:
CH2=CH CH3
Br CH3CHCH2 Br HBr CH3CH2CH2Br Br
Chain Termination:
2015-6-1
20
5.4.2 甲烷的卤化
X
+ CH3-H 439.3
CH3 + H-X H /(kJmol-1) 568.2 -128.9
Ea/(kJmol-1)
F
+4.2
Cl
Br I
431.8
366.1 298.3
+7.5
+73.2 +141
+16.7
+75.3 > +141
有机化学第7章课后习题答案
第7章习题答案章习题答案(1)(3)(5)(7)(9)(11)OH CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2Mg BrI O C 2H 5CH 3CH 2C H CH 2D NHCH 3CN CH 3CH 3CH 2CH 2CH 2CCCH 3(2)(4)(6)(8)(10)(12)CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2CH 3CH 2CH 2CH 2+ AgBrCH 3(CH 2)3ONO 2+ AgBrCH 3(CH 2)3OOCCH 31.2. 两组化合物的排列顺序为:两组化合物的排列顺序为:(a )按亲核取代反应的难易次序排列:(1)C >B >A (2)B >C >A (b )按与AgNO 3(醇溶液中)反应的活性顺序排列:(1)C >B >A (2)B >C >A (c )按亲电加成难易次序排列(1)B >C > A, 亲电取代的难易次序排列:(2)C >B > A 3. (1) CH 3Br 和C 2H 5Br 是伯卤代烷,进行碱性水解按S N 2机理进行。
增加水的含量,可使溶剂的极性增大,不利于S N 2;(CH 3)3CCl 是叔卤代烷,水解按S N 1机理进行。
增加水的含量,使溶剂的极性增大,有利于S N 1。
(2)(CH 3)3CCH 2X 在进行S N 1反应时,C-X 键断裂得到不稳定的1º1ºC C +,所以S N 1反应速度很慢;(CH 3)3CCH 2X 在进行S N 2反应时,α-C 上有空间障碍特别大的叔丁基,不利于亲核试剂从背面进攻α-C ,所以S N 2速度也很慢。
度也很慢。
(3) 在浓的乙醇钠的乙醇溶液中,反应均按S N 2机理进行,无C +,无重排;,无重排; 在乙醇溶液中加热,反应是按照S N 1机理进行的,有C +,有重排:,有重排:CH 3CHCH=CH 2ClCH 3CHCH=CH 2CH 3CH=CHCH 2- Cl -(4) 亲核性:(B )>)>(C) > (A) 原因:三种亲核试剂的中心原子均是氧,故其亲核性顺序与碱性一致。
自由基反应
O C6H5 + O NBr
CCl4
O NC6H5 + Br O
光引发
O NBr CCl 4
O N O
HBr + C6H5CH2 CH2 CHCH2
+ Br
链传递
Br +
O
C6H5CH3 CH2 CHCH3
O HBr + O NBr Br2 +
O NH O
Br2 +
C6H5CH2 CH2 CHCH2
Br +
C6H5CH2Br CH2 CHCH2Br
例
O O
CH3CH2CH2CH
C6H5COOCC6H5 CH2 NBS/CCl4
CH3CH2CHCH CH2 + CH3CH2CH CHCH2Br
HBr Br
Br
Br Br2
δ⋅ δ⋅
CH3CH2CHCH CH2
CH3CH2CH CH CH2
二、芳环上的自由基取代反应 例1: Sandmeyer反应 反应
Br HBr
C2H5
CH3 *C CH2 Br Br
CH3 * C C2H5
Br CH2
Br
Br2 Br
DBr
同位素标记 C2H5 构型保持产物
CH3 *C CH2 Br D
4.反应举例 4.反应举例 (1)烷烃卤化 反应试剂:X2,CCl4,NBS, (1)烷烃卤化 反应试剂: , BrOOC(CH3)3,RNHX, R2NX, SO2Cl2, , , Cl3CSO2Cl等。除X2外,其它试剂需用引发剂或 等 紫外光照。试剂不同,反应机理不完全相同。 紫外光照。试剂不同,反应机理不完全相同。 例如: 例如: 链引发 链传递
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
自由基反应 Radical Reactions
2020/8/5
1
5.1 碳自由基的定义和结构
定义:带有孤电子的原子或原子团称为自由基。 碳自由基:含有孤电子碳的体系称为碳自由基。
CH3CH2
一级碳自由基
CH3CHCH3
二级碳自由基
CH3CCH3 CH3
三级碳自由基
2020/8/5
2
自由基的结构特点:有三种可能的结构; (1)刚性角锥体,(2)迅速翻转的角锥体, (3)平面型。如下图:
2020/8/5
12
两点说明
影响自由基稳 定性的因素是很多 的,如: 电子离 域,空间阻碍,螯 合作用和邻位原子 的性质等;
碳自由基的最
外层为七个电子, 反应时总要寻找另 外的电子来达到八 隅体结构,所以是 亲电的。
2020/8/5
13
5.3 自由基反应的共性
定义:由化学键均裂引起的反应称为自由基反应。
共 (1)反应机理包括链引发、链增长、链终止三个阶段。
(2)反应必须在光、热或自由基引发剂的作用下发生。 (3)溶剂的极性、酸或碱催化剂对反应无影响。
性 (4)氧气是游离基反应的抑制剂。
单自由基比双自由基稳定
CH3 + O O
CH3 O O
2020/8/5
双自由基
单自由基
14
5.4 烷烃的卤化
5.4.1 甲烷的氯化 5.4.2 甲烷的卤化 5.4.3 高级烷烃的卤化
3 无取代基的环烷烃的一氯化反应也可以用相应方法制备, C(CH3)4的一氯化反应也能用此方法制备。
2020/8/5
20
5.4.2 甲烷的卤化
•X + CH3-H F 439.3
• CH3 + H-X H /(kJmol-1) 568.2 -128.9
Ea/(kJmol-1)
+4.2
Cl
431.8 +7.5
C
C
C
刚性角锥体
迅速翻转的角锥体
平面型
2020/8/5
3
2020/8/5
4
2020/8/5
5
2020/8/5
6
5.2 键解离能和碳自由基的稳定性 自由基的产生
热均裂产生
O CH3CO
辐射均裂产生
Br
O OCCH3
55 - 85oC
C6H6
O CH3CO
Br
光
25oC
2Br
单电子转移的氧化还原反应产生
2020/8/5
15
5.4.1 甲烷的氯化
取代反应
分子中的原子或基团被 其它原子或基团取代的 反应称为取代反应。
卤代反应
分子中的原子或基团被 卤原子取代的反应称为 卤代反应。
2020/8/5
16
甲烷的氯化
反应式 CH4 + Cl2
hv
CH3Cl + HCl
反应机理(反应过程的详细描述)
链引发 链增长
2020/8/5
9
2020/8/5
10
CH2 > CH2 CHCH2 > (CH3)3C > (CH3)2CH
苯甲基自由基
烯丙基自由基 三级丁基自由基 异丙基自由基
> CH3CH2 > CH3 >
乙基自由基 甲基自由基 苯基自由基
2020/8/5
11
Question: List in order of decreasing stability all of radicals that can be obtained by abstraction of a hydrogen atom from 2-methylbutane.
2020/8/5
H2O2 + Fe2+ RCOO-
-e-
电解
HO• + HO- + Fe3+ RCOO •
7
2020/8/5
8
自由基的稳定性
CH2 CHCH2
H
CH2 CHCH2 H
均裂 H=359.8kJmol-1(87kcalmol-1)
共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
不变
hv Cl2
CH4 + Cl
2Cl
生成
CH3 + HCl
H = 7.5 kJmol-1 Ea= 16.7 kJmol-1
CH3 + Cl2
CH3Cl + Cl
H = -112.9 kJmol-1 Ea= 8.3 kJmol-1
链终止 Cl + Cl
Cl2
消失
CH3 + CH3
Cl + CH3
H3CCH3
氯化 ν : 1oH ν :2oνH = 13oH : 4 : 5.3
烷烃氯化反应的选择性
2020/8/5
22
烷烃溴化反应的选择性
CH3CH2CH3 + Br2
127oC 光照
CH3CH2CH2Br + CH3CHBrCH3
2020/8/5
21
5.4.3 高级烷烃的卤化
CH3CH2CH2CH3 + Cl2
35oC 光照
(CH3)3CH + Cl2
35oC 光照
CH3CH2CH2CH2Cl + CH3CH2CHClCH3
28 %
72 %
(CH3)2CHCH2Cl + (CH3)3CCl
63 %
37 %
ν 1oH : ν 2oH = 28/6 : 72/4 = 1 : 4 ν 1oH: ν =3oH63/9 : 37/1 = 1 : 5.3
+16.7
Br
366.1 +73.2
+75.3
I
298.3 +141
> +141
总反应热/(kJmol-1): F(-426.8) Cl(-104.6) Br(-30.96) I(53.97)
1. 氟化反应难以控制。 2. 碘化反应一般不用。碘自由基是不活泼的自由基。 3. 氯化和溴化反应常用,氯化比溴化反应快5万倍。
推论:3oH最易被取代,2oH次之,1oH最难被取代。
2020/8/5
19
甲烷氯化反应的适用范围CH4ຫໍສະໝຸດ Cl2 300-400OC
or光照
CH3Cl +
HCl
Cl2 光照
CH2Cl2 +
HCl
Cl2 光照
CHCl3
+ HCl
Cl2 光照
CCl4 +
HCl
1 该反应只适宜工业生产而不适宜实验室制备。
2 该反应可以用来制备一氯甲烷或四氯化碳,不适宜制备二氯甲烷 和三氯甲烷。
H3CCl
2020/8/5
17
势能 /(kJ mol-1)
Cl
H
CH3
H3C
Cl
Cl
+16.7
Ea1
Ea2
+8.3
CH4 + Cl
CH3 + HCl
Cl2
+7.5
112.9 105.4
CH3Cl + Cl
O 2020/8/5
反应进程
18
甲烷氯化反应势能图的分析
1 第一步反应的活化能比较大,是速控步骤。 2 第二步反应利于平衡的移动。 3 反应 1 吸热,反应 2 放热,总反应放热,所以反应只需开始时供热。 4 过渡态的结构与中间体(中间体是自由基)相似,所以过渡态的稳定 性顺序与自由基稳定性顺序一致。
