有机化学 第十三章
有机化学-第13章_糖类

糖 类
Carbohydrates
一个羰基共多羟, 古误碳水今为糖。 单糖缩聚糖苷键, 植物动物贮能量。
本章学习要求
1. 了解糖的来源和糖的分类;
2. 掌握单糖、二糖及多糖的结构和性质,
3. 掌握单糖的开链式、氧环式和Haworth
式的画法.
糖的存在、组成与通式
糖类化合物又称碳水化合物,在在自然界 分布最广; 维持生命活动(贮能与其他功能).
xCO 2 + yH 2 O
光
叶绿素
C x (H 2 O) y + xO 2
Cx(H2O)y + xO2
xCO2 + yH2O + 能量
C、H、O组成,通式Cm(H2O)n,
不符合碳水比例的糖:
鼠李糖 C5H12O5(甲基糖);脱氧核糖 C5H10O4
符合碳水比例的非糖:
甲醛(CH2O)、乙酸(C2H4O2)、乳酸(C3H6O3)
答: 1. 是 2. C1-差向异构体 3. 非对映体
三、单糖的物理性质
甜味,无色晶体,易溶于水。
ቤተ መጻሕፍቲ ባይዱ
四、单糖的化学性质
1. 显色反应 2. 异构化作用 3. 氧化反应 4. 还原 5. 成脎反应
1. 显色反应(color-reaction)
莫利施反应: 糖类+-萘酚
浓H2SO4
紫色物质
定性鉴别糖类物质 西列瓦诺夫反应(间苯二酚反应): 酮糖+间苯二酚/浓HCl 区别醛糖和酮糖
D-葡萄糖
D-甘露糖
D-半乳糖
A与B仅C2构型不同为C2差向异构体 A与C仅C4构型不同为C4差向异构体 B与C不属于差向异构体
简写糖分子
①连接氢的短横省略,-OH用短横表示;
有机化学第十三章

(3)单键的裂解 光解或电荷分解NH3或N2H4,也能生成没有取代 的乃春。
13.5 乃春的反应 乃春的反应也和卡宾的相似。乃春很容易发生插 入、加成、重排、氢提取、二聚和歧化反应。 (1)插入反应 乃春,特则是羧酰基乃春和磺酰基乃春,可以插 入C-H和其他的键,例如:
(2)对C=C键的加成 烷基乃春对双键环加成,形成氮杂环丙烷衍生 物。
(d)其它乃春 在-75°C,及四甲基乙烯中,用苯基锂处理氯 胺,确实产生了少量的四甲基氮杂环丙烷。
对甲苯磺酰基叠氮热分解,形成对甲苯磺酰基乃 春。
13.4 乃春的生成 (1)α-消去 例如,用碱处理苯磺酰羟胺,则生成乃春。
(2)叠氮化合物的分解 生成乃春最常用的方法是叠氮化合物的光分解或 热裂解。
(3)重排反应 烷基乃春的重排发生得很快,因而一般不发生上 述两种反应,烷基乃春重排,形成Schiff碱。
芳基乃春高温容易重排。
(4)氢提取 乃春可以从烷烃提取氢原子,形成游离基。
(5)二聚
(6)歧化反应 HN可以歧化,形成热力学稳定的氮乃春(nitrenes),R-N:是卡宾的氮类似物。它非常 活泼,以致在普通条件下是难以离析到的。在4K,在 模床中捕集,曾经离析到过烷基乃春;在77K,曾经 捕集过芳基乃春。HN:的基态是三线态;但是,乃春 也有两种形式单线态和三线态生成。
最简单的乃春是NH,可以把它看成是乃春的母 体,其他乃春则看成是它的衍生物。可用通式R-N表 示,式中的R用来代表H、F,Cl,Br,烷基、芳 基、酰基或磺酰基等。 13.2 乃春的结构 乃春的氮原于只有六个价电子,是缺电子的中性 物种。它与卡宾是等电子的,其结构与卡宾有些类 似。单重态氮烯具有亲电性,而三重态氮烯的行为则 象双自由基。
课件有机化学第13章 取代酸和二羰基化合物

第十三章 取代酸 和β-二羰基化合物Substituted Carboxylic Acids and β-Dicarbonyl Compounds1CONTENT1 2 3 4 5取代酸的酸性(自学) 羟基酸 羰基酸(氧代酸) β-酮酸酯 β-二羰基化合物的反应213.1 取代酸的酸性(自学)• 有利离解出质子的因素使酸性增强 • 不利离解出质子的因素使酸性减弱O吸电子基O给电子基C OC O提高羧酸根阴离子 稳定性的因素降低羧酸根阴离子 稳定性的因素313.2 羟基酸1. 羟基酸的命名和物理性质(自学)许多羟基酸来自于动植物,常用俗名来表示2-羟基丙酸(乳酸)2-羟基丁二酸(苹果酸)413.2 羟基酸2. 羟基酸的制备• 卤代酸水解CH3CH2CHCOOH Br NaOH/H2O H+ CH3CH2CHCOOH OHCH3 CH3C OH CN CH3 CH3C OH COOH• 羟基腈水解CH3COCH3 HCN H• Reformatsky反应O + BrCH2CO2Et Zn Benzene H2O H+ OH CH2CO2H513.2 羟基酸3. 羟基酸的反应• 氧化反应OHCH3CH2COOHTollens 试剂CH3COCOOHCH3COOH• 脱水反应(1) α-羟基酸OH RCHCOOHOO C R CH O CH R O C OC R CH OH O H H O HO CH R C O6(2) β-羟基酸OH RCHCH2CO2H H+ RCH CHCO2H(3) γ-羟基酸OH RCHCH 2CH2CO2H R O O713.3 羰基酸(氧代酸)CH3COCH2COOH 3-氧代丁酸• 酸性大于羧酸 • α或β-酮酸受热易脱羧RCOCH2COOHNa2Cr2O7/H2SO4RCOCH3RCHCH2COOH OH813.4 β -酮酸酯1. β -酮酸酯的形成Claisen 酯缩合:含α−氢的酯在碱(醇钠)的作 用下,两分子酯发生缩合反应,生成 β −羰基酸 酯同时消去一分子醇O 2 CH3COEt 乙酸乙酯 Ethyl acetate EtONa EtOH H2 O H+OOCH3C CHCOEt + EtOH 乙酰乙酸乙酯 Ethyl acetoacetate9反应机理pKa 24.5CH3CO2Et + EtO CH2CO2Et O − CH3 C OEt + CH2CO2Et CH O−−−+ EtOH O C−3OEtCH3 C CH2CO2Et + EtO O O + − Na EtO − CH C CH3 C CH2CO2Et CHCO2Et + EtOH 3pKa ~11CH2CO2EtOH+CH3 C CH2CO2Et10作业•P283: 13.1(1);•P285: 13.2;•P293: 13.5,13.6;•P297: 13.10,13.11;习题•P306: 3,5(1),(2),6。
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
《有机化学》第13章 杂环化合物和生物碱

4-甲基嘧啶
4-甲基噻唑
⑶ 连有取代基的杂环化合物命名时,也可将杂环作为取代基,以侧链为母体来命名。
4-嘧啶磺酸
β-吲哚乙酸(3-吲哚乙酸)
2-苯并咪唑甲酸乙酯
⑷ 为区别杂环化合物的互变异构体,需标明杂环上与杂原子相连的氢原子所在的位 置,并在名称前面加上标位的阿拉伯数字和大写H的斜体字。
2023/6/13
⑴ 卤代反应
在室温条件下,吡咯、呋喃和噻吩能与氯或溴发生激烈反应,得到多卤代物。将反应 物用溶剂稀释并在低温下进行反应时,可以得到一氯代物或一溴代物。碘化反应需要 在催化剂存在下进行。例如:
2023/6/13
6
(2)硝化反应
在低温条件下,吡咯、呋喃和噻吩能与比较缓和的硝化剂硝酸乙酰酯(CH3COONO2) 发生硝化反应,主要生成α-硝基化合物。例如:
3. 颜色反应
生物碱能与一些试剂发生颜色反应,比如钒酸铵的浓硫酸溶液、浓硝酸、浓硫酸、 甲醛、氨水等,利用此性质可鉴别生物碱。比如莨菪碱遇1%钒酸铵的浓硫酸溶液显 红色,可待因遇甲醛-浓硫酸试剂显紫红色等。
二、重要的生物碱 1. 烟碱 又叫尼古丁,主要以苹果酸盐及柠檬酸盐的形式存在于烟草中。其结构式
2023/6/13
13
血红素是卟啉环与Fe2+形成的配合物;叶绿素是卟啉环与Mg2+形成的配合物,它们的 结构式如下:
血红素在体内与蛋白质结合形成血红蛋白,存在于红细胞中,是人和其他哺乳动物 体内运输氧气的物质。叶绿素是植物进行光合作用不可缺少的物质。
2023/6/13
14
二、呋喃衍生物
呋喃甲醛是最常见的呋喃衍生物,又称为糠醛,它是一种无色液体,沸点为161.7℃, 在空气中易氧化变黑,是一种良好的溶剂。 糠醛是合成药物的重要原料,通过硝化可制得一系列呋喃类抗菌药物,如治疗泌尿 系统感染的药物呋喃坦丁、治疗血吸虫病的药物呋喃丙胺等。
有机化学第十三章 羧酸及其衍生物
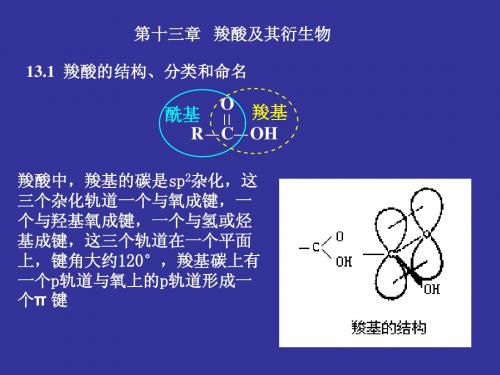
2) 与羰基相连的基团(Y) 空间体积; 3) 与羰基相连的基团(Y)
离去能力; 4) 反应物稳定化程度。
离去基团的离去能力: X- > RCOO- > RO > H2N
O R C Y
OR C Y+
羧酸衍生物亲核取代反应活性顺序:
O O O O > RCNH2 ~ ~ RCN
RCX > RCOCR >
RCH2Cl3 + H2O RCH2CN + H2O RCH2COOR' + H2O ......
RCH2COOH
13.3 羧酸的物理性质(P309) 13.4 羧酸的化学性质(P311) 1、酸性和成盐
sp
2
自学
R C
O OH R C
O
O OH
O C O
R C O-
两个碳氧键键长不同
四电子三中心的分子轨道 两个碳氧键键长等同。
O HO HC HOH2C OH
O
CH3
OH
Erythromycin A (红霉素) A
Vitamin C
• 酰胺
CH3 O O HCN-CH3 CH3
N,3-二甲基戊酰胺 N,N-二甲基甲酰胺
COOH
CH3CH2CHCH2CNHCH3
NHCOCH3
4-乙酰氨基-1萘羧酸
氮原子上有取代基, 在取代基名称前加N标出。
O NH R O R-C-NH N O S CH3 CH3 COOH
R=C6H5CH2(penicillin G)
γ -内酰胺
青霉素 ( penicillin )
物理性质(自学)
13.9 羧酸衍生物的物理性质
有机化学第十三章羧酸衍生物总结

反应活性较差
叔醇
吡啶
O C OC(CH3)3
不仅起催化作用 还可吸收产生的HCl
2) 酯交换:由低级醇酯制高级醇酯
= H+
CH2 CHCOOCH3 + CH3(CH2)2CH2OH
b.p: 80.5℃ 低沸点酯
= CH2 CHCOO(CH2)3CH3 + CH3OH
b.p: 145℃
b.p: 64.7℃
R C =O > X
=
R C =O
O RC
O
> R C =O > R C =O
OR′
NH2
第二步——取决于离去基团的离去能力。
基团的离去能力:
! 试解释之
X > RCOO > RO > NH2
碱性越小离去能力越强。
碱性强弱:
X < RCOO < RO < NH2
结论:
羧酸衍生物的反应活性顺序为
R C =O > X
== =
== =
O C O C4H9_ n
C OH
O
邻苯二甲酸单正丁酯
O CH3 C O CH2 CH3 C O CH2
O
乙二醇二乙酸酯
CH2OCOR CHOCOR'
甘油三酯:脂肪和油
CH2OCOR''
O
H3C
CH3
H3C
HO H3CH2CH
OH O
O
CH3
CH3 OH HO O
O O
N(CH3)2
青霉素 ( penicillin )
酸酐:两个羧酸名加“酐”字。
O
OO
OO
COC
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
羧酸:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1.葡萄糖相对构型的确定
19世纪末20世纪初,德国化学家费歇尔
(E•Fischer)首先对糖进行了系统的研究,确定了葡
萄糖的结构。葡萄糖的构型表示如下:
H HO H H
CHO OH H OH OH CH2OH
HO H HO HO
CHO H OH H H CH2OH
D-(+) 葡萄糖 L ( ) 葡萄糖 十六个己醛糖都经合成得到,其中十二个是费 歇尔一个人合成出来的(于1890年完成合成)。所 以费歇尔被誉为“糖化学之父”。也因此而获得了 1902年的诺贝尔化学奖。
碳水化合物如:糖、淀粉 、纤维素等,都是天 然有机化合物,它们对维持动植物的生命起着重要的作 用。因这类化合物都是由C、H、O三种元素组成,三 种元素中 H :O = 2 :1,相当于H2O中的 H :O之比, 可用通式:Cn(H2O)m表示,碳水化合物因此而得名。 例如: 葡萄糖的分子式为C6H12O6,可表示为C6(H2O)6, 蔗糖的分子式为C12H22O11,可表示为C12(H2O)11等。 但也有部分例外。例如:鼠李糖——C6H12O5、 脱氧核糖——C5H10O4。 也有些化合物的组成符合碳水化合物的比例,但却 不属于碳水化合物。例如
H HO H H
CHO OH H OH OH CH2OH
CHO OH HO OH OH CH2OH
CHO
CH2OH
单糖的开链结构是由它的一些性质导推出来的,因 此,开链结构能说明单糖的许多化学性质,但开链结构 不能解释单糖的所有性质。
如果单糖是一种链式结构,那么应该: (1)有固定的比旋光度,
(2)能与NaHSO3反应,
2.单糖构型的标记和表示方法
(1)单糖构型的标记 糖类的构型习惯用D / L标记法进行标记。 理论上讲,所有单糖都可由甘油醛衍生得到,所以 单糖的构型是以甘油醛为相对标准来确定的。 单糖的递升(将糖变为高一级糖的过程)
CN
CHO H OH HCN
H H
OH OH CH 2OH
CN
水解
COOH H OH H OH CH 2OH
正庚酸
CH
CN
COOH
COOH
HO HI/P (CHOH)4 HCN (CHOH) 2 (CHOH)5 (CH2)5 4
CH2OH
CH2OH
CH2OH
CH3
己醛糖
结论:直链、一个醛基、五个羟基 ——链型的醛式碳架结构
(二)单糖的构型
葡萄糖有四个手性碳原子,应该有24=16个对映 异构体。所以只测定糖的构造式是不够的,还必须 确定它的立体构型。
②与NH2OH或HCN反应,形成一元肟或一元-羟基腈
C6H12O6 + NH2OH → C5H12O5(C=NOH) +H2O 说明分子中有一个醛基
说明分子中有一个羰基
③用Br2-H2O氧化,得到一元羧酸 ④将②中得到的-羟基腈水解,再用强烈的还原剂还原 得到正庚酸。 证明碳架为直链
CHO
HO
非 对 映 体
差向异构体:含有多个C*的旋光异构体,只有一个C*的 构型不同,其余C*的构型完全相同的旋光 异构体。
用符号简便表示:
CHO OH CH2OH
D-(+)-甘油醛
D-(-)-赤藓糖
D-(-)-苏阿糖
碳链 D-核糖
糖 的 递 升
D-阿拉伯糖 D-来苏糖
D-木糖
D-
D-
D-
D-
D阿 洛 糖
CH2OH
D-葡萄糖
D-甘露糖
D-半乳糖
结论:单糖构型的确定是以甘油醛为相对标准
D-甘露糖是D-葡萄糖的2-位差向异构体; D-半乳甘露糖是D-葡萄糖的4-位差向异构体;
1 CH
1 CHO
2OH
1 CHO
2Cα
O
H H H
2 α 3 β 4 γ 5
OH OH OH
H H H
2 α 3 β 4 γ 5
D-
D-
D阿 卓 糖
葡 萄 糖
甘 露 糖
塔 罗 糖
半 乳 糖
古 罗 糖
艾 杜 糖
CHO H HO
CHO
α
CHO HO HO H H
α β γ
CHO H HO HO H
α β γ
OH
H H OH
OH H H
β H γ
H
α β
H H
OH
OH
δ OH
δ OH
δ OH
CH2OH
D-甘油醛
CH2OH
CH2OH
第十三章 碳水化合物
学习要求 1、掌握重要单糖(葡萄糖、果糖)、双糖(麦芽 糖、蔗糖)的结构(开链/哈武斯/构象式)和理 化性质。 2、掌握还原性双糖和非还原性双糖的结构特征 及理化性质。 3、会用化学方法鉴别还原糖与非还原糖(葡萄 糖、果糖、麦芽糖、蔗糖、淀粉、纤维素)
【本章重点】 1.重要单糖的D/L构型及哈沃斯透视式构型 2.单糖的理化性质 3.重要二糖的结构(哈沃斯式)特点及理化性质 4.淀粉、纤维素、糖原的结构及性质。
单糖是构成低聚糖和多糖的基本单位
第一节 单糖
一 单糖的分类 醛糖 官能团 酮糖 碳原子数 丙糖 丁糖 戊糖 己糖
一般是将两种方法结合起来分类,称为某醛糖或某酮糖。 CHO CH2OH CHO CHOH CHOH C O CHOH CH 2OH CH2OH CH 2OH 丙醛糖 丙酮糖 丁醛糖
CHO
CH 2OH D-型甘油醛
HO H
H OH CH2OH
COOH 水解 HO H H OH CH2OH
COOH H OH H OH CH 2OH
COOH H HO H OH CH2OH
生成内酯 Na-Hg
CHO H OH H OH CH 2OH D-(-)-赤鲜糖 CHO H HO H OH CH 2OH D-(-)-苏阿糖
糖的费歇尔投影式结构不能反映出各个基团的相对
空间位置。为了更清楚地反映糖的氧环式结构,哈沃斯透
视式是最直观的表示方法。 4. ―氧环式”结构的表达——哈武斯环状透视结构式 将链状结构书写成哈沃斯式的步骤如下: ①将碳链向右放成水平,使原基团处于左上右下的位置
H HO H H CHO OH H OH OH CH2OH
H OH OH
HO H H
3 β 4 γ 5 δ 6
H OH OH
CH 2OH
D-核糖
CH 2OH
D-2-脱氧核糖
CH 2OH
D-果糖 (酮糖)
结论:单糖构型的确定是以甘油醛为相对标准
结论:单糖构型的确定是以甘油醛为相对标准
将距离C=O最远的C*的构型与甘油醛相比较,和 D-甘油醛的构型相同者称为D-型糖,和L-甘油醛构型相 同者称为L-型糖。 即编号最大的手性碳原子上OH在费歇尔投影式右 边的称为D-型糖,在费歇尔投影式左边的称为L-型糖。
H
H HOCH2
H
OH H
3
OH OH H
2 CHO
OH
以C2、C3为底边 向后弯曲成环状
H HO
OH OH H
CH2OH H CHO OH
CH2OH O OH H H OH H HO H H OH
旋转C4-C5键
CH2OH OH H H CHO H OH HO H OH
CH2OH O H H H OH H HO OH H OH
H HOCH2 OH OH H OH H OH H CHO
②将碳链水平位置以C2-C3为底边弯成六边形状。 ③ 以C4-C5为轴逆时针旋转120°使C5上的羟基与醛基接 近,然后成环(因羟基在环平面的下面,它必须旋转到 环平面上才易与C1成环。
H HO H H CHO OH H OH OH CH2OH
C OR'
OR'
半缩醛
缩醛
那么,葡萄糖分子中的-CHO 与 -OH也可在分子内
缩合生成具有五元或六元环的分子内半缩醛,即:
端基碳原子
半缩醛羟基
HO * H C OH HO H H CH2OH H O OH
H H
1 O C
H * OH 3 H HO 态 平 衡 H 4 OH 5 OH
(3)能与 2 分子ROH反应生成缩醛。 但是单糖却存在下列奇怪的现象: (1)在水溶液中有变旋现象。 (2)单糖的水溶液不与NaHSO3反应——说明游离醛基 很少。 (3)只与一分子ROH反应生成缩醛——说明单糖是一 个分子内半缩醛结构。
→
实验事实: D – 葡萄糖在不同的溶剂中结晶时,可得到两种晶体, 其物理性质如下:
H
H
OH
H
6 CH2OH
CH2OH
-D-(+)-葡萄糖 开链式 β -D-(+)-葡萄糖 β-D-(+)-葡萄糖 -D-(+)-葡萄糖 ~37% ~63% 0.01% 平衡混合的比旋光度=+52.7 []D=+113.4 ° []D=+19.7°
3.环状半缩醛结构的构型和β构型 糖分子中醛基与羟基作用形成半缩醛时,由于C=O 为平面结构,羟基可从平面的两边进攻C=O,所以得到 两种异构体构型和β构型。两种构型可通过开链式相 互转化而达到平衡。这就是糖具有变旋光现象的原因。 构型——生成的半缩醛羟基与决定单糖构型的羟基在 碳链同一侧。 β构型——生成的半缩醛羟基与决定单糖构型的羟基在 碳链的两侧。 -型糖与β-型糖是一对非对映体,-型与β-型的 区别在C1的构型上,故又称为端基异构体或异头物。 注意:(1)单糖在水溶液中三种形式同时存在 (2)含有半缩醛羟基的糖溶于水时都有变旋现象。
天然存在的单糖大多是D-型糖。
D-(+)-甘油醛
CHO
