2019-2020学年人教版高中化学物质结构与性质第二章《分子结构与性质》测试卷
第二章《分子结构与性质》测试题2021-2022学年高二下学期人教版(2019)化学选择性必修2
第二章《分子结构与性质》测试题一、单选题(共15题)1.下列有关化学键类型的说法错误的是A .乙烯分子中σ键、π键的电子云的对称性不同B .物质中有σ键不一定有π键,有π键一定有σ键C .已知丙炔的结构简式为3CH C CH ≡,则丙炔分子中存在5个σ键和3个π键D .乙烷分子中只存在σ键,即C H -和C C -均为σ键2.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是 A .CH 4与C 2H 2 B .H 2O 与HCl C .H 2与Cl 2D .Cl 2与N 23.下列说法正确的是A .非极性分子中的原子上一定不含孤电子对B .平面三角形分子一定是非极性分子C .二氯甲烷(CH 2Cl 2)分子的中心原子采取sp 3杂化,键角均为109°28′D .AB n 型分子的中心原子最外层满足8电子结构,则AB n 不一定是非极性分子 4.下表中各粒子、粒子对应的立体构型及解释均正确的是 选项 粒子立体构型 解释A 氨基负离子()-2NH直线形 N 原子采用sp 杂化B 二氧化硫()2SOV 形 S 原子采用3sp 杂化C三氧化硫()3SO三角锥S 原子采用3sp 杂化D 乙炔()22C H直线形C 原子采用sp 杂化且C 原子的价电子均参与成键5.X 、Y 、Z 、W 是四种原子序数依次增大的短周期元素,W 的最外层电子数比X 的最外层电子数少1个,X 、Y 、Z 为同一周期元素,X 、Y 、Z 组成一种化合物(ZXY)2的结构式如图所示。
下列说法错误的是A .化合物W 2Z 3是良好的耐高温材料B .Y 的氧化物对应的水化物不一定是强酸C .X 的氢化物的沸点一定小于Z 的氢化物的沸点D .化合物(ZXY)2中Z 元素的化合价为-1 6.下列说法中正确的是( )A .分子中键能越大,键长越长,则分子越稳定B .元素周期表中的第ⅠA 族和第ⅠA 族元素的原子间可能形成共价键C .水分子可表示为H—O—H ,分子中键角为180°D .电子从较高能量的激发态跃迁到较低能量的激发态或基态时,将吸收能量 7.下列关于水的说法正确的是 A .纯水和溶液中的水都能电离 B .水的电离和电解都需要通电C .水中氢键的存在既增强了水分子的稳定性,也增大了水的沸点D .加入电解质一定会破坏水的电离平衡,其中酸和碱通常都会抑制水的电离 8.下列描述中,正确的是A .2CS 是空间结构为V 形的极性分子B .3ClO -的空间结构为平面三角形 C .3NO -中所有的原子不都在一个平面上D .4SiF 和23SO -的中心原子的杂化轨道类型均为3sp 杂化9.已知O 3的空间构型为V 型,分子中正电中心和负电中心不重合,则下列关于O 3和O 2在水中的溶解度的叙述中,正确的是 A .O 3在水中的溶解度和O 2的一样 B .O 3在水中的溶解度比O 2的小 C .O 3在水中的溶解度比O 2的大D .无法比较10.酸性溶液中过氧化氢能使Cr 2O 27-转化成蓝色的过氧化铬CrO 5,其分子结构如图。
高中化学选修二第二章《分子结构与性质》经典测试题

一、选择题1.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是()A.H2+CuO=Cu+H2O B.2Na2O2+2H2O=4NaOH+O2↑C.H2+Cl2=2HCl D.2NaOH+Cl2=NaCl+NaClO+H2O答案:B【详解】A.H2中只含有非极性共价键,CuO中含有离子键,Cu中含有金属键,H2O中含有极性共价键,则反应物中只有非极性共价键、离子键的断裂,生成物中只有金属键、极性共价键的形成,故A不符合题意;B.Na2O2中含有非极性键和离子键,H2O中只含有极性共价键,NaOH中含有离子键和极性共价键,O2中含有非极性共价键,则反应中有离子键、极性共价键、非极性共价键的断裂和形成,故B符合题意;C.H2、Cl2中都只含有非极性共价键,HCl中只含有极性共价键,故C不符合题意;D.NaOH中含有离子键和极性共价键,Cl2中含有非极性共价键,NaCl中含有离子键,NaClO中含有离子键和极性共价键,H2O中只含有极性共价键,则产物中没有非极性共价键的形成,故D不符合题意;故选B。
2.能够用键能解释的是()A.氮气的化学性质比氧气稳定B.常温常压下,溴呈液体,碘为固体C.稀有气体一般很难发生化学反应D.乙醇能够任意比例与水互溶答案:A【详解】A. 氮气中是氮氮三键,键能大于氧气的,所以氮气稳定,A选;B. 溴和碘的状态和熔沸点有关、熔沸和晶体类型点有关、溴和碘形成的晶体是分子晶体,其熔沸点和分子间作用力有关,碘的分子间作用力强于溴的,熔沸点高于溴的,B不选;C. 稀有气体的最外层电子已经达到稳定结构,其原子即分子,不存在共价键,化学性质稳定但与键能无关,C不选;D. 乙醇能够任意比例与水互溶,是因为乙醇分子与水分子间形成氢键,和键能无关,D不选;答案选A。
3.下列描述中正确的是A.CS2为V形的极性分子B.PH3的空间构型为平面三角形C.SF6中有4对完全相同的成键电子对SO的中心原子均为sp3杂化D.SiF4和2-4答案:D 【详解】A .根据价电子对互斥理论,中心碳原子只有两对价电子对,CS 2为直线形的非极性分子(与CO 2的结构相似),A 项错误;B .根据杂化轨道理论:VSEPR 模型、中心原子杂化和分子几何形状的关系判断,PH 3的空间构型为三角锥形,B 项错误;C .SF 6分子中S 原子的价电子全部用来成键,与F 形成6对共用电子对,C 项错误;D .SiF 4的中心原子形成了4个σ键,SO 的中心原子的价层电子对数是4,所以中心原子均为sp 3杂化,D 项正确; 故答案为D 。
2020学年度人教版高中化学选修三第二章《分子结构与性质》章末测评(含解析)
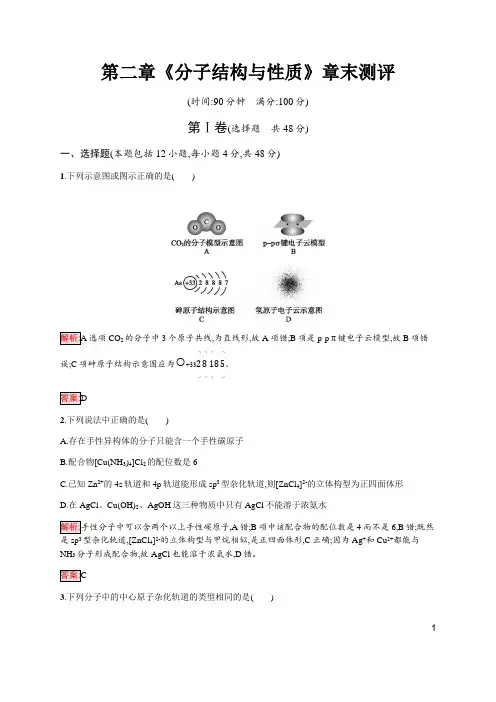
1第二章《分子结构与性质》章末测评(时间:90分钟 满分:100分)第Ⅰ卷(选择题共48分)一、选择题(本题包括12小题,每小题4分,共48分)1.下列示意图或图示正确的是( )选项CO 2的分子中3个原子共线,为直线形,故A 项错;B 项是p-p π键电子云模型,故B项错误;C 项砷原子结构示意图应为○+33◝2◞◝8◞◝18◞◝5◞。
2.下列说法中正确的是( )A.存在手性异构体的分子只能含一个手性碳原子B.配合物[Cu(NH 3)4]Cl 2的配位数是6C.已知Zn 2+的4s 轨道和4p 轨道能形成sp 3型杂化轨道,则[ZnCl 4]2-的立体构型为正四面体形D.在AgCl 、Cu(OH)2、AgOH 这三种物质中只有AgCl 不能溶于浓氨水,A 错;B 项中该配合物的配位数是4而不是6,B 错;既然是sp 3型杂化轨道,[ZnCl 4]2-的立体构型与甲烷相似,是正四面体形,C 正确;因为Ag +和Cu2+都能与NH 3分子形成配合物,故AgCl 也能溶于浓氨水,D 错。
3.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与C6H6B.CH4与NH3C.BeCl2与BF3D.C2H2与C2H42中C原子采取sp杂化,苯分子中C原子采取sp2杂化;CH4和NH3中的C原子、N原子都是采取sp3杂化;BeCl2中Be原子采取sp杂化而BF3中的B原子采取sp2杂化;C2H2中C原子采取sp杂化而C2H4分子中C原子采取sp2杂化。
4.在BrCH CHBr分子中,C—Br键采用的成键轨道是()A.sp-pB.sp2-sC.sp2-pD.sp3-psp2杂化,溴原子的价电子为4s24p5,4p轨道上有一个单电子,与碳原子的一个sp2杂化轨道成键。
5.下列说法正确的是()A.HF、HCl、HBr、HI的熔点、沸点依次升高B.H2O的熔点、沸点高于H2S,是由于H2O分子之间可以形成氢键C.乙醇分子与水分子之间只存在范德华力D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4分子间可以形成氢键,沸点最高,沸点高低顺序应为HF>HI>HBr>HCl,A错误;O元素的电负性较大,水分子间可以形成氢键,则H2O的熔、沸点高于H2S,B正确;乙醇分子与水分子之间还可以形成氢键,C错误;Cl元素的化合价越高,对应的氧化物的水化物的酸性越强,酸性强弱应为HClO<HClO2<HClO3<HClO4,D错误。
人教版高中化学选修二第二章《分子结构与性质》检测题(答案解析)

一、选择题1.(0分)[ID:139552]下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是()A.H2+CuO=Cu+H2O B.2Na2O2+2H2O=4NaOH+O2↑C.H2+Cl2=2HCl D.2NaOH+Cl2=NaCl+NaClO+H2O2.(0分)[ID:139531]下列说法正确的是()A.非极性键只能存在单质中,不可能存在化合物中B.阴、阳离子间通过静电引力所形成的化学键是离子键C.冰中H2O分子间存在氢键,H2O分子内存在极性共价键D.HBr比HCl的热稳定性差,说明HBr的分子间作用力比HCl弱3.(0分)[ID:139526]吡啶是含有一个氮原子的六元杂环化合物,结构简式如下图,可以看作苯分子中的一个(CH)被取代的化合物,故又称为氮苯。
下列有关吡啶的说法正确的是A.吡啶分子中含有Π的大π键B.吡啶分子为非极性分子C.吡啶的分子式为C5H6ND.吡啶分子中含有10个σ键4.(0分)[ID:139599]下列说法中正确的是A.随着核电荷数的递增同主族元素的单质熔点不断升高B.草酸二甲酯分子中σ键和π键个数比为6:1C.DNA的双螺旋结构与氢键无关D.原子的价电子排布为(n-1)d6~8ns2的元素一定位于元素周期表d区5.(0分)[ID:139595]下列叙述中正确的是A.能电离出H+的化合物除水外都是酸,分子中含有几个氢原子它就是几元酸B.无机含氧酸分子中含有几个羟基,它就属于几元酸C.H3PO4和H2CO3分子中非羟基氧的个数均为1,但它们的酸性不相近,H3PO4是中强酸而H2CO3是弱酸D.同一元素的含氧酸,该元素的化合价越高,其酸性越强,氧化性也越强6.(0分)[ID:139588]M、X、Y、Z、W是原子序数依次增大的短周期元素,Z的最外层电子数是次外层电子数的3倍,M和Y二者原子核外电子数之和等于W的原子核外电子数。
由五种元素组成的化合物结构如图所示(箭头表示共同电子对由W提供)。
人教版(2019)化学选择性必修2《分子结构与性质》测试题(含答案).docx

《分子结构与性质》测试题一、单选题1.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24.下列有关叙述错误的是()W WZ+[ W-X-Y-Y ]~I I IW W WA.YW3分子中Y原子采用sp3杂化B.简单离子半径:Y>ZC.XC13中并非所有原子均为8电子稳定结构D.第二周期中,第一电离能介于X、Y元素之间的元素共有2种2.化合物甲是一种常见无机物,其结构如下图所示(图中的“一”为单键或双键),其中W、X、Y、Z为元素周期表中的短周期主族元素,且原子序数依次增大,W和Y、X 和Z 分别为同主族元素,其四种元素原子的最外层电子数之和为14.下列叙述正确的是()r x T-/Y* X—Z\L X—W」A.W分别与X、Z形成的简单分子均为10电子微粒B.X、Y形成的离子化合物只含离子键C.X、Y、Z三种元素的简单离子半径大小顺序为Z>X>YD.等物质的量Y和Z的最高价氧化物对应的水化物反应生成甲3.下列性质中,可以证明某化合物中一定存在离子键的是A.可溶于水B.有较高的熔点C.水溶液能导电D.熔融状态能导电4.化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的是()①用电子式表示HC1的形成过程:―肘阿②CC14的电子式:C1:CC1ci③3-的结构示意图:④H、D、T互为同素异形体⑤次氯酸分子的结构式:H-0-C1A.①③⑤B.②③④C.①②③D.③⑤5.下列说法错误的是()A.C2H6(乙烷)不存在同分异构体B.C60与金刚石互为同素异形体C.H2O的沸点比H2S的高是由于H2O分子间存在氢键D.符号为琴C的核素,其质子数为6,中子数为146.下列说法中正确的是A.分子的结构是由键角决定的B.出0分子中两个O-H键的键角为180。
C.共价键的键能越大,共价键越牢固,由该键形成的分子越稳定D.CF4、CC1, CBr4> CI4中C-X键的健长、键角均相等7.下列叙述正确的是( )A.Li、Na、K、Rb四种单质中,Rb的熔点最高B.氯化钙的电子式为Q2+[: Cl:]^C.离子化合物一定只含离子键D.HF的热稳定性强于HC1,说明非金属性:F>C1&下列中心原子的杂化轨道类型和分子几何构型不正确的是()A.PC13中P原子sp3杂化,为三角锥形B.BC13中B原子sp'杂化,为平面三角形C.CS2中C原子sp杂化,为直线形D.H2S分子中,S为sp杂化,为直线形9.短周期元素X、Y、Z、W原子序数依次增大。
2020—2021学年人教版(2019)化学选择性必修2第二章《分子结构与性质》测试题(含答案)

C.最高价氧化物对应水化物的酸性:W>Y
D.气态简单氢化物的热稳定性:Y>Z
9.厌氧氨化法(Anammox)是一种新型的氨氮去除技术。下列说法中错误的是
A.联氨(N2H4)中含有极性键和非极性键
B.过程II中N2H4发生了氧化反应
C.过程IV中 发生了氧化反应
A.f在元素周期表的位置是第3周期ⅢA族。
B.d、e常见离子的半径大小:r(O2-)>r(Na+)
C.g、h的最高价氧化物对应的水化物的酸性强弱是:HClO4>H2SO4
D.x2d2的结构式:
14.下列各组物质中,前者与后者不相同的是
A.反应热效应:稀硫酸和NaOH与Zn和稀盐酸
B.化学键类型:Mg3N2与Na2O2
(3)叠氮酸(HN3)是一种弱酸,可部分电离出H+和 。请写出两种与 互为等电子体的分子的化学式:__________________。
(4)NaN3与KN3相比,NaN3的晶格能________(填“>”、“=”或“<”)KN3的晶格能。
(5)某元素X形成的离子X+中K、L、M三个电子层均充满了电子。它与 形成晶体的结构如图所示。X+的符号是________,晶体中距离每个 最近的X+有________个。
2.下列关于化学键的说法中不正确的是
A.化学键是一种作用力
B.化学键可以使离子相结合,也可以使原子相结合
C.化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成
D.氢键也是一种化学键
3.CFCl3破坏臭氧层的过程如图所示,下列说法错误的是( )
A.过程Ⅰ:断裂C-Cl键
B.过程Ⅱ:O3+Cl=ClO+O2
第二章 分子结构与性质 检测题-高二化学人教版(2019)选择性必修2
第二章《分子结构与性质》检测题一、单选题(共13题)1.下列分子中,中心原子杂化类型相同,分子的空间结构也相同的是 A .22BeCl CO 、B .22H O SO 、C .64SF CH 、D .33NF BF 、2.氨基酸是构成人体必备蛋白质的基础,某氨基酸的结构简式如图所示。
下列有关说法正确的是A .第一电离能:O>N>C>HB .基态氧原子的电子有8种空间运动状态C .该分子中碳原子的杂化类型有sp 、2sp 和3spD .键的极性大小:N -H<O -H<F -H 3.下列说法正确的是A .硫难溶于水,微溶于酒精,易溶于CS 2,说明极性:H 2O>C 2H 5OH>CS 2B .BF 3、CCl 4中每个原子都满足8电子稳定结构C .分子晶体中一定存在共价键D .I 2低温下就能升华,说明碘原子间的共价键较弱 4.下列叙述不正确的是A .HF 、HCl 、HBr 、HI 的沸点逐渐增大B .在周期表中金属与非金属的分界处,可以找到半导体材料C .Li 、Na 、K 原子的电子层数依次增多D .X 元素最高价氧化物对应的水化物为HXO 3,它的气态氢化物为H 3X5.臭氧通常存在于距离地面25km 左右的高层大气中,它能有效阻挡紫外线,保护人类健康。
但是在近地面,臭氧却是一种污染物。
已知O 3的空间结构为V 形,分子中正电中心和负电中心不重合。
下列说法不正确的是 A .O 3和O 2互为同素异形体 B .在水中的溶解度:O 3>O 2 C .O 3是极性分子,O 2是非极性分子 D .O 3分子中的共价键是极性键 6.下列物质中,酸性最强的是A .2CH ClCOOHB .2CH FCOOHC .2CHF COOHD .2CHBr COOH7.下列各项叙述中,正确的是A .SO 2分子的空间构型与它的VSEPR 模型一致B .价电子排布为5s 25p 1的元素位于第五周期第I A 族,是s 区元素C .在同一电子层上运动的电子,其自旋方向可以相同D .s -s σ键与s -p σ键的电子云形状的对称性不相同8.碳原子的杂化轨道中s 成分的含量越多,则该碳原子形成的C-H 键键长会短一些。
高中化学人教版本物质结构与性质第二章《分子结构与性质》单元测试卷
第二章《分子结构与性质》单元测试卷一、单选题(共15小题)1.下列叙述中正确的是()A.一切四面体空间构型的分子内键角均为109°28′B. Cu(OH)2能溶于过量氨水形成[Cu(NH3)4]2+,中心离子为Cu2+,配体是NH3C.任何晶体,若含阳离子也一定含阴离子D.水分子稳定是因为水分子间存在氢键作用2.下列有关物质性质、结构的表述均正确,且存在因果关系的是()A.答案AB.答案BC.答案CD.答案D3.六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。
下列有关六氟化硫的推测正确的是()A.六氟化硫易燃烧生成二氧化硫B.六氟化硫中各原子均达到8电子稳定结构C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等D.六氟化硫分子中S原子的价层电子对数为44.从碘水中提取碘,可供选择的有机试剂是()A.苯、酒精B.汽油、甘油C.四氯化碳、汽油D.二硫化碳、乙醇5.日常生活中用的防晒霜,如氨基苯甲酸、羟基丙酮等。
它们之所以能“防晒”是() A.因它们为有机物,涂用后形成了一层“保护层”B.因它们挥发时吸热,降低皮肤温度C.因它们含有π键,能够有效吸收紫外线D.因它们能与皮肤形成一层“隔热层”,阻碍照射6.下列物质的分子中,没有π键的是()A. CO2B. N2C. CH≡CHD. HClO7.下列含氧酸中酸性最弱的是()A. HClOB. HNO3C. H2SO4D. HIO48.下列各组微粒的空间构型相同的是()①NH3和H2O①NH和H3O+①NH3和H3O+①O3和SO2①CO2和BeCl2①SiO和SO①BF3和Al2Cl6A.全部B.除①①①以外C. ①①①①D. ①①①9.H2O分子中每个O原子结合2个H原子的根本原因是()A.共价键的方向性B.共价键的饱和性C.共价键的键角D.共价键的键长10.在分子结构中,当a、b、x、y为彼此不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。
第二章《分子结构与性质》测试卷-高二化学人教版(2019)选择性必修2
第二章《分子结构与性质》测试卷一、单选题(共15小题)1.根据实际和经验推知,下列叙述不正确的是()A.卤化氢易溶于水,不易溶于四氯化碳B.碘易溶于汽油,微溶于水C.氯化钠易溶于水,也易溶于食用油D.丁烷易溶于煤油,难溶于水2.关于CS2,SO2,NH3三种物质的说法中正确的是()A. CS2在水中的溶解度很小,是由于其属于极性分子B. SO2和NH3均易溶于水,原因之一是它们都是极性分子C. CS2为非极性分子,所以在三种物质中熔、沸点最低D. NH3在水中溶解度很大只是由于NH3分子有极性3.下列说法正确的是()A. σ键强度小,容易断裂,而π键强度较大,不易断裂B.所有共价键都具有方向性C.含有共价键的化合物一定是共价化合物D.两个原子之间形成共价键时,最多有一个σ键4.下列各组物质中,都是由极性键构成的极性分子的是()A. CH4和Br2B. NH3和H2OC. H2S和CCl4D. CO2和HCl5.下列物质中σ键和π键数目比为1∶2的是()A. O2B. HCNC. CO2D. N26.在乙炔分子中有3个σ键、两个π键,它们分别是()A. sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且互相垂直B. sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且互相平行C. C﹣H之间是sp形成的σ键,C﹣C之间是未参加杂化的2p轨道形成的π键D. C﹣C之间是sp形成的σ键,C﹣H之间是未参加杂化的2p轨道形成的π键7.根据等电子原理,下列各组分子或离子的空间构型不相似的是()A. SO2和O3B. NH和CH4C. H3O+和NH3D. CO2和H2O8.下列分子或离子中采用sp3杂化,但是V形结构的是()A. NH3B. H2SC. BeCl2D. NO3﹣9.科学家最近研制出可望成为高效火箭推进剂的N(NO2)3,如图,已知该分子中N﹣N﹣N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是()A.分子中 N、O 间形成的共价键是极性键B.图中加“*”N原子的杂化方式为sp3C.该物质既有氧化性又有还原性D. 15.2g 该物质含有 6.02×1022个原子10.在气相中,关于BeF2和SF2的说法错误的是()A.BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2B. BeF2分子的立体结构为直线形C.SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子D.在气相中,BeF2是直线形而SF2是V形11.从键长的角度来判断下列共价键中最稳定的是()A. H—FB. H—NC. H—CD. H—S12.下列说法中正确的是()A.分子间作用力越大,分子越稳定B.分子间作用力越大,物质的熔、沸点越高C.相对分子质量越大,其分子间作用力越大D.分子间只存在范德华力13.下列叙述正确的是()A.离子化合物中不可能存在非极性键B.非极性分子中不可能既含有极性键又含有非极性键C.非极性分子中一定含有非极性键D.不同非金属元素的原子之间形成的化学键都是极性键14.用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小。
人教版(2019)选择性必修2第二章《分子结构与性质》测试题(含答案))
分子结构与性质》测试题一、单选题1.下列物质中,含有非极性共价键的是( )A .KOHB .H 2SC .Cl 2D .MgO 2.依据键能数据判断下列分子跟H 2反应能力最强的是A .O 2B .N 2C .F 2D .Br 2 3.下列说法不正确的是A .全部由非金属元素组成的化合物中可能含有离子键B .SiO 2属于原子晶体,熔化破坏共价键C .HF 、HCl 、 HBr 、HI 的分子间作用力依次增大D .H 2O 的稳定性强于H 2S ,说明H-O 键稳定性强于H-S 键4.下列关于酸性强弱比较正确的是A .HI<HBrB .2HClO <HClOC .2434H SO <H POD .2324H SO <H SO5.下列说法正确的是A .Na 2O 2和NaOH 所含化学键类型完全相同B .NH 3比PH 3稳定是因为NH 3分子间存在氢键C .CO 2溶于水和干冰升华都只有分子间作用力改变D .NaHSO 4溶于水电离的过程既破坏离子键又破坏共价键6.主族元素W 、X 、Y 、Z 的原子序数依次增加,且均不超过20,W 、X 、Y 的最外层电子数之和为15,Z +[Y-W≡X]-是实验室常用的一种化学试剂,下列说法中错误的是 A .Z 2Y 的水溶液呈碱性B .W 和X 的氢化物沸点:X>WC .W 和X 的非金属性强弱X>WD .[Y-W≡ X]- 中各原子最外层电子均满足8电子稳定结构7.下列对一些实验事实的理论解释不正确的是A.A B.B C.C D.D8.下列说法正确的是( )A.12C和14C是同位素B.金刚石和石墨是同分异构体C.共价晶体中,共价键越强,熔点越低D.冰融化时,水分子的共价键被破坏9.氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业;合成氨反应为N 2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ/mol。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章《分子结构与性质》测试卷一、单选题(共15小题)1.对配合物[Cu(NH3)4]SO4的叙述,错误的是()A. Cu2+和NH3之间以配位键结合B. [Cu(NH3)4]2+和SO42-之间以离子键结合C. Cu2+和NH3之间以离子键结合D. [Cu(NH3)4]SO4在水中全部电离成[Cu(NH3)4]2+和SO42-2.碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为()A. CCl4与I2相对分子质量相差较小,而H2O与I2相对分子质量相差较大B. CCl4与I2都是直线型分子,而H2O不是直线型分子C. CCl4和I2都不含氢元素,而H2O中含有氢元素D. CCl4和I2都是非极性分子,而H2O是极性分子3.向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的AgNO3溶液,生成氯化银沉淀的物质的量为()A. 0molB. 1molC. 2molD. 3mol4.用萃取法从碘水中分离碘,所用萃取剂应具有的性质是()①不和碘或水起化学反应②能溶于水③不溶于水④应是极性溶剂⑤应是非极性溶剂A.①②⑤B.②③④C.①③⑤D.①③④5.下列分子中,所有原子的最外层均为8电子结构的是()A. BeCl2B. H2SC. NCl3D. SF46.下列分子中,属于含有极性键的非极性分子的是()A. H2OB. N2C. NH3D. CH47.Co(Ⅲ)的八面体配合物CoCl m•nNH3,若1mol配合物与AgNO3作用生成1molAgCl沉淀,则m、n的值是()A. m=3 n=6B. m=3 n=4C. m=4 n=1D. m=4 n=58.下列反应中无配合物生成的是()A.向氨水中加入过量硝酸银B.含氟牙膏中加入氯化铝并充分搅拌C.锌与过量氢氧化钠溶液反应D.向氯化铁溶液中依次加入氟化钠溶液、硫氰化钾溶液,无血红色出现9.已知在CH4中,C—H键间的键角为109°28′,NH3中,N—H 键间的键角为107°,H2O中O—H 键间的键角为105°,则下列说法中正确的是()A.孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力B.孤电子对与成键电子对间的斥力小于成键电子对与成键电子对间的斥力C.孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间的斥力D.题干中的数据不能说明孤电子对与成键电子对间的斥力与成键电子对与成键电子对间的斥力之间的大小关系10.通常把原子总数和价电子总数相同的分子或离子称为等电子体。
人们发现等电子体的空间结构相同,则下列有关说法中正确的是()A. CH4和是等电子体,键角均为60°B.和是等电子体,均为平面正三角形结构C. H3O+和PCl3是等电子体,均为三角锥形结构D. B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道11.COCl2分子的结构式为,COCl2分子内含有()A. 4个σ键B. 2个σ键,2个π键C. 2个σ键、1个π键D. 3个σ键、1个π键12.向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是()A. [Co(NH3)4Cl2]ClB. [Co(NH3)3Cl3]C. [Co(NH3)6]Cl3D. [Co(NH3)5Cl]Cl213.下列说法中不正确的是()A.共价化合物中不可能含有离子键B.有共价键的化合物,不一定是共价化合物C.离子化合物中可能存在共价键D.以极性键结合的分子,肯定是极性分子14.下列叙述中正确的是()A. NH3,CO,CO2都是极性分子B. CH4,CCl4都是含有极性键的非极性分子C. HF、HCl、HBr、HI的稳定性依次增强D. CS2,H2O,C2H2都是直线形分子15.下列各组互为等电子体的是()A. N2O和NO2B. O3和SO2C. CH4和NH3D. OH﹣和NH2﹣二、填空题(共3小题)16.“三鹿奶粉事件”在社会上引起了人们对食品质量的恐慌,三鹿奶粉中被掺杂了被称为“蛋白精”的工业原料三聚氰胺。
已知三聚氰胺的结构简式如图所示。
三聚氰胺是氰胺(H2N—C≡N)的三聚体,请回答下列问题:(1)写出基态碳原子的电子排布式______________。
(2)氰胺中—C≡N中的氮原子、三聚氰胺环状结构中的氮原子和氨基中的氮原子,这三种氮原子的杂化轨道类型分别是__________、__________、__________。
(3)一个三聚氰胺分子中有______个σ键。
(4)三聚氰胺与三聚氰酸分子相互之间通过氢键结合,在肾脏内易形成结石。
三聚氰酸分子中C原子采取________杂化。
该分子的结构简式中,每个碳氧原子之间的共价键是__________(填选项)。
A.2个σ键 B.2个π键 C.1个σ键,1个π键17.长期以来一直认为氟的含氧酸不存在,但1971年美国科学家将F2通入细冰沫获得HFO(次氟酸)。
(1)HFO的电子式为________。
(2)HFO与水反应得到物质A(结构如图所示),写出HFO与水反应的化学方程式________________。
(3)分子A中存在________键。
A.仅有σ键B.仅有π键C.同时含有σ键、π键D.同时存在极性键和非极性键18.计算下列各微粒中心原子的杂化轨道数,判断中心原子的杂化轨道类型,写出VSEPR模型名称。
(1)CS2__________、__________、__________;(2)NH__________、__________、__________;(3)H2O__________、__________、__________;(4)PCl3__________、__________、__________;(5)BCl3__________、__________、__________。
答案解析1.【答案】C【解析】A.该配合物中氮原子提供孤电子对,所以氨气分子是配位体,铜离子提供空轨道,Cu2+和NH3之间以配位键结合,故A正确;B.[Cu(NH3)4]SO4中外界是SO42﹣,內界是[Cu(NH3)4]2+,以离子键结合,故B正确;C.该配合物中,铜离子提供空轨道,是中心离子,氮原子提供孤电子对,氨气分子是配位体,Cu2+和NH3之间以配位键结合,故C错误;D.[Cu(NH3)4]SO4中外界是SO42﹣,內界是[Cu(NH3)4]2+,以离子键结合,水中全部电离成[Cu(NH3)4]2+和SO42﹣,故D正确;2.【答案】D【解析】根据“相似相溶”原理,非极性分子组成的溶质易溶在非极性分子组成的溶剂中;极性分子组成的溶质易溶在极性分子组成的溶剂中。
CCl4和I2都是非极性分子,H2O是极性分子,比较而言,I2更易溶在CCl4中而不易溶于水中,D项正确。
其余选项都没有揭示问题的实质。
3.【答案】C【解析】在配合物[Co(NH3)5Cl]Cl2中,外界是Cl﹣,內界是[Co(NH3)5Cl]2+,有一个氯离子中内界,有两个氯离子在外界,[Co(NH3)5Cl]Cl2的电离方程式为[Co(NH3)5Cl]Cl2=[Co(NH3)Cl]2++2Cl﹣,溶液中能与银离子反应生成沉淀的是在外界的氯离子,所以依据Ag++Cl﹣=AgCl↓可知,51mol此配合物电离产生2mol氯离子,由此可推断1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的AgNO3溶液,生成氯化银沉的物质的量是2mol。
4.【答案】C【解析】碘是非极性分子,水是极性分子,碘不溶于水。
萃取法是利用物质的溶解性规律来进行物质的提纯的方法。
5.【答案】C【解析】该题型常用方法是:化合物分子中每种元素的价态的绝对值与其最外层电子数之和若等于8,则符合题意。
BeCl2分子中Be原子最外层电子为2+2=4,不符合要求;H2S中H原子最外层电子数为1+1=2,不符合要求;NCl3中N原子最外层电子数为5+3=8,Cl原子最外层电子为7+1=8,符合要求;SF4中S原子最外层电子为6+4=10,不符合要求。
6.【答案】D【解析】首先判断分子中是否含有极性共价键,然后看分子的空间结构是否对称,正负电荷中心是否完全重合。
H2O分子中O—H键为极性键,两个O—H键之间的夹角约为105°,整个分子电荷分布不对称,是极性分子;N2是双原子单质分子,N≡N键是非极性键,属于含非极性键的非极性分子;NH3分子中N—H键是极性键,分子构型是三角锥形,氮原子位于顶端,电荷分布不对称,是极性分子;CH4分子中C—H键是极性键,分子构型呈正四面体形,碳原子位于正四面体中心,四个氢原子分别位于正四面体的四个顶点,电荷分布对称,是非极性分子。
7.【答案】B【解析】由1mol配合物生成1 mol AgCl沉淀,知道1mol配合物电离出1mol Cl﹣,即配离子显+1价,又因为外界有一个Cl﹣,且Co显+3价,所以[CoCl m﹣1•nNH3]+中有两个氯原子,即m=3,又因为是正八面体,所以n=6﹣2=48.【答案】A【解析】A.硝酸银中滴氨水是银氨溶液的配制,先产生白色氢氧化银沉淀,继续滴加,形成配合物银氨络离子(银氨溶液)使沉淀溶解,离子方程式为Ag++NH3•H2O=AgOH↓+NH4+,后发生:AgOH+2NH3•H2O=[Ag(NH3)2]++OH﹣+2H2O,当硝酸银过量时,氢氧化银不溶于硝酸银,故A 正确;B.铝离子和氟离子反应生成配离子AlF63﹣,所以能生成配合物,故B错误;C.锌和过量氢氧根离子反应生成Zn(OH)42﹣,所以能生成配合物,故C错误;D.铁离子和硫氰根离子反应生成配合物硫氰化铁,故D错误。
9.【答案】A【解析】由中心原子上孤电子对数的计算公式可知,CH4中碳原子无孤电子对,NH3中的氮原子有1对孤电子对,H2O中的氧原子有2对孤电子对。
根据题意知CH4中C—H键间的键角为109°28′,若孤电子对与成键电子对间的斥力等于成键电子对与成键电子对间的斥力,则NH3中N—H键间的键角和H2O中O—H键间的键角均应为109°28′,故C不正确;若孤电子对与成键电子对间的斥力小于成键电子对与成键电子对间的斥力,则NH3中N—H键间的键角和H2O中O—H键间的键角均应大于109°28′,现它们的键角均小于109°28′,故B不正确;孤电子对与成键电子对间的斥力大于成键电子对与成键电子对间的斥力,将成键电子对压得靠近一点,使其键角变小,D错误,A正确。
10.【答案】B【解析】CH4和都是正四面体结构,键角均为109°28′,A项不正确;和是等电子体,均为平面正三角形结构,B项正确;H3O+和PCl3价电子总数不相等,不是等电子体,C项不正确;B3N3H6结构与苯相似,也存在“肩并肩”式重叠的轨道,D项不正确。
