中山大学-植物生理学学实验-植物组织培养综述
植物生理学实验进度安排 - 中山大学生命科学学院
缺素 N P K Ca Mg Fe P Mg Mg Fe N Mg Fe K
2012 年植物生理学实验分组名单
上课时间:周五下午 18:00-21:30;上课地点:东校区实验中心 F 座 303
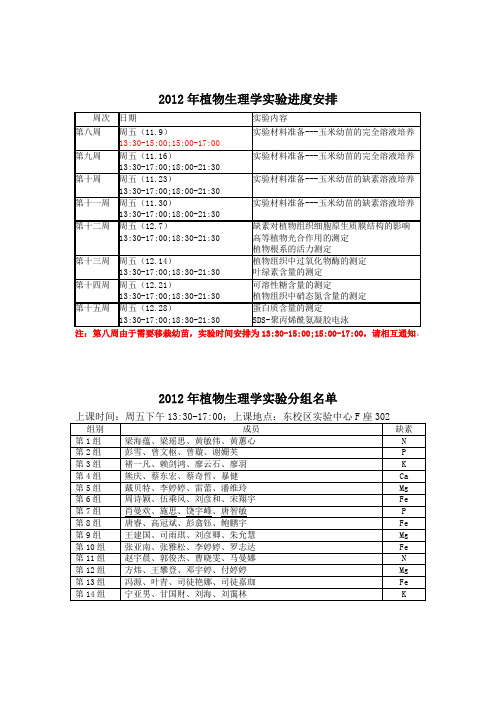
组别
成员
第1组
周志芬、周佳妮、周律影、林丽花
第2组
林裕庭、郑霖、姚立宇、段天琳
第3组
钟乐源、夏才俊、夏滢颖、聂鹏
N
第 12 组 程碧燕、蒋泽洲、谢立仪、蓝子皓
Mg
第 13 组 詹晓虹、谭兰晶、蓝子皓
Fe
第 14 组
K
第 10 组 张亚南、张雅松、李婷婷、罗志达
Fe
第 11 组 赵宇晨、郭俊杰、曹晓雯、马曼娜
N
第 12 组 方炜、王攀登、邓宇婷、付婷婷
Mg
第 13 组 冯源、叶青、司徒艳娜、司徒嘉珈
Fe
第 14 组 宁亚男、甘国财、刘海、刘霭林
K
2012 年植物生理学实验分组名单
上课时间:周五下午 18:00-21:30;上课地点:东校区实验中心 F 座 302
2012 年植物生理学实验进度安排
周次 日期
实验内容
第八周
周五(11.9) 13:30-15:00;15:00-17:00
实验材料准备---玉米幼苗的完全溶液培养
第九周 第十周
周五(11.16) 13:30-17:00;18:00-21:30 周五(11.23) 13:30-17:00;18:00-21:30
姚晓冬、柳华滔、段永江、唐晓敏
第8组
夏哈代提·迪力夏提、殷甘强、黄佐治、黄翠莹
第9组
雍远舜、蔡坤杉、蔡敏琪、谭展瑶
第 10 组 赛丁·艾散、潘建中、黎文杰、何汪运
植物组培的实习报告

一、实习目的本次植物组培实习旨在通过实际操作,让学生了解植物组织培养的基本原理、技术流程和实验方法,掌握植物细胞培养的基本技能,提高学生的实践操作能力和科研思维能力。
同时,通过实习,使学生认识到植物组织培养在植物繁殖、品种改良、遗传育种以及植物基因工程等领域的重要应用。
二、实习内容1. 植物组织培养概述实习首先介绍了植物组织培养的基本概念、发展历程、应用领域以及实验室的基本设备。
2. 植物组织培养技术(1)植物材料的选择与预处理介绍了植物材料的选择标准、预处理方法(如消毒、切割等)以及预处理过程中需要注意的问题。
(2)培养基的配制与灭菌详细讲解了培养基的配方、配制方法、灭菌方法以及注意事项。
(3)植物细胞的诱导与增殖介绍了植物细胞诱导与增殖的方法,如愈伤组织的诱导、胚性愈伤组织的诱导、不定芽的诱导等。
(4)植物胚胎发生与植株再生讲解了植物胚胎发生的过程、影响因素以及植株再生的技术要点。
3. 实验操作(1)植物材料的消毒与切割在指导老师的指导下,学生进行了植物材料的消毒与切割操作,掌握了消毒液的配置、消毒时间、切割工具的使用等技能。
(2)培养基的配制与灭菌学生亲自参与了培养基的配制、分装、灭菌等过程,了解了培养基的配方、配制方法、灭菌方法等。
(3)植物细胞的诱导与增殖学生在指导老师的指导下,进行了愈伤组织的诱导、胚性愈伤组织的诱导、不定芽的诱导等实验,掌握了相关技术。
(4)植物胚胎发生与植株再生学生进行了植物胚胎发生与植株再生的实验,了解了植物胚胎发生的过程、影响因素以及植株再生的技术要点。
三、实习收获1. 理论知识与技能的提升通过本次实习,学生对植物组织培养的基本原理、技术流程和实验方法有了更深入的了解,掌握了植物细胞培养的基本技能。
2. 实践操作能力的提高学生在实习过程中,亲自参与了植物材料的消毒、切割、培养基的配制、灭菌、细胞诱导与增殖、胚胎发生与植株再生等实验操作,提高了实践操作能力。
3. 科研思维的培养通过实习,学生学会了如何分析实验现象、解决问题,培养了科研思维。
药用植物的组织培养[文献综述]
![药用植物的组织培养[文献综述]](https://img.taocdn.com/s3/m/44ad65ad19e8b8f67c1cb977.png)
毕业论文文献综述生物工程药用植物的组织培养一、前言部分1.1药用植物及其现状药用植物资源指在一定社会和经济条件下,被人们认识和利用的植物资源中对人体疾患具有医疗或保继作用,并对家养动物病害具有治疗作用,以及具有杀虫、杀菌、除草等功效的各类植物的总称。
【1】中药是中华文明的瑰宝,为人类健康做出了巨大贡献,而药用植物资源是中药资源最重要的组成部分。
随着我国“中药现代化科技产业行动,‘计划”的实施和中药产业的快速发展,对药用植物资源的需求量也越来越大。
但是,由于缺乏对绝大多数药用植物资源更新规律的研究,加上药材采收的不合理,抢采、抢收、掠夺式利用现象十分严重。
【2】生态经济学理论是药用植物资源可持续管理的理论基础,药用植物资源可持续管理是一种对药用植物资源的经营管理过程,在这个过程中既要实现经济的可持续增长,又要使药用植物资源的开发利用不能超过其最大生态生产量,既能使药用植物资源满足当代人最大持久的利益,又要保持其潜力以满足后代的需求”。
【3】建立药用植物资源的科学采收制度和可持续利用理论与技术体系相当重要。
药用植物资源的再生能力,从狭义上讲,是指药用植物资源具有不断繁殖后代的能力;从广义上讲,不仅指其繁殖后代的能力,而且还包括其自身组织和器官的再生能力。
【4】植物快繁是利用体外培养方式快速繁殖植物的技术,主要应用于用其他方式不能繁殖,或繁殖效率低的植物的繁殖。
为了保持某一品种的基因型稳定,避免在有性繁殖过程中发生变异,也采用植物快繁技术。
快繁中利用的植物材料主要是茎尖、茎切段、叶片、胚等。
快繁技术容易掌握,繁殖率高。
【5】1.2组织培养技术植物组织培养是以植物生理学为基础发展起来的一门新生的生物技术学科。
植物组织培养包括了所有类型的无菌培养技术,主要有:成熟及未成熟植物胚胎的离体培养;离体器官包括根尖、茎尖、叶原基、花器官原基或未成熟花器官各部分以及未成熟果实的培养;从植物各种器官的外殖体增殖而形成的愈伤组织培养;能保持良好分散性的离体细胞或很小细胞团的液体培养;除去细胞壁的植物原生质体培养。
组织培养实验报告

一、实验目的1. 掌握无菌操作的植物组织培养方法。
2. 通过配置MS培养基母液,掌握母液的配置和保存方法。
3. 通过诱导植物细胞形成愈伤组织,学习愈伤组织的建立方法。
4. 了解植物细胞通过分裂、增殖、分化、发育,最终长成完整再生植株的过程,加深对植物细胞全能性的理解。
二、实验原理植物组织培养是一种利用植物细胞的全能性,在人工条件下实现植物器官、组织或细胞再生为完整植株的技术。
其基本原理包括:1. 脱分化作用:原本已经分化停止生长的细胞,在人工培养基的诱导下,重新进入分裂状态,形成没有特定组织结构的细胞团,即愈伤组织。
2. 再分化作用:愈伤组织在一定条件下,可以分化为具有特定结构和功能的组织,如根、茎、叶等,最终形成完整的植株。
3. 植物激素:在组织培养过程中,植物激素如生长素(IAA)、细胞分裂素(CK)等起着关键作用,调节细胞分裂、分化和器官形成。
三、实验材料与仪器材料:1. 植物外植体:如叶片、茎段、芽等。
2. MS培养基母液:包括大量元素、微量元素、有机物、维生素和植物激素等。
3. 灭菌剂:如乙醇、HgCl2(或次氯酸钠)等。
仪器:1. 培养室2. 高压灭菌锅3. 水浴锅4. 解剖刀5. 三角烧瓶(100mL)6. 烧杯7. 量筒8. 培养皿9. 超净工作台10. 分析天平11. 镊子12. 剪刀13. 橡皮筋四、实验步骤1. 外植体消毒:将外植体放入含有乙醇、HgCl2(或次氯酸钠)的消毒液中浸泡5-10分钟,然后用无菌水冲洗干净。
2. 愈伤组织诱导:将消毒后的外植体接种到含有不同激素浓度和比例的MS培养基中,置于培养室内培养。
3. 愈伤组织继代培养:待愈伤组织形成后,将其转移到新的培养基中进行继代培养,以扩大愈伤组织数量。
4. 再分化培养:将愈伤组织转移到含有不同激素浓度和比例的培养基中,诱导其分化为根、茎、叶等器官。
5. 生根与移栽:待植物分化出根、茎、叶等器官后,将其移栽到土壤中,进行正常生长。
植物组织培养综述

植物组织培养技术综述摘要:组织培养是细胞生物学研究最常用的方法之一,是指从生物体中取出组织或细胞,在离体的条件下模拟体内的生理环境,使其生存、生长、繁殖或传代,借以观察、研究细胞的生长发育等生命活动现象。
植物组织培养以其条件可控、便于观察的优点,在快速繁殖、育种、保护珍贵苗木等工作中应用广泛。
以菊花的组织培养为例,从原理、方法和常见问题三个方面对植物组织培养进行讨论。
关键词:菊花;花瓣;MS培养基;组织培养1 引言自1902年,德国植物学家Haberlandt根据细胞学说,提出单个细胞的植物细胞全能性(totipotency)理论以来,组织培养技术的研究已有100多年历史。
植物组织培养是指在无菌的条件下,将离体的植物器官(根、茎、叶、花、果实等)、组织(形成层、花药、皮层等)、细胞(体细胞和生殖细胞),以及原生质体,培养在人工配制的培养基上,给予适当的培养条件,使其长成完整的植株。
根据所培养的植物材料的不同,可以把组织培养分为5种类型,即愈伤组织培养、悬浮组织培养、器官培养(胚、花药、子房、根和茎的培养等)、茎尖分生组织培养和原生质体组织培养。
现在植物组织培养技术已在科研和生产中广泛应用,成为最引人注目的生物技术之一,广泛应用于植物的快速繁殖、品种改良、基因工程育种、种质资源保存、次生代谢产物生产等方面,产生了巨大的经济效益和社会效益,对现代农业和医药等领域产生了深刻影响。
2 组织培养基本原理植物细胞具有全能性,即生物体的细胞具有使后代细胞形成完整个体的潜能。
离体的植物组织或细胞(也称外植体),在培养了一段时间以后会通过细胞分裂形成愈伤组织(愈伤组织的细胞排列疏松而无规则,是一种高度液泡化呈无定形状态的薄壁细胞)。
由高度分化的植物组织或细胞产生愈伤组织的过程,称为植物组织的脱分化,或者叫作去分化。
脱分化产生的愈伤组织继续进行培养,又可以重新分化成根或芽等器官,这个过程叫作再分化。
再分化产生的试管苗,移栽到地里,可以发育成完整的植物体。
组培实验报告

一、实验简介实验名称:植物组织培养实验目的:通过植物组织培养技术,了解植物细胞生长、分化和再生的过程,掌握组培技术的操作方法,并应用于植物繁殖和遗传改良。
二、实验原理植物组织培养是利用植物细胞的全能性,通过特定的培养基和外界条件,使植物组织在体外进行生长、分化和再生,最终形成完整的植株。
该技术广泛应用于植物繁殖、遗传改良、基因工程等领域。
三、实验材料与仪器1. 实验材料:植物外植体(如叶片、茎段、愈伤组织等)培养基(MS培养基、改良MS培养基等)诱导培养基(1/2MS培养基、添加生长调节剂的培养基等)细菌培养基(如牛肉膏蛋白胨培养基)灭菌剂(如75%酒精、1%次氯酸钠溶液)其他:超净工作台、接种针、酒精灯、移液器、培养皿、培养箱等2. 实验仪器:电子天平高压蒸汽灭菌器移液器超净工作台培养箱显微镜四、实验步骤1. 材料预处理:选择健康、无病虫害的植物材料,用流水冲洗干净。
将外植体浸泡在1%次氯酸钠溶液中消毒5-10分钟,然后用无菌水冲洗3-5次。
将消毒后的外植体用无菌滤纸吸干水分。
2. 培养基制备:称取适量的培养基粉末,加入少量蒸馏水溶解。
将溶解后的培养基过滤除菌,加入适量的琼脂和生长调节剂。
将培养基倒入培养皿中,待凝固后备用。
3. 外植体接种:在超净工作台中,用无菌接种针将外植体接种到培养基上。
每个外植体接种3-5个,确保接种密度适宜。
4. 培养与观察:将接种后的培养皿放入培养箱中,控制适宜的温度、光照和湿度。
定期观察外植体的生长情况,记录愈伤组织形成、芽生长和根生长等过程。
5. 培养基调整与继代培养:当外植体形成愈伤组织或芽生长到一定长度时,可进行培养基调整和继代培养。
将愈伤组织或芽切割成小块,重新接种到新的培养基上。
根据生长情况,适时调整培养基成分和生长调节剂浓度。
五、实验结果与分析1. 愈伤组织形成:在适宜的培养基和条件下,外植体可形成愈伤组织。
愈伤组织是细胞增殖和分化的基础,是组织培养成功的关键。
植物组织培养(毕业论文doc)
引言1.1 植物组织培养的概述1.1.1 植物组织培养的概念植物组织培养(plant tissue culture)是植物的组织培养是根据植物细胞具有全能性这个理论,近几十年来发展起来的一项无性繁殖的新技术。
植物的组织培养广义又叫离体培养,指从植物体分离出符合需要的组织.器官或细胞,原生质体等,通过无菌操作,在人工控制条件下进行培养以获得再生的完整植株或生产具有经济价值的其他产品的技术。
狭义是指组培指用植物各部分组织,如形成层.薄壁组织.叶肉组织.胚乳等进行培养获得再生植株,也指在培养过程中从各器官上产生愈伤组织的培养,愈伤组织再经过再分化形成再生植物。
1.1.2 植物组织培养的理论起源19 世纪30 年代,德国植物学家施莱登和德国动物学家施旺创立了细胞学说,根据这一学说,如果给细胞提供和生物体内一样的条件,每个细胞都应该能够独立生活。
1902 年,德国植物学家哈伯兰特在细胞全能性的理论是植物组培的理论基础。
1958 年,一个振奋人心的消息从美国传向世界各地,美国植物学家斯蒂瓦特等人,用胡萝卜韧皮部的细胞进行培养,终于得到了完整植株,并且这一植株能够开花结果,证实了哈伯兰特在五十多年前关于细胞全能的预言。
植物组培的简单过程如下:植物组培的大致过程是:在无菌条件下,将植物器官或组织(如芽、茎尖、根尖或花药)的一部分切下来,用纤维素酶与果胶酶处理用以去掉细胞壁,使之露出原生质体,然后放在适当的人工培养基上进行培养,这些器官或组织就会进行细胞分裂,形成新的组织。
不过这种组织没有发生分化,只是一团薄壁细胞,叫做愈伤组织。
在适合的光照、温度和一定的营养物质与激素等条件下,愈伤组织便开始分化,产生出植物的各种器官和组织,进而发育成一棵完整的植株。
植物组织培养即植物无菌培养技术,又称离体培养,是根据植物细胞具有全能性的理论,利用植物体离体的器官如根、茎、叶、茎尖、花、果实等)组织(如形成层、表皮、皮层、髓部细胞、胚乳等)或细胞(如大孢子、小孢子、体细胞等)以及原生质体在无菌和适宜的人工培养基及光照、温度等人工条件下,能诱导出愈伤组织、不定芽、不定根,最后形成完整的植株的学科。
植物组织培养技术的研究进展
植物组织培养技术的研究进展一、本文概述植物组织培养技术,作为一种在无菌条件下,通过人工操作将离体的植物组织、细胞或器官培养在人工配制的培养基上,使其再生为完整植株或生产具有经济价值的其他产品的技术,自其诞生以来,就在生物学、农业、林业、医药等领域引发了广泛的关注和研究。
本文旨在全面综述植物组织培养技术的研究进展,探讨其在实际应用中的潜力与挑战,以期为推动该领域的发展提供有益的参考。
本文将首先回顾植物组织培养技术的发展历程,梳理其从早期的摸索阶段到现代的精细化、高效化发展的主要历程。
接着,我们将重点关注近年来在植物组织培养技术方面取得的重要突破,包括培养基的优化、外植体选择的新策略、基因编辑技术在组织培养中的应用等。
我们还将探讨植物组织培养技术在植物育种、脱毒、次生代谢产物生产、生物反应器等方面的应用,并分析其在实际应用中的优势和局限性。
我们将对植物组织培养技术的未来发展进行展望,探讨如何通过技术创新和方法优化,进一步提高植物组织培养的效率和质量,以满足日益增长的农业生产需求和社会经济发展要求。
我们也将关注植物组织培养技术在应对全球气候变化、生物多样性保护等重大问题中的潜在作用,以期为推动植物组织培养技术的可持续发展提供新的思路。
二、植物组织培养技术的基本原理和方法植物组织培养技术,又称为植物微繁殖或植物细胞培养,是一种通过控制环境条件,利用植物细胞或组织的再生能力,在无菌条件下进行植物繁殖或遗传改良的技术。
其基本原理主要基于植物细胞的全能性,即植物体的每一个活细胞都含有该物种的全套遗传信息,并有能力发育成完整的植株。
植物组织培养的基本方法主要包括以下几个步骤:从植物体上获取所需的外植体(如叶片、茎尖、花药等)。
然后,通过表面消毒和切割处理,将外植体接入含有适当营养成分和植物生长调节剂的培养基中。
这些调节剂如细胞分裂素和生长素,对细胞的分裂和分化起着重要的调控作用。
接着,将接种后的外植体置于适宜的光照、温度和湿度条件下进行培养。
植物组织培养综合实验报告模块(2012年3月)
《植物组织培养大实验》综合报告书写说明植物组织培养这一个综合性很强的大实验,《植物组织培养大实验》课程实验由7个分实验组成:①实验用具的洗涤和灭菌,② MS培养基母液的配制,③ MS培养基的配制和灭菌,④植物外植体消毒和接种,⑤愈伤组织的诱导(又称原代培养或初代培养),⑥愈伤组织的继代培养,⑦愈伤组织的生根培养(植株再生)。
实验报告是对实验观察、比较所得结果的真实记载,是科学的记录。
实验报告的形式可以根据实验风容的不同而分文字描述、绘图和列表3种形式。
为了减少实验报告写作过程中的重复性和减轻学生完成实验报告的负担,《植物组织培养大实验》课程实验报告由5次综合实验报告组成,即:1、《植物组织培养大实验》综合报告(一)(必做):实验用具的洗涤和灭菌、MS 培养基母液及MS培养基的配制和灭菌;2、《植物组织培养大实验》综合报告(二)(必做):植物外植体消毒和接种;3、《植物组织培养大实验》综合报告(三)(必做):愈伤组织的诱导(又称原代培养或初代培养);4、《植物组织培养大实验》综合报告(四)(必做):愈伤组织的继代培养;5、《植物组织培养大实验》综合报告(五)(选做):愈伤组织的生根培养(植株再生)。
学生在写《植物组织培养大实验》综合报告时,实验报告中的实验内容、实验目的、实验原理、仪器设备和试剂等4部分可按照教师拟定的《植物组织培养大实验》综合报告(一)至(五)中的内容写。
实验方法部分可参照教师编写的实验指导。
实验结果与分析是学生对自已实验结果的真实记载和分析,思考题是教师为了让学生加深对植物组织培养的原理与技术的理解和掌握而设计的。
因此,综合报告中的实验结果与分析、思考题2部分内容,要求学生必需独立完成。
《植物组织培养大实验》综合报告(一)(必做)【实验内容】实验用具的洗涤和灭菌、MS培养基母液及MS培养基的配制和灭菌【实验目的】1、掌握植物组织培养中常用实验用具的洗涤、灭菌方法及注意事项;2、掌握MS培养基母液的配制方法和注意事项;3、掌握MS培养基的配制、灭菌方法和注意事项。
植物组织培养报告四则
(实验题目)开题报告姓名:学院(系、所):学科专业:导师姓名:开题时间:论文题目中文垂吊矮牵牛再生体系的建立英文The establishment of petunia's regeneration system论文工作计划简述(开题报告内容)1、本论文课题国内外概况和文献综述:矮牵牛, 又名碧冬茄、灵芝牡丹, 属茄科矮牵牛属的多年生草本植物. 矮牵牛花大而色彩丰富, 是装饰花坛、街道的理想花卉, 广泛地应用于城市及园林绿化, 是世界上最普及,销售量最大的花卉之一[1 ] .近年来矮牵牛在组织培养方面的研究发展很快,现将国内外研究概况分述如下。
1.外植体的选择根据植物细胞全能性,理论上任何活组织在适宜的条件下都能发育成完整的植株。
但是,在不同生长状况下、发育阶段、生长环境和不同部位的外植体存在一定的生理生化差异,因此选择不同的外植体课影响组织培养的形态发生。
分别以叶片、茎尖、茎段、种子、花蕾、花药等作外植体获得再生植株[3-8 ] , 但从分化结果来看, 茎尖作外植体最好, 幼芽分化所需时间短,分化出来的幼芽健壮;其次为茎段,叶片不但产生愈伤组织少,而且产生幼苗所需时间长。
在茎尖和茎段试验中,前者无论在生长势或分化率方面都优于后者.由于茎尖数量有限,而叶片培养时间长,因此以茎段(包括茎尖)作为外植体是矮牵牛组培的最佳选择。
2.培养基和培养条件的选择在基本培养基的选择上,主要用MS和1/ 2MS , 其中MS 主要用来培养愈伤组织及继代增殖, 1/ 2MS 主要用于生根培养.也有用N H 培养基[ 6 ] 和1/ 4MS 培养基[ 9 ] 对矮牵牛进行组培的. 针对不同的要求,可以改变基本培养基中的营养成分及其含量。
目前为止, 大部分组织培养研究者都用6-BA 作为主要激素[4 ,6 ,10-11 ] , 至于使用量, 不同的品种、不同的材料和不同的研究者得到了不同的结论.大部分研究者用BA或6-BA或NAA 组合来诱导愈伤组织的产生,而且取得了良好的效果。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物组织培养XXX(中山大学生命科学学院生物技术与应用基地班广州 510275)摘要植物组织培养是细胞生物学研究中的常用技术。
主要内容是在人工模拟的植物体内生理环境中,对外植体进行培养,使其生存、生长、繁殖或传代,并加以观察和研究。
植物组织培养以细胞全能性为理论基础,实际操作包含培养基的配制、外植体的处理与消毒灭菌、接种、培养等主要步骤。
植物组织培养的成功与否受培养基成分、外植体的选择、实际操作等因素的影响。
关键词植物;外植体;组织培养;1 引言植物组织培养技术,是一种将植物体的部分细胞或组织与母体分离,在适当的条件下加以培养,使它们能够生长、发育、分化与增殖的技术。
原理是来自植物细胞的全能性分化能力,即植物体内的某一类细胞,能够独立发育并且分化成为完整的植物成体的能力。
植物组织培养能够以少量的母体培养出大量的植物,这使植物组织培养具有广泛用途。
植物组织培养技术的诞生发与展可溯已久。
1902年,德国植物学家G. Haberlanclt基于细胞全能性理论,提出了植物体细胞在适当的条件下, 可不断分裂分化, 最终发育成完整植株的潜力的观点。
1943 年, 美国学者White 在使用烟草愈伤组织作为实验材料的实验中,偶然培养得到了芽组织,首次证明了G. Haberlanclt观点具有正确性。
1958年,美国植物学家Stiefvater等人,利用胡萝卜韧皮部的细胞进行培养,最终得到完整且可以开花结果的植株,确切证实了G. Haberlanclt的观点。
进入20世纪60年代以后,组织培养技术在基础理论、实际操作方面不断取得进展,相继在植物体细胞杂交、单倍体育种、种质资源保存、快速育苗、人工种子制造、次生代谢物生产等方面有了可喜的成果,已经成为基础坚实、易于掌握、应用面广的一种技术手段,广泛应用于研究、生产的众多领域,创造了巨大价值。
[1][2]2 植物组织培养基本原理植物细胞的全能性是植物组织培养的理论基础。
外植体是离体的植物组织或细胞。
在适宜条件下在培养了一段时间后,外植体中高度分化的植物细胞会发生去分化作用变为薄壁细胞,薄壁细胞继续分裂会形成愈伤组织。
愈伤组织经过继续的培养,重新分裂分化形成根与芽(胚状体),而根和芽接下来可发育为含有叶、茎等器官的完全植物体。
植物组织培养的一个关键步骤就是诱导愈伤组织的形成,培养基在这里扮演了重要角色。
组织培养的基础培养基有MT、MS、SH、White、N等,目前普遍使用的是MS培养基。
MS培养基含有各种植物所需的大量元素、微量元素、有机物和植物激素。
其中植物激素作用关键,可以诱导产生愈伤组织、胚状体、不定芽、根等器官,其含量与种类还决定了植物组织的分化与发育方向。
[1][3]3 植物组织培养过程植物组培的大致过程是:在无菌条件下,将植物器官或组织(如芽、茎尖、根尖或花药)的一部分切下来,用纤维素酶与果胶酶处理用以去掉细胞壁,使之露出原生质体,然后放在适当的人工培养基上进行培养,这些器官或组织就会进行细胞分裂,形成新的组织。
不过这种组织没有发生分化,只是一团薄壁细胞,叫做愈伤组织。
在适合的光照、温度和一定的营养物质与激素等条件下,愈伤组织便开始分化,产生出植物的各种器官和组织,进而发育成一棵完整的植株。
下面以我们的课程内容——菊花花瓣分化培养的基本操作为例介绍一下具体的步骤:培养基的配制实验所用MS培养基分为分化培养基和生根培养基:分化培养基成分为MS+3mg/L6-BA+0.1mg/L NAA+糖3%+琼脂0.7%,pH 5.8。
生根培养基成分为MS+0.5mg/L NAA+糖3%+琼脂0.7%,pH 5.8。
②外植体的处理与消毒灭菌取新鲜的菊花花瓣,用清洁剂或洗衣粉洗净,之后自来水冲洗30min,干燥水分。
移入超净工作台,用70%的乙醇溶液消毒0.5min,后用0.1% HgCl2溶液消毒10min。
最后用无菌水洗5~7次,干燥水分。
③接种在超净台中把菊花花瓣头尾剪去,余下部分剪成0.8-1cm的小段,接种在承有培养基的150ml 锥形瓶中,每瓶1-2段。
④培养接种后,在26~28℃,光照度1000~2000lx,每天照光12h的实验室条件下培养14d左右,就可诱导出愈伤组织。
愈伤组织在原条件下培养10~15d便可分化出不定芽。
当芽长到1~2cm时,分割芽转入生根培养基中,继续培养10d上下,就可长出白根,形成完整的植株。
[2][4]4. 影响植物组织培养成功的因素植物组织培养成功与否,除了规范的操作作为保障,还与其它一些因素密切相关。
4.1 培养基成分4.1.1 基本培养基与pH 值不同植物、不同外植体进行植物组织培养培养要求的基本培养基均有差异。
不同基本培养基的成分(盐浓度、有机物含量等)会有不同。
例如,某一植物的外植体在培养过程中要求较高的盐浓度,而这样的浓度用于另一外植体则会造成褐化现象。
因此,二者要选择不同的基本培养基。
培养基的pH 值因培养材料不同而异, 大多数植物种类要求pH 值在5. 0~ 6. 0。
培养基的pH值可以通过影响培养物的营养元素的吸收过程来影响呼吸代谢、多胺代谢与脱氧核糖核酸合成、植物激素进出细胞等作用, 进而直接或间接地影响愈伤组织形成及形态建成;适当降低PH值还可有助于抑制褐化现象。
4.1.2 外源激素的种类和浓度植物组织培养中,只有使用适当的外源激素才能绣导细胞分裂的启动、愈伤组织生长以及根、芽的分化等合乎理想的变化。
不同的植物、不同的外植体对于不同种类、浓度的外源激素反应不同。
①生长素类生长素类的主要作用是使已停止分裂的植物细胞恢复分裂能力。
常用生长素有2, 4- D( 2, 4- 二氯苯氧乙酸) 、NAA( 萘乙酸) 、IAA( 吲哚乙酸)、IBA( 吲哚丙酸) 等。
不同植物种类对生长素的浓度反应不同, 一般而言, 2, 4- D 是生长素中诱导愈伤组织和实现细胞悬浮培养最有效的物质,常用浓度为0. 2~ 2. 0 mg / L。
实际效果视具体情况而定,例如较高浓度的2, 4- D 对 Chinese Leymus 组织培养再生芽的诱导和再生非常有效。
②细胞分裂素细胞分裂素通过促进细胞的分裂和扩大, 使茎增粗, 抑制茎伸长, 诱导芽的分化, 进而促进侧芽萌发生长。
常用的细胞分裂素有激动素( KT) 、6 - 苄基腺嘌呤( 6- BA) 等。
细胞分裂素在诱导愈伤组织的时候, 一般要和生长素配合使用, 增强生长素的诱导作用和效果。
在愈伤组织的诱导、器官发生和增殖过程中, 细胞分裂素和生长素的比例是非常重要的,当细胞分裂素含量高时产生不定芽, 反之, 产生不定根或维持愈伤组织。
而两者的具体比例因内、外源激素的含量不同而不同, 并且内、外源激素对植物离体培养形态发生起着相互的连续性作用。
细胞分裂素对某些植物胚性细胞的诱导有抑制作用。
因此, 要根据需要选用适当的细胞分裂素种类。
4.1.3 碳源碳源不仅给外植体提供能量, 而且也能维持一定的渗透压,是植物组织培养不可缺少的成分。
常用的碳源有果糖、葡萄糖、蔗糖、蔗糖等。
植物对于不同糖的反应不同,而糖类的浓度大小不仅影响出愈率, 而且还影响愈伤组织的质地和结构。
例如,当糖类( 蔗糖或葡萄糖) 浓度由4% 降到1%时, 西黄松子叶愈伤组织由原来致密、干燥状变为松软包围着一层粘液膜的软湿状。
因此,碳源的选择要适当。
4.1.4 琼脂琼脂在植物组织培养中作为凝固剂。
琼脂含量低容易导致玻璃化现象发生。
4.2 外植体的选择同一植物不同的器官和组织, 变为外植体后,所需的培养条件是不同的;即使是相同种类的组织或器官,但存在生理学或发育年龄的差异,成功进行组织培养也需要不同的培养环境。
外植体的选择是影响组织培养效果的主要因素之一。
外植体脱分化难易程度与其生理状态有关。
外植体的年龄与分化程度对组织的再生能力有很大的影响。
通常植株的幼嫩组织, 如胚、子叶、实生苗的嫩茎和嫩芽、幼龄植株上的组织作为外植体要比老龄化植株上的组织容易诱导成功,分化程度低的外植体比高度分化的外植体容易诱导成功。
取材时间对培养的成功也会造成影响。
一般春季是植物生长的旺季, 植物再生能力最强, 是进行植物组织培养的最佳时节。
4.3 操作过程操作中有一些需注意的事项,关乎实验的成败:(1)接种需要严格执行无菌操作:用的工具、器具、培养基必须结果高压灭菌。
接种前,要用紫外消毒接种室20min,接种者要用肥皂洗干净双手,然后用70%酒精棉球消毒。
(2)外植体在培养基中要分布均匀,放置外植体数量根据锥形瓶的大小确定,以充分利用培养基中的营养成分和光照条件。
(3)要轻压外植体,保证与培养基的充分接触,但又要注意不可完全浸没,因为需要与空气接触。
(4)接种后的锥形瓶最好放在无菌箱中培养,培养期间应定期消毒,控制好温度和光照。
4.4 其它因素除了上述因素外,诸如实验经验、试剂品质等因素均会影响实验的成功率。
[5][6]参考文献[1]班振国,汤国庆等. 植物组织培养技术初探[J]. 内蒙古林业调查设计, 2009,32(3):103-106.[2]梁一池,杨华. 植物组织培养技术的研究进展[J]. 福建农林大学林学院, 2002,22(1):93-96.[3]肖哲丽,柳金凤. 植物组织培养的研究进展及新技术应用[J]. 宁夏农林科技, 2011, 52(1):13-14.[4]王金发、何炎明.《细胞生物学实验教程》.2004年9月第一版.北京:科学出版社,2004.9:83-85,91-93.[5]李万德,杜桂等. 植物组织培养实验中存在的问题及其解决办法[J]. 湖北生态工程技术学院学报, 2006,4(2):11-12.[6]张彦妮.影响植物组织培养成功的因素[J].北方园艺.2006(3):132-133Review on plant tissue culture technologyXXX( biotechnology and application,School of Life Science Sun Yat-sun University, Guangzhou, 510275) Abstract: Tissue culture is a kind of common methods of cell biology research..Its main point is to observeand research the explants growing,reproduing or passaging in a vitro environment simulating to the inner conditions of plants. Tissue culture is base on the theory of cell totipotency and it has several main steps that are the preparation of Culture medium ,the preparation of explants,disinfection,inoculation and training.Tissue culture will turn out to be successful or not depends on some important Tissue factor,such as Medium composition,choice of explants,practical operation and so on.Key words: plant; explant; tissue culture。
