2008年宁夏(理综)高考试卷及答案
2008年普通高等学校招生全国统一考试宁夏卷理综物理部分

2008年普通高等学校招生全国统一考试(宁夏卷)理科综合能力测试物理部分第I 卷二、选择题:本题共8小题,每小题6分,在每小题给出的四个选项中,有的只有一处选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分。
14.在等边三角形的三个顶点a 、b 、c 处,各有一条长直导线垂直穿过纸面,导线中通有大小相等的恒定电流,方向如图。
过c 点的导线所受安培力的方向A.与ab 边平行,竖直向上B.与ab 边平行,竖直向下C.与ab 边垂直,指向左边D.与ab 边垂直,指向右边15.一个T 型电路如图所示,电路中的电Ω=10R 1, Ω=120R 2 ,Ω=40R 3.另有一测试电源,电动势为100V ,内阻忽略不计。
则A.当cd 端短路时,ab 之间的等效电阻是40ΩB. 当ab 端短路时,cd 之间的等效电阻是40ΩC. 当ab 两端接通测试电源时,cd 两端的电压为80 VD. 当cd 两端接通测试电源时,ab 两端的电压为80 V16.如图所示,同一平面内的三条平行导线串有两个电阻R 和r ,导体棒PQ 与三条导线接触良好;匀强磁场的方向垂直纸面向里。
导体棒的电阻可忽略。
当导体棒向左滑动时,下列说法正确的是A.流过R 的电流为由d 到c ,流过r 的电流为由b 到aB.流过R 的电流为由c 到d ,流过r 的电流为由b 到aC.流过R 的电流为由d 到c ,流过r 的电流为由a 到bD.流过R 的电流为由c 到d ,流过r 的电流为由a 到b17.甲乙两年在公路上沿同一方向做直线运动,它们的v-t 图象如图所示。
两图象在t=t1时相交于P 点,P 在横轴上的投影为Q ,△OPQ 的面积为S 。
在t=0时刻,乙车在甲车前面,相距为d 。
已知此后两车相遇两次,且第一次相遇的时刻为t ′,则下面四组t ′和d 的组合可能是A. t ′=t 1 , d=SB. S 41d t 21t 1==', C.S 21d t 21t 1==', D. S 43d t 21t 1==', 18.一滑块在水平地面上沿直线滑行,t=0时其速度为1 m/s 。
2008年普通高等学校招生全国统一考试宁夏卷理
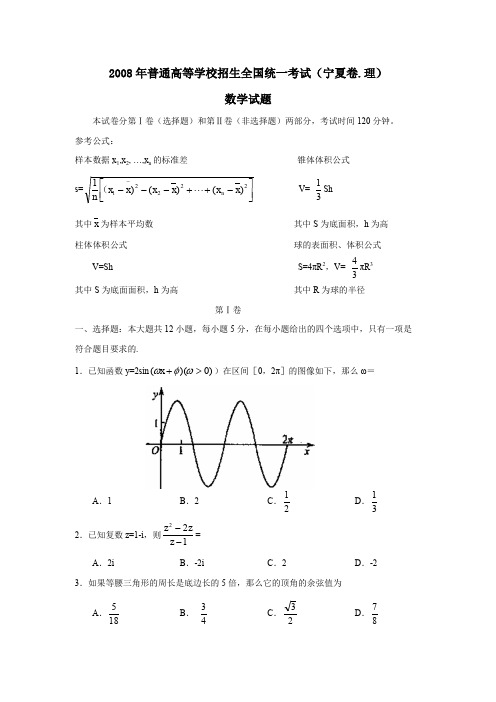
2008年普通高等学校招生全国统一考试(宁夏卷.理)数学试题本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,考试时间120分钟。
参考公式:样本数据x 1,x 2, …,x n 的标准差 锥体体积公式s=⎥⎦⎤⎢⎣⎡-++----22221)()()1x x x x x x n n ( V= 31Sh 其中x 为样本平均数 其中S 为底面积,h 为高 柱体体积公式球的表面积、体积公式 V=ShS=4πR 2,V=34πR 3其中S 为底面面积,h 为高其中R 为球的半径第Ⅰ卷一、选择题:本大题共12小题,每小题5分,在每小题给出的四个选项中,只有一项是 符合题目要求的.1.已知函数y=2sin )0)((>+ωφωx )在区间[0,2π]的图像如下,那么ω=A .1B .2C .21D .31 2.已知复数z=1-i ,则122--z zz =A .2iB .-2iC .2D .-23.如果等腰三角形的周长是底边长的5倍,那么它的顶角的余弦值为A .185 B .43 C .23 D .874.设等比数列(a n )的公比q=2,前n 项和为S n , 则24a S = A .2 B .4 C .215 D .217 5.下面的程序框图,如果输入三个实数a, b, c,要求输出这三个数中最大的数,那么在空白的判断框中,应该填入下面四个选项中的A .c>xB .x>cC .c>bD .b>c6.已知a 1>a 2>a 3>0,则使得(1- a i x )2<1(i=1,2,3)都成立的x 取值范围是A .(0,11a ) B .(0,12a ) C .(0,31a ) D .(0,32a ) 7.23sin 702cos 10-︒=-︒A .12B.2C .2 D.28.平面向量a, b 共线的充要条件是A .a, b 方向相同B .a, b 两向量中至少有一个为零向量C .∃λ∈R ,b=λaD .存在不全为零的实数λ1,λ2,λ1a+λ2b=09.甲、乙、丙3位志愿者安排在周一至周五的5天中参加某项志愿者活动,要求每人参加一天且每天至多安排一人,并要求甲安排在另外两位前面.不同的安排方法共有A .20种B .30种C .40种D .60种10.由直线x=12,x=2,曲线1y x =及x 轴所围图形的面积为 A .154 B .174 C .1ln 22D .2ln211.已知点P 在抛物线24y x =上,那么点P 到点Q (2,-1)的距离与点P 到抛物线焦点距离之和取得最小值时,点P 的坐标为A .(14,-1) B .(14,1) C .(1,2) D .(1,-2)12.,在该几何体的正视图中,的线段,在该几何体的侧视图与俯视图中,这条棱的投影分别是长为a 和b 的线段,则a+b 的最大值为A .B .C .4D .第Ⅱ卷本卷包括必考题和选考题两部分。
(精编精校)2008年普通高等学校招生全国统一考试 理综化学(宁夏卷) 解析版

2008年宁夏高考化学试卷一、选择题:本题共7小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的.1.(6分)(2008•宁夏)图标所警示的是()A.当心火灾﹣﹣氧化物B.当心火灾﹣﹣易燃物质C.当心爆炸﹣﹣自燃物质 D.当心爆炸﹣﹣爆炸性物质【分析】A、根据氧化物的正确标志进行分析;B、根据易燃物质的正确标志进行分析;C、根据当心爆炸与自燃物质的正确标志进行分析;D、根据当心爆炸与爆炸性物质的正确标志进行分析.【解答】解:A 、氧化物的正确标志为,故A错误;B 、如图所示图标是当心火灾﹣﹣﹣﹣易燃物质的正确标志,故B正确;C 、自燃物质的正确标志是,故C错误;D 、当心爆炸﹣﹣﹣﹣爆炸性物质的正确标志是,故D错误;故选B.【点评】在生活实践中有很多图标,对人们的生活、生产有着重要的指导作用,特别是在实验室中很多图标关乎我们的生命和健康,要认真对待,要了解并熟记其含义.2.(6分)(2008•宁夏)在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是()A.①②B.②③C.③④D.②④【分析】在常见的有机化合物中甲烷是正四面体结构,乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断.【解答】解:①丙烯CH2=CH﹣CH3中有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故①错误;②乙烯具有平面型结构,CH2=CHCl 看作是一个氯原子取代乙烯中的一个氢原子,所有原子在同一个平面,故②正确;③苯是平面型结构,所有原子在同一个平面,故③正确;④甲苯含有一个甲基,甲基具有甲烷的结构特点,因此所有原子不可能处于同一平面上,故④错误.所以②③正确,故选B.【点评】本题主要考查有机化合物的结构特点,做题时注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.3.(6分)(2008•宁夏)下列说法错误的是()A.乙醇和乙酸都是常用调味品的主要成分B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C.乙醇和乙酸都能发生氧化反应D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应【分析】A.料酒的主要成分是乙醇,食醋的主要成分是乙酸;B.乙醇和乙酸常温下为液体,C2H6、C2H4常温下为气体;C.乙醇可以发生催化氧化,乙醇与乙酸都可以燃烧;D.酯化反应和皂化反应需要的条件不同,物质不同,二者不是互为逆反应.【解答】解:A.料酒的主要成分是乙醇,食醋的主要成分是乙酸,故A正确;B.乙醇分子之间、乙酸分子之间都存在氢键,乙醇和乙酸常温下为液体,C2H6、C2H4常温下为气体,乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高,故B正确;C.乙醇可以发生催化氧化,乙醇与乙酸都可以燃烧,燃烧属于氧化反应,故C正确;D.乙醇和乙酸之间发生酯化反应生成乙酸乙酯,皂化反应是在碱性条件下进行的水解反应生成高级脂肪酸盐与水,与酯化反应的条件不同,物质不同,二者不互为逆反应,故D错误;故选D.【点评】本题考查乙醇、乙酸的性质与用途等,比较基础,旨在考查学生对基础知识的理解掌握.4.(6分)(2008•宁夏)一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是()A.CH3OH(g)+O2(g)=H2O(l)+CO2(g)+2H+(aq)+2e﹣B.O2(g)+4H+(aq)+4e﹣=2H2O(l)C.CH3OH(g)+H2O(l)=CO2(g)+6H+(aq)+6e﹣D.O2(g)+2H2O(l)+4e﹣=4OH﹣【分析】燃料电池是一种特殊的原电池,负极上是燃料发生失电子的氧化反应,正极上是氧气发生得电子的还原反应,电子从负极流向正极.【解答】解:以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳.该电池负极发生的反应是:CH3OH+H2O﹣6e﹣═CO2+6H+,故选C.【点评】本题考查学生燃料电池的工作原理知识,可以根据所学知识进行回答,难度不大.5.(6分)(2008•宁夏)第三周期元素E的氯化物ECl n的熔点为﹣78℃,沸点为59℃;若0.2molECl n与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀.下列判断错误的是()A.E是一种非金属元素B.在ECl n中E与Cl之间形成共价键C.E的一种氧化物为EO2D.E位于元素周期表的IV A族【分析】第三周期元素E的氯化物ECl n的熔点为﹣78℃,沸点为59℃,因而ECl n形成的晶体为分子晶体,即E 元素是一种非金属元素,根据氯原子守恒计算n的值,确定E元素.据此解答.【解答】解:ECl n熔沸点较低,因而ECl n形成的晶体为分子晶体,即E元素是一种非金属元素.0.2molECl n与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀,根据氯原子守恒有:0.2mol×n=,即n=2,即E应为硫元素.A、根据题中信息可知:ECl n熔沸点较低,因而ECl2形成的晶体为分子晶体,E元素是一种非金属元素,且E为硫元素,故A正确;B、E元素是一种非金属元素,为硫元素,非金属元素之间形成共价键,所以S与Cl之间形成共价键,故B正确;C、E为硫元素,硫的一种氧化物为SO2,故C正确;D、E为硫元素,原子核外有16个电子,核外电子排布为2、8、6,所以硫元素处于第三周期第ⅥA族,故D错误.故选D.【点评】本题考查位置结构与性质关系,根据晶体性质结合计算确定元素种类是解题关键,难度较大.6.(6分)(2008•宁夏)将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)⇌NH3(g)+HI(g);②2HI(g)⇌H2(g)+I2(g)达到平衡时,c(H2)=0.5mol•L﹣1,c(HI)=4mol•L﹣1,则此温度下反应①的平衡常数为()A.9 B.16 C.20 D.25【分析】反应①的平衡常数k=c(NH3)•c(HI),NH4I分解生成的HI为平衡时HI与分解的HI之和,即为NH4I 分解生成的NH3,由反应②可知分解的c(HI)为平衡时c(H2)的2倍,求出为NH4I分解生成的NH3,代入反应①的平衡常数k=c(NH3)•c(HI)计算.【解答】解:平衡时c(HI)=4mol•L﹣1,HI分解生成的H2的浓度为0.5mol•L﹣1.NH4I分解生成的HI的浓度为4mol•L﹣1+2×0.5mol•L﹣1=5mol•L﹣1,所以NH4I分解生成的NH3的浓度为5mol•L ﹣1,所以反应①的平衡常数k=c(NH3)•c(HI)=5mol•L﹣1×4mol•L﹣1=20mol2•L﹣2.故选C.【点评】本题的解题关键在于平衡时HI为NH4I分解生成的HI与分解的HI之差,难度较大.7.(6分)(2008•宁夏)已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ•mol﹣1、1411.0kJ•mol ﹣1和1366.8kJ•mol﹣1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为()A.﹣44.2 kJ•mol﹣1B.+44.2 kJ•mol﹣1C.﹣330 kJ•mol﹣1D.+330 kJ•mol﹣1【分析】由燃烧热的概念写出各反应的热化学方程式,利用盖斯定律计算.【解答】解:已知H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是﹣285.8kJ/mol、﹣1411.0kJ/mol和﹣1366.8kJ/mol,则有:①H2(g)+O2(g)=H2O(l)△H=﹣285.8kJ/mol;②C2H4(g)+3O2(g)=2H2O(l)+2CO2(g)△H=﹣1411.0kJ/mol;③C2H5OH(l)+3O2(g)=3H2O(l)+2CO2(g)△H=﹣1366.8kJ/mol;根据盖斯定律②﹣③可得:C2H4(g)+H2O(l)=C2H5OH(l)△H=﹣44.2kJ/mol,故选A.【点评】本题考查反应热的计算,题目难度中等,注意盖斯定律应用于反应热的计算.二、非选择题8.(14分)(2008•宁夏)已知可逆反应:M(g)+N(g)⇌P(g)+Q(g)△H>0,请回答下列问题.(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol•L﹣1,c(N)=2.4mol•L﹣1,达到平衡后,M的转化率为60%,此时N的转化率为25%.(2)若反应温度升高,M的转化率增大(填“增大”、“减小”或“不变”)(3)若反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L﹣1,a=6.(4)若反应温度不变,反应物的起始浓度为:c(M)=c(N)=b mol•L﹣1,达到平衡后,M的转化率为41%.【分析】(1)根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N 的浓度变化量,再根据转化率定义计算;(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;(3)由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算;(4)设平衡时M的浓度变化量为xmol/L,由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算x的值,在利用转化率等于计算.【解答】解:(1)△c(M)=60%×1mol•L﹣1=0.6mol•L﹣1,浓度变化量之比等于化学计量数之比,所以△c(N)=△c(M)=0.6mol•L﹣1,故此时N的转化率×100%=25%,故答案为:25%;(2)该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大,故答案为:增大;(3))△c(M)=60%×1mol•L﹣1=0.6mol•L﹣1,则:M(g)+N(g)⇌P(g)+Q(g);初始(mol/L):1 2.4 0 0转化(mol/L):0.6 0.6 0.6 0.6平衡(mol/L):0.4 1.8 0.6 0.6故该温度下平衡常数k==0.5,反应温度不变,反应物的起始浓度分别为c(M)=4mol•L﹣1,c(N)=amol•L﹣1;达到平衡后,c(P)=2mol•L ﹣1,则:M(g)+N(g)⇌P(g)+Q(g);初始(mol/L):4 a 0 0转化(mol/L):2 2 2 2平衡(mol/L):2 a﹣2 2 2所以=0.5,解得a=6,故答案为:6;(4)设平衡时M的浓度变化量为为xmol/L,则:M(g)+N(g)⇌P(g)+Q(g);初始(mol/L):b b 0 0变化(mol/L):x x x x平衡(mol/L):b﹣x b﹣x x x所以=0.5,解得x=0.41b,故M的转化率为×100%=41%,故答案为:41%.【点评】本题考查化学平衡的有关计算、平衡常数的有关计算等,题目难度不大,注意理解化学平衡常数的用途,判断反应进行程度、判断反应进行的方向、计算转化率等.9.(14分)(2008•宁夏)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子.有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜.填写下面空白.(1)图中标号处需加入的相应物质分别是①铁屑、②稀硫酸、③稀硝酸、④氢氧化钠、⑤氢氧化钠.(2)写出①处发生反应的离子方程式Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+;2Au3++3Fe=2Au+3Fe2+.写出③处发生反应的化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O.(3)铁红的化学式为Fe2O3;分别写出铁红和氧化铜在工业上的一种主要用途:铁红用作红色涂料;氧化铜用作制造铜盐的原料.【分析】由工艺流程图示知,E为铁元素的离子,而A为铜、金的单质,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,因此①处加入的物质为铁屑,发生的反应为Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;②处加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的硫酸亚铁溶液与含Fe2+的E溶液相混合;③处利用金不溶于硝酸的性质将铜与金分离开;④处将得到的铜离子用氢氧化钠转化为氢氧化铜沉淀,从而再受热分解为氧化铜;⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红(氧化铁),以此解答题中各小问.【解答】解:由工艺流程图示知,E为铁元素的离子,而A为铜、金的单质,通过过滤将铁元素与活泼性比它弱的铜、金分离出来,因此①处加入的物质为铁屑,发生的反应为Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;②处加入稀硫酸以除去铜、金中过量的铁屑,并将过滤后的硫酸亚铁溶液与含Fe2+的E溶液相混合;③处利用金不溶于硝酸的性质将铜与金分离开;④处将得到的铜离子用氢氧化钠转化为氢氧化铜沉淀,从而再受热分解为氧化铜;⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红(氧化铁).(1)由以上分析可知①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠,故答案为:铁屑;稀硫酸;稀硝酸;氢氧化钠;氢氧化钠;(2)①处加入的物质为铁屑,发生的反应为Fe+2H+═Fe2++H2↑,2Fe3++Fe═3Fe2+,Cu2++Fe═Cu+Fe2+,2Au3++3Fe═2Au+3Fe2+;③处利用金不溶于硝酸的性质将铜与金分离开,反应的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+;2Au3++3Fe=2Au+3Fe2+;3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;(3)⑤处加入氢氧化钠将亚铁离子转化为氢氧化亚铁沉淀,再利用空气将其转化为氢氧化铁沉淀,最终受热分解为铁红,常用作红色涂料,氧化铜常用作制造铜盐的原料.故答案为:Fe2O3;用作红色涂料;用作制造铜盐的原料.【点评】本题考查常见金属及其化合物的综合应用,题目难度中等,本题注意铁与多种氧化剂反应的顺序以及氢氧化亚铁易被氧化的性质.10.(15分)(2008•宁夏)为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);方案二:将g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol•L﹣1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液.请回答下列问题:(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+1K2SO4+8H2O(2)在滴定实验中不能选择碱式滴定管,理由是KMnO4是强氧化剂,它会腐蚀乳胶管;(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为和;(铁的相对原子质量以55.9计)(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析.①方案一不一定准确(填“准确”“不准确”“不一定准确”),理由是如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确;②方案二不一定准确(填“准确”“不准确”“不一定准确”),理由是如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确.【分析】(1)根据氧化还原反应得失电子数目相等结合质量守恒定律配平;(2)橡胶可以被酸性物质和强氧化性物质腐蚀;(3)根据反应的化学方程式计算方案一和方案二铁片中铁的质量分数;(4))①方案一:如金属不纯,存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;含有不生成氢气的氧化物,会导致结果偏低;②方案二不一定准确,如含有其它还原性金属,在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低.【解答】解:(1)元素的化合价变化为:Mn:+7→+2,改变数为5,Fe:+2→+3,改变数为1,根据化合价升降的总数相等可知,KMnO4与FeSO4的化学计量数比值为1:5,然后根据质量守恒配平化学方程式,配平后的化学方程式为2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,故答案为:2;10;8;5;2;1;8;(2)根据橡胶的性质,可以被酸性物质和强氧化性物质腐蚀,所以滴定时量取KMnO4溶液用酸式滴定管,故答案为:碱;KMnO4是强氧化剂,它会腐蚀乳胶管;(3)方案一:Fe+H2SO4=FeSO4+H2↑,n(H2)=n(Fe)=,m(Fe)=n(Fe)×56g/mol=1.45g,质量分数w(Fe)=,方案二:Fe+H2SO4=FeSO4+H2↑,2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O n(Fe)=n(FeSO4)=5n(KMnO4)=5×0.02000mol•L﹣1×0.025L=0.0025mol;m(Fe)=56×0.0025g=0.14g,质量分数w(Fe)=;故答案为:;;(4)①方案一:如金属不纯,存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;含有不生成氢气的氧化物,会导致结果偏低,故答案为:不一定准确;如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确;②方案二不一定准确,如含有其它还原性金属,在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低,故答案为:不一定准确;如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确.【点评】本题考查物质的组成和含量的测量,题目较为综合,难度较大,注意把握实验方案的设计原理.本题易错点为(4);试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.。
2008年普通高等学校招生全国统一考试理综试题及答案-宁夏卷

绝密★启用前2008年普通高等学校招生全国统一考试(宁夏卷)理科综合能力测试本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,其中第Ⅱ卷第30~38题为选考题,其它题为必考题。
考生作答时,将答案答在答题卡上,在本试卷上答题无效。
考试结束后,将本试卷和答题卡一并交回。
注意事项:1、答题前,考生务必先将自己的姓名、准考证号填写在答题卡上,认真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。
2、选择题答案使用2B铅笔填涂,如需改动,用橡皮擦干净后,再选涂其它答案标号;非选择题答案使用0、5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚。
3、请按照题号在各题的答题区域(黑色线框)内作答,超出答题区域书写的答案无效。
4、保持卡面清洁,不折叠,不破损。
5、做选考题时,考生按照题目要求作答,并用2B铅笔在答题卡上把所选题目对应的题号涂黑。
第I卷一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1、下列过程不.属于细胞分化的是A、B淋巴细胞形成浆细胞B、胚胎干细胞形成神经细胞C、质壁分离植物细胞的复原D、蜥蜴断尾再生2、为证实叶绿体有效放氧功能,可利用含有水绵与好氧细菌的临时装片进行实验,装片需要给予一定的条件,这些条件是A、光照、有空气、临时装片中无NaHCO3稀溶液B、光照、无空气、临时装片中无NaHCO3稀溶液C、黑暗、有空气、临时装片中无NaHCO3稀溶液D、黑暗、无空气、临时装片中无NaHCO3稀溶液3、刺激某一个神经元引起后一个神经元兴奋。
当给予某种药物后,再刺激同一个神经元,发现神经冲动的传递被阻断,但检测到突触间隙中神经递质的量与给予药物之前相同。
这是由于该药物A、抑制了突触小体中递质的合成B、抑制了突触后膜的功能C、与递质的化学结构完全相同D、抑制了突触前膜递质的释放4、长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别分A、降低、CO2、Na2CO3B、降低、乳酸、NaHCO3C、升高、CO2、H2CO3D、升高、乳酸、NaHCO35、以下有关基因重组的叙述,错误..的是A、非同源染色体的自由组合能导致基因重组B、非姊妹染色单体的交换可引起基因重组C、纯合体自交因基因重组导致子代性状分离D、同胞兄妹间的遗传差异与父母基因重组有关6、有一山区由于开采露天小铁矿等活动,自然生态系统完全被破坏,成为一片废墟,为尽快使该山区恢复到原有自然生态系统状态,应采取的最好措施是在这片废墟上A、回填土壤,引进多种外来物种,重建新的生态系统B、撤出人类全部活动,实行全面封闭,等待自然恢复C、回填土壤,栽培当地经济农作物,发展农业生产D、回填土壤,栽种多种当地原有的植物,实行封山育林7、图标所警示的是A、当心火灾——氧化物B、当心火灾——易燃物质C、当心爆炸——自然物质D、当心爆炸——爆炸性物质8、在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是A、①②B、②③C、③④D、②④9、下列说法错误..的是A、乙醇和乙酸都是常用调味品的主要成分B、乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C、乙醇和乙酸都能发生氧化反应D、乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应10、一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
2008年高考宁夏卷

2008年高考宁夏卷--理综(生物)(本卷生物选择题包括6小题,每小题6分,单选,共36分;非选择题包括2小题必做,39分,2小题选做1,15分,共54分;生物部分合计90分;全卷物化生总计300分)一、选择题(6小题,每小题6分,共36分)1、下列过程不属于细胞分化的是A、B淋巴细胞形成浆细胞B、胚胎干细胞形成神经细胞C、质壁分离植物细胞的复原D、蜥蜴断尾再生2、为证实叶绿体有放氧功能,可利用含有水绵与好氧细菌的临时装片进行实验,装片需要给予一定的条件,这些条件是A、光照、有空气、临时装片中无NaHCO3稀溶液B、光照、无空气、临时装片中有NaHCO3稀溶液C、黑暗、有空气、临时装片中无NaHCO3稀溶液D、黑暗、无空气、临时装片中有NaHCO3稀溶液3、刺激某一个神经元引起后一个神经元兴奋。
当给予某种药物后,再刺激同一个神经元发现神经冲动的传递被阻断,但检测到突触间隙中神经递质的量与给予药物之前相同。
这是由于该药物A、抑制了突触小体中递质的合成B、抑制了突触后膜的功能C、与递质的化学结构完全相同D、抑制了突触前膜递质的释放4、长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别是A、降低、CO2、Na2CO3B、降低、乳酸、NaHCO3C、升高、CO2、H2CO3D、升高、乳酸、NaHCO35、以下有关基因重组的叙述,错误的是A、非同源染色体的自由组合能导致基因重组B、非姊妹染色单体的交换可引起基因重组C、纯合体自交因基因重组导致子代性状分离D、同胞兄妹的遗传差异与父母基因重组有关6、有一山区由于开采露天小铁矿等活动,自然生态系统完全被破坏,成为一片废墟,为尽快使该山区恢复到原有自然生态系统状态,应采取的最好措施是在这片废墟上A、回填土壤,引进多种外来物种,重建新的生态系统B、撤出人类全部活动,实行全面封闭,等待自然恢复C、回填土壤,栽培当地经济农作物,发展农业生产D、回填土壤,栽种当地原有的植物,实行封山育林二、非选择题必做题(39分,包括28、29题,共2题)28、(16分)回答下列Ⅰ、Ⅱ题:Ⅰ、将长势相同、数量相等的甲、乙两个品种的大豆幼苗分别置于两个相同的密闭透明玻璃罩内,在光照、温度等相同且适宜的条件下培养,定时测定玻璃罩内的CO2含量,结坚果如图。
2008年全国新课标理综高考试卷加答案

2008年普通高等学校招生全国统一考试(宁夏卷)理科综合能力测试第Ⅰ卷一、选择题(本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
)1.下列过程不.属于细胞分化的是()A.B淋巴细胞形成浆细胞B.胚胎干细胞形成神经细胞C.质壁分离植物细胞的复原D.蜥蜴断尾再生2.为证实叶绿体有放氧功能,可利用含有水绵与好氧细菌的临时装片进行实验,装片需要给予一定的条件,这些条件是()A.光照、有空气、临时装片中无NaHCO3稀溶液B.光照、无空气、临时装片中有NaHCO3稀溶液C.黑暗、有空气、临时装片中无NaHCO3稀溶液D.光照、无空气、临时装片中有NaHCO3稀溶液3.刺激某一个神经元引起后一个神经元兴奋。
当给予某种药物后,再刺激同一个神经元,发现神经冲动的传递被阻断,但检测到突触间隙中神经递质的量与给予药物之前相同。
这是由于该药物()A.抑制了突触小体中递质的合成B.抑制了突触后膜的功能C.与递质的化学结构完全相同D.抑制了突触前膜递质的释放4.长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别是()A.降低、CO2、Na2CO3B.降低、乳酸、NaHCO3C.升高、CO2、H2CO3D.升高、乳酸、NaHCO35.以下有关基因重组的叙述,错误..的是()A.非同源染色体的自由组合能导致基因重组B.非姐妹染色单体的交换可引起基因重组C.纯合体自交因基因重组导致子代性状分离D.同胞兄妹间的遗传差异与父母基因重组有关6.有一山区由于开采露天小铁矿等活动,自然生态系统完全被破坏,成为一片废墟,为尽快使该山区恢复到原有自然生态系统状态,应采取的最好措施是在这片废墟上()A.回填土壤,引进多种外来物种,重建新的生态系统B.撤出人类全部活动,实行全面封闭,等待自然恢复C.回填土壤,栽培当地经济农作物,发展农业生产D.回填土壤,栽种多种当地原有的植物,实行封山育林7.图标所警示的是()A.当心火灾——氧化物B. 当心火灾——易燃物质C.当心爆炸——自燃物质D. 当心爆炸——爆炸性物质8.在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是()A.①②B.②③C.③④D.②④9.下列说法错误..的是()A.乙醇和乙酸都是常用调味品的主要成分B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C.乙醇和乙酸都能发生氧化反应D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应10.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
2008年高考试题--理综(宁夏卷)word含答案
2008年普通高等学校招生全国统一考试理科综合能力测试第I卷一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列过程不.属于细胞分化的是A.B淋巴细胞形成浆细胞B.胚胎干细胞形成神经细胞C.质壁分离植物细胞的复原D.蜥蜴断尾再生2.为证实叶绿体有效放氧功能,可利用含有水绵与好氧细菌的临时装片进行实验,装片需要给予一定的条件,这些条件是A.光照、有空气、临时装片中无NaHCO3稀溶液B.光照、无空气、临时装片中无NaHCO3稀溶液C.黑暗、有空气、临时装片中无NaHCO3稀溶液D.光照、无空气、临时装片中无NaHCO3稀溶液3.刺激某一个神经元引起后一个神经元兴奋。
当给予某种药物后,再刺激同一个神经元,发现神经冲动的传递被阻断,但检测到突触间隙中神经递质的量与给予药物之前相同。
这是由于该药物A.抑制了突触小体中递质的合成B.抑制了突触后膜的功能C.与递质的化学结构完全相同D.抑制了突触前膜递质的释放4.长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别分A.降低、CO2、Na2CO3B.降低、乳酸、NhHCO3C.升高、CO2、H2CO3D.升高、乳酸、NaHCO35.以下有关基因重组的叙述,错误..的是A.非同源染色体的自由组合能导致基因重组B.非姊妹染色体的交换可引起基因重组C.纯合体自交因基因重组导致子代性状分离D.同胞兄妹间的遗传差异与父母基因重组有关6.有一山区由于开采露天小铁矿等活动,自然生态系统完全被破坏,成为一片废墟,为尽快使该山区恢复到原有自然生态系统状态,应采取的最好措施是在这片废墟上A.回填土壤,引进多种外来物种,重建新的生态系统B.撤出人类全部活动,实行全面封闭,等待自然恢复C.回填土壤,栽培当地经济农作物,发展农业生产D.回填土壤,栽种多种当地原有的植物,实行封山育林7.图标所警示的是A.当心火灾——氧化物B. 当心火灾——易燃物质C.当心爆炸——自然物质D. 当心爆炸——爆炸性物质8.在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是A.①②B.②③C.③④D.②④9.下列说法错误..的是A.乙醇和乙酸都是常用调味品的主要成分B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C.乙醇和乙酸都能发生氧化反应D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应10.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
2008高考宁夏理综物理卷(word版)
2008年普通高等学校招生全国统一考试理科综合能力测试(物理部分)第I 卷二、选择题:本题共8小题,每小题6分,在每小题给出的四个选项中,有的只有一处选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分。
14.在等边三角形的三个顶点a 、b 、c 处,各有一条长直导线垂直穿过纸面,导线中通有大小相等的恒定电流,方向如图。
过c 点的导线所受安培力的方向A.与ab 边平行,竖直向上B.与ab 边平行,竖直向下C.与ab 边垂直,指向左边D.与ab 边垂直,指向右边15.一个T 型电路如图所示,电路中的电110R =Ω,23120,40R R =Ω=Ω.另有一测试电源,电动势为100V ,内阻忽略不计。
则A.当cd 端短路时,ab 之间的等效电阻是40ΩB. 当ab 端短路时,cd 之间的等效电阻是40ΩC. 当ab 两端接通测试电源时, cd 两端的电压为80 VD. 当cd 两端接通测试电源时, ab 两端的电压为80 V16.如图所示,同一平面内的三条平行导线串有两个最阻R 和r ,导体棒PQ 与三条导线接触良好;匀强磁场的方向垂直纸面向里。
导体棒的电阻可忽略。
当导体棒向左滑动时,下列说法正确的是A.流过R 的电流为由d 到c ,流过r 的电流为由b 到aB.流过R 的电流为由c 到d ,流过r 的电流为由b 到aC.流过R 的电流为由d 到c ,流过r 的电流为由a 到bD.流过R 的电流为由c 到d ,流过r 的电流为由a 到b17.甲乙两年在公路上沿同一方向做直线运动,它们的v-t 图象如图所示。
两图象在t =t 1时相交于P 点,P 在横轴上的投影为Q ,△OPQ 的面积为S 。
在t =0时刻,乙车在甲车前面,相距为d 。
已知此后两车相遇两次,且第一次相遇的时刻为t ′,则下面四组t ′和d 的组合可能是A. t ′=t 1 ,d=SB. t ′=111,24t d S = C. t ′111,22t d S == D. t ′=113,24t d S =18.一滑块在水平地面上沿直线滑行,t =0时其速度为1 m/s 。
2008年高考物理(宁夏卷)
2008理科综合能力测试·宁夏卷(物理部分)参考答案二、选择题14、C 15、AC 16、B17、D18、B19、D20、AB21、BC三、非选择题(一)必考题22、Ⅰ、⑴60;⑵7.18;⑶3.59Ⅱ、⑴0.495~0.497 m/s2;⑵①CD;②天平;⑶23、解:设两颗恒星的质量分别为m1、m2,做圆周运动的半径分别为r1、r2,角速度分别为ω1,ω2。
根据题意有ω1=ω2r1+r2=r根据万有引力定律和牛顿定律,有解得:24、解:⑴由几何关系得:R=dsinφ由洛仑兹力公式和牛顿第二定律得解得:⑵质点在电场中的运动为类平抛运动。
设质点射入电场的速度为v0,在电场中的加速度为a,运动时间为t,则有v0=vcosφvsinφ=at d=v0t解得:设电场强度的大小为E,由牛顿第二定律得qE =ma解得:(二)选考题30、⑴B C⑵解:①当木条A端刚刚离开斜面时,受力情况如图所示。
设斜面倾角为θ,根据力矩平衡条件,若满足条件木条就不会脱离斜面。
根据题意解得:②设G为木条重心,由题意可知当木条A端刚刚离开斜面时,受力情况如图所示。
由①中的分析可知,若满足>木条就不会脱离斜面解得:>0。
25 m31、⑴D⑵解:设大气和活塞对气体的总压强为p0,加一小盒沙子对气体产生的压强为p,由玻马定律得:解得:再加一小盒沙子后,气体的压强变为p0+2p。
设第二次加沙子后,活塞的高度为h′′解得:h′=32、⑴BD⑵解:由图知:sinα=由折射定律得:解得:β=30°由几何关系知,γ=30°。
由折射定律得:因此:解得::θ=60°33、(⑴8 4⑵设摆球A、B的质量分别为mA、mB,摆长为l,B球的初始高度为h1,碰撞前B球的速度为vB,在不考虑摆线质量的情况下,根据题意及机械能守恒定律得设碰撞前、后两摆球的总动量的大小分别为P1、P2。
有P1=mBvB 解得:同理可得:解得:即:由此可以推出:≤4%所以,此实验在规定的范围内验证了动量守恒定律。
(7)全国统一考试理科综合能力测试(宁夏)
2008年普通高等学校招生全国统一考试理科综合能力测试(宁夏)本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,其中第Ⅱ卷第30~38题为选考题,其它题为必考题。
考生作答时,将答案答在答题卡上,在本试卷上答题无效。
考试结束后,将本试卷和答题卡一并交回。
注意事项:1.2. 3. 4.5.做选考题时,考生按照题目要求作答,并用2B铅笔在答题卡上把所选题目对应的题号涂黑。
第I卷一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
(1-6生物题)7.图标所警示的是A.当心火灾——氧化物B. 当心火灾——易燃物质C.当心爆炸——自然物质D. 当心爆炸——爆炸性物质8.在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是A.①②B.②③C.③④D.②④9.下列说法错误..的是A.乙醇和乙酸都是常用调味品的主要成分B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C.乙醇和乙酸都能发生氧化反应D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应10.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
该电池负极发生的反应是A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+ (aq)+2e -B.O2(g)+4H+(aq)+4e -=2H2O(1)C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e -D.O2(g)+2H2O(1)+4e -=4OH -11.短周期元素E的氯化物ECl n R的熔点为-78℃,沸点为59℃;若0.2molECl n与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。
下列判断错误..的是A.E是一种非金属元素B.在ECl n中E与Cl之间形成共价键C.E的一种氧化物为EO2D.E位于元素周期表的IV A族12.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:达到平衡时,c(H2)=0.5mo l·L-1,c(HI)=4mo l·L-1,则此温度下反应①的平衡常数为A.9B.16C.20 25D.13.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mlo-1、-1411.0kJ·mlo-1和-1366.8kJ,则由C2H4(g)和H2O(I)反应生成C2H5OH(I)的△H为A.-44.2kJ·mol-1B.+44.2kJ·mlo-1C.-330kJ·mol-1D.+330kJ·mlo-1二、选择题:本题共8小题,每小题6分,在每小题给出的四个选项中,有的只有一处选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
绝密★启用前2008年普通高等学校招生全国统一考试(宁夏卷)理科综合能力测试本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,其中第Ⅱ卷第30~38题为选考题,其它题为必考题。
考生作答时,将答案答在答题卡上,在本试卷上答题无效。
考试结束后,将本试卷和答题卡一并交回。
注意事项:1.答题前,考生务必先将自己的姓名、准考证号填写在答题卡上,认真核对条形码上的姓名、准考证号,并将条形码粘贴在答题卡的指定位置上。
2.选择题答案使用2B铅笔填涂,如需改动,用橡皮擦干净后,再选涂其它答案标号;非选择题答案使用0.5毫米的黑色中性(签字)笔或碳素笔书写,字体工整、笔迹清楚。
3.请按照题号在各题的答题区域(黑色线框)内作答,超出答题区域书写的答案无效。
4.保持卡面清洁,不折叠,不破损。
5.做选考题时,考生按照题目要求作答,并用2B铅笔在答题卡上把所选题目对应的题号涂黑。
第I卷一、选择题:本题共13小题,每小题6分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列过程不.属于细胞分化的是A.B淋巴细胞形成浆细胞B.胚胎干细胞形成神经细胞C.质壁分离植物细胞的复原D.蜥蜴断尾再生2.为证实叶绿体有效放氧功能,可利用含有水绵与好氧细菌的临时装片进行实验,装片需要给予一定的条件,这些条件是A.光照、有空气、临时装片中无NaHCO3稀溶液B.光照、无空气、临时装片中无NaHCO3稀溶液C.黑暗、有空气、临时装片中无NaHCO3稀溶液D.黑暗、无空气、临时装片中无NaHCO3稀溶液3.刺激某一个神经元引起后一个神经元兴奋。
当给予某种药物后,再刺激同一个神经元,发现神经冲动的传递被阻断,但检测到突触间隙中神经递质的量与给予药物之前相同。
这是由于该药物A.抑制了突触小体中递质的合成B.抑制了突触后膜的功能C.与递质的化学结构完全相同D.抑制了突触前膜递质的释放4.长时间运动引起机体缺氧时,血液pH的变化趋势、引起pH变化的物质、能起缓冲作用的物质分别分A.降低、CO2、Na2CO3B.降低、乳酸、NaHCO3C.升高、CO2、H2CO3D.升高、乳酸、NaHCO35.以下有关基因重组的叙述,错误..的是A.非同源染色体的自由组合能导致基因重组B.非姊妹染色单体的交换可引起基因重组C.纯合体自交因基因重组导致子代性状分离D.同胞兄妹间的遗传差异与父母基因重组有关6.有一山区由于开采露天小铁矿等活动,自然生态系统完全被破坏,成为一片废墟,为尽快使该山区恢复到原有自然生态系统状态,应采取的最好措施是在这片废墟上A.回填土壤,引进多种外来物种,重建新的生态系统B.撤出人类全部活动,实行全面封闭,等待自然恢复C.回填土壤,栽培当地经济农作物,发展农业生产D.回填土壤,栽种多种当地原有的植物,实行封山育林7.图标所警示的是A.当心火灾——氧化物B. 当心火灾——易燃物质C.当心爆炸——自然物质D. 当心爆炸——爆炸性物质8.在①丙烯②氯乙烯③苯④甲苯四种有机化合物中,分子内所有原子均在同一平面的是A.①②B.②③C.③④D.②④9.下列说法错误..的是A.乙醇和乙酸都是常用调味品的主要成分B.乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高C.乙醇和乙酸都能发生氧化反应D.乙醇和乙酸之间能发生酯化反应,酯化反应和皂化反应互为逆反应10.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。
该电池负极发生的反应是A.CH3OH(g)+O2(g)=H2O(1)+CO2(g)+2H+(aq)+2e -B.O2(g)+4H+(aq)+4e -=2H2C(1)C.CH3OH(g)+H2O(1)=CO2(g)+6H+(aq)+6e -D.O2(g)+2H2O(1)+4e -=4OH -11.短周期元素E的氯化物ECl n的熔点为-78℃,沸点为59℃;若0.2molECl n与足量的AgNO3溶液完全反应后可以得到57.4g的AgCl沉淀。
下列判断错误..的是A.E是一种非金属元素B.在ECl n中E与Cl之间形成共价键C.E的一种氧化物为EO2D.E位于元素周期表的IV A族12.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:① NH4I(s) NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g)达到平衡时,c(H2)=0.5mol²L-1,c(HI)=4mol²L-1,则此温度下反映①的平衡常数为A.9B.16C.20D. 2513.已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ²mol-1、-1411.0kJ²mol-1和-1366.8kJ²mol-1,则由C2H4(g)和H2O(I)-反应生成C2H5OH(I)的△H为A.-44.2kJ²mol-1B.+44.2kJ²mol-1C.-330kJ²mol-1D.+330kJ²mol-1二、选择题:本题共8小题,每小题6分,在每小题给出的四个选项中,有的只有一处选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分。
14.在等边三角形的三个顶点a、b、c处,各有一条长直导线垂直穿过纸面,导线中通有大小相等的恒定电流,方向如图。
过c点的导线所受安培力的方向A.与ab边平行,竖直向上B.与ab边平行,竖直向下C.与ab 边垂直,指向左边D.与ab 边垂直,指向右边15.一个T 型电路如图所示,电路中的电110R =Ω,23120,40R R =Ω=Ω.另有一测试电源,电动势为100V ,内阻忽略不计。
则A. 当cd 端短路时,ab 之间的等效电阻是40ΩB. 当ab 端短路时,cd 之间的等效电阻是40ΩC. 当ab 两端接通测试电源时, cd 两端的电压为80 VD. 当cd 两端接通测试电源时, ab 两端的电压为80 V16.如图所示,同一平面内的三条平行导线串有两个电阻R 和r ,导体棒PQ 与三条导线接触良好;匀强磁场的方向垂直纸面向里。
导体棒的电阻可忽略。
当导体棒向左滑动时,下列说法正确的是A.流过R 的电流为由d 到c ,流过r 的电流为由b 到aB.流过R 的电流为由c 到d ,流过r 的电流为由b 到aC.流过R 的电流为由d 到c ,流过r 的电流为由a 到bD.流过R 的电流为由c 到d ,流过r 的电流为由a 到b17.甲乙两年在公路上沿同一方向做直线运动,它们的v-t 图象如图所示。
两图象在t =t 1时相交于P 点,P 在横轴上的投影为Q ,△OPQ的面积为S 。
在t =0时刻,乙车在甲车前面,相距为d 。
已知此后两车相遇两次,且第一次相遇的时刻为t ′,则下面四组t ′和d 的组合可能是A. t ′=t 1 ,d=SB. t ′=111,24t d S = C. t ′111,22t d S == D. t ′=113,24t d S =18.一滑块在水平地面上沿直线滑行,t =0时其速度为1 m/s 。
从此刻开始滑块运动方向上再施加一水平面作用F ,力F 和滑块的速度v 随时间的变化规律分别如图a 和图b 所示。
设在第1秒内、第2秒内、第3秒内力F 对滑块做的功分别为123W W W 、、,则以下关系正确的是A. 123W W W ==B. 123W W W <<C. 132W W W <<D. 123W W W =<19.如图a 所示,一矩形线圈abcd 放置在匀强磁场中,并绕过ab 、cd 中点的轴OO ′以角速度ω逆时针匀速转动。
若以线圈平面与磁场夹角45θ︒=时(如图b )为计时起点,并规定当电流自a 流向b 时电流方向为正。
则下列四幅图中正确的是20.一有固定斜面的小车在水平面上做直线运动,小球通过细绳与车顶相连。
小球某时刻正处于图示状态。
设斜面对小球的支持力为N ,细绳对小球的拉力为T ,关于此时刻小球的受力情况,下列说法正确的是A.若小车向左运动,N 可能为零B.若小车向左运动,T 可能为零C.若小车向右运动,N 不可能为零D.若小车向右运动,T 不可能为零21.如图所示,C 为中间插有电介质的电容器,a 和b 为其两极板;a 板接地;P 和Q 为两竖直放置的平行金属板,在两板间用绝缘线悬挂一带电小球;P 板与b 板用导线相连,Q 板接地。
开始时悬线静止在竖直方向,在b 板带电后,悬线偏转了角度a 。
在以下方法中,能使悬线的偏角a 变大的是A.缩小a 、b 间的距离B.加大a 、b 间的距离C.取出a 、b 两极板间的电介质D.换一块形状大小相同、介电常数更大的电介质第Ⅱ卷三、非选择题:包括必考题和选考题两部分。
第22题~第29题为必考题,每个试题考生都必须做答。
第30题~第38题为选考题,考生根据要求做答。
(一)必考题(8题,共129分)22.(15分)I.右图为一正在测量中的多用电表表盘.(1)如果是用³10Ω档测量电阻,则读数为Ω。
(2)如果是用直流10 mA档测量电流,则读数为mA。
(3)如果是用直流5 V档测量电压,则读数为V。
Ⅱ.物理小组在一次探究活动中测量滑块与木板之间的动摩擦因数。
实验装置如图,一表面粗糙的木板固定在水平桌面上,一端装有定滑轮;木板上有一滑块,其一端与电磁打点计时器的纸带相连,另一端通过跨过定滑轮的细线与托盘连接。
打点计时器使用的交流电源的频率为50Hz。
开始实验时,在托盘中放入适量砝码,滑块开始做匀加速运动,在纸带上打出一系列小点。
(1)上图给出的是实验中获取的一条纸带的一部分:0、1、2、3、4、5、6、7是计数点,每相邻两计数点间还有4个打点(图中未标出),计数点间的距离如图所示。
根据图中数据计算的加速度a= (保留三位有效数字)。
(2)回答下列两个问题:①为测量动摩擦因数,下列物理量中还应测量的有。
(填入所选物理量前的字母)A.木板的长度lB.木板的质量m1C.滑块的质量m2D.托盘和砝码的总质量m3E.滑块运动的时间t②测量①中所选定的物理量时需要的实验器材是。
(3)滑块与木板间的动摩擦因数μ=(用被测物理量的字母表示,重力加速度为g)。
与真实值相比,测量的动摩擦因数(填“偏大”或“偏小”)。
写出支持你的看法的一个论据:。
23.(15分)天文学家将相距较近、仅在彼此的引力作用下运行的两颗恒星称为双星。
双星系统在银河系中很普遍。
利用双星系统中两颗恒星的运动特征可推算出它们的总质量。
已知某双星系统中两颗恒星围绕它们连线上的某一固定点分别做匀速圆周运动,周期均为T,两颗恒星之间的距离为r,试推算这个双星系统的总质量。
