FDA药品审评和研究中心 (CDER)
【医疗药品管理】FDA新药申请指南
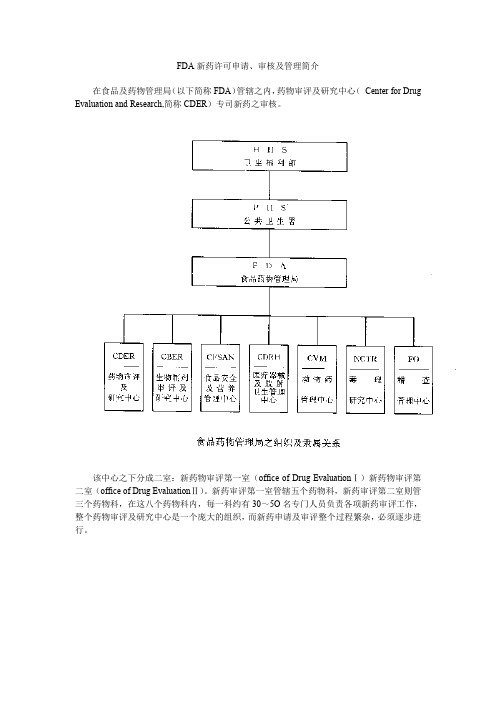
FDA新药许可申请、审核及管理简介在食品及药物管理局(以下简称FDA)管辖之内,药物审评及研究中心(Center for Drug Evaluation and Research,简称CDER)专司新药之审核。
该中心之下分成二室:新药物审评第一室(office of Drug EvaluationⅠ)新药物审评第二室(office of Drug EvaluationⅡ)。
新药审评第一室管辖五个药物科,新药审评第二室则管三个药物科,在这八个药物科内,每一科约有30~5O名专门人员负责各项新药审评工作,整个药物审评及研究中心是一个庞大的组织,而新药申请及审评整个过程繁杂,必须逐步进行。
药物审评及研究中心(Center for Drug Evalution and Research,CDER)之组织说明如下:1.秘书室(Executive Secretariant Staff)2.总务室(Office of Management)(l)药物资记中心(Drug Information Resource)(2)医学图书馆(Medical Library)(3)总务及王计(Management and Budget)(4)资讯系统设计(Information System Design)3.专业进修室(Professional Development)4.顾问团(Advisors and Consultants Staff)5·前导性新药审评(Pilot Drug Evaluation)6.非处方药审评室(office of OTC Drug Evaluation)(1)单篇非处方药审评室(MonograPh Review Staff)(2)非处方药政策性科(OTC Drug Policy Staff)(3)医学审评科(Medical Review Staff)7.非专利处方药室(office of Generic Drugs)(1)化学第一科(ChemistryⅠ)(2)化学第二科(ChemistryⅡ)(3)生体相等性科(Bioequivalence)8.研究发展室(Office of Research Resources)(1)研究及试验科(Research and Testing)(2)药品分析科(Drug Analysis)(3)生体药学科(Biopharmaceutics)(4)临床药理科(Clinical pharmacology)9.新药标准室(Office of Drug Standards)(l)新药市场广告及信息科(Drug Marketing,Advertising and Communications)10.新药合法性室(Office of Compliance)(1)新药信息科(Drug Labeling Compliance)(2)新药品质审核科(Drug Quality Evaluation)(3)新药产品及制造品质科(Mahufacturing and Product Quality)(4)科学性侦查科(Scientific Investigations)(5)新药管理科(Regulatory Affairs)11.新药流行学及统计生物学室(Office of Epidemiology and Biostatistics)(1)流行学及监视科(Epidemiology and Surveillances)(2)生物统计科(Biometrics)12.新药审评第一室(Office of Drug EvaluationⅠ,ODEI)(1)心脏药物科(Division of Cardio-Renal Drug Products)(2)神经药物科(Division of Neuropharmacological Drug Products)(3)肿瘤肺药物科(Division of Oncology and Pulmonary Drug Products)(4)影像、手术及牙药物科(Division of Medical Imaging Surgical and Dental Drug Products)(5)胃肠及凝血药物科(Division of Gastrointestinal and Coagulation Drug Products)13.新药审评第二室(Office of Drug Evaluation Ⅱ, ODE Ⅱ)(1)新陈代谢及内分泌药物科(Division of Metabolism and Endocrine Drug ProductS)(2)抗传染药物科(Division of Anti-Infective Drug Products )(3)抗病毒药物科(Division of Anti—Viral Drug ProductS)二、新药申请(一)药物的定义依据联邦食品药物及化妆品法第二章第201节,药物的定义如下:l.美国药典,同种治疗法药典,或者国家处方集(National Formulary)中所列的物质。
全球主要药事执法机构比较

(三)FDA的职责
食品 —安全、有益健康、卫生 人用及兽用药品、生物制品、医疗器械 —安全、有效 化妆品 —安全 释放射线的电子产品 —安全
所有这些产品都应诚实、准确、全面的标示 所有这些产品必须符合法律及FDA规章的要 求 任何不符合法律及FDA规章的情形应能识别 并纠正 任何不安全或非法的产品应从市场上撤回
1968
健康教育部重组为公共健康服务部
(二)FDA的组织机构
生物制品评价与研究中心“CBER” 医疗器械和放射健康中心“CDRH” 药品评价与研究中心“CDER” 食品安全与应用营养中心“CFSAN” 兽药中心“CVM” 全美毒理研究中心“NCTR”
局长办公室“OC” 监管事务办公室“ORA”
全球主要药事执法机构比较
一、美国FDA的概况
(一)FDA的历史演进
1862 1927 1930
农业部下属的化学处 食品、药品、杀虫剂监管局 FDA(仍属农业部)
1940
FDA(划转到联邦安全局)
联邦安全局更名为健康教育部
1953,FDA 1988 FDA
HHS, 人类健康服务部 “Food drug Administration Act” FDA
负责对药品生产商、批发商及进口商的发 照、检查 签发出口证书 在要求的情况下签发,以帮助出口商满足 进口商的要求 检查GLP、 GCP 产品质量监测 ……
三、医药食品安全局
(Pharmaceutical and food safety bureau , PFSB)
(一)PFSB成立的背景
1、注册处:Licensing division
常用制药及GMP英文缩写

常用制药及GMP英文缩写第一篇:常用制药及GMP英文缩写ISO(International Organization for Standardization):国际标准化组织日常办事机构是中央秘书处,设在瑞士日内瓦WHO(World Health Organization):世界卫生组织是联合国属下的专门机构,国际最大的公共卫生组织,总部设于瑞士日内瓦PIC/S(Pharmaceutical Inspection Convention/Pharmaceutical Inspection Cooperation Scheme):国际医药品稽查协约组织由欧洲自由贸易区(EFTA)组建ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use):人用药物注册技术要求国际协调会由欧盟(EU)、欧洲制药工业协会联合会(EFPIA)、日本厚生省(MHW)、日本制药工业协会(JPMA)、美国FDA、美国药物研究生产联合会(PRMA)等机构组成WHO、EFTA、加拿大卫生保健局(CHPB)为观察员ISPE(International Society for Pharmaceutical Engineering):国际制药工程协会是致力于培训制药领域专家并提升制药行业水准的世界最大的非盈利性组织之一,在美国坦帕州设有全球总部,在布鲁塞尔设有欧洲总部,亚洲总部在新加坡HHS(United States Department of Health and Human Services):美国卫生及公共服务部(美国卫生部)FDA(Food and Drug Administration):美国食品药品监督管理局(HHS下属机构)PDA(Parenteral Drug Association):美国注射剂协会EPA (Environmental Protection Agency):美国国家环境保护局CDER(Center for Drug Evaluation and Research):FDA药物评价与研究中心EMEA(The European Agency for the Evaluation of Medicinal Products):欧洲药物评审组织MHW(Ministry of Health and Welfare):日本厚生省,现改为厚生劳动省MHLW(Ministry of Health, Labor and Welfare),负责医疗卫生和社会保障的主要部门 D&B(Dun & Bradstreet):邓白氏公司DUNS(DataUniversal Numbering System):邓白氏公司提供的唯一的公司代号,用于信用评级等在SMF文件中会用到GMP(Good Manufacturing Practice):药品良好生产规范cGMP(Current Good Manufacture Practices):动态药品生产管理规范,即现行的GLP(Good Laboratory Practice):药物非临床研究质量管理规范,及优良实验室规范GSP(Good Supplying Practice):药品经营质量管理规范,及良好的药品供应规范GAP(Good Agricultural Practice for Chinese Crude Drugs):中药材生产质量管理规范GDP(Good Documentation Practice):良好文件管理GEP (Good Engineering Practice):工程设计规范GAMP(Good Automated Manufacturing Practice):优良自动化生产规范USP(united states pharmacopeia):美国药典EP (European Pharmacopeia):欧洲药典JP(Japanese Pharmacopoeia):日本药典CFR(Code of Federal Regulations):美国联邦法律CFR 21 Part 11(Code of Federal Registry Part11):联邦法规法律标题21第11部分CEP/COS(Certificate of Suitability to the monographs of European Pharmacopoeia):欧洲药典适应性认证证书CEP认证,COS证书CTD(Common Technical Document):国际注册用常规技术文件CTD文件是国际公认的文件编写格式,用来制作一个向药品注册机构递交的结构完善的注册申请文件EHS(Environment、Health、Safety):环境-健康-安全管理体系HACCP(Hazard Analysis and Critical Control Point):(保健食品)危害分析和关键控制点REACH(REGULATION concerning the Registration, Evaluation, Authorization and Restriction of Chemicals):欧盟规章《化学品注册、评估、许可和限制》,欧盟建立的,并于2007年6月1日起实施的化学品监管体系 ICH-Q1A:新原料药和制剂的稳定性试验ICH-Q1B:稳定性试验:新原料药和制剂的光稳定性试验ICH-Q1C:稳定性试验:新剂型的要求ICH-Q1D:新原料药和制剂的稳定性试验的括号法和矩阵法设计ICH-Q1E:稳定性数据的评价ICH-Q1F:气候带Ⅲ和Ⅳ注册申请的稳定性数据 ICH-Q2A:分析步骤验证:正文ICH-Q2B:分析步骤验证:方法学ICH-Q3A:原料药中的杂质 ICH-Q3B:新制剂中的杂质ICH-Q3C:杂质;残留溶剂的指导原则 ICH-Q4:药典ICH-Q4A:药典的同一化ICH-Q4B:各地区使用的药典正文评估和建议ICH-Q5A:来源于人或动物细胞系的生物技术产品的病毒安全性评价ICH-Q5B:生物技术产品的质量:rDNA衍生蛋白质产品生产细胞的表达构建体分析ICH-Q5C:生物技术产品的质量:生物制品/生物技术产品的稳定性试验ICH-Q5D:用于生物技术产品及生物制品生产的细胞基质的来源和鉴定 ICH-Q5E:生物技术产品/生物制品在工艺变更时的可比性ICH-Q6A:质量标准新原料药和制剂的检测以及可接受标准:化学物质ICH-Q6B:质量标准:生物技术产品及生物制品的检测方法和可接受标准ICH-Q7:原料药良好制造规范(ICH-Q7A的新版)ICH-Q7A:原料药的GMP规范 ICH-Q8:药物研发指南 ICH-Q9:质量风险管理ICH-Q10(PQS):药物质量体系QA(Quality Assurance):质量保证QC(Quality Control):质量控制QRM(Quality Risk Management):质量风险管理IPC (InproceicsQuality Control):制程品质控制/中控OOS(Out of Specification):检验结果超标 OOT(Out of Trend):超趋势结果OOL(Out of Limit):超出极限的结果,如温湿度等OOE (Out of Expectation):超期望结果SAL(SterilityAssuranceLevel):无菌保证水平灭菌后微生物的存活概率的负对数,要求≥6SAL=−lg存活率=F0D−lgN0D值:杀灭90%的微生物所需要的时间,D值越大,微生物死亡越难,D值与细菌的耐热性成正比Z值:指灭菌时间减少到原来的10%所需要升高的温度或是相同的灭菌时间内杀死99%的微生物所需要提高的温度F值:为一定温度下,给定Z值所产生的灭局效果与参比温度T0下给定Z值所产生的灭菌效果相同时所相当的时间F值用于干热灭菌F0值:为一定温度下,Z值为10℃产生的灭菌效果与120℃,Z 值为10℃时产生的灭菌效果相当的时间,t分钟内的灭菌效果相当于120℃下灭菌F0分钟的效果F0被称为标准灭菌时间,用于热压灭菌LRV:除菌过滤的对数下降值LRV=lgN0-lgN SOP(Standard Operation Procedure):标准操作规程 DMF(Drug Master File):药品主文件 SMF(Site Master File):工厂主文件URS(User Requirement Specification):用户需求标准FS (Functional Specification):功能标准DS(Design Specification):设计标准 DQ(Design Qualification):设计确认IQ(Installation Qualification):安装确认OQ(Operational Qualification):运行确认PQ(Performance Qualification):性能确认 RQ(Requalification):再确认CAPA(Corrective Action & Preventive Action):纠正预防系统,Q10的四大要素之一QbD(Quality byDesign):质量源于设计COA(Certificate of Analysis):分析证书/检验报告书/检验报告单 BPR(Batch Production Record):批生产记录API(Active Pharmaceutical Ingredients):药物活性成分,通常指的原料药 PMC(Product Material Control):生产物料控制PC 生产控制;MC物料控制CMC(Chemistry and manufacture control):生产和化学控制APR(Annual Products Review):年度质量回顾 KPI(Key Performance Indicators):关键业绩指标P&ID(Piping and Instrument Diagram):工艺管道仪表流程图 PFD(Process Flow Diagram):工艺流程图 UFD(Utility Flow Diagram):公用工程流程图CIP(Cleaning in Place):原位清洗(全自动,如针剂配制系统)WIP(Washing in Place):在线清洁(半自动,需要手动的拆卸,如流化床)SIP(Sterilization in Place):在线灭菌WFI (Water for Injection):注射用水HVAC(Heating Ventilation Air Conditioning):供热空气调节净化系统 HEPA(High Efficiency Particulate Air Filter):高效过滤器DOP:为邻苯二甲酸二辛酯,HEPA检漏用的气溶胶PAO:聚-α-烯烃,HEPA检漏用的气溶胶 IBC(IntermediateBulkContainer):中型散装容器BFS(Blowing Filling and Sealing):吹-灌-封PAT (Process Analytical Technology):过程分析技术PLC (Programmable Logic Controller):可编程逻辑控制CPP (Critical Process Parameters):关键工艺参数FBD(Fluid Bed Dryer):流化床AHU(Air Handling Unit):空气处理单元SAT (SiteAcceptance T est):现场验收测试 FAT(Factory Acceptance Test):工厂验收测试第二篇:GMP英文缩写1.AQAI(Automated Quality Assurance Inspection Equipment):在线自动质量保证检查设备 2.API(Active Pharmaceutical Ingredient):活性药物物质即原料药 3.ANDA(Abbreviated New Drug Application):简化新药申请 4.ADR(Adverse Drug Reaction):不良反应5.BSE(Bovine Spongiform Encephalopathy):疯牛病6.BPCS(Business Planning and Control System):业务计划及控制系统7.BIA(Business impact assessment): 商业影响评估8.cGMP(current Good Manufacturing Practice):现行药品生产质量管理规范 CD(China Certification Committee for Drugs):中国药品认证委员会10.CIP(Cleaning In Place):在线清洁11.CV(Concurrent Validation):同步验证12.CDER(Center for Drug Evaluation and Research): 药品研究与评价中心13.COA(Certificate Of Analysis):分析报告单14.CFR(Code of Federal Regulation):(美国)联邦法规15.CDC(Centers for Disease Control and Prevention):疾病预防控制中心16.COS / CEP(Certificate of Suitability for European Pharmacopeia):欧洲药典适用性证书D(Certification Committee for Drugs):药品认证管理中心18.CPMP(Committee for Proprietary Medicinal Products): 欧洲专利药品委员会19.CTD(Common Technical Document):通用技术文件20.CDC(Centers for Disease Control and Prevention): 疾病预防控制中心21.GMP(Good Manufacturing Practice):药品生产质量管理规范22.ICH(International Conference on Harmonization of Technical Requirements for Registration ofPharmaceuticals for Human Use):人用药品注册技术要求国际协调会 23.EU(European Union):欧洲联盟24.EFPIA(European Federation of Pharmaceutical Industries Associations):欧洲制药工业协会联合会25.MHW(Ministry of Health and Welfare,Japan):日本厚生省26.JPMA(Japan Pharmaceutical Manufacturers Association):日本制药工业协会27.FDA(US Food and Drug Adminiistration):美国食品与药品管理局28.PRMA(Pharmaceutical Research and Manufacturers of America):美国药物研究和生产联会29.WHO(World Health Organization):世界卫生组织30.IFPMA(International Federation of Pharmaceutical Manufacturers Associations):国际制药工业协会联合会31.TQC(Tota lQuality Control),TQM(Total Quality Management): 全面质量管理32.PDCA(Plan,Do,Check,Action):计划执行检查处理33.QA(Quality Assurance):质量保证 34.QC(Quality Control):质量控制 35.QS(Quality System):质量体系36.QM(Quality Management): 质量管理37.SOP(Standard Operating Procedure): 标准操作规程38.SMP(Standard Management Procedure):标准管理程序39.SOR(Standard Operating Record): 标准操作记录 40.GEP(Good Engineering Practice):工程设计规范41.HVAC(Heating Ventilation and Air Conditioning):空调净化系统42.DQ(Design Qualification):设计确认43.IQ(Installation Qualification):安装确认44.OQ(Operational Qualification):运行确认 45.PQ(Performance Qualification):性能确认46.OOS(Out-Of-Specification):检验结果偏差,有别于偏差47.PFDS(Process Flow Diagrams):工艺流程图48.MRA(cMutual Reognition Agreements): 现场检查多边认同协议 49.DMF(Drug Master File):药物主文件50.EDMF(European Drug Master File)欧盟药物主文件51.EDQM(European Directorate for Quality Medicines): 欧洲药品质量管理局 52.ORA(Office of Regulatory Affairs):药政事务办公室53.GGPs(Good Guidance Practices): 优良指南规范54.MOA(Method Of Analysis):分析方法 55.VMP(Validation Master Plan):验证主计划 56.VP(Validation Protocol):验证方案57.MSDS(Material Safety Data Sheet):物料安全技术说明书58.NDA(New Drug Application):新药申请59.OTC(Over-the-counter):非处方60.INN(International Nonproprietary Name):国际非专有名称P(the united state pharmacopeia): 美国药典62.NF(National Formulary):(美国)国家药品集63.GAP(Good Agricultural Practice):中药材种植管理规范64.GCP(Good Clinical Practice):药物临床试验质量管理规范65.GLP(Good Laboratory Practice):药物实验室管理规范66.GSP(Good Supply Practice):药品经营质量管理规范67.GUP(Good Use Practice):药品使用质量管理规范 68.SM(Starting Material):起始物料69.PMF(Plant Master File);SMF(Site Master File):工厂主文件70.EDL(List of Essential Drugs): 基本药物目录 71.PI(Package Insert):说明书72.PCT(Patent Cooperation Treaty): 专利合作条约73.PPAC(Patent Protection Association of China):中国专利保护协会 74.PIC(Person In Charge):负责人75.PDS(Pharmaceutical Development Services):整体新药研发机构 76.SPC(Summary of Product Characteristics):产品特性摘要第三篇:GMP常见英文缩写(本站推荐)GMP常见英文缩写AQAI(Automated Quality Assurance Inspection Equipment):在线自动质量保证检查设备 API(Active Pharmaceutical Ingredient):活性药物物质,即原料药 ANDA(Abbreviated New Drug Application):简化新药申请ADR(Adverse Drug Reaction):不良反应BSE(BovineSpongiform Encephalopathy):疯牛病BPCS(Business Planning and Control System):业务计划及控制系统 BIA(Business impact assessment): 商业影响评估cGMP(current Good Manufacturing Practice):现行药品生产质量管理规范 CCCD(China Certification Committee for Drugs):中国药品认证委员会CIP(Cleaning In Place):在线清洁CV(Concurrent Validation):同步验证CDER(Center for Drug Evaluation and Research): 药品研究与评价中心COA(Certificate Of Analysis):分析报告单CFR(Code of Federal Regulation):(美国)联邦法规CDC(Centers for Disease Control and Prevention):疾病预防控制中心COS/ CEP(Certificate of Suitability for European Pharmacopeia):欧洲药典适用性证书 CCD(Certification Committee for Drugs):药品认证管理中心CPMP(Committee for Proprietary Medicinal Products): 欧洲专利药品委员会 CTD(Common Technical Document):通用技术文件CDC(Centers for Disease Control and Prevention): 疾病预防控制中心 GMP(Good Manufacturing Practice):药品生产质量管理规范ICH(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use):人用药品注册技术要求国际协调会 EU(European Union):欧洲联盟EFPIA(European Federation of PharmaceuticalIndustries Associations):欧洲制药工业协会联合会MHW(Ministry of Health and Welfare,Japan):日本厚生省JPMA(Japan Pharmaceutical Manufacturers Association):日本制药工业协会 FDA(US Food and Drug Adminiistration):美国食品与药品管理局PRMA(Pharmaceutical Research and Manufacturers ofAmerica):美国药物研究和生产联合会WHO(World Health Organization):世界卫生组织IFPMA(International Federation of Pharmaceutical Manufacturers Associations): 国际制药工业协会联合会TQC(Total Quality Control),TQM(Total Quality Management): 全面质量管理PDCA(Plan,Do,Check,Action):计划,执行,检查,处理QA(Quality Assurance):质量保证QC(Quality Control):质量控制QS(Quality System):质量体系 QM(Quality Management): 质量管理SOP(Standard Operating Procedure): 标准操作规程SMP(Standard Management Procedure):标准管理程序SOR(Standard Operating Record): 标准操作记录GEP(Good Engineering Practice):工程设计规范HVAC(Heating Ventilation and Air Conditioning):空调净化系统DQ(Design Qualification):设计确认IQ(Installation Qualification):安装确认OQ(Operational Qualification):运行确认PQ(Performance Qualification):性能确认OOS(Out-Of-Specification):检验不合格;超标 PFDS(Process Flow Diagrams):工艺流程图MRA(cMutual Reognition Agreements): 现场检查多边认同协议 DMF(Drug Master File): EDMF(European Drug Master File)欧盟药物主文件EDQM(European Directorate for Quality Medicines): 欧洲药品质量管理局 ORA(Office of Regulatory Affairs):药政事务办公室GGPs(Good Guidance Practices): 优良指南规范MOA(Method Of Analysis):分析方法VMP(Validation Master Plan):验证主计划VP(Validation Protocol):验证方案MSDS(Material Safety Data Sheet):物料安全技术说明书NDA(New Drug Application):新药申请OTC(Over-the-counter):非处方INN(International Nonproprietary Name)国际非专有名称USP(the united state pharmacopeia): 美国药典NF(National Formulary):(美国)国家药品集GAP(Good Agricultural Practice):中药材种植管理规范GCP(Good Clinical Practice):药物临床试验质量管理规范 GLP(Good Laboratory Practice):药物实验室管理规范GSP(Good Supply Practice):药品经营质量管理规范 GUP(Good Use Practice):药品使用质量管理规范 SM(Starting Material):起始物料PMF(Plant Master File);SMF(Site Master File):工厂主文件EDL(List of Essential Drugs): 基本药物目录 PI(Package Insert):说明书PCT(Patent Cooperation Treaty): 专利合作条约PPAC(Patent Protection Association of China):中国专利保护协会 PIC(Person In Charge):负责人PDS(Pharmaceutical Development Services): 整体新药研发机构 SPC(Summary of Product Characteristics):产品特性摘要第四篇:英文缩写GM(General Manager)总经理VP(Vice President)副总裁FVP(First Vice President)第一副总裁AVP(Assistant Vice President)副总裁助理CEO(Chief Executive Officer)首席执行官COO(Chief Operations Officer)首席运营官CFO(Chief Financial Officer)首席财务官CTO(Chief Technology Officer)首席技术官HRD(Human Resource Director)人力资源总监OD(Operations Director)运营总监MD(Marketing Director)市场总监OM (Operations Manager)运作经理PM(Production Manager生产经理、Product Manager产品经理、Project Manager项目经理)注:这里面变化比较多,要结合谈话时的背景来判断究竟是指哪种身份)BM(Branch Manager)部门经理DM(District Manager)区域经理RM(Regional Manager)区域经理President 总裁Vice-President 副总裁Assistant VP 副总裁助理Executive Marketing Director 市场行政总监General Manager 总经理Branch Manager部门经理Product Manager 产品经理Project Manager 项目经理Regional Manager 区域经理Production Manager 生产经理Transportation Manager 运输经理Applications Programmer 应用软件程序员Computer Operator 电脑操作员Computer Operations Supervisor 电脑操作主管Hardware Engineer 硬件工程师Computer T echnician 电脑技术MIS Manager 管理信息系统部经理Developmental Engineer 开发工程师Operations Analyst 操作分析Director of Information Services 信息服务主管LAN Administrator 局域网管理员Systems Analyst 系统分Manager of Network Administration 网络管理经理Systems Engineer 系统工程师Product Support Manager 产品支持经理Systems Programmer 系统程序员VP Sales 销售副总裁VP Marketing 市场副总裁Senior Account Manager 高级客户经理Telemarketing Director 电话销售总监Sales Administrator 销售主管Telemarketer 电话销售员Regional Sales Manager 地区销售经理Tele-Interviewer 电话调查员Regional AccountManager 地区客户经理Salesperson 销售员Sales Representative 销售代表Merchandising Manager 采购经理Sales Manager 销售经理Marketing Consultant 市场顾问Sales Executive 销售执行者Marketing Assistant 市场助理Sales Assistant 销售助理Marketing and Sales Director 市场与销售总监Retail Buyer 零售采购员Market Research Analyst 市场调查分析员Manufacturer’s Representative 厂家代Purchasing Agent 采购代理Assistant Account Executive 客户管理助理Marketing Manager 市场经理Advertising Manager 广告经理Marketing Intern 市场实习Advertising Coordinator 广告协调员Marketing Director 市场总监Advertising Assistant 广告助理Account Manager 客户经理Account Representative 客户代表Accounting Payable Clerk 应付帐款文员Accounting Assistant 会计助理Accounting Manager 会计经理AccountsReceivable Clerk 应收帐款文员Accounting Clerk 会计文员Certified Public Accountant 注册会计师Senior Accountant 高级会计Chief Financial Officer 首席财务官Audit Manager 审计经理Collections Officer 收款负责人Auditor 审计师Junior Accountant 初级会计Loan Administrator 贷款管理员Management Accountant 管理会计Billing Clerk 票据文员Billing Supervisor 票据管理员Bookkeeper 档案管理Staff Auditor 审计员Bookkeeping Clerk 档案管理助理Budget Analyst 预算分析Tax Accountant 税务会计Credit Analyst 信用分析Credit Manager 信用管理经理Vice-President of Administration and Finance 财务行政副总裁Financial Analyst 财务分析Vice-President of Finance 财务副总裁Financial Consultant 财务顾问Financial Manager 财务经理Financial Planner 财务计划员VP HR 人力资源副总裁Assistant VP HR 人力资源副总裁助理HR Director 人力资源总监Compensation &Benefit Manager 薪酬福利经理Staffing Manager 招聘经理Training Manager 培训经理Benefits Coordinator 员工福利协调员Employer Relations Representative 员工关系代表Payroller 工资专员Training Coordinator 培训协调Training Specialist 培训专员HR Supervisor(Training)培训主管Vice-President of Administration 行政副总裁Administrative Director 行政总监Office Manager 办公室经理File Clerk 档案管理员Administration Assistant 行政助理Receptionist 接待员General Office Clerk 办公室文员Secretary 秘书Order Entry Clerk 订单输入文员Operator 接线员Typist 打字员公司部门:总公司Head Office分公司Branch Office营业部Business Office人事部 Personnel Department人力资源部 Human Resources Department总务部 General Affairs Department财务部General Accounting Department销售部 Sales Department国际部International Department广告部 Advertising Department企划部Planning Department研发部 Research and Development Department(R&D)秘书室 Secretarial Pool销售相关名词:KA:Key Accounts(原:主要客户)大卖场,大型连锁DM:DeliverMessageDirectMail 宣传单张POP:Point of the purchase(原:据点上的购买)店头广告PDCA:Plan,Do,Check,Action 计划、实施、检核、措施为管理循环的简称4PS:Product,Price,Place,Promotion 行销组合4p(产品价格通路促销)4CS:Consumer needs,Costs,Convienience,Communication行销组合4c(顾客需求顾客接受的成本便利性沟通)MINI:Mininum 小SWOT:trength,Weakness,Opportunity,Threat(优势弱势机会问题)为内外环境分析的一个工具USP:Unique Special Point 独特点FAB:Feature,Advantage,Benefit 产品特性,利益,功效推销法POD:Product Of Difference 产品的卖点SP:Sales Promotion 促销AD:Advertisement 广告NP:News Paper 报纸杂志PR:Public Relation 公共关系Store Check:Store Audit(偏于量的终端调查)终端调查,铺市率调查(可见度)FGD:Focus Group Discuss 座谈会(市调一种)Outdoor:户外GRP: Gross Rating Point(媒介用语)毛评点;总收视点3A:Avalible,Able,Adsire买得到,买得起,乐得买A&U:Attitude and Usage 消费态度和行为(市场调查)TG:端架SKU:单品CPM:每一百万个使用者会有几次抱怨(Complaint per Million)CRM:客户关系管理(Customer Relationship Management)JIT: 即时管理(Just In Time)KM:知识管理(Knowledge Management)LTC:最小总成本法(Least Total Cost)LUC:最小单位成本(Least Unit Cost)SO:订单(Sales Order)销售中的4P:产品(Product)、价格(Price)、通路(Place)、促销(Promotion)销售中的4C:消费者(Consumer)、成本(Cost)、方便(Convenience)、Inventory Control Manager 库存管理经理Regional Manager 区域经理Executive Marketing Director 市场行政总监Warehouse Manager 仓库经理Manager(Non-Profit and Charities)非盈利性慈善机构管理Cashier 出纳员Buyer 采购员Clerk/Receptionist 职员/接待员Civil Engineer 土木工程师Clerk Typist & Secretary 文书打字兼秘书Marketing Representative 销售代表Simultaneous Interpreter 同传公司英文标识总公司Head Office分公司Branch Office 营业部Business Office人事部 Personnel Department人力资源部Human Resources Department 总务部General Affairs Department财务部General Accounting Department 销售部Sales Department 促销部Sales Promotion Department 国际部 International Department 出口部Export Department进口部Import Department 公共关系Public Relations Department 广告部Advertising Department 企划部Planning Department 产品开发部Product Development Department 研发部Research and Development Department(R&D)艺术类词汇:服装设计师Fashion Designer电影摄制助理Film Production Assistant画面设计师Graphic Designer 装饰设计师Interior Designer制片协调员Production Coordinator男演员/女演员Actor/Actress艺术总监Art Director舞蹈教练Choreographer喜剧演员Comedian舞蹈家 Dancer摄影师 Photographer服务行业词汇: 办案员Case Worker城市规划者Urban Planner临床医学家Therapist社会工作者Social Worker心理学家Psychologist客户服务经理 Customer Service Manager客户服务代表 Customer Service Representative健康俱乐部经理Health Club Manager厨师Chef美容师Cosmetologist发型师Hairstylist 教育词汇:校长Principal外语教师 Foreign Language Teacher银行词汇:工商银行 ICBC: Industrial and Commercial Bank of China中国银行 BOC: Bank of China建设银行CCB: China Construction Bank农业银行ABOC: Agriculture Bank of China交通银行BOCM: Bank of Communication招商银行CMB: China Merchant Bank民生银行 CMBC: China Minsheng Banking Group,.Ltd光大银行 CEB: China Everbright Bank华夏银行 Huaxia Bank中信银行 ChinaCitic Bank广东发展银行Guangdong Development Bank深圳发展银行Shenzhen Development Bank上海浦东发展银行SPDB: Shanghai Pudong Development Bank兴业银行 CIB: China Industrial Bank Co., Ltd.MPV是指多用途汽车(multi-Purpose Vehicles),从源头上讲,MPV是从旅行轿车逐渐演变而来的,它集旅行车宽大乘员空间、轿车的舒适性、和厢式货车的功能于一身,一般为单厢式结构,即多用途车。
美国食品和药物管理局

美国食品和药物管理局(Food and Drug Administration)简称FDA,FDA 是美国政府在健康与人类服务部(DHHS) 和公共卫生部(PHS) 中设立的执行机构之一。
作为一家科学管理机构,FDA 的职责是确保美国本国生产或进口的食品、化妆品、药物、生物制剂、医疗设备和放射产品的安全。
它是最早以保护消费者为主要职能的联邦机构之一。
该机构与每一位美国公民的生活都息息相关。
在国际上,FDA 被公认为是世界上最大的食品与药物管理机构之一。
其它许多国家都通过寻求和接收FDA 的帮助来促进并监控其本国产品的安全。
食品和药物管理局(FDA)主管:食品、药品(包括兽药)、医疗器械、食品添加剂、化妆品、动物食品及药品、酒精含量低于7%的葡萄酒饮料以及电子产品的监督检验;也包括化妆品、有辐射的产品、组合产品等与人身健康安全有关的电子产品和医疗产品。
产品在使用或消费过程中产生的离子、非离子辐射影响人类健康和安全项目的测试、检验和出证。
根据规定,上述产品必须经过FDA检验证明安全后,方可在市场上销售。
FDA有权对生产厂家进行视察、有权对违法者提出起诉。
根据监管的不同产品范围,可分为以下几个主要监管机构:1、食品安全和实用营养中心(CFSAN):该中心是FDA工作量最大的部门。
它负责除了美国农业部管辖的肉类、家禽及蛋类以外的全美国的食品安全。
尽管美国是世界上食品供应最安全的国家,但是,每年还是有大约有七千六百万食源性疾病发生,三十二万五千人因食源性疾病需要住院治疗,五千左右人死于食源性疾病。
食品安全和营养中心致力于减少食源性疾病,促进食品安全。
并促进各种计划,如:HACCP计划的推广实施等。
该中心的职能包括:确保在食品中添加的物质及色素的安全;确保通过生物工艺开发的食品和配料的安全;负责在正确标识食品(如成分、营养健康声明)和化妆品方面的管理活动;制定相应的政策和法规,以管理膳食补充剂、婴儿食物配方和医疗食品;确保化妆品成分及产品的安全,确保正确标识;监督和规范食品行业的售后行为;进行消费者教育和行为拓展;与州和地方政府的合作项目;协调国际食品标准和安全等。
FDA生物制品评价和研究中心(CBER)组织机构和主要职位清单

Division of Viral Products(病毒制品处)
Deputy Director(副主任)
Laboratory of Hepatitis Viruses(肝炎病毒实验室)
Deputy Director(副主任)
Blood and Plasma Branch(血液和血浆科)
Regulatory Project Management Branch(项目监管科)
Devices Review Branch(器械审查科)
七、OFFICE OF VACCINES RESEARCH AND REVIEW(疫苗研究和审查办公室)
Laboratory of Respiratory & Special Pathogens(呼吸系统和特殊病原体实验室)
Laboratory of Bacterial Toxins(细菌毒素实验室)
Lab. of Enteric & Sexually Transmitted Diseases(肠道和性传播疾病实验室)
Laboratory of Biophysics(生物物理学实验室)
Laboratory of Bacterial Polysaccharides(细菌多糖类实验室)
Laboratory of Mycobacterial Diseases & Cellular Immunology(分歧杆菌疾病和细胞免疫学实验室)
Division of Bacterial, Parasitic & Allergenic Products(细菌、寄生和变应原产品处)
CDER加快药品审评途径

CDER加快药品审评途径美国药品审评和研究中心(CDER)的新规允许研发申报单位和审评机构使用“滚动审核”(rollin review)的过程。
在提交完整的申报材料前,申报方可先提交部分,CDER先查看这部分申报材料,以便早发现问题,更正或终止研发过程,既节约了申报新药企业的资源,也节约了审评资源,提高研发质量,加快新药上市进度。
目前,FDA有四个快速审批途径——快速通道、突破、优先审核、加速审批。
2013年,CDER对新药审评过程进行了创新,启用快速审评审批程序。
当年,CDER 批准了27个新药,这些药物多数具有显著疗效和潜在市场。
在FDA批准的新药中,首创新型(First-in-Class)占33%,即用一个新的或独特的机制治疗疾病,这是创新药的一个重要指标。
首创新型药物的批准率表明,27个新药中,33%是具有创新性的新产品。
例如,具有新机制的降血糖新药;用于HER2阳性的晚期(转移性)乳腺癌新药和用于一些慢性丙型肝炎患者的口服干扰素,以及治疗转移性黑色素瘤的新药。
孤儿药占CDER批准新药的33%左右。
CDER借助加快审评进程的创新方法,加快了新分子实体的上市,其他还有用于治疗晚期(转移性)非小细胞肺癌、多发性硬化症的复发和慢性丙肝的新药等。
同时改良新监管方法,新药从提交到批准,均快于原10个月的审批时限,有些药物只经数月。
在27个获批新药中,有10个使用了快速通道(Fast Track)。
有3个被认定为“突破疗法”(Breakthrouh),即药物的试验与临床初步证明该药物可能超过或至少对一个临床终点的治疗有实质性的改善。
快速审批途径有关法规是2012年生效的,2013年是新药被认定和批准具有突破治疗效用的第一年。
优先审核(Priority Review)方面,27个新药中有10个属于优先审核,确定药物有可能提供医疗保健显著进步的潜力,审核以6个月为目标,而不是标准的10个月。
加速审批(Accelerated Approval),去年有2个新药走的是这个途径。
FDA新药审评

美国FDA CDER新药质量审评部简介除非处方药典药(O T Cmonograph drugs)及临床试验药(Investigational New Drugs,IND)以外,在美国上市的所有新药都必须遵守美国相关新药申请(New Drug Application)法规,事先接受美国食品药品管理局(US Food and Drug Administration,FDA)的审理并取得其批准。
FDA 下属的化学类药物评价与研究中心(Center for Drug Evaluation and Research,CDER)是其属下的五个中心之一。
此中心的职责为审评并批准申请在美上市的化学类药品及某些生物类药品的安全性、有效性及质量可控性。
新药申请材料中相当一部分涉及药品的药物化学、药品生产以及生产和质量监控(Chemistry,M a n u f a c t u r e a n d C o n t r o l ,CMC)。
而这部分的审评则为CDER下属的新药质量评审部(Office of New Drug Quality Assessment,ONDQA)的主要职责,生物药品的这部分则属于生物科技产品部的职责。
需要补充说明的是国际会议协调组织(InternationalConference Harmonization,I C H )将C M C 部分统称为质量(Quality),在其网址上对此有细述。
关于新药质量审评部此部目前的机构设置建于2005年10月。
该设置便于实施新的药物质量评审体系(PharmaceuticalQuality Assessment System,PQAS)。
此系统的详细讨论和描述可见于发表在2004年FDA白皮书上的论文“21世纪药品生产质量管理规范——一种以风险为考量的模式”(cGMP for the 21st century– A Risk Based Approach)。
药学相关英文缩写

药学相关英文缩写API Active Pharmaceutical Ingredient 原料药(活性药物组分)BP British Pharmacopoeia 《英国药典》CAC Codex Alimentarius Committee (国际)食品法典委员会CBER FDA Center for Biologics Evaluation and Research (美国)FDA生物制品评价与研究中心CCD Certification Committee for Drugs (国家食品药品监督管理局)药品认证管理中心CDC Centers for Disease Control (美国)疾病控制中心CDE Center for Drug Evaluation (国家食品药品监督管理局)药品审评中心CDER FDA Center for Drug Evaluation and Research (美国)FDA药品评价与研究中心CDR Center for Drug Reevaluation (国家食品药品监督管理局)药品评价中心CDRH FDA Center for Devices and Radiological Health (美国)FDA医疗器械和辐射健康中心CFSAN FDA Center for Food Safety and Applied Nutrition (美国)FDA食品安全和应用营养中心CGMPs Current good manufacturing practices 现行良好制造规范;现行药品生产质量管理规范CMA Chinese Medical Association 中华医学会CNAO National Audit Office of the People's Republic of China 中华人民共和国审计署CNMA China Nonprescription Medicines Association 中国非处方药协会COS Certificate of Suitability (《欧洲药典》)适用性证书CP The Pharmacopoeia of the PRC 《中国药典》CPA China Pharmaceutical Association 中国药学会CPMA China Preventive Mediceine Association 中华预防医学会CVM FDA Center for Veterinary Medicine (美国)FDA兽药中心DE Drug evaluation 药品评价DEA Drug Enforcement Administration (美国)毒品强制执行管理局DIC Drug information center 药品信息中心DME Drug-metabolizing enzyme 药物代谢酶DMF Durg master file 药品主文件DUR Drug utilization review 药物利用评价DUR Drug use review 药物使用评论DHHS Department of Health and Human Services (美国)健康和人类服务部EFSA European Food Safety Authority 欧洲食品安全局ELA Establishment license application 机构许可申请EP European pharmacopoeia 《欧洲药典》EMEA European Agency for the Evaluation of Medicinal Products 欧洲药品评价署EPA Environmental Protection Agency (美国)环境保护署EU European Union 欧盟FAO United Nations Food and Agricultural Organization 联合国粮农组织FD&C Act Federal Food, Drug and Cosmetic Act 《联邦食品、药品和化妆品法》FDA Food and Drug Administration (美国)食品药品管理局FSIS Food Safety Inspection Service (USDA) (美国农业部)食品安全检查服务局FTC Federal Trade Commission (美国)联邦贸易委员会GLP Good laboratory practice 良好实验室规范;药品非临床研究质量管理规范GMP Good manufacturing practices 药品生产和管理规范GPP Good pharmacy practice 良好药房规范;医疗机构制剂配制管理规范GPSP Good Post-marketing Surveillance Practice 良好上市后监督规范;上市药品监督规范GSP Good supplying practice 良好供应规范;药品经营质量管理规范HVAC Heating Ventilation Air Conditioning 空调净化系统ICH International Conference on Harmonization 国际(药品注册)协调会议IMIC International Medical Information Center 国际医学信息中心INCB International Narcotics Control Board 国际麻醉药品管制局IOM Institute of Medicine (美国国家科学院)医学研究所IPF International Pharmaceutical Federation 国际制药联合会IRC International Red Cross 国际红十字会IRCC International Red Cross Conference 国际红十字大会ISO International Standards Organization 国际标准化组织IVDC China Institute of Veterinary Drug Control 中国兽医药品监察所JIFSAN Joint Institute for Food Safety and Applied Nutrition (美国FDA)食品安全和应用营养联合研究所KFDA Korea Food and Drug Administration (韩国)食品药品管理局MHLW Ministry of Health, Labour and Welfare (日本)厚生劳动省MII China Ministry of Information Industry 中华人民共和国信息产业部MOF Ministry of Finance People's Republic of China 中华人民共和国财政部MoH Ministry of Health P.R.China 中华人民共和国卫生部MOST Ministry of Science and Technology of the People's Republic of China 中华人民共和国科学技术部NBS National Bureau of Statistics of China 国家统计局NCI National Cancer Institute (美国)国家癌症研究所NDA New drug application 新药申请NCTR FDA National Center for Toxicological Research (美国)FDA国家毒理学研究中心NIAID National Institute of Allergy and Infectious Diseases (美国)国家过敏症和传染病研究所NIDA National Institute on Drug Abuse (美国)国家药物滥用研究所NIH National Institute of Health (美国)国家健康研究所ORA FDA Office of Regulatory Affairs (美国)FDA监管事务办公室OTC Over the counter drug (Nonprescription drugs) 放在柜台上的药品(非处方药)PHS Public Health Service (美国)公众健康服务局Ph Gal Pharmacopoeia galisa 《法国药典》[拉]Ph J Pharmacopoeia japonica 《日本药典》PhI Pharmacopoeia internationalis 《国际药典》[拉]PLA Product license application 产品许可申请PRC People's Republic of China 中华人民共和国QA Quality assurance 质量保证QC Quality control 质量控制SAIC State Administration For Industry & Commerce 国家工商行政管理总局SAMHSA Substance Abuse and Mental Health Services Administration (美国)物质滥用和精神健康服务管理局SATCM State Administration of Traditional Chinese Medicine (中国)国家中医药管理局SETC State Economic and Trade Commission,PRC 中华人民共和国国家经济贸易委员会SFDA State Food and Drug Administration (中国)国家食品药品监督管理局SIPO State Intellectual Property Office of the People's Republic of China 国家知识产权局SOP Standard operating procedure 标准操作规程TFDA Thailand Food and Drug Administration (泰国)食品药品管理局TGA Therapeutic Goods Administration (澳大利亚)治疗产品管理局TQC Total quality control 全面质量控制UK United Kingdom (大不列颠)联合王国USP The united states pharmacopoeia 《美国药典》WHO United Nations World Health Organization (联合国)世界卫生组织WTO World Trade Organization 世界贸易组织ZDA Zhejiang Drug Administration 浙江省药品监督管理局。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
For personal use only in study and research; not for commercial useFDA药品审评和研究中心 (CDER)色谱方法验证审评指南1994.11 CMC 3For personal use only in study and research; not for commercial use目录. 绪言.色谱分类A.高效液相色谱 (HPLC)1.手性液相色谱2.离子交换色谱3.离子对/亲和色谱4.正相色谱5.反相色谱6.分子排阻色谱B.气相色谱 (GC)C.薄层色谱 (TLC).参考标准.药物及其制剂HPLC方法验证的参数A.准确性B.检出限和定量限C.线性D.精密度1.重复性a.进样重复性b.分析重复性2.组间精密度3.重现性E.范围F.回收率G.耐久性H.供试品溶液的稳定性I.专属性/选择性J.系统适用性规定和试验1.容量因子2.精密度/进样重复性3.相对保留时间4.分离度5.拖尾因子6.理论塔板数K.要点.注解和结论.致谢.参考文献色谱方法验证审评指南. 绪言本技术指南的目的是给审评人员审评验证色谱方法的, 该文件讨论色谱方法的要点和不足, 以便CDER的审评人员能够保证方法的良好性能,也使化学工作者了解为通过审评应给出的足够的信息。
国际协调会议(ICH)1993年定义的分析术语,已在这一指南中运用。
色谱方法通常用于原料、药物、药物制剂和生物体液中化合物的定性和定量。
涉及的成分包括手性的或非手性的药物、过程杂质、残留溶媒、附加剂如防腐剂、分解产物、从容器和密闭包装或制造过程中带入的可提取和可过滤的杂质、植物药中的农药和代谢物等。
试验方法的目的是得到可信赖的和准确的数据,无论是用于验收、出厂、稳定性或药物动力学研究。
得到的数据用于药品开发或批准后的定性和定量,试验包括原料的验收、药物和药物制剂的出厂、过程检验(In- process testing)的质量保证和失效期的建立。
方法的验证是由药品的开发者或使用者来检验其方法是否达到预期的可靠性、准确度和精密度的过程。
得到的数据成为方法的验证资料的一部分交给CDER.。
方法的验证对于完成机构满足档案要求不是一次性的,开发者和使用者都应验证其方法的耐用度或耐久性(ruggedness or robustness.),其他的分析者、用其它相当的仪器,在其它的日期或地点,在药品生产期限(有效期)全过程,方法都应能够重现。
如果产生数据的方法是可靠的,那么所得到的验收、出厂、稳定性或药物动力学的数据就是可信赖的。
验证的过程和方法的设计应在开发过程中重要的数据产生之前,如果方法改变了,还应该再验证。
. 色谱类型色谱是一种技术,通过该技术,样品中的组分载入液相或气相中,通过在固定相上由吸附—解吸附来完成。
A. 高效液相色谱 (HPLC)HPLC分离是基于在样品在流动相液体和固定相之间的不同分配。
一般地说HPLC大体分为以下几种(未考虑其重要性顺序)1. 手性液相色谱2. 离子交换色谱3. 离子对/亲和色谱4. 正相色谱5. 反相色谱6. 分子排阻色谱1. 手性液相色谱分离光学异构体可在手性固定相上,用衍生化试剂或在非手性固定相上用流动相添加剂形成非对对映体来实现。
用作杂质试验方法时,如果光学异构体杂质在光学异构体药物之前洗脱,要增加灵敏度。
2. 离子交换色谱分离基于荷电功能团,样品负离子(X - )为阴离子,样品正离子((X + )为阳离子,一般用pH程序洗脱。
3. 离子对/亲和色谱分离基于与目标样品的专一的化学相互作用。
更普遍的反相型用缓冲液和加入的对离子(与被分离的样品荷相反电荷)分离。
分离受pH、离子强度、温度、浓度和共存的有机溶剂类型的影响。
亲和色谱,一般用于大分子,使用配合体(共价结合在固体基质上的生物活性分子),与其同类的抗原(分析介质)反应,生成可逆转的复合物,通过改变缓冲条件洗脱。
4. 正相色谱正相色谱为用有机溶剂为流动相和极性的固定相。
此时较小极性的组分比较大极性组分更快地洗脱。
5. 反相色谱报给CDER的最通常的实验方法是反相HPLC方法,最通常用紫外检测器。
反相色谱,一种键合相的色谱技术,用水作基本溶剂,选择性也受溶剂强度、柱温和pH的影响,一般来说较大极性比较小极性组分洗脱更快。
紫外检测器可以用于所有色谱,这类检测器要注意的是灯老化后的灵敏度降低,其灵敏度因(仪器)的设计和/或者制造厂家的不同有小的变异。
需要指出,用紫外检检测器和反相HPLC组合得到的色谱图不一定能真实的反映事实,原因是:·极性比目标化合物大得多的化合物可能被掩盖(在溶剂前沿或死体积时同时洗脱)。
·极性比目标化合物小得多的化合物洗脱出来晚,甚至保留在柱上。
·紫外吸收系数较低和最大吸收不同的化合物在检测相对较低浓度的目标分析物时不能被检出,因为通常只有一个检测波长。
6. 排阻色谱也叫凝胶渗漉(permeation)或滤过,分离基于化合物分子大小或水动力学(hydrodynamic)容积。
比多孔柱填料孔径大得多的分子最先洗脱,小分子进入孔隙洗脱晚,其余的洗脱速率取决于其分子的相对大小。
B. 气相色谱(GC)气相色谱基于挥发性样品由作为流动相的载气运载,通过色谱柱内的固定相时发生吸附和解吸附过程进行分离。
通常气相色谱分析的样品是低分子量化合物,这些化合物是易挥发的和高温时稳定的。
在这一方面,药物和药物制剂中的残留溶剂适于气相色谱分析。
生成化学衍生物可达到易挥发和热稳定的目的。
常用的检测器是用于含碳化合物的火焰离子化检测器(FID),用于卤代化合物的电子捕获式检测器(ECD),用于含硫和含磷化合物的火焰光度检测器(FPD),以及用于含氮或磷化合物的氮磷检测器(NPD)。
气相色谱也能实现手性分离。
填充柱迅速被毛细管取代来改进分离度和分析时间,在气相色谱上分析物位置与HPLC一样,用保留时间(R t)表示。
C. 薄层色谱(TLC)薄层色谱是一种最简便普通的色谱技术,分离基于在一端浸于溶剂混合物(流动相)中的薄层板(固定相)上点的样品移动进行分离,整个系统在密封的缸中进行。
对于本身没有颜色的化合物,检出技术包括荧光、紫外和喷雾显色剂(通用的和专一的)。
分析物在薄层板上的位置用R f值来表示,R f值为化合物的移动距离与溶剂前沿的比值。
三种方法,气相、液相和薄层中,薄层色谱是最普通的试验方法,因为薄层板上所有的组分都可用适宜的检测技术检出。
然而通常不如HPLC那么准确和灵敏。
虽然选用适宜的检测技术,TLC法能见到分析的“全图”(whole picture) ,但比HPLC分析变异较大。
. 参考标准品(对照品)参考标准品为经充分鉴定的高纯度化合物,色谱方法更大程度上依赖参考标准品来提供准确的数据。
因而参考标准品的质量和纯度是很重要的,有二类参考标准品,化学的和放射性的。
后者应考虑放射标记纯度和化学纯度。
按照提交方法验证的样品和分析数据,指南中的二类化学参考标准品如下:· USP / NF参考标准品,不需要鉴定。
·非总目录标准品,应用合理方法制备,并经充分鉴定,以保证其鉴别、含量、质量和纯度达到最高。
应该指出·大多数USP / NF参考标准品未标示化合物纯度。
·对非USP参考标准品,提出纯度的校正数应包括在试验方法的计算中。
·提供的参考标准品中没有以下杂质,诸如合成过程的结构相似的杂质和其它的过程杂质,如重金属、残留溶剂、水分(结合的和非结合的)、植物来源制剂中的农药和分解产物等。
·如果在方法中规定,用前参考标准品要干燥除去残留溶剂、非结合水分和有时是结合水(取决于干燥条件),对易潮解的化合物总是包括干燥步骤的。
但另一方面干燥可能导致结晶水的损失或引起热敏感化合物的降解。
色谱方法用外标法和内标法进行定量。
A. 外标法当参考标准品与样品在不同的色谱图上进行分析时,用外标法。
定量基于样品的峰面积/高(HPLC或GC)或强度(TLC)与分析对象、参考标准品的比值。
更适合用外标法的样品如下:1.样品具有单一的目标浓度和狭窄的浓度范围,例如验收和出厂检验。
2.简便的样品制备操作。
3. 增加走基线的时间,为检测可能的额外峰,如杂质试验。
B. 内标法加入一种已知纯度并且在分析中不产生干扰的化合物至样品混合液中,定量基于被分析的化合物与内标的响应比值与参考标准品得到的比值进行比较。
这一方法很少用于TLC。
更适合用内标法的样品如下:1.复杂的样品制备过程,如多次提取。
2.低浓度的样品(灵敏度是确定的),如药代动力学的研究。
3.在样品分析中预计是很宽的浓度范围,如药物动力学研究。
虽然CDER不规定方法应该用内标或外标法用于定量,但一般的看法是用于验收、稳定性和TLC用外标法,对生物体液和GC用内标法。
工作浓度为方法中规定的被分析对象的目标浓度。
保持样品浓度与标准的浓度相近可以改善方法的准确性。
建议1.如果参考标准品的纯度校正因子已知,那么在计算中应该包括。
2.在方法中要规定标准品和样品的工作浓度。
. 药物和药物制剂HPLC验证的参数虽然许多种HPLC都可采用,但最普遍上报的方法都是用紫外检测器的反相HPLC法,以此作为验证参数的例子。
这一方法验证的规定可以扩展到其它检测器和其它色谱。
对于验收、出厂或稳定性试验,准确性应最佳化,因为要表明实测值和真值的差异是最为关注的。
A. 准确性准确性是衡量测量实验值和真值的接近程度。
推荐药物和药物制剂的准确性研究在标示量的80%、100%和120%的水平上来进行的,这与“The Guideline for Submitting Samples and Analytical Data for method Validation”的规定是一致的。
对于药物制剂,准确性试验通常是将已知量的药物 [按重量或体积(溶于稀释剂)] 以分析对象检测浓度的线性范围量加到空白处方内来完成的。
对于液体制剂,这是真实的回收率;而对于诸如片剂、栓剂、透皮吸收制剂等,这不能检测稀释剂中的赋形剂与活性成分间可能产生的作用。
实际上要做一个已知活性药物量的单个剂量单位(single unit)来进行回收试验是困难的。
准确性试验评价在赋形剂存在时,在分析药物制剂的色谱条件下,试验方法的专属性。
但这只是样品制备过程和色谱过程中的回收率,而不是制造过程的影响。
在每个推荐检测浓度重复进样,其重复进样的RSD提供了分析方法的变动性,或是试验方法的精密程度。
重复性的均值以标示量的%来表示,这表明试验方法的准确程度。
建议回收试验在每个水平上(标示量的80%、100%和120%)至少做3份,均数用来估计准确性的,RSD是估计样品分析精密度的。
