初中化学常见的离子
初中化学常见的离子

初中化学常见的离子
1.阴离子有:
SO42—(硫酸根离子)、NO3—(硝酸根离子)、CO32—(碳酸根离子)、OH—(氢氧根离子)、HCO3—(碳酸氢根离子)、S2—(硫离子)、O2—(氧离子)、Cl—(氯离子)
2.阳离有:
NH4+(铵根离子)、H+(氢离子)、K+(钾离子)、Ca2+(钙离子)、Na+(钠离子)、Mg2+(镁离子)、Al3+(铝离子)、Zn2+(锌离子)、Fe2+(亚铁离子)、Fe3+(铁离子)、Cu2+(铜离子)、Ag+(银离子)、Ba2+(钡离子)
以上离子必须记住。
下面这些离子了解,可以不记:
MnO4—(高锰酸根离子)、MnO42—(锰酸根离子)、PO43—(磷酸根离子)、
ClO3—(氯酸根离子)、HSO4—(硫酸氢根离子)、HPO42—(磷酸氢根离子)、
H2PO4—(磷酸二氢根离子)、
温馨提示:以上“初中化学常见元素及符号、初中化学常见的离子”是每一个初中学生学好化学的前提,希望同学们暑假把它们记住,到时候要听写。
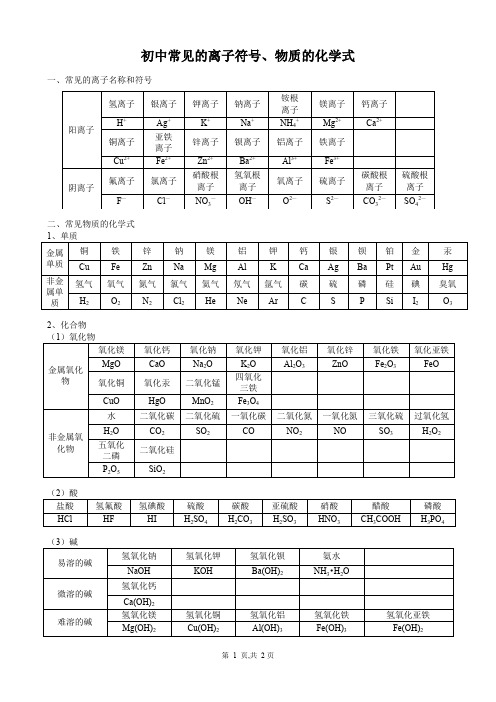
初中化学 常见的离子符号、物质的化学式
Ne
Ar
C
S
P
Si I2
O3
2、化合物 (1)氧化物
氧化镁
金属氧化 物
MgO 氧化铜
非金属氧 化物
CuO 水
H2O 五氧化
二磷 P2O5
氧化钙 氧化钠 氧化钾 氧化铝 氧化锌 氧化铁 氧化亚铁
CaO 氧化汞
HgO 二氧化碳
Na2O 二氧化锰
MnO2 二氧化硫
K2O 四氧化
三铁
Fe3O4 一氧化碳
Al2O3 二氧化氮
KNO3 2 价)
碳酸铵 碳酸氢钠 碳酸氢钙
Fe(NO3)3 Fe(NO3)3 AgNO3 碳酸氢铵
Na2CO3 K2CO3 CaCO3 BaCO3 (NH4)2CO3 NH4HCO3 Ca(HCO3)2 NH4HCO3
硝酸铵 NH4NO3
第 2 页,共 2 页
氯化铝 氯化钡
AlCl3
BaCl2
氯化钾 氯化钙 氯化铜
KCl
CaCl2
CuCl2
硫酸盐(硫酸根显—2 价)
氯化铁 FeCl3
氯化亚 铁
氯化银
FeCl2 AgCl
氯化铵 NH4Cl
硫酸钠 硫酸镁 硫酸铝 硫酸钡 Na2SO4 MgSO4 Al2(SO4)3 BaSO4
硫酸钾 硫酸钙 硫酸铜
K2SO4
初中常见的离子符号、物质的化学式
一、常见的离子名称和符号
阳离子 阴离子
氢离子 H+
铜离子 Cu2+
氟离子 F—
银离子
Ag+ 亚铁 离子 Fe2+
氯离子
Cl—
钾离子
K+
锌离子
初中化学离子知识点梳理

初中化学离子知识点梳理化学离子是初中化学中重要的知识点之一,在学习化学的过程中,离子是我们必须掌握和理解的基本概念。
本文将对初中化学离子的相关知识点进行梳理和介绍。
一、离子的概念和分类离子是由原子或分子失去或获得电子而形成的带电粒子。
根据离子所带电荷的性质,离子可分为阳离子和阴离子两类。
1. 阳离子阳离子是失去一个或多个电子的原子或分子,带正电荷。
阳离子通常是非金属元素接受电子形成的。
例如,钠原子 (Na) 失去一个电子,成为带有一个正电荷的钠离子 (Na+)。
其他常见的阳离子还有铵离子 (NH4+)、镁离子 (Mg2+) 等。
2. 阴离子阴离子是获得一个或多个电子的原子或分子,带负电荷。
阴离子通常是金属元素失去电子形成的。
例如,氯原子 (Cl) 获得一个电子,成为带有一个负电荷的氯离子 (Cl-)。
其他常见的阴离子还有氧离子 (O2-)、氢氧根离子 (OH-) 等。
二、离子的命名规则离子的命名遵循一定的规则,以确保离子的名称能够准确反映其组成元素和电荷数目。
1. 金属阳离子的命名金属阳离子一般以金属元素的名称来命名。
例如,钠离子 (Na+)、铜离子(Cu2+)、铁离子 (Fe2+、Fe3+) 等。
2. 非金属阳离子的命名非金属阳离子的命名根据元素名称的尾音,将其改为“-ium”。
例如,氢离子(H+)、氨离子 (NH4+)、铵离子 (NH4+) 等。
3. 阴离子的命名阴离子的命名需要考虑原子或分子中所带电子数目。
一般情况下,以元素名称的根据尾音变为“-ide”来命名。
例如,氯离子 (Cl-)、溴离子 (Br-)、氧离子 (O2-) 等。
三、离子的化学式和化合物的组成离子可以通过化学式来表示,其中离子的化学式由带电荷的原子符号和电荷数目表示。
例如,氯离子的化学式为Cl-,氨离子的化学式为NH4+。
化合物是由两种或更多种元素通过化学键相互结合而形成的。
化合物中离子的组成可以通过离子的化学式获得。
例如,氯化钠 (NaCl) 是由钠离子 (Na+) 和氯离子 (Cl-) 结合而成。
初中化学中颜色离子

初中化学中颜色离子
在初中的化学课程中,我们可能会遇到各种不同颜色的离子。
以下是部分常见颜色离子:
蓝色离子:铜离子(Cu²⁺)
浅绿色离子:亚铁离子(Fe²⁺)
淡紫色离子:铁离子(Fe³⁺,但通常在溶液中呈现棕黄色)
浅粉色离子:锰离子(Mn²⁺)
粉色离子:钴离子(Co²⁺)
绿色离子:镍离子(Ni²⁺),亚铬离子(Cr²⁺),铬离子(Cr³⁺),镉离子(Cd²⁺)
金黄色离子:金离子(Au³⁺)
紫红色离子:高锰酸根离子(MnO₄⁻)
墨绿色离子:锰酸根离子(MnO₄²⁻)
黄色离子:铬酸根离子(CrO₄²⁻),重铬酸根离子(Cr₂O₇²⁻),四氯合铜络离子[CuCl₄]⁻
血红色离子:硫氰合铁络离子[Fe(SCN)]⁻
以上是部分初中化学中可能涉及的有颜色的离子,如需更多信息,建议阅读化学书籍或请教化学老师。
初中化学常见离子符号

初中化学常见的离子符号常见的金属离子: 锂离子:Li+钾离子:K+ 钠离子:Na+ 钙离子:Ca2+镁离子:Mg2+ 钡离子:Ba2+ 铝离子:Al3+锌离子:Zn2+ 铁离子:Fe3+ 亚铁离子:Fe2+铜离子:Cu2+亚铜离子:Cu+ 银离子:Ag+常见的非金属离子:氟离子:F —氯离子:Cl — 溴离子: Br — 碘离子:I —硫离子:S2— 氧离子 O2— 氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子: SO42 — 亚硫酸 根离子:SO32—硝酸根离子:NO3— 氢氧根离子: OH — 氯酸根离子 ClO3 — 磷 酸根离子: PO43 —碳酸氢根离子:HCO3—高锰酸根离子:MnO4— 锰酸根离子: MnO42— 铵根离子:NH4+说明: 1、 离子不可单独存在,有阴离子存在必然有阳离子,由阴 阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化 合物中元素表现的化合价数值和正负均一致。
例如,硫离子 S2—中 S 的化合价为—2 3、离子团所带的电荷数与其整体表现化合价数值和 正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N 显—3 价,H 显+1 价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
一、默写。
(每空 1 分,共15 分)1、关关雎鸠,在河之洲。
2、求之不得,。
悠哉悠哉。
3、,。
所谓伊人,在水一方。
4、溯洄从之,。
,宛在水中坻。
5、李贺《雁门太守行》一诗中分别从听觉和视觉两方面铺写阴寒惨烈的战地气氛的两句是,。
6、,受上赏;,受中赏;,,受下赏。
二、课内文言文阅读(70 分)(一)生于忧患,死于安乐(16 分)舜发于畎亩之中,傅说举于版筑之中,胶鬲举于鱼盐之中,管夷吾举于士,孙叔敖举于海,百里奚举于市。
初中化学常见离子的检验

初中化学常见离子的检验一、H+、Ag+、OH—、Cl-、SO42—、CO32-的检验(1)H+检验。
方法1、将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变红,则证明H+存在。
方法2、用干燥清洁的玻璃棒蘸取未知液滴在蓝色石蕊试纸上,如果蓝色试纸变红,则证明H+的存在。
方法3、用干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH小于7,则证明H+的存在。
2)Ag+检验。
将少量盐酸或少量可溶性的盐酸盐溶液倒入盛有少量待测液的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失,则证明Ag+的存在.(3)OH-的检验。
方法1、将紫色石蕊试液滴入盛有少量待测液的试管中,振荡,如果石蕊试液变蓝,则证明OH-的存在。
方法2、用干燥清洁的玻璃棒蘸取未知液滴在红色石蕊试纸上,如果红色石蕊试纸变蓝,则证明OH—的存在.方法3、将无色的酚酞试液滴入盛有少量待测液的试管中,振荡,如果酚酞试液变红,则证明OH-的存在.方法4、干燥清洁的玻璃棒蘸取未知液滴在pH试纸上,然后把试纸显示的颜色跟标准比色卡对照,便可知道溶液的pH,如果pH大于7,则证明OH—的存在.(4)Cl-的检验。
将少量的硝酸银溶液倒入盛有少量待测液的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失,则证明Cl-的存在。
(5)SO42—的检验。
将少量氯化钡溶液或硝酸钡溶液倒入盛有少量待测液的试管中,振荡,如果有白色沉淀生成,再加入少量的稀硝酸,如果沉淀不消失,则证明SO42—的存在。
(6)CO32-的检验。
将少量的盐酸或硝酸倒入盛有少量待测液的试管中,如果有无色气体放出,将此气体通入盛有少量澄清石灰水的试管中,如果石灰水变浑,则证明原待测液中CO32—的存在.。
初中常见离子符号、化学式和化学方程式
初中常见离子符号、化学式和化学方程式(初二部分)常见的离子符号常见的金属离子:1、带一个单位正电荷的锂离子:Li+钾离子:K+钠离子:Na+银离子:Ag+亚铜离子:Cu+2、带两个单位正电荷的钙离子:Ca2+镁离子:Mg2+钡离子:Ba2+锌离子:Zn2+亚铁离子:Fe2+铜离子:Cu2+3、带三个单位正电荷的铁离子:Fe3+ 铝离子:Al3+常见的非金属离子:1、带一个单位负电荷的氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—2、带两个单位负电荷的硫离子:S2—氧离子O2—3、带一个单位正电荷的氢离子:H+常见的原子团:(也叫酸根离子,NH4+除外)硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—锰酸根离子:MnO42—铵根离子:NH4+说明:带正电荷的叫阳离子(如金属离子)带负电荷的叫阴离子(如常见的非金属离子和常见的原子团。
H+和NH4+除外。
)1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S的化合价为—23、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
价的代数和。
例如,铵根离子NH4常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
常见的化学式➢常见的化学方程式一、化合反应1、红磷在空气(或氧气)中燃烧:4P + 5O2 2P2O52、氢气在空气中燃烧生成水:2H2 + O22H2O3、硫磺在空气(或氧气)中燃烧:S + O2 SO24、镁条在空气(或氧气)中燃烧:2Mg + O22MgO5、铁丝在氧气中燃烧:3Fe + 2O2 Fe3O46、木炭在空气(或氧气)中完全燃烧:C + O2 CO27、木炭不充分燃烧:2C + O22CO8、一氧化碳燃烧:2CO + O2 2CO29、二氧化碳和水反应生成碳酸:CO2 + H2O == H2CO310、二氧化碳通过灼热的炭层:CO2+ C 2CO 二、分解反应11、高锰酸钾制氧气:2KMnO4 K2MnO4+ MnO2+ O2↑12、氯酸钾制氧气:2KClO3 2KCl + 3O2↑13、双氧水制氧气:2H2O22H2O + O2↑14、电解水:2H2O 2H2↑+ O2↑15、碳酸分解:H2CO3H2O + CO2↑16、高温煅烧石灰石:CaCO3 CaO +CO2↑三、其他反应类型17、石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl = CaCl2+H2O+CO218、硫酸铜溶液和氢氧化钠溶液反应:CuSO4+2NaOH = Na2SO4+Cu(OH)2↓19、二氧化碳通入澄清石灰水中:CO2 + Ca(OH)2== CaCO3↓+ H2O20、氢氧化钠吸收二氧化碳:CO2+ 2NaOH = Na2CO3+ H2O21、氢氧化钠溶液吸收二氧化硫:SO2 + 2NaOH==Na2SO3+ H2O22、酒精燃烧:C2H5OH + 3O22CO2+ 3H2O点燃点燃点燃点燃点燃点燃点燃高温点燃△MnO2△MnO2通电高温点燃点燃23、甲烷燃烧:CH4 + 2O2CO2+ 2H2O---精心整理,希望对您有所帮助。
初中化学知识点归纳常见离子的性质和生成规律
初中化学知识点归纳常见离子的性质和生成规律初中化学知识点归纳——常见离子的性质和生成规律化学是我们日常生活中不可或缺的一部分,学习化学的过程中,离子是一个重要的概念。
离子是由原子或原子团中失去或获得电子而带有电荷的化学物种。
在化学中,我们常见的离子可以分为阳离子和阴离子,具有不同的性质和生成规律。
本文将归纳和总结初中化学中常见离子的性质和生成规律。
I. 阳离子的性质和生成规律1. 氢离子(H+)性质:氢离子是单个的质子,不带任何电子,带有+1的电荷。
氢离子通常与其他阴离子结合,形成不稳定的化合物或者溶液中的酸性离子。
生成规律:氢离子可以由酸的解离产生。
例如, HCl(盐酸)在溶液中会解离成H+和Cl-离子。
2. 铵离子(NH4+)性质:铵离子是由氨基团(NH3)与氢离子(H+)结合而成,带有+1的电荷。
铵盐通常是固体,易溶于水,并且具有良好的导电性。
生成规律:铵离子可以由铵盐的溶解或者氨的质子化生成。
例如,NH4Cl(氯化铵)在水中溶解时,会生成NH4+和Cl-离子。
3. 钠离子(Na+)性质:钠离子是一种在化合物中常见的阳离子,带有+1的电荷。
它是一种金属离子,在化合物中具有良好的溶解性和导电性。
生成规律:钠离子可以由钠金属失去一个电子生成。
例如,NaCl (氯化钠)中的钠离子可以由Na原子电离得到。
II. 阴离子的性质和生成规律1. 氯离子(Cl-)性质:氯离子是一种非金属离子,带有-1的电荷。
它通常与金属离子结合形成盐类化合物。
氯离子具有良好的溶解性和导电性。
生成规律:氯离子可以由氯原子接受一个电子生成。
例如,Cl2(氯气)可以在电解质溶液中接受电子,生成Cl-离子。
2. 硫酸根离子(SO4^2-)性质:硫酸根离子是一种带有-2电荷的多原子离子,广泛存在于硫酸盐中。
它具有良好的稳定性和溶解性。
生成规律:硫酸根离子可以由硫酸的解离产生。
例如,H2SO4(硫酸)溶解时会产生SO4^2-离子和H+离子。
初中化学常见离子符号
初中化学常见的离子符号常见的金属离子:锂离子:Li+ 钾离子:K+ 钠离子:Na+ 钙离子:Ca2+ 镁离子:Mg2+ 钡离子:Ba2+ 铝离子:Al3+ 锌离子:Zn2+ 铁离子:Fe3+ 亚铁离子:Fe2+ 铜离子:Cu2+ 亚铜离子:Cu+银离子:Ag+常见的非金属离子:氟离子:F—氯离子:Cl—溴离子:Br—碘离子:I—硫离子:S2—氧离子 O2—氢离子:H+常见的离子团:碳酸根离子:CO32—硫酸根离子:SO42—亚硫酸根离子:SO32—硝酸根离子:NO3—氢氧根离子:OH—氯酸根离子 ClO3—磷酸根离子:PO43—碳酸氢根离子:HCO3—高锰酸根离子:MnO4—锰酸根离子:MnO42—铵根离子:NH4+说明: 1、离子不可单独存在,有阴离子存在必然有阳离子,由阴阳离子构成的物质是离子化合物。
2、离子所带的电荷数与其在化合物中元素表现的化合价数值和正负均一致。
例如,硫离子S2—中S的化合价为—2 3、离子团所带的电荷数与其整体表现化合价数值和正负一致,其整体化合价是其组成元素所表现化合价的代数和。
例如,铵根离子NH4+的整体化合价是+1,这是由于其中N显—3价,H显+1价决定的。
常用化合价口诀:一价氢氯(-1)钾钠银,二价氧(-2)钙钡镁锌,三铝四硅五氮磷,二三铁二四碳,二(-2)四六硫都齐全,单质为零铜正二,金正非负和为零。
负一硝酸氢氧根,负二硫酸碳酸根,负三只有磷酸根,正一价的是铵根。
一、默写。
(每空1分,共15分) 1、关关雎鸠,在河之洲。
,。
2、求之不得,。
悠哉悠哉。
3、,。
所谓伊人,在水一方。
4、溯洄从之,。
,宛在水中坻。
5、李贺《雁门太守行》一诗中分别从听觉和视觉两方面铺写阴寒惨烈的战地气氛的两句是,。
6、,受上赏;,受中赏;,,受下赏。
二、课内文言文阅读(70分)(一)生于忧患,死于安乐(16分)舜发于畎亩之中,傅说举于版筑之中,胶鬲举于鱼盐之中,管夷吾举于士,孙叔敖举于海,百里奚举于市。
初中化学离子知识点总结
初中化学离子知识点总结初中化学离子知识点总结前言初中化学中的离子是学习化学的基础知识之一。
掌握离子的概念以及常见的离子组成和特性对于理解化学反应和物质性质起着重要的作用。
本文将对初中化学中离子的相关知识进行总结。
正文1. 离子的定义离子是由失去或获得电子而带电的化学物质。
失去电子的离子带正电荷,称为阳离子;获得电子的离子带负电荷,称为阴离子。
离子的形成与元素的电子层结构有关。
2. 离子的命名离子的命名通常根据元素的名称进行。
阳离子一般使用原子元素名称,如钠离子、铁离子等。
阴离子则根据元素名称后缀加上-ide,如氯离子、氧离子等。
3. 常见离子的组成和特性•钠离子(Na+)和氯离子(Cl-):组成盐类,如食盐(NaCl),具有较高的热稳定性。
•铁离子(Fe2+和Fe3+):常见于铁的化合物中,如铁的氧化物,具有良好的催化作用。
•氢离子(H+):是酸性溶液中的阳离子,与氧离子(O2-)结合形成水分子。
•氧离子(O2-):是氧化性物质,参与许多化学反应,如氧化金属形成金属氧化物。
4. 离子之间的作用离子之间通过离子键相互吸引,组成离子化合物。
离子化合物在溶液中可以分解成离子,导电性极强。
离子在溶液中可以发生反应,参与化学平衡和反应。
5. 离子的配位数离子的配位数指的是围绕在离子周围的化学物质的数目。
比如,铁离子(Fe3+)的配位数通常为6,即六配位。
结尾离子是化学反应和物质性质的关键因素之一,对于初中化学的学习起着重要作用。
通过本文的总结,我们对离子的定义、命名、组成和特性、离子之间作用以及配位数有了基本的了解。
希望本文对你的化学学习有所帮助!注意:文章内部不得出现HTML字符,网址、图片及电话号码等内容不可包含。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学常见的离子
Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
初中化学常见的离子1.阴离子有:
SO
42—(离子)、NO
3
—(离子)、CO
3
2—(离子)、OH—(离子)、HCO
3
—(离子)、S2—(硫离子)、
O2—(氧离子)、Cl—()
2.阳离有:
NH
4
+(离子)、H+(氢离子)、K+()、Ca2+()、Na+(钠离子)、Mg2+()、Al3+(铝离子)、Zn2+()、Fe2+()、Fe3+()、Cu2+()、Ag+(银离子)、Ba2+(钡离子)
以上离子必须记住。
下面这些离子了解,可以不记:
MnO4—(高锰酸根离子)、MnO42—(锰酸根离子)、PO43—(根离子)、
ClO
3—(氯酸根离子)、HSO
4
—(硫酸氢根离子)、HPO
4
2—(磷酸氢根离子)、
H
2PO
4
—(磷酸二氢根离子)、
温馨提示:以上“初中化学常见元素及符号、初中化学常见的离子”是每一个初中学生学好化学的前提,希望同学们暑假把它们记住,到时候要听写。
