第十四章 β- 二羰基化合物
合集下载
有机化学第十四章

COOC2H5 CH3COCH2COOC2H5 + C2H5OH COCH2COOC2H5
两种产物在性质上有较大差别, 两种产物在性质上有较大差别,可分离
分子内Claisen 酯缩合(Dieckmann狄克曼缩合) 酯缩合( 狄克曼缩合) 分子内 狄克曼缩合
CH2CH2COOC2H5 CH2CH2COOC2H5 O
C2H5C O + CH2COOC2H5 CN CH3
乙酸铵-乙酸
C6H6
CH3 C2H5
C C COOC2H5 CN 85%
CHO
+
CH2(COOH)2
哌啶,95~100℃ ℃ -H2O
CH C(COOH)2
- CO2
CH CHCOOH (80%~95%)
五、Michael加成 加成
O + CH2(COOC2H5)2 C2H5ONa C2H5OH CH(COOC2H5)2 90% (C2H5)3N,叔丁醇 叔 O
三、丙二酸二乙酯的合成及应用
1、制备 、
CH2COONa Cl
NaCN
CH2COONa CNOC H 2 5
腈化反应
水解、 水解、成酯反应
2、应用 、 (1)制备取代乙酸(一取代或二取代): )制备取代乙酸(一取代或二取代): 脱H+,生成钠盐 生成钠盐
步2
制备甲基酮或烷基取代酸: 制备甲基酮或烷基取代酸:
①稀OH -,②H+,③∆ 酮式分 解 ①40%OH-,②H+,③∆ 酸式分解
CH3 CH3COCCOOC2H5 CH2CH2CH3
CH3 CH3COCHCH2CH2CH3
CH3 CH3CH2CH2CHCOOH
第14章β-二羰基化合物

(1)乙酰乙酸乙酯的制备 乙酰乙酸乙酯的制备
的酯在强碱 有α-H的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 发生缩合反应,失去一分子醇 生成β-羰基酯 一分子醇, 羰基酯的反应叫做酯 发生缩合反应,失去一分子醇,生成 羰基酯的反应叫做酯 缩合反应,又称为克莱森( 缩合反应,又称为克莱森(Claisen)缩合。 )缩合。
有机化学
上页 下页
重要β 二羰基化合物 重要 –二羰基化合物
O O C 2 H 5 O-C-CH 2 -C-OC 2 H 5
丙二酸二乙酯
O O CH3-C CH2-C-OC2H5
乙酰乙酸乙酯
有机化学
上页
下页
三、 丙二酸酯在有机合成上的应用
一.丙二酸二乙酯的制备 丙二酸二乙酯的制备
O O O O NaCN C H OH CH2-C-OH CH2-C-ONa 2 5 C2H5O-C-CH2-C-OC2H5 OH H2SO4 Cl CN
OH O CH3-C=CH-C-OC H5 2 烯醇式 (7%)
有机化学
上页
下页
二、 β –二羰基化合物碳负离子的反应 二羰基化合物碳负离子的反应
碳负离子是带部分负电荷的碳原子或氧原子, 碳负离子是带部分负电荷的碳原子或氧原子,都具 是带部分负电荷的碳原子或氧原子 亲核性, 有亲核性,在碳原子和氧原子上都有可能发生亲核 反应,主要发生在碳原子上 常见的反应有下列几种: 在碳原子上。 反应,主要发生在碳原子上。常见的反应有下列几种: (1)碳负离子与卤代烷的反应 卤代烷的反应 )碳负离子与卤代烷 羰基化合物的缩合反应 (2)碳负离子和羰基化合物的缩合反应 )碳负离子和羰基化合物 不饱和羰基化合物的共轭加成 (3)碳负离子和 ,β-不饱和羰基化合物的共轭加成 )碳负离子和α, 不饱和 反应
的酯在强碱 有α-H的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 的酯在强碱(一般是用乙醇钠)的作用下与另一分子酯 发生缩合反应,失去一分子醇 生成β-羰基酯 一分子醇, 羰基酯的反应叫做酯 发生缩合反应,失去一分子醇,生成 羰基酯的反应叫做酯 缩合反应,又称为克莱森( 缩合反应,又称为克莱森(Claisen)缩合。 )缩合。
有机化学
上页 下页
重要β 二羰基化合物 重要 –二羰基化合物
O O C 2 H 5 O-C-CH 2 -C-OC 2 H 5
丙二酸二乙酯
O O CH3-C CH2-C-OC2H5
乙酰乙酸乙酯
有机化学
上页
下页
三、 丙二酸酯在有机合成上的应用
一.丙二酸二乙酯的制备 丙二酸二乙酯的制备
O O O O NaCN C H OH CH2-C-OH CH2-C-ONa 2 5 C2H5O-C-CH2-C-OC2H5 OH H2SO4 Cl CN
OH O CH3-C=CH-C-OC H5 2 烯醇式 (7%)
有机化学
上页
下页
二、 β –二羰基化合物碳负离子的反应 二羰基化合物碳负离子的反应
碳负离子是带部分负电荷的碳原子或氧原子, 碳负离子是带部分负电荷的碳原子或氧原子,都具 是带部分负电荷的碳原子或氧原子 亲核性, 有亲核性,在碳原子和氧原子上都有可能发生亲核 反应,主要发生在碳原子上 常见的反应有下列几种: 在碳原子上。 反应,主要发生在碳原子上。常见的反应有下列几种: (1)碳负离子与卤代烷的反应 卤代烷的反应 )碳负离子与卤代烷 羰基化合物的缩合反应 (2)碳负离子和羰基化合物的缩合反应 )碳负离子和羰基化合物 不饱和羰基化合物的共轭加成 (3)碳负离子和 ,β-不饱和羰基化合物的共轭加成 )碳负离子和α, 不饱和 反应
第十四章_β-二羰基化合物
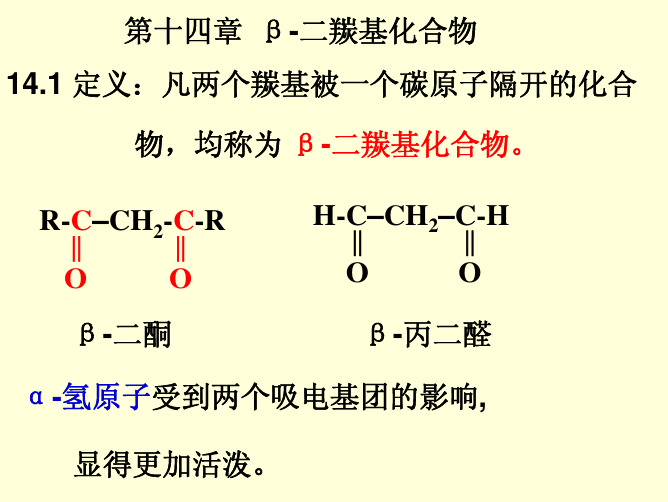
第十四章 β-二羰基化合物 14.1 定义:凡两个羰基被一个碳原子隔开的化合
物,均称为 β-二羰基化合物。
R-‖C–CH2-‖C-R
O
O
β-二酮
H-‖C–CH2–C‖-H
O
O
β-丙二醛
α-氢原子受到两个吸电基团的影响,
显得更加活泼。
14.2 命名
HO-‖C–CH2-‖C-OH
O
O
β- 丙二酸
R-‖C–CH2–C‖-OR’
CH3︱CH=CH‖COC2H5 OH O
NaOC2H5 H+
CH3‖C CH-‖COC2H5 OO
Na
+
CH3‖CCH2C‖OC2H5 OO
①5%NaOH CH3COCH2COOH
②H+
CH3COCH3
△,-CO2
?
CH3‖CCH2C‖OC2H540%△NaOH OO
CH3‖COON+a
C2H5OH
CH3‖CO︱CCHH‖O2CCOHC2C2HO①5O5C%2H︱CNHaO2CHH2CCHO3‖OCO︱CCHHH2‖OCCOHN2CaOONa ②H+ , ③△ CH3‖CCH2
O
CH3‖C︱CCHH‖2CCOHC2C2HO5OC酮2式H 分解 OO
C︱H2CH2COOH CH3‖CCH2
O
︱CH2CH2COO酸C2式H分5 解
CH3‖CCH2C‖OC2H5 OO
H2N-OH H+
CH3‖CCH2COOC2H5 N-OH
Na CH3︱C= CH ‖COC2H5 ONa O
CH3︱C = CHC‖OC2H5 OH O
+ H2
CH3‖C-CH-‖COC2H5Na +
物,均称为 β-二羰基化合物。
R-‖C–CH2-‖C-R
O
O
β-二酮
H-‖C–CH2–C‖-H
O
O
β-丙二醛
α-氢原子受到两个吸电基团的影响,
显得更加活泼。
14.2 命名
HO-‖C–CH2-‖C-OH
O
O
β- 丙二酸
R-‖C–CH2–C‖-OR’
CH3︱CH=CH‖COC2H5 OH O
NaOC2H5 H+
CH3‖C CH-‖COC2H5 OO
Na
+
CH3‖CCH2C‖OC2H5 OO
①5%NaOH CH3COCH2COOH
②H+
CH3COCH3
△,-CO2
?
CH3‖CCH2C‖OC2H540%△NaOH OO
CH3‖COON+a
C2H5OH
CH3‖CO︱CCHH‖O2CCOHC2C2HO①5O5C%2H︱CNHaO2CHH2CCHO3‖OCO︱CCHHH2‖OCCOHN2CaOONa ②H+ , ③△ CH3‖CCH2
O
CH3‖C︱CCHH‖2CCOHC2C2HO5OC酮2式H 分解 OO
C︱H2CH2COOH CH3‖CCH2
O
︱CH2CH2COO酸C2式H分5 解
CH3‖CCH2C‖OC2H5 OO
H2N-OH H+
CH3‖CCH2COOC2H5 N-OH
Na CH3︱C= CH ‖COC2H5 ONa O
CH3︱C = CHC‖OC2H5 OH O
+ H2
CH3‖C-CH-‖COC2H5Na +
第十四章 β-二羰基化合物

+
1
O
2 3
例2:由 CH2(COOC2H5)2
解:
Oδ CH2(COOC2H5)2 O CH(COOC2H5)2
H2O/H
+
CH2-COOH
4 5
ONaOC2H5
+
+
δ
CH(COOC2H5)2 O CH(COOH)2
-CO2
CH3COOH
O
CH2COOH
25
本章要点
⑴丙二酸酯的制备和应用。 ⑵克莱森酯缩合反应。 ⑶乙酰乙酸乙酯的应用。 ⑷互变异构。 ⑸麦克尔反应。
C-CH3
②制二酮 β- 二酮 二酮(1,3-二酮 : 二酮): 二酮
O O CH3CCHCOC2H5
O
-
Na
+
R-C-Cl or (RCO)2O
1,4-二酮: 1,4-二酮: 二酮
O O 2 CH3-C-CH2-C-OC2H5
5%NaOH H+ NaOC2H5
O O CH3CCHCOC2H5 C=O R
6
①制备烃基取代乙酸
(ⅰ)
烃基不同, 烃基不同,分步取代 利用丙二酸酯α 碳上的烷基化反应是制备 烃基取 碳上的烷基化反应是制备α 利用丙二酸酯α-碳上的烷基化反应是制备α-烃基取 代乙酸最有效的方法。 代乙酸最有效的方法。
7
8
②制备二元羧酸
Br Br
2CH2(COOC2H5)2
H2O/H+
NaOC2H5
酮式
O C
5%NaOH
H
+
O CH 3 C-CH 2 - C-CH
1,5-二羰基化合物 (1,2-加成产物)
第14章_β-二羰基化合物和有机_[1]...
![第14章_β-二羰基化合物和有机_[1]...](https://img.taocdn.com/s3/m/489a41b68762caaedd33d446.png)
不含α-H的酯如草酸二乙酯、甲酸酯、碳酸二乙酯 苯甲酸酯等在酰化反应中可分别引入-COCO2C2H5, -CHO, -COOC2H5, -COPh基团。
2. 酰基化反应
使用草酸酯得到的产物既是β-酮酯,又是α-酮 酯。由于α-酮酯在加热时可脱去羰基,为合成取 代丙二酸酯及相关化合物提供一条方便的途径。
3. 迈克尔加成反应
活泼氢化合物在催化量碱(常用醇钠,季铵碱及 苛性碱等)作用下与α, β-不饱和化合物发生1, 4-加成的反应称为Michael加成反应。
催化量 C2H5ONa + CH2=CHCCH3 C2H5OH O O (H5C2O2C) 2CH CH2CH2CCH3
CH2(CO2C2H5)2
COOC2H5 C2H5ONa PhCH2CO2C2H5 + COOC2H5 COOC2H5 C CO2C2H5 O 178° C
Ph HC
PhCH(COOC2H5)2
Ph HC
COOC2H 5 C CO 2C 2H 5 O
H 3O+
COOH Ph CH C COOH - CO2 O
PhCH2COCOOH
CH 3 O O
2-甲基-1,3-环戊二酮
练习14.2
14.1.2 β-二羰基化合物活泼氢的酸性
• β-二羰基化合物的两个羰基之间的α-氢原子的 酸性,由于其相应阴离子的共振稳定化而大大增 强。 pKa在9~13之间。 在碱的作用下,活性亚甲基上的质子具有酸性,易 脱去形成二羰基碳负离子或烯醇负离子,存在着酮 式和烯醇式的互变异构。
+ NaX
C
OC2H5 + C2H5OH
二烃基乙酰乙酸酯
α-烃基乙酰乙酸乙酯的应用
第14章 β-二羰基化合物

14.3 丙二酸酯的制备及其在有机合成上的应用
丙二酸二乙酯的制备: ①丙二酸二乙酯的制备 氯乙酸钠
◆丙二酸二乙酯分子中的α 丙二酸二乙酯分子中的α
-亚甲基上的氢非常活泼, 亚甲基上的氢非常活泼, 亚甲基上的氢非常活泼 在醇钠作用下失H形成碳负离子 形成碳负离子: 在醇钠作用下失 形成碳负离子
钠盐 碳负离子为强亲核试剂 强亲核试剂,可与卤烷发生一烃基或二烃 ◆碳负离子为强亲核试剂 可与卤烷发生一烃基或二烃 基取代反应. 基取代反应
CH2(COOC2H5)2
2 C2H5ONa Br(CH2)5Br
COOC2H5 COOC2H5
物料比1: 物料比 :1
COOH
用丙二酸酯为原料的合成法常称为丙二酸酯合成法 丙二酸酯合成法。 ◆用丙二酸酯为原料的合成法常称为丙二酸酯合成法。
14.4 乙酰乙酸乙酯的合成与 —克莱森 克莱森Claisen(酯)缩合反应 克莱森 酯 缩合反应
14.2 β-二羰基化合物的结构及反应特征 二羰基化合物的结构及反应特征
酸性:亚甲基同时受到两个羰基的影响, ① 酸性:亚甲基同时受到两个羰基的影响,使α-H 有较强的酸性(比醇和水强)。 有较强的酸性(比醇和水强)。 互变异构:酮式与烯醇式之间的互变。 二羰基 ②互变异构:酮式与烯醇式之间的互变。β-二羰基 共轭效应, 化合物,由于烯醇式存在共轭效应 能量降低, 化合物,由于烯醇式存在共轭效应,能量降低, 因而比较稳定。 因而比较稳定。 例如: 例如:
14.1 β-二羰基化合物的概念与典型化合物 二羰基化合物的概念与典型化合物 分子中含有两个羰基官能团的化合物叫二羰基化合物; ◆分子中含有两个羰基官能团的化合物叫二羰基化合物; 其中两个羰基为一个亚甲基相间隔的化合物叫β 二羰 其中两个羰基为一个亚甲基相间隔的化合物叫β-二羰 基化合物。 基化合物。 ◆β-二羰基化合物的亚甲基对两个羰基来说都是α位置, 二羰基化合物的亚甲基对两个羰基来说都是α 位置, 二羰基化合物的亚甲基对两个羰基来说都是 所以α 特别活泼 也叫含有活泼亚甲基的化合物。 特别活泼。 所以α-H特别活泼。 也叫含有活泼亚甲基的化合物。
第十四章 β-二羰基化合物

第十四章 β-二羰基化合物
(一) 命名下列化合物:
CH3 (1) HOCH2CHCH2COOH
(3) CH3CH2COCH2CHO
O (2) (CH3)2CHCCH2COOCH3
OH (4) (CH3)2C=CHCH2CHCH3
CHO
(5) ClCOCH2COOH
(7)
OCH3 NO2
OCH3 (6) OH
O
O
CH3C CH2C OC2H5 ( 以下同)
来自三乙 (1) 分析:
O
H3C C CH CH3
CH3
上2个 CH3I
O CH3C
解:
O CH2C
OC2H5
C2H5O-Na+ CH3 I
O CH3C
O CHC CH3
OC2H5
C2H5O-Na+ CH3 I
O CH3C
CH3 O CC CH3
(1) 稀OH- , (2) H+, (3) ∆
OC2H5
酮式分解
O H3C C CH CH3
CH3
CH3OH HI CH3I
OH
CH3CHCH2CH2CH2CH3
H2 Ni
(2) 分析:
O CH3CCH2CH2CH2CH3
上BrCH2CH2CH3
来自三乙
O
O
OO
CH3C CH2COC2H5 C2H5O-Na+ CH3CH2CH2Br CH3C CHCOC2H5
CH3
来自丙二
CH2(COOC2H5)2 C2H5O-Na+
解:
CH3CH=CHCOOC2H5
CH3CH CH2COOC2H5 CH(COOC2H5)2
(一) 命名下列化合物:
CH3 (1) HOCH2CHCH2COOH
(3) CH3CH2COCH2CHO
O (2) (CH3)2CHCCH2COOCH3
OH (4) (CH3)2C=CHCH2CHCH3
CHO
(5) ClCOCH2COOH
(7)
OCH3 NO2
OCH3 (6) OH
O
O
CH3C CH2C OC2H5 ( 以下同)
来自三乙 (1) 分析:
O
H3C C CH CH3
CH3
上2个 CH3I
O CH3C
解:
O CH2C
OC2H5
C2H5O-Na+ CH3 I
O CH3C
O CHC CH3
OC2H5
C2H5O-Na+ CH3 I
O CH3C
CH3 O CC CH3
(1) 稀OH- , (2) H+, (3) ∆
OC2H5
酮式分解
O H3C C CH CH3
CH3
CH3OH HI CH3I
OH
CH3CHCH2CH2CH2CH3
H2 Ni
(2) 分析:
O CH3CCH2CH2CH2CH3
上BrCH2CH2CH3
来自三乙
O
O
OO
CH3C CH2COC2H5 C2H5O-Na+ CH3CH2CH2Br CH3C CHCOC2H5
CH3
来自丙二
CH2(COOC2H5)2 C2H5O-Na+
解:
CH3CH=CHCOOC2H5
CH3CH CH2COOC2H5 CH(COOC2H5)2
第十四章 β二羰基化合物

C6H5
COOCH3 + CH3CH2CH2COOEt
NaH
N
COCHCOOEt
CH2CH3 N
3)分子内酯缩合( Dieckmann缩合) 建立五、六元脂环系 CH2COOEt CH3CH2ONa
实例 1
CH2CH2CO2C2H5 Na, C2H5OH(少量)
CH2CH2CO2C2H5
C6H5CH3
CO2C2H5 O
实例 2
CH3 CH2CHCO 2C2H5 CH2CH2CO2C2H5
CH3 CO2C2H5 O
CH3 O
CO2C2H5
CH3 O-
CO2C2H5
实例 3
O
O
CH3CH2C-CH2CH2CH2-COC2H5
酸等)
例如,用丙二酸二乙酯法合成下列化合物,其结构分析如下:
引入
CH3
原有
CH3 CH2 CH COOH
引入
原有 COOH
引入 CH2 CH2COOH CH2 CH2COOH
原有
原有 CH3 CH2 CH COOH
引入
CH2COOH
COOC2H5 CH2
C2H5ONa
COOC2H5
COOC2H5
_ CH
基的亲核加成反应;还原变为3-羟基丁酮酸乙 酯。
烯醇式结构:CH3C=CHCOOC2H5
OH
证据:烯烃性质-加溴(使溴水褪色);烯醇式 结构-三氯化铁水溶液显色;醇的性质—与三 氯化磷,乙酰氯反应等
乙酰乙酸乙酯实际是酮式和烯醇式混合物, 酮式和烯醇式混合物是互变异构,两者 处于平衡状态,互相转换。
原因如下:
1、羰基( C O)是个吸电子能力较强的基团,两个羰基对它们 中间有亚甲基的吸电子诱导作用一致,具有加和性,使得α-H的 活性增强。
COOCH3 + CH3CH2CH2COOEt
NaH
N
COCHCOOEt
CH2CH3 N
3)分子内酯缩合( Dieckmann缩合) 建立五、六元脂环系 CH2COOEt CH3CH2ONa
实例 1
CH2CH2CO2C2H5 Na, C2H5OH(少量)
CH2CH2CO2C2H5
C6H5CH3
CO2C2H5 O
实例 2
CH3 CH2CHCO 2C2H5 CH2CH2CO2C2H5
CH3 CO2C2H5 O
CH3 O
CO2C2H5
CH3 O-
CO2C2H5
实例 3
O
O
CH3CH2C-CH2CH2CH2-COC2H5
酸等)
例如,用丙二酸二乙酯法合成下列化合物,其结构分析如下:
引入
CH3
原有
CH3 CH2 CH COOH
引入
原有 COOH
引入 CH2 CH2COOH CH2 CH2COOH
原有
原有 CH3 CH2 CH COOH
引入
CH2COOH
COOC2H5 CH2
C2H5ONa
COOC2H5
COOC2H5
_ CH
基的亲核加成反应;还原变为3-羟基丁酮酸乙 酯。
烯醇式结构:CH3C=CHCOOC2H5
OH
证据:烯烃性质-加溴(使溴水褪色);烯醇式 结构-三氯化铁水溶液显色;醇的性质—与三 氯化磷,乙酰氯反应等
乙酰乙酸乙酯实际是酮式和烯醇式混合物, 酮式和烯醇式混合物是互变异构,两者 处于平衡状态,互相转换。
原因如下:
1、羰基( C O)是个吸电子能力较强的基团,两个羰基对它们 中间有亚甲基的吸电子诱导作用一致,具有加和性,使得α-H的 活性增强。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
δ C
δC
δ C
δ O
βα
由于羰基的极化和共轭π 键的离域,不仅 羰基碳上带有部分正电荷, β C 上也带有 部分正电荷,因此与亲核试剂加成时就有两 种可能
C C C O + Nu
1,2加成
H CCCO
Nu
1,4-加成
CCCO H Nu
C C C OH Nu
C C C OH Nu
不稳定(互变) H CCCO Nu
引
例 2:合成
O CH3
引
CH3 C CH CH2CH=CH2
原
要分两次引入,先引入 CH3 再引入 CH2CH=CH2
9
例 3:合成
O
O
CH3 C CH2 C
原
引
O
C CH3
引
原
说明:乙酰乙酸乙酯合成法主要用其酮式分解制取酮,酸式分解制酸很少,制酸一般用 丙二酸二乙酯合成法。
§14.6 不饱和羰基化合物
OO CH3 C CH C OC2H5 稀 OH
COR
O
O
CH3 C CH2 C R
C2H5OH + CO2 C2H5OH + CO2
(b) 酸式分解 乙酰乙酸乙酯及其取代衍生物在浓碱作用下,主要发生乙酰基的断
3
例如:
裂,生成乙酸或取代乙酸,故称为酸式分解。
O
O
浓NaOH
CH3 C CH2 C OC2H5
反应主要发生在亲核的碳原子上。
亚甲基活泼氢的性质:
1.酸性
乙酰乙酸乙酯的α-C 原子上由于受到两个吸电子基(羰基和酯基)的作用,α-H 很活
2
泼,具有一定的酸性,易与金属钠、乙醇钠作用形成钠盐。
O
O
CH3 C CH2 C OC2H5 C2H5ONa
OO CH3 C CH C OC2H5 Na
pKa =11
R CHCOOH R'
COOC2H5 COOC2H5
NaOH H2O
(1) H
(2)
CO2
COOH
(3)丙二酸二乙酯在有机合成的应用 丙二酸二乙酯的上述性质在有机合成上用途很广,用于合成各种类型的羧酸(一取代乙 酸,二取代乙酸,环烷基甲酸,二元羧酸等)。 例如,用丙二酸酯合成法合成下列化合物,其结构分析如下:
R
COOC2H5
C
R' COOC2H5
4
2 CH2(COOC2H5)2
NaOC2H5 X(CH2)nX n = 3~7
CH(COOC2H5)2 (CH2)n CH(COOC2H5)2
C(COOC2H5)2 CH2I2
(CH2)n CH2 NaOC2H5
C(COOC2H5)2
2.水解脱羧
CH2(COOC2H5)2 (1) NaOC2H5 (2) Br(CH2)4Br
COOC2H5 CH2
COOC2H5
NaOC2H5
COOC2H5 Na CH
COOC2H5
pKa = 13
COOC2H5 Na CH
COOC2H5
RX -NaX
COOC2H5 R CH
COOC2H5
COOC2H5 R CH
COOC2H5
NaOC2H5
COOC2H5
RC
Na
COOC2H5
RX -NaX
(1)制法:可以从氯乙酸的钠盐来制备丙二酸二乙酯。
CH3COOH P Cl2 CH2COOH Cl
NaCN NaOH
CH2COONa C2H5OH
CN
H2SO4
COOC2H5 CH2
COOC2H5
(2)性质
1.酸性和烃基化:活泼亚甲基能与醇钠反应生成钠盐,产生的碳负离子(强亲核试剂)
与卤代烃反应,产生一烃基取代的丙二酸酯。
2.钠盐的烷基化和酰基化
乙酰乙酸乙酯的钠盐与卤代烃、酰卤反应,生成烃基和酰基取代的乙酰乙酸乙酯。
(a)烷基化:
OO CH3 C CH C OC2H5 Na
RX -NaX
OO CH3 C CH C OC2H5
R
CH3
OO C CH C
OC2H5
C2H5ONa CH3
O CC
O C
OC2H5
Na
R
R
R'X -NaX
④ Dieckmann 缩合反应 酯缩合反应也可在分子内进行,形成环酯,这种环化酯缩合反应又称为 Dieckmann 反应。 (己二酸酯和庚二酸酯在醇钠作用下进行自身的酯缩合反应)
注意!酯缩合常用的碱性催化剂是醇钠 RONa,不是醇加钠。醇加钠是一组还原剂,它要 将酯还原成醇。
它是合成五元环、六元碳环的一个方法。(并不是所有的二元酸酯都能发生环缩合,一般 局限于生成稳定的五、六碳环。所以,只是有α氢的己二酸酯和庚二酸酯才能起 Dieckmann 缩合)如:
第十四章 β-二羰基化合物
学习目的及基本要求: 1.掌握酯的水解和克莱森(Claisen)酯缩合历程。 2.掌握乙酰乙酸乙酯和丙二酸二酯在合成上的应用。 3. 理解互变异构。 4.理解合成路线设计的基本知识。 5.了解麦克尔加成的涵义和应用。 重点:酯的水解和克莱森(Claisen)酯缩合历程,乙酰乙酸乙酯和丙二酸二酯在合成上的 应用。 难点:互变异构,碳负离子和α,β-不饱和羰基化合物的共轭加成——麦克尔反应。 教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
C C Z +R H
(Z 代表能和 C=C 共轭的基团)
CCZ RH
CH3 C CH
R
一取代丙酮
+ CO2 + C2H5OH
① 浓 OH② H+
O R CH2 C OH + CH3COOH + C2H5OH
一取代乙酸
同理,二取代乙酰乙酸乙酯进行酮式分解将得到二取代丙酮;进行酸式分解将得到二取 代乙酸。
O
例 1:合成
CH3 C CH2 CH2
经结构分析,需引入
CH2
原
COOC2H5 COOC2H5
丙二酸二乙酯及其取代衍生物水解生成丙二酸,丙二酸不稳定,易脱羧成为羧酸。
例如:
COOC2H5 R CH
COOC2H5
COONa
NaOH
(1) H
R CH
H2O
COONa (2)
R CH2COOH CO2
R COOC2H5 C
R' COOC2H5
NaOH H2O
(1) H (2) CO2
当酯的α-碳上只有一个氢时,由于增加了烃基的诱导效应,酸性减弱了,进行酯缩合反应 时,需要使用比醇钠更强的碱(如ph3CNa,NaH),夺取酯的α氢,形成较稳定的α负碳离子,才 能迫使反应朝右方进行。
② 交叉 Claisen 缩合 如两个酯只有一个酯有α—H,相互缩合就能得到一个单纯产物。
7
③ 酮与酯缩合 酮的α-H 比酯的α-H 活泼:
不饱和羰基化合物是指分子中即含有羰基,又含有不饱和烃基的化合物,根据不饱 和键和羰基的相对位置可分为三类。
(1) 烯酮(RCH=C=O) (2) α,β-不饱和醛酮(RCH=CH-CHO) (3) 孤立不饱和醛酮 (RCH=CH(CH2)nCHO) n≥1 孤立不饱和醛酮兼有烯和羰基的性质,α,β-不饱和醛酮、烯酮有其特性及用途,下面 我们主要讨论这两类化合物。 14.6.1 乙烯酮 最简单且最重要的烯酮是乙烯酮。 14.6.2α,β-不饱和醛酮 α,β-不饱和醛酮的结构特点是碳碳双键与羰基共轭,故α,β-不饱和醛酮兼有烯烃、 醛、酮和共轭二烯烃的性质,若与亲电试剂加成,则应加到碳碳双键上,若与亲核试剂加成 则应加到羰基上,但其特性反应是共轭加成。 1.共轭加成(1,2-加成或 1,4-加成)
14.1.2 烯醇负离子的稳定性
乙酰乙酸乙酯:又叫 β-丁酮酸乙酯,简称三乙,是酮式和烯醇式互变异构的一个最著名的 例子。
(1)性质:在室温下为无色液体,无色有水果香味的液体;沸点 180.4CO;微溶于水, 易溶于乙醚、乙醇等有机溶剂。以酮式和烯醇式两种结构以动态平衡而同时存在的互变异构 体。
1.互变异构现象
2 CH3COOH &#OH
CH3COOH + RCH2COOH + C2H5OH
R
OO
浓 OH
CH3 C CH C OC2H5
CH3COOH + RCOCH2COOH + C2H5OH
COR
14.3 丙二酸二乙酯
丙二酸二乙酯CH2(COOC2H5)2为无色液体,有芳香气味,沸点 199.3℃,不溶于水,易 溶于乙醇、乙醚等有机溶剂。
C OC2H5
CH
(2)烯醇负离子:在碱的作用下生成烯醇负离子,以 2,4-戊二酮为例
O H3C C
H2 O
OH
C C CH3
O H3C C
O C C CH3 H
O H3C C
O H3C C
O C C CH3 H
O C C CH3 H
14.2β-二羰基化合物碳负离子的反应
由共振结构式可知,碳负离子都具有带负电荷的碳原子或氧原子,都具有亲核性能,但
14.4.酯缩合反应: ① 克莱森(Claisen)缩合反应- 乙酰乙酸乙酯的合成
这类反应称为 Claisen 缩合反应 历程:
6
乙酸乙酯的酸性是很弱的(Pka~24),而乙醇钠又是一个比较弱的碱(乙醇Pka~15.9)。 因此,可以想到乙酸乙酯形成的负离子在平衡体系中是很少的。这也就是说,用乙氧负离子 把乙酸乙酯变为 -CH2COOC2H5是很困难的。但是在实际上为什么这个反应会进行的如此完全呢? 其原因就是最后产物乙酰乙酸乙酯是一个比较强的酸(Pka~11),形成很稳定的负离子,可 以使平衡朝产物方向移动。体系中乙酸乙酯负离子浓度虽然很低,但一形成后,就不断的反应, 结果使反应完成。
