北京大学医学继续教育学院 无机化学 答案P02A作业4-1
《无机化学》习题册及答案[精品文档]
![《无机化学》习题册及答案[精品文档]](https://img.taocdn.com/s3/m/9806b3401711cc7931b7164c.png)
《无机化学》课程习题册及答案第一章溶液和胶体一、是非题:(以“+”表示正确,“-”表示错误填入括号)1.渗透压力比较高的溶液,其物质的量浓度也一定比较大。
()2.相同温度下,物质的量浓度均为200mmol·L-1的NaCl溶液和葡萄糖溶液,其渗透压相等()3.相同温度下,渗透浓度均为200mmol·L-1的NaCl溶液和CaCl2溶液,其渗透压相等()4.临床上的两种等渗溶液只有以相同的体积混合时,才能得到等渗溶液。
()5. 两种等渗溶液以任意比例混合所得溶液在临床上必定是等渗溶液()6.临床上,渗透浓度高于320 mmol⋅L-1的溶液称高渗液()7.在相同温度下,0.3 mol⋅L-1的葡萄糖溶液与0.3 mol⋅L-1的蔗糖溶液的渗透压力是相等的()8. 物质的量浓度均为0.2mol·L-1的NaCl液和葡萄糖液渗透浓度相等()9. 对于强电解质溶液,其依数性要用校正因子i来校正。
()二、选择题1.使红细胞发生溶血的溶液是()A.0.2mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖D.0.4mol·L-1 NaCl2.物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最大的是()A.葡萄糖B.NaCl C.CaCl2D.无法比较3.使红细胞发生皱缩的溶液是()A.0.1mol·L-1 NaCl B.0.1mol·L-1葡萄糖C.0.3mol·L-1葡萄糖D.0.2mol·L-1 NaCl4.在相同温度下,物质的量浓度均为0.1 mol·L-1的下列溶液,其渗透压最小的是()A.葡萄糖B.NaCl C.CaCl2D.无法比较5.物质的量浓度均为0.1 mol·L-1的下列溶液,在临床上属于等渗溶液的是()A.葡萄糖B.NaCl C.CaCl2D.蔗糖6. 试排出在相同温度下下列溶液渗透压由大到小的顺序( )a. c(C6H12O6)= 0.2 mol·L-1b. c[(1/2)Na2CO3]= 0.2 mol·L-1c. c[(1/3)Na3PO4]= 0.2 mol·L-1d. c(NaCl)= 0.2 mol·L-1A. d>b>c>aB. a>b>c>dC. d>c>b>aD. b>c>d>a7. 医学上的等渗溶液,其渗透浓度为()A. 大于280 mmol·L-1B. 小于280 mmol·L-1C. 大于320 mmol·L-1D. 280-320 mmol·L-18.欲使同温度的A、B两种稀溶液间不发生渗透,应使两溶液(A、B中的基本单元均以溶质的“分子”式表示)( ) A 质量摩尔浓度相同 B 物质的量浓度相同C 质量浓度相同D 渗透浓度相同9. 质量浓度为11.1g·L-1CaCl2 (M=111.0 g·mol-1)溶液的渗透浓度是( )A.100mmol ·L-1B.200mmol ·L-1C.300mmol ·L-1D.400mmol ·L-1三、填充题:1.10.0 g·L-1NaHCO3(Mr=84)溶液的渗透浓度为__________mol·L-1。
北师大《无机化学》第四版习题答案——下册

第13章氢和稀有气体13-1 氢作为能源,其优点是什么?目前开发中的困难是什么?1、解:氢作为能源,具有以下特点:(1)原料来源于地球上储量丰富的水,因而资源不受限制;(2)氢气燃烧时放出的热量很大;(3)作为燃料的最大优点是燃烧后的产物为水,不会污染环境;(4)有可能实现能量的储存,也有可能实现经济高效的输送。
发展氢能源需要解决三个方面的问题:氢气的发生,氢气的储备和氢气的利用13-2按室温和常压下的状态(气态液态固态)将下列化合物分类,哪一种固体可能是电的良导体?BaH2;SiH4;NH3;AsH3;PdH0.9;HI13-3试述从空气中分离稀有气体和从混合气体中分离各组分的根据和方法。
3、解:从空气中分离稀有气体和从混合稀有气体中分离各组分,主要是利用它们不同的物理性质如:原子间不同的作用力、熔点沸点的高低以及被吸附的难易等差异达到分离的目的。
13-4试说明稀有气体的熔点、沸点、密度等性质的变化趋势和原因?4、解:氦、氖、氩、氪、氙,这几种稀有气体熔点、沸点、密度逐渐增大。
这主要是由于惰性气体都是单原子分子,分子间相互作用力主要决定于分子量。
分子量越大,分子间相互作用力越大,熔点沸点越来越高。
密度逐渐增大是由于其原子量逐渐增大,而单位体积中原子个数相同。
13-5你会选择哪种稀有气体作为:(a)温度最低的液体冷冻剂;(b)电离能最低安全的放电光源;(c)最廉价的惰性气氛。
13-6用价键理论和分子轨道理论解释HeH、HeH+、He2+粒子存在的可能性。
为什么氦没有双原子分子存在?13-7 给出与下列物种具有相同结构的稀有气体化合物的化学式并指出其空间构型:(a) ICl 4- (b)IBr 2- (c)BrO 3- (d)ClF7、 解: 4X e F 平面四边形 2XeF 直线形3XeO 三角锥 XeO 直线形13-8用 VSEPR 理论判断XeF 2 、XeF 4、XeF 6、XeOF 4及ClF 3的空间构型。
北京大学医学继续教育学院 无机化学 答案P02A作业4-1

单选题1、已知MnO2(s)=MnO(s) + ½O2(g)的=akJ∙mol-1;Mn(s) + MnO2(s) = 2MnO(s)的=b kJ∙mol-1,则MnO2(s)的标准摩尔生成焓为()kJ∙mol-1(4A.2a – bB.b – 2aC.a – 2bD.a – b我的答案:B得分:4分2、HA起始浓度为c,达解离平衡HA⇌H+ + A−时的解离度为α,则HA的Ka为()(4 分)A.B.C.D.我的答案:A得分:4分3、某可逆反应,当温度由T1升高至T2时,标准平衡常数>,则该反应的等cc6fab934c894e7压反应热()(4 分)A.大于零B.小于零C.等于零D.无法判断我的答案:A得分:4分4、某反应物在一定条件下的平衡转化率为36%,当加入催化剂,而反应条件不变时,其平衡转化率为()(4A.大于36%B.等于36%C.小于36%D.无法确定我的答案:B得分:4分5、反应A(s) + B2+(aq) ⇌A2+(aq) + B(s)在温度T时的标准平衡常数 = 1.0。
若B2+和A2+的浓度分别为0.50mol∙L-1和0.10mol∙L-1,则反应()(4 分)f4b43bbf076042A.正向自发进行B.处于平衡态C.逆向自发进行D.无法判断方向我的答案:A得分:4分6、反应aA(g) + bB(g) ⇌dD(g) + eE(g)达平衡后,在温度不变的情况下,增大压力,平衡向正反应方向移动,由此可知,下列各式中正确的是()(4A.a + b=d + eB.(a + b)>(d + e)C.(a + b)<(d + e)D.a>b,d>e我的答案:B得分:4分7、在某温度下,已知反应½N2(g) + ³⁄2H2(g) ⇌NH3(g)的标准平衡常数为a,该反应若写成2NH3(g) ⇌N2(g) + 3H2(g),则在相同温度下反应的标准平衡常数为()(4 分)A.a/2B.2aC.a2D.(1/a)2我的答案:D得分:4分8、对反应H2(g) + I2(g) ⇌2HI(g),下列措施中将改变标准平衡常数的是()(4 分)A.加更多的H2B.除去一些HIC.使用较小的反应容器D.升高温度我的答案:D得分:4分9、下列说法中正确的是()(4A.放热反应都是自发反应B.ΔrSm为正值的反应都可自发进行C.若化学反应的>0,则此反应不能发生D.若化学反应的ΔrHm和ΔrSm都是正值,当温度升高时,ΔrGm将减小我的答案:D得分:4分10、NaOH固体溶解于水中,溶液变热,则该过程的、、为()(4 分)A.>0,<0,<0B.<0,>0,<0C.>0,>0,>0D.<0,<0,<0我的答案:B得分:4分11、下列反应的标准自由能变等于产物的标准摩尔生成自由能的是()(4967abddfa7c040分)A.H2(g) + ½O2(g) = H2O(l)B.CO(g) + ½O2(g) = CO2(g)C.H2(g) + Cl2(g) = 2HCl(g)D.Ag(s) + ½Br2(g) = AgBr(s)我的答案:A得分:4分12、下列反应中熵增加的是()(4A.水蒸气凝结为水B.酒精挥发C.Ag+(aq) + I−(aq) =AgI(s)D.H2(g) + Cl2(g) =2HCl(g)我的答案:B得分:4分13、在热力学中,焓的定义式为()(4A.DU = Q + WB.H = U + pVC.G = H −TSD.=Qp我的答案:B得分:4分14、某系统经过一系列变化又回到初始状态,则系统的()(4A.Q>W,DU = Q + W,= 0B.Q = 0,W = 0,DU = 0,= 0C.Q = −W,Q + W = 0,= 0D.Q>0,W<0,DU = 0,= 0我的答案:C得分:4分15、某系统由A态到B态,沿途经Ⅰ放热100J,环境对系统做功50J;如果系统由A态沿途径Ⅱ到B态,吸热40J,则其W为()J(4A.−90B.10C.90D.110我的答案:A得分:4分16、下列各组物理量中,均为状态函数的是()(4A.U,H,GB.T,V,QvC.W,Qp,pD.,S,G我的答案:A得分:4分17、维持毛细血管内外水平衡的是()(4A.晶体渗透压B.胶体渗透压C.氯化钠产生的渗透压D.电解质分子产生的渗透压我的答案:B得分:4分18、下列溶液中,使红细胞发生溶血的溶液是()(4A.9.0g∙L-1NaCl溶液B.0.15mol∙L-1CaCl2溶液C.50.0g∙L-1葡萄糖溶液D.5.0g∙L-1NaCl溶液我的答案:D得分:4分19、相同条件下,下列4种水溶液中,凝固点最低的是()(4A.9.0g∙L-1NaCl溶液B.0.20mol∙L-1蔗糖溶液C.50.0g∙L-1葡萄糖溶液D.0.15mol∙L-1CaCl2溶液我的答案:D得分:4分20、等渗溶液应是()(4A.质量浓度相等的溶液B.质量摩尔浓度相等的溶液C.凝固点降低相同的溶液D.物质的量浓度相等的溶液我的答案:C得分:4分21、欲使被半透膜隔开的A、B两种稀溶液之间不发生渗透,应使两溶液的()(4 分)A.物质的量浓度相等B.渗透浓度相等C.质量摩尔浓度相等D.质量浓度相等我的答案:B得分:4分22、已知HAc的Ka = 1.8´10−5,300mL、0.20mol∙L-1HAc溶液,稀释到体积为()时,其解离度增大一倍。
北京中医药大学远程教育《无机化学Z》作业4答案

A型题:1. Cu(I)在下例哪种情况下稳定A.低温B.酸中C.干态D.水溶液中E.加氧化剂2. 加入NaOH,得不到氧化物的是A.Cu2+B.Ag+C.Hg2+D.Hg22+E.HgCl23. 在MnSO4溶液中滴加NaOH后,在空气中放置可以观察到的现象是A.开始为白色胶状沉淀→棕色沉淀B.开始生成白色沉淀→黄色沉淀→棕色沉淀→黑色沉淀C.开始生成白色沉淀→变灰绿色沉淀→棕色沉淀D.黄色沉淀→黑色沉淀E.黑色沉淀→白色沉淀4. 在下列化合物中,氢键表现最强的是A.NH3B.H2OC.H2SD.HClE.HBr5. sp3杂化可以描述下列那一种分子中共价键的形成A.H2O2B.HClO4C.NH3D.H2OE.四种分子都可以6. 主成分含铁的中药是A.芒硝B.朱砂C.赭石D.轻粉E.雄黄7. 盛放AgNO3的滴瓶口中常有灰黑色物质,主要是A.AgNO3在空气中被氧化B.由于Ag+发生歧化反应C.由于日光作用,AgNO3慢慢分解的结果 D.AgNO3水解的结果 E.以上都不是8. 在K2CrO4溶液中,加入H2SO4,然后再加H2O2。
实验可观察到的现象是A.由黄色→橙色→兰色→绿色并有气泡产生B.由绿色→黄色→兰色C.由无色→黄色→兰色D.由紫色→绿色→黄色E.以上都不对9. 单质碘在水中的溶解度很小,但在KI或其它碘化物的溶液中碘的溶解度增大,这是因为A.发生了离解反应B.发生了配位反应C.发生了氧化还原反应D.发生了盐效应E.发生了水解反应10. 下列各酸中何者为酸性最强的酸A.H2SO4B.HClO4C.HBrO4D.HIO4E.HCl11. 实验室中配制FeSO4溶液须A.加稀H2SO4与铁屑B.加铁屑C.加浓H2SO4D.加浓H2SO4与铁屑E.加稀H2SO412. 下列硫化物能溶于浓盐酸的是A.CuSB.Ag2SC.HgSD.CdSE.都不溶13. 下列物质中水解度最大的是A.FeCl2B.FeCl3C.BaCl2D.PCl3E.NaCl14. Pb2+离子的电子构型是A.8电子构型B.18电子构型C.18+2电子构型D.9~17电子构型E.2电子构型15. 硼酸的分子式为H3BO3,所以它是A.三元酸B.二元酸C.一元弱酸D.一元强酸E.三元弱酸16. 中药胆矾的主要成分是A.CuCl2·H2OB.FeSO4·7H2OC.CuSO4D.Cu(OH)2·CuCO3E.CuSO4·5H2O17. 下列物质中热稳定性最好的是A.Ca(HCO3)2B.CaCO3C.BaCO3D.H2CO3E.MgCO318. 在酸性溶液中欲将Mn2+氧化为MnO4-,在下列氧化剂中应选择A.PbO2B.Cl2C.K2CrO7D.H2O2E.KClO319. 下列化合物属于两性氧化物的是A.Na2OB.Al2O3C.CO2D.SO3E.CaO20. 实验证明,在中性介质中,KMnO4与Na2SO3的反应,它们的产物是A.MnO42-、SO42-B.Mn2+、SO42-C.MnO2、SO2D.Mn2+、HSO3-E.MnO2、SO42-21. 用来检验Fe2+离子的试剂是下列试剂中的哪一种A.H2SB.NH4CNSC.K4Fe(CN)6D.K3Fe(CN)6E.NaOH22. 在水溶液中易自发歧化的是A.Fe2+B.Hg22+C.Cu+D.Hg2+E.Cr3+23. 只能溶于王水的是A.CuSB.Ag2SC.CuID.HgSE.Hg2S24.A.紫色B.肉色C.棕色D.无色E.绿色25. 下列物质中酸性最弱的是A.H3PO4B.HClO4C.H3AsO4D.H3AsO3E.HCl26. 过氧化氢中氧原子是采用何种杂化轨道成键A.spB.sp2C.sp3D.dsp2E.sp3d27. 能溶于Na2S溶液的是A.CuSB.Ag2SC.CuID.HgSE.Hg2S28. 在铬(III)盐溶液中加过量碱溶液其存在形式为A.Cr(OH)3B.Cr3+C.CrO2-D.CrO42-E.Cr2O72-29. 硝酸钾的热分解产物是A.KNO2和O2B.K2O、N2O和O2C.K、N2O和O2D.K、N2O、O2和H2OE.K、N2和H2O30. 在用H2SO4酸化的锰酸钾溶液中,加入过氧化氢时,过氧化氢起什么作用A.起氧化剂作用B.起还原剂作用C.还原硫酸D.分解成氢和氧E.起催化作用31. 下列哪一种酸能于玻璃反应A.H2SO4B.HNO3C.HFD.HClO4E.HCl32. 下列硫化物能溶于稀盐酸的是A.ZnSB.CuSC.Ag2SD.HgSE.CdS33. 下列哪一族离子在中性条件下通入H2S都不生成硫化物沉淀A.Fe2+、Mg2+B.Ca2+、Co2+C.Ag+、Pb2+D.Mg2+、Ca2+E.Ag+、Sn2+34. 在水溶液中都具有颜色的离子是A.Cu2+、Na+、Al3+B.Fe2+、Co2+、Mg2+C.Cr3+、Fe2+、Cu2+D.Mn2+、Zn2+、Cd2+E.AsO43-、MnO4-、Cl-35. 可以使Hg22+歧化的方法是A.加硝酸B.加Hg2+的沉淀剂C.加Hg2+的配位剂D.加还原剂E.以上方法都不行36. 硝酸分子中有一个π键,可表示为A. B. C.D. E.37. p区元素含氧酸既可做氧化剂,又能做为还原剂的是A.HNO3B.H3PO4C.HNO2D.HClO4E.H2HO438. 下列氢化物中沸点最低的是A.HClB.HBrC.HID.HFE.H2OB型题:A.FB.HC.CsD.AtE.O39. 电负性最高的元素是A B C D E40. 电负性最低的元素是A B C D EA.砖红色沉淀生成B.棕色沉淀生成C.白色沉淀生成D.黄色沉淀生成E.没有沉淀生成41. 向K2Cr2O7溶液中加入Pb2+,则有A B C D E42. 向K2Cr2O7溶液中加入Ag+,则有A B C D EA.AgNO3B.K2Cr2O7C.HgCl2D.FeSO4·7H2OE.CaSO4·5H2O43. 应避光保存的是A B C D E44. 在空气中不稳定的是A B C D EA.Mn2+B.Cd2+C.Pb2+D.Hg2+E.Zn2+45. 上述离子中,加入Na2S溶液后,产生黄色沉淀的是A B C D E46. 上述离子中。
北京大学中无机化学答案

北京⼤学中⽆机化学答案⽆机化学习题参考答案(II)第⼀章1.4.解:(1)H 2O 22C(2)S 2O 323v C(3)N 2O (NN O ⽅式) v C ∞(4)Hg 2Cl 2h D ∞(5)H 2C=C=CH 2 2d D (6)UOF 4 C 5v (7)BF 4d T (8)SClF 54v C (9)反-Pt(NH 3)2Cl 2 2h D(10)PtCl 3(C 2H 4)2v C1.B(CH 3)3和BCl 3相⽐,哪⼀个的Lewis 酸性强,为什么?⼀般来说,CH 3为推电⼦基团,Cl 为吸电⼦基团,因此的Lewis 酸性强。
(BCl 3易⽔解;B(CH 3)3不溶于⽔,在空⽓中易燃)2.BH 3和BF 3都可和(CH 3)2NPF 2⽣成加合物,在⼀种加合物中,B 原⼦和N 相连,另⼀种则和P 相连,绘出两种结构式,并说明形成两种结构的原因。
PFFH 3C CH 3NPF F H 3CCH 3NB BH 3F 34. 吸⽔后失效的AlCl 3有什么⽅法可以脱⽔?因为Al 3+是典型的硬酸,与氧的亲合⼒很强,因此实验室不能在HCl ,NH 4Cl ,SOCl 2等⽓氛下加热脱⽔。
(只能加强热⽣成 Al 2O 3后,⽤⾼温下⽤加C 和Cl 2⽤还原氯化法制备,这就不是脱⽔⽅法了)。
第⼆章2.1 解:Ni 2+ d 8组态Pt 2+ d 8组态第四周期(分裂能⼩)第六周期(分裂能⼤)P Ni ClP ClPtCl ClPtCl ClP PPPtrans cis四⾯体构型平⾯四⽅形构型(两种构型)只有⼀种结构(P 代表PPh 3)2.2 解(1)MA 2B 4(2)MA 3B 3M A AB BBB M ABA BBB M ABA ABB M A AA Btrans cis fac(⾯式) mer(经式) D 4h C 2v C 3v C 2v =0 0 0 facmer2.3 Co(en)2Cl 2+D 2hC 2 光活异构体 C 2Co(en)2(NH 3)Cl 2+Cl NH3ClNH 3ClH3Ntrans cis Co(en)(NH3)2Cl2+NH3NH3ClClClNH3ClNH3ClNH3ClNH3ClClNH3NH3trans(1) trans(2) cis2.4 Co(en)33+Ru(bipy)32+⼿性分⼦D3D3PtCl(dien)+ClNCH2CH2CH2NH2NH2CH2基本上为平⾯分⼦,⽆⼿性2.5 (1) 分别⽤BaCl2溶液滴⼊,有⽩⾊沉液出现的为[Co(NH3)5Br]SO4,或分别加⼊AgNO3溶液,产⽣浅黄⾊沉淀的为[Co(NH3)5SO4]Br。
北大医学网络教育有机化学P030作业4-2.pptx
A)Z-1-氟T-氯-2-漠乙烯
r
B)ET-氟T-氯-2-漠乙烯 C)反式T-氟T-氯-2 -漠乙烯 D)顺式-1-氟T-氯-2 -漠乙烯
r
E)ZT-漠T-氯-2-氟乙烯
4.下列正碳离子哪一个相对最稳定.
+
CH3 A) CH
B)
4
「旧」(「玦
D)
o (CH3)2CH
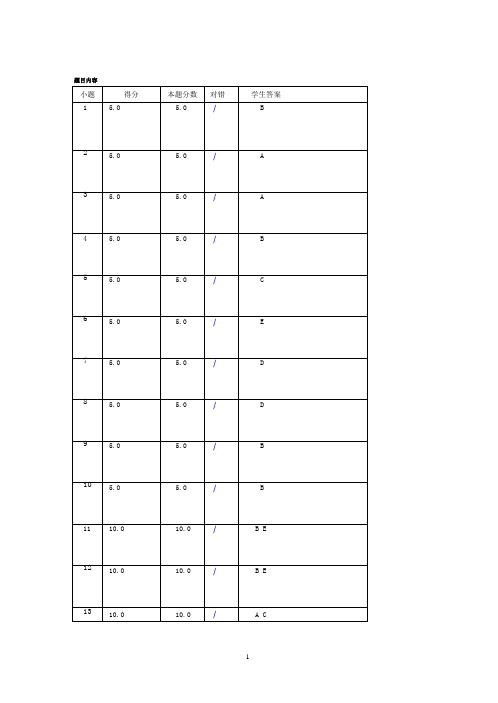
题目内容
小题 1
得分 5.0
本题分数 对错
5.0
/
学生答案 B
2
5.0
3
5.0
4
5.0
5
5.0
6
5.0
7
5.0
8
5.0
9
5.0
10 5.0
11 10.0 12 10.0
13 10.0
5.0
/
A
5.0
/
A
5.0
/
B
5.0
/
C
5.0
/
E
5.0
/
D
5.0
/
D
5.0
/
B
5.0
/
B
10.0
/
BE
10.0
/
BE
6
12,下列哪两个氯代烃能与AgNO3乙醇溶液作用,形成白色沉淀(AgCD.
r
A)氯苯
B)氯苄
r
C)氯乙烯
r
D)1-氯T-丙烯
E)2-甲基-2 -氯丙烷
13.下列化合物中,哪两个有内消旋化合物
A)2,3-二漠丁烷
r
B)2,3-二漠戊烷
C)2,4-二漠戊烷
无机化学教材习题答案
答
23.判断下列各组分子之间存在着什么形式的分子间作用力?
①苯和CCl4;②氦和水;③CO2气体;④HBr气体;⑤甲醇和水。
答
24.试判断Si和I2晶体哪种熔点较高,为什么?
答
第五章
1.说出BaH2,SiH4,NH3,AsH3,PdH0.9和HI的名称和分类?室温下各呈何种状态?哪种氢化物是电的良导体?
NaF,AgBr,RbF,HI,CuI,HBr,CrCl。
答
6.如何理解共价键具有方向性和饱和性?
答
7.BF3是平面三角形的几何构型,但NF3却是三角的几何构型,试用杂化轨道理论加以说明。
答
8.指出下列化合物合理的结构是哪一种?不合理结构的错误在哪里?
(a)
(b)
(c)
答
N2O存在
9.在下列各组中,哪一种化合物的键角大?说明其原因。
答
(5)按斯莱脱规则计算K,Cu,I的最外层电子感受到的有效核电荷及相应能级的能量。
答
(6)根据原子结构的知识,写出第17号、23号、80号元素的基态原子的电子结构式。
答
(7)画出s,p,d各原子轨道的角度分布图和径向分布图,并说明这些图形的含意。
答见课本65页
s电子云它是球形对称的。
p电子云它是呈无柄的桠铃形。
答
2.如何利用路易斯结构和价层电子对互斥理论判断H2Se,P2H4,H3O+的结构?
答
3.写出工业制氢的三个主要化学方程式和实验室中制备氢气最简便的方法?
答
4.He在宇宙中丰度居第二位,为什么在大气中He含量却很低?
答
5.哪种稀有气体可用作低温制冷剂?哪种稀有气体离子势低,可做放电光源需要的安全气?哪种稀有气体最便宜?
无机化学第四版课后习题答案
= = 0.070
则 = 0.26100 kPa = 26 kPa
平衡时该气体混合物的总压为52 kPa
(2)T不变, 不变。
NH4HS(s)NH3(g)+ H2S(g)
平衡分压/kPa 25.3+
= = 0.070
= 17 kPa
13.解:(1)PCl5(g)PCl3(g)+ Cl2(g)
酸碱中和后:H++ OH-→H2O
c(OH-)=0.045mol·L-1
pH=12.65
3.解:正常状态时
pH=7.35c(H+)=4.5×10-8mol·L-1
pH=7.45c(H+)=3.5×10-8mol·L-1
患病时
pH=5.90c(H+)=1.2×10-6mol·L-1
患此种疾病的人血液中c(H+)为正常状态的27~34倍。
HOAc H++ OAc-
c平/(mol·L-1) 0.078-x x 0.74+x
,x=1.9×10-6,pH=-lgc(H+)=5.72
向此溶液通入0.10molHCl气体,则发生如下反应:
NaOAc + HCl→NaCl + HOAc
反应后:c(HOAc)=0.18mol·L-1,c(OAc-)=0.64mol·L-1
p(Ar) =1103Pa
6.解:(1) 0.114mol;
(2)
(3)
7.解:(1)p(H2) =95.43 kPa
(2)m(H2) = =0.194 g
8.解:(1)=5.0 mol
(2)=2.5 mol
结论:反应进度()的值与选用反应式中的哪个物质的量的变化来进行计算无关,但与反应式的写法有关。
无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw
无机化学_第四版_北师大版_课后答案(补充:1-11章)_khdaw第一章原子结构与元素周期系1-14Br2分子分解为Br原子需要的最低解离能为190kJ/mol,求引起溴分子解离需要吸收的最低能量子的波长与频率。
答:∵E=190kJ/mol∴每个分子解离所需要的能量为190×10-3/6.02×1023=3.156×10-19(J)所需吸收光子能量为E=hν=3.156×10-19J∴λ=c/ν=c·h/E=3×108×6.63×10-34/3.156×10-19=6.3×10-7(m)=630(nm)ν=4.76×10141-19氢原子核外电子光谱中的莱曼光谱中有一条谱线的波长为103nm,问:它相应于氢原子核外电子的哪一个跃迁?答:氢原子莱曼系的跃迁吸收光子的波数公式为ǔ=1/λ=R H·(1/12-1/n2)已知波长λ=103nm=1.03×10-7m∴1/1.03×10-7=R H·(1/12-1/n2),R H=1.09677×10-7∴n=2.95≈3∴相应于氢原子电子从n=1的轨道向n=3的轨道跃迁的过程,即从K 层→M层轨道的跃迁1-21当电子的速度达到光速的20.0%时,该电子的德布罗意波长多大?当锂原子(质量7.02amu)以相同速度飞行时,其德布罗意波长多大?答:对电子,λ=h/mv=6.63×10-34×(9.11×10-31×3×108×20%)-1=1.21×10-11m=12.1(pm)对锂原子,其m=7.02×1.660×10-24×10-3=1.165×10-26(kg)∴λ=h/mv=6.63×10-34×(1.165×10-26×3×108×20%)-1 =9.48×10-16m=9.48×10-4(pm)1-23处于K、L、M层的电子最大可能数目各为多少?答:处于K层,即n=1,而每个能层能容纳的最大电子数目为2n2∴第K层:2×12=2(个)第L层:2×22=8(个)第M层:2×32=18(个)1-24以下哪些符号是错误的?(a)6s(b)1p(c)4d(d)2d(e)3p(f)3f答:(a)6s对;(b)1p错(因为n=1,则l只能是0,即s);(c)4d对;(d)2d错(因为n=2,则l可能是0,1,即s,p轨道);(e)3p对;(f)3f错(因为n=3,则l可能是0,1,3即s,p,d轨道)。
2021年无机化学题库及答案
普化无机试卷(气体一)答案一、选取题1..(0101..(C)2..(0102.. (B................................3..(0103.. (D................................4..(0104.. (B................................5..(0105.. (B................................6..(0106.. (C................................7..(0108.. (A................................8..(0123.. (A................................9..(0124.. (B................................10..(0125.. (C................................11..(0126.. (B................................12..(0127.. (C................................13..(0130.. (C................................14..(0131.. (B................................15..(0132.. (B................................16..(0133.. (C................................17..(0134.. (B................................18..(0135.. (B................................19..(0136.. (C................................20..(0144.. (C................................21..(0145.. (D................................22..(0146.. (C................................24..(0148.. (D................................25..(0150.. (B................................26..(0151.. (D................................27..(0153.. (C................................28..(0154.. (A................................29..(0155.. (C................................30..(0156.. (D................................31..(0157.. (B................................32..(0160.. (B................................33..(0164.. (D................................34..(0165.. (C................................35..(0167.. (B................................36..(0168.. (C................................37..(0169.. (A................................38..(0170.. (D................................39..(0171.. (C................................40..(0172.. (A................................41..(0173.. (D................................42..(0174.. (B................................43..(0175.. (C................................44..(0176.. (B................................45..(0177.. (C................................46..(0178.. (D................................48..(0180.. (C................................49..(0181.. (A................................50..(0182.. (B................................51..(0183.. (B................................52..(0184.. (A................................53..(0185.. (B................................54..(0186.. (B................................55..(0187.. (C................................56..(0188.. (C................................57..(0189.. (D................................58..(0190.. (A................................59..(0191.. (A................................60..(0192.. (B................................61..(0193.. (D................................62..(0194.. (A................................63..(0195.. (A................................64..(0196.. (C................................65..(0197.. (A................................66..(0198.. (B................................67..(0199.. (B................................二、填空题( 共7题13分)68..(0107.. 低压高.............................69..(0128.. 分子间作用... 分子体..................70..(0137.. . 3..MP... . 1..MP... . 4..MP.........................71..(0149.. 0.5...............................72..(0161.. 46................................73..(0162.. (1.H2.H..N..CO2..(2.分子平均能量都相......................74..(0163.. 1.00.三、计算题 ( 共3题 155分 )75..(0109)pV 96.9×150×10-32X n = ── = ──────── = 0.00250 (mol)RT 8.31×(427+273)2MX 2(g) = 2MX(g) + X 2(g)1.120 g 0.720 g 0.400 gX2摩尔质量为: 0.400/0.00250 = 160 (g ·mol-1) X 相对原子质量为 80n MX = 2×0.00250 = 5.00×10-3 (mol)MX 摩尔质量为: 0.720/(5.00×10-3)=144 (g ·mol-1)M 相对原子质量为 6476..(0110)n 1.0×109p =── RT =────── ×8.31×1200=1.7×10-11 (kPa)V 6.0×102377..(0111)pV=nRT 当 p,V 一定期, n 随 T 变,pV 1 1Δn =───×(──── ─ ──── )R T (冬) T (夏)1.00×106 1 1=103×─────( ─── ─ ─── )= 10.5×103(mol)8.31 248 3144CH m =10.5×16.0=168 (kg)78..(0112)2H 2O +CaC 2= Ca(OH)2+C 2H 2↑设反映后得到了 n mol C2H2,即含 2n mol H2O ,21.0×10-3因此 n = 1.00×102×────── = 8.62×10-4 (mol)8.31×2932×8.62×10-4×18.0H 2O 质量分数=────────────×100% = 2.06 %1.50879..(0113)T 1 p 2 273 207d 2= d 1·──·── = 1.43 ──·── = 2.76 (g ·dm -3 )T 2 p 1 290 10180..(0114)p 1V 1 p 2V 2(1) 膨胀前为状态1, 膨胀后为状态2, ───── = ─────T 1 T 2202×V 101×4V───── = ────── T 2= 600 (K)300 T 2(2) 22H H x p p 总= Ne H H H 222n n n x +=25.0 75.02H n = ─── = 12.5(mol) n Ne = ─── = 3.71(mol)2.020.2 12.52H x =────── = 0.77212.5+3.712H p = 202×0.772 = 156 (kPa)81..(0115)(1) p 1V 1= p 2V 2101×1.0101×1.0 = 50.5×V 2 V 2= ───── = 2.0 (dm 3)50.5V 1 V 2 1.0 V 373(2) ── = ── ── = ─── V 2 = ───×1.0 = 1.1 (dm 3)T 1 T 2 330 373 33082. (0116)(1) p 空V =p’空V’ (不考虑水)(101.3-17.3)×1.0=(202.6-17.3)×V’ V’= 0.45 (dm 3)pV p 'V’(2) ─── = ─── (不考虑水)T T'(101.3-17.3)×1.0 (101.3-1.2)×V’─────────= ─────────∴V’= 0.72(dm3)330 28383. (0117)设球体积为V, 当两球都在沸水中时101(2V) =nR×373 ---------------------- (1)若一球在沸水中, 另一球在冰水中, 两球平衡时压力为p, 在沸水中有n1mol N2, 而在冰水中有n2mol N2则: n1+n2= n n1373 = n2273p(2V) = n1R×373 +n2R×273= n1R×373 +n1R×373 = 2n1R×373 ------------------------------------- (2)(1) 101 n 1 n2 1 373──= ──= ──= ──(1+──)= ──(1+──) = 1.18(2) p2n1 2 n1 2 273p= 85.6 kPa84. (0118)(1) 冷却前为状态1, 冷却后为状态2, 冷却先后空气质量不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单选题
1、已知MnO2(s)=MnO(s) + ½O2(g)的=akJ∙mol-1;Mn(s) + MnO2(s) = 2MnO(s)的
=b kJ∙mol-1,则MnO2(s)的标准摩尔生成焓为()kJ∙mol-1
(4
A.2a – b
B.b – 2a
C.a – 2b
D.a – b
我的答案:B
得分:4分
2、HA起始浓度为c,达解离平衡HA⇌H+ + A−时的解离度为α,则HA的Ka为()(4 分)
A.
B.
C.
D.
我的答案:A
得分:4分
3、某可逆反应,当温度由T1升高至T2时,标准平衡常数>,则该反应的等
cc6fab934c894e7
压反应热()(4 分)
A.大于零
B.小于零
C.等于零
D.无法判断
我的答案:A
得分:4分
4、某反应物在一定条件下的平衡转化率为36%,当加入催化剂,而反应条件不变时,其平
衡转化率为()(4
A.大于36%
B.等于36%
C.小于36%
D.无法确定
我的答案:B
得分:4分
5、反应A(s) + B2+(aq) ⇌A2+(aq) + B(s)在温度T时的标准平衡常数 = 1.0。
若B2+和A2+的浓度分别为0.50mol∙L-1和0.10mol∙L-1,则反应()(4 分)
f4b43bbf076042
A.正向自发进行
B.处于平衡态
C.逆向自发进行
D.无法判断方向
我的答案:A
得分:4分
6、反应aA(g) + bB(g) ⇌dD(g) + eE(g)达平衡后,在温度不变的情况下,增大压力,平衡向
正反应方向移动,由此可知,下列各式中正确的是()(4
A.a + b=d + e
B.(a + b)>(d + e)
C.(a + b)<(d + e)
D.a>b,d>e
我的答案:B
得分:4分
7、在某温度下,已知反应½N2(g) + ³⁄2H2(g) ⇌NH3(g)的标准平衡常数为a,该反应若写成2NH3(g) ⇌N2(g) + 3H2(g),则在相同温度下反应的标准平衡常数为()(4 分)
A.a/2
B.2a
C.a2
D.(1/a)2
我的答案:D
得分:4分
8、对反应H2(g) + I2(g) ⇌2HI(g),下列措施中将改变标准平衡常数的是()(4 分)
A.加更多的H2
B.除去一些HI
C.使用较小的反应容器
D.升高温度
我的答案:D
得分:4分
9、下列说法中正确的是()(4
A.放热反应都是自发反应
B.ΔrSm为正值的反应都可自发进行
C.若化学反应的>0,则此反应不能发生
D.若化学反应的ΔrHm和ΔrSm都是正值,当温度升高时,ΔrGm将减小
我的答案:D
得分:4分
10、NaOH固体溶解于水中,溶液变热,则该过程的、、为()(4 分)
A.>0,<0,<0
B.<0,>0,<0
C.>0,>0,>0
D.<0,<0,<0
我的答案:B
得分:4分
11、下列反应的标准自由能变等于产物的标准摩尔生成自由能的是()(4
967abddfa7c040
分)
A.H2(g) + ½O2(g) = H2O(l)
B.CO(g) + ½O2(g) = CO2(g)
C.H2(g) + Cl2(g) = 2HCl(g)
D.Ag(s) + ½Br2(g) = AgBr(s)
我的答案:A
得分:4分
12、下列反应中熵增加的是()(4
A.水蒸气凝结为水
B.酒精挥发
C.Ag+(aq) + I−(aq) =AgI(s)
D.H2(g) + Cl2(g) =2HCl(g)
我的答案:B
得分:4分
13、在热力学中,焓的定义式为()(4
A.DU = Q + W
B.H = U + pV
C.G = H −TS
D.=Qp
我的答案:B
得分:4分
14、某系统经过一系列变化又回到初始状态,则系统的()(4
A.Q>W,DU = Q + W,= 0
B.Q = 0,W = 0,DU = 0,= 0
C.Q = −W,Q + W = 0,= 0
D.Q>0,W<0,DU = 0,= 0
我的答案:C
得分:4分
15、某系统由A态到B态,沿途经Ⅰ放热100J,环境对系统做功50J;如果系统由A态沿
途径Ⅱ到B态,吸热40J,则其W为()J(4
A.−90
B.10
C.90
D.110
我的答案:A
得分:4分
16、下列各组物理量中,均为状态函数的是()(4
A.U,H,G
B.T,V,Qv
C.W,Qp,p
D.,S,G
我的答案:A
得分:4分
17、维持毛细血管内外水平衡的是()(4
A.晶体渗透压
B.胶体渗透压
C.氯化钠产生的渗透压
D.电解质分子产生的渗透压
我的答案:B
得分:4分
18、下列溶液中,使红细胞发生溶血的溶液是()(4
A.9.0g∙L-1NaCl溶液
B.0.15mol∙L-1CaCl2溶液
C.50.0g∙L-1葡萄糖溶液
D.5.0g∙L-1NaCl溶液
我的答案:D
得分:4分
19、相同条件下,下列4种水溶液中,凝固点最低的是()(4
A.9.0g∙L-1NaCl溶液
B.0.20mol∙L-1蔗糖溶液
C.50.0g∙L-1葡萄糖溶液
D.0.15mol∙L-1CaCl2溶液
我的答案:D
得分:4分
20、等渗溶液应是()(4
A.质量浓度相等的溶液
B.质量摩尔浓度相等的溶液
C.凝固点降低相同的溶液
D.物质的量浓度相等的溶液
我的答案:C
得分:4分
21、欲使被半透膜隔开的A、B两种稀溶液之间不发生渗透,应使两溶液的()(4 分)
A.物质的量浓度相等
B.渗透浓度相等
C.质量摩尔浓度相等
D.质量浓度相等
我的答案:B
得分:4分
22、已知HAc的Ka = 1.8´10−5,300mL、0.20mol∙L-1HAc溶液,稀释到体积为()时,其
解离度增大一倍。
(4
A.600mL
B.1200mL
C.1800mL
D.2400mL
我的答案:B
得分:4分
23、配制0.10mol∙L-1HCl(MHCl= 36.5g∙mol-1)溶液500mL,需质量分数为36%的HCl溶
液(密度为 1.19kg∙L-1)的体积为()mL(4 分
A.4.3
B.43.0
C.12.0
D.8.3
我的答案:A
得分:4分
24、在较早的教材中,生理盐水的浓度是以质量−体积百分浓度(m/V)表示,它为0.90%的NaCl溶液,即100mL溶液中含0.90g NaCl(MNaCl= 58.5g×mol-1),则其物质的量浓度
cNaCl为()(4
A.9.0mol∙L-1
B.0.308mol∙L-1
C.0.154mol∙L-1
D.0.154mmol∙L-1
我的答案:C
得分:4分
多选题
25、为提高反应CO(g) + H2O(g) ⇌CO2(g) + H2(g)(<0)中CO的转化率,可
a371b1a6c34e40
采取的措施是()(4 分)
A.增加水蒸气的分压
B.增加总压
C.增加CO的分压
D.按比例增加水蒸气和CO的分压
E.降低反应温度
我的答案:AE
得分:4分。
