高中有机化学乙烯烯烃
高中有机化学-烯烃

(3)、 加聚反应
问:乙烯分子之间可否发生加成反应呢?
nCH2=CH催2化剂 ─[CH2 ─]CH2─n
聚乙烯
说明:1、聚乙烯是高分子有机物、混合物,无固定的分子式, 无固定熔沸点。
2、聚乙烯等白色塑料废弃物,微生物不能降解,是白色污染 物。
由不饱和的相对分子质量小的化 合物分子结合成相对分子质量大的化 合物的分子,这样的反应是加成反应 同时又是聚合反应,简称加聚反应。
HH HC CH
Br Br
碳碳双健中两个化学键的强度不同
1,2-二溴乙烷 无色液体
反应实质:乙烯分子中的碳碳双键断开一个, 2个Br 分别直接与2个价键不饱和的C结合。
乙烯 溴分子
1,2-二溴乙烷
扩展:烯烃α-氢上的取代反应
扩展:烯烃α-氢上的取代反应
加热或光照 CH2=CHCH3+Cl2 CH2=CHCH2Cl+HCl 所以:烯烃与卤素反应应注意反应条件
2)油脂工业中,将含不饱和键的液态油脂部分氢 化,以改变油脂的性质(如人造黄油)。
(二)亲电加成
1、亲电加成反应和亲电试剂 2、 Markovnikov规律 3、常见的亲电加成反应
(1) 与HX加成(X=Cl、Br、I) (2) 与水加成 (3) 与H2SO4加成 (4) 与X2加成(X=Cl、Br) (5) 与HXO加成(X=Cl、Br) (6) 说明
hνor△ CH3CH2CH — CH2 95%
讨论:
H Br
有过氧化物存在或光照条件下,
HBr会发生反马氏加成 ,其他卤
化氢仍会发生马氏加成。
2、实验室制取氯乙烷, 是采取CH3-CH3与Cl2 取代反应好, 还是采用CH2=CH2与HCl加成反 应好?
有机化学课件-6烯烃
三、烯烃的命名(CCS系统命名法): (一)命名原则:
1. 主链选择:含碳碳双键(官能团)在内的最长碳链作为主链;
如:CH3CH2CH2CH2C=CH2 (√) CH2CH2CH(3 没有把碳碳双键都包含在内)
2-丙基-1-己烯 或2-丙基己烯(官能团处于1位时可省略去位次)
2. 主链编号:使碳碳双键处于尽量小的编号;
2×7 +2 - 8
,C7H8 ,Ω=
=4; 三个C=C和一个环
2
CH3CH2OH ,C2H6O ,Ω=
O
CH3C NH2,C2H5ON ,Ω=
2×2 +2 - 6
=0
2 2×2 +2 - 5 +1
=1
2
二、烯烃的同分异构: (一)构造异构:
如分子式为 C4H8 的烯烃的构造异构体有: CH3 CH3CH2CH=CH2 ,CH3CH=CHCH3 ,CH3C=CH2
CH3 CH
CH3
CH2CH3
C H
(E)-2,3-二甲基-3-己烯
和顺反命名法相比较,顺式的可能是Z构型的,也可能是E构型;
§2 烯烃的相对稳定性
一、燃烧热:
燃烧热kJ/mol
稳定性
例: CH3CH2CH=CH2
2718
H3C
CH3
CC
2711
HH
H3C
H
CC
2708
H
CH3
高
烯烃中碳碳双键上的烷基越多,稳定性越高;
6 CH3 如:CH3CH2CH=CHCH2CHCHCH3
1 2 3 4 5 CH37 8
6,7-二甲基-3-辛烯
3. 标明双键的位次;只写双键两个碳原子中位次较小的一个,放
高中化学课件烯烃

b.乙烯制乙醇:
催化剂 CH2==CH2+H2O― ― ― ― ― ― → CH3CH2OH △ 。
c.乙烯制氯乙烷: 催化剂 CH2==CH2+HCl― ― ― ― ― → CH3CH2Cl △
。
d.丙烯转化为丙烷: 催化剂 CH2==CHCH3+H2― ― ― ― ― ― → CH3CH2CH3 △
(1)三种位置异构: 答案
解析
,_______________,___________________。
(2)两种顺反异构:__________________,___________________。 答案
不同,可推知其结构不同,从其结构简式可以看出碳碳双键连接的原子
或原子团的空间排列方式不同。
2.根据以上分析,总结顺反异构的概念 (1)顺反异构:由于 碳碳双键不能旋转而导致分子中原子或原子团在空间的 ____________________ 排列方式 ________不同所产生的异构现象,称为顺反异构。 (2)顺反异构产生的条件 ①分子中具有 碳碳双键 结构; ②组成双键的每个碳原子必须连接两个 不同 的原子或原子团。 (3)顺反异构的类别 ①顺式结构:两个相同的原子或原子团排列在双键的 同一侧 。 ②反式结构:两个相同的原子或原子团分别排列在双键的 两侧 。
化学 性质基本相同, 物理 性质有一定的差异。
活学活用
3.下列各组有机物中,能形成顺反异构的是 答案
解析
A.1,2-二氯丙烯 √
C.1,1-二氯丙烯
B.2-氯丙烯
D.1-丁烯
存在顺反异构:一是要含有碳碳双键;二是两个不饱和碳原子上一定分
别连有不同的原子或原子团,若同一个不饱和双键碳原子上连有相同原
。
有机化学方程式总结

高中有机化学方程式总结一、烃 1.甲烷烷烃通式:C n H 2n -2 (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O甲烷不可使酸性高锰酸钾溶液及溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl二氯甲烷:CH 3Cl+Cl 2CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯化碳:CHCl 3+Cl 2 CCl 4+HCl2.乙烯乙烯的制取:CH 3CH 2OH H 2C=CH 2↑+H 2O 烯烃通式:C n H 2n (1)氧化反应乙烯的燃烧:H 2C=CH 2+3O 2 2CO 2+2H 2O 乙烯能够使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:H 2C=CH 2+Br 2 CH 2Br —CH 2Br与氢气加成:H 2C=CH 2+H 2 CH 3CH 3与氯化氢加成:H 2C=CH 2+HCl CH 3CH 2Cl与水加成:H 2C=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n H 2C=CH n3.乙炔乙炔的制取:CaC 2+2H 2O ≡CH ↑+Ca(OH)2(1)氧化反应乙炔的燃烧:HC ≡CH+5O 2 4CO 2+2H 2O乙炔能够使酸性高锰酸钾溶液褪色,发生氧化反应。
(2)加成反应与溴水加成:HC ≡CH+Br2 HC=CHBrCHBr=CHBr+Br 2 CHBr 2—CHBr 2与氢气加成:HC ≡CH+H 2 H 2C=CH 2与氯化氢加成:HC ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH n乙炔加聚,得到聚乙炔:n HC ≡ n4.苯苯的同系物通式:C n H 2n-6 (1)氧化反应苯的燃烧:2C 6H 6+15O 2 12CO 2+6H 2O点燃光光光光浓硫酸170℃ 高温催化剂△2-CH 2图1 乙烯的制取点燃图2 乙炔的制取催化剂△Br 2—CHClCH=CH点燃苯不能使溴水和酸性高锰酸钾溶液褪色。
化学高一下册乙烯知识点

化学高一下册乙烯知识点化学是一门研究物质的性质、组成、转化以及与能量的关系的学科。
在高中化学课程中,我们将学习到许多重要的化学知识点。
本文将重点介绍化学高一下册中与乙烯相关的知识点。
一、乙烯的基本概念1. 乙烯的化学式为C2H4,属于烯烃类化合物。
2. 乙烯是一种无色、无气味的气体,其密度小于空气。
3. 乙烯具有较高的燃烧性和易燃易爆性。
二、乙烯的制备方法1. 从石油裂解气中分离:乙烯是石油裂解气中的主要组分之一,可以通过分离提纯得到。
2. 乙醇脱水:将乙醇与浓磷酸或浓硫酸加热反应,可以得到乙烯和水。
三、乙烯的重要性及应用1. 乙烯是重要的工业原料,广泛用于聚乙烯、乙烯醋酸乙酯、氯乙烯等的生产。
2. 聚乙烯是一种常见的塑料,用于制作塑料袋、瓶子等日常用品。
3. 乙烯可以用于合成其他有机化合物,如乙醛、乙二酸等。
四、乙烯的性质及反应1. 乙烯可与氧气发生燃烧反应,生成二氧化碳和水。
2. 乙烯可与溴水反应,生成1,2-二溴乙烷。
3. 乙烯可与氢气在催化剂存在下发生加成反应,生成乙烷。
五、乙烯的环境问题及安全措施1. 乙烯是一种温室气体,过量排放乙烯会导致大气污染和环境问题。
2. 在乙烯的使用和储存过程中,应采取严格的安全措施,防止火灾和爆炸事故的发生。
六、乙烯的扩展知识1. 乙烯是植物生长激素的一种,能够促进植物的伸长和开花。
2. 乙烯受到环境温度、光照和氧气浓度的影响,温度较高、光照充足、氧气供应充足时,乙烯合成增加。
通过学习化学高一下册中的乙烯知识点,我们可以更好地了解乙烯的性质、应用及相关反应,增强对这种重要化合物的认识和理解。
在学习过程中,我们还要关注乙烯的环境问题,并严格遵守安全操作规范,确保实验和生产过程的安全性。
总结:本文主要介绍了化学高一下册中有关乙烯的知识点,包括乙烯的基本概念、制备方法、重要性及应用、性质及反应,以及环境问题和安全措施。
通过学习乙烯知识,我们可以更好地理解这一重要化合物,并应用于实际生活和工业生产中。
乙烯、烯烃练习及答案

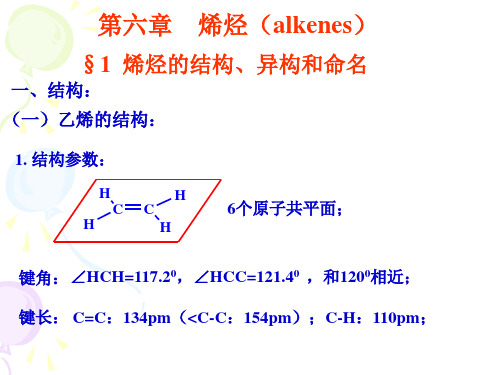
乙烯烯烃乙烯一、乙烯的分子结构化学式:电子式:结构式:结构简式:分子构型:键角:分子极性:不饱和烃:___________________________________________________________。
实验表明,C=C的键能为615kJ/mol,C-C的键能为348kJ/mol,即双键的键能并非单键键能的两倍,而是比两倍略小。
因此只要较少的能量就能使双键里的一个键断裂。
二、乙烯的物理性质通常状况下,乙烯是一种_____色__________味的气体,_____溶于水,密度比空气_______。
三、乙烯的实验室制法:1.药品:和{比例()约为}2.装置:3.反应原理:反应方程式:用结构式表示断键方式:反应类型:4.注意事项:⑴实验中温度计的水银球应位于_________________。
⑵实验中碎瓷片的作用是_____________________。
⑶实验中浓硫酸的作用是_____________________。
⑷实验中加热的方式应使溶液温度_____________(填迅速或缓慢)升高至________℃。
⑸实验完成后,应该先撤____________,后撤____________。
四、乙烯的化学性质1.氧化反应(1)可燃性现象:_______________________________________,解释__________________________。
化学方程式:(2)与酸性高锰酸钾反应现象:_____________________________。
用途:鉴别乙烯(烯烃)和烷烃。
2.加成反应乙烯通过溴的四氯化碳溶液或者溴水,能使溶液褪色。
化学方程式:加成反应:一定条件下,乙烯还能与氢气、氯气、卤化氢、水等发生加成反应。
OH CH CH O H CH CH ClCH CH HCl CH CH Cl CH Cl CH Cl CH CH CH CH H CH CH 2322223222222233222--−−→−+=-−→−+=-−→−+=-−−→−+=∆加热加压催化剂催化剂 3.聚合反应化学方程式:聚合反应:加聚反应:高分子化合物:单体:五、乙烯的用途乙烯是石油化工最重要的基础原料,乙烯工业的发展水平是衡量一个国家石油化工水平的重要标志之一。
乙烯烯烃

3、烯烃的命名: 、烯烃的命名: 与烷烃命名类似,但不完全相同。 与烷烃命名类似,但不完全相同。 ①确定包括双键在内的碳原子数目最多的碳链为 主链。 主链。 ②主链里碳原子的编号依次从离双键最近的一端 开始。 开始。 ③双键的位置可以用阿拉伯数字标在某烯字样的 前面。 前面。 CH3CH=CHCH-CH3 如: CH3 4-甲基 戊烯 甲基-2-戊烯 甲基
思考: 思考: 1)碎瓷片的作用? )碎瓷片的作用? 防止爆沸 2)迅速升温至1700C目的? )迅速升温至 目的? 目的 1400C乙醇会发生分子间脱水生成副产品乙醚。 乙醇会发生分子间脱水生成副产品乙醚。 乙醇会发生分子间脱水生成副产品乙醚 3)温度计水银球所在的位置? )温度计水银球所在的位置? 温度计的水银球必须伸入液面以下, 温度计的水银球必须伸入液面以下,因为温度计 指示的是反应液的反应温度。 指示的是反应液的反应温度。 4)能否用排空法收集乙烯? )能否用排空法收集乙烯? 不能,因为乙烯的密度与空气的密度接近。 不能,因为乙烯的密度与空气的密度接近。 5)实验结束是先撤酒精灯还是先撤导管? )实验结束是先撤酒精灯还是先撤导管? 先撤导管,防止倒吸。 先撤导管,防止倒吸。
CH2=CH-CH=CH2 乙炔
CH
CH
所有碳碳键碳氢键之间的键角均为1200 所有碳碳键碳氢键之间的键角均为
空间结构:
平面(矩形 平面 矩形) 矩形
小结: 小结: 乙烯和乙烷的比较: 乙烯和乙烷的比较:
名称 分子式 电子式 结构式 结构简式 空间构型 分子 键 结构 型 特点 极 性 乙烷 乙烯
乙烯的化学性质
乙烯分子的结构特点: 乙烯分子的结构特点 C=C双键所具有的能量并不是 双键所具有的能量并不是C-C单键的 倍, 单键的2倍 双键所具有的能量并不是 单键的 而是小于2倍 双键的键长也不是C-C单键的 而是小于 倍;C=C双键的键长也不是 双键的键长也不是 单键的 一半,而是大于C-C单键的一半,所以乙烯分子中 单键的一半, 一半,而是大于 单键的一半 C=C双键中的两个键是不一样的,其中一个键容 双键中的两个键是不一样的, 双键中的两个键是不一样的 易断裂不稳定,乙烯的化学性质比乙烷活泼。 易断裂不稳定,乙烯的化学性质比乙烷活泼。
高一化学烯烃试题答案及解析

高一化学烯烃试题答案及解析1.苯与乙烯相比较,下列叙述不正确的是A.都容易发生取代反应B.苯不能被KMnO4氧化C.苯只能在特殊条件下发生加成反应D.都能在空气中燃烧【答案】A【解析】苯能发生取代反应和加成反应,乙烯可以发生加成反应,因此A选项是错误的【考点】考查有机物苯与乙烯性质的相关知识点。
2.巴豆酸的结构简式为CH3CH="CHCOOH" 现有:①氯化氢,②溴水,③纯碱溶液,④酸性KMnO4溶液, ⑤乙醇,试根据其结构特点,判断在一定条件下能与巴豆酸反应的物质组合是A.只有②④⑤B.只有①③④C.只有①②③D.都可以【答案】D【解析】巴豆酸的结构简式为CH3CH=CHCOOH,官能团是碳碳双键和羧基,所以可与氯化氢、溴水发生加成反应,羧基与纯碱发生复分解反应,与酸性KMnO4溶液发生氧化反应,与乙醇发生酯化反应,所以答案选D。
【考点】考查官能团的化学性质3. CH4中混有CH2=CH2, 欲除去CH2=CH2得到CH4, 最好依次通过哪一组试剂( )A.澄清石灰水、浓硫酸B.KMnO4酸性溶液、浓硫酸C.溴水、浓硫酸D.浓硫酸、KMnO4酸性溶液【答案】C【解析】CH2=CH2能够与溴水发生反应产生1,2-二溴乙烷留在溶液中,若使用KMnO4酸性溶液乙烯会变为CO2气体,而混入了杂质。
而甲烷是不能发生反应,所以通过盛有溴水的洗气瓶就可以除去乙烯,然后再把气体通过盛有浓硫酸的洗气瓶就可以干燥甲烷,从而得到纯净、干燥的甲烷。
因此选项是C。
【考点】考查混合气体中杂质的除去方法的知识。
4.欧盟正考虑在欧盟范围内全面禁止使用塑料袋。
下列有关说法正确的是A.塑料垃圾可直接露天焚烧B.实施“禁塑令”有助于遏制白色污染C.纤维素、油脂、蛋白质均属于有机高分子D.聚丙烯结构式为:【答案】B【解析】A项塑料垃圾直接露天焚烧,会给环境带来污染,错误;B项实施“禁塑令”能有助于遏制白色污染,正确;C项油脂不属于高分子化合物,错误;D项聚丙烯正确的结构简式为,错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、学习目标:
1、掌握乙烯的分子结构
2、掌握乙烯的实验室制法
3、掌握乙烯的物理性质与化学性质
二、(一)、不饱和烃
,这样的烃叫不饱和烃。
(二)、乙烯的分子结构
乙烯分子式:,电子式:,结构式:,结构简式:。
根据书上图5-9可以看出:CH2=CH2分子中的6个氢原子处于同一个内,键角为,乙烯分子为分子。
(三)、乙烯的实验室制法:
1、试剂
和,体积比为。
2、反应原理:
3、发生装置
选用的反应装置,与制的装置相同,将制的装置中的改为即可。
4、收集方法
用法收集(因乙烯的密度跟空气的密度接近且难溶于水)
5、注意事项
(1)、反应液中酒精和浓硫酸的体积比为;
(2)、在圆底烧瓶的底部中加入少量的碎瓷片,其目的是;(3)、往圆底烧瓶里加入反应物的正确顺序是:;(4)、温度计的水银球应,以准确测定反应的温度;
(5)、在制取乙烯时,浓硫酸的作用:;
(6)、加热时,要使反应液的温度迅速升高到,以减少杂志气体的生成。
(四)、乙烯的物理性质
1、在通常情况下,乙烯是,气味的气体,溶于水,在标准状
况下,密度为,比空气。
(五)、乙烯的化学性质
1、氧化反应
①、乙烯在空气中燃烧,火焰,并伴有,乙烯完全燃烧的方程为
式。
②、往酸性高锰酸钾中通入乙烯后,会发现,这说明,
用这个实验现象可以鉴别和。
③、烯烃的通式:,在氧气中燃烧。
三、合作探究:
1、实验室制乙烯时,在加热过程中通常闻到刺激性气味且反应液逐渐由无色变成棕
色,甚至变为黑褐色,原因是什么?如何净化制出乙烯气体?
一、学习目标:
1、掌握乙烯的化学性质
二、乙烯的化学性质
1、加成反应
加成反应是指:,将乙烯通入溴的四氯化碳溶液,现象:,反应方程式为;试写出溴水的四氯化碳溶液与丙烯反应方程式:。
2、加聚反应
①、乙烯生成聚乙烯的过程原理:CH2=CH2+ CH2=CH2+ CH2=CH2+ ,
②、乙烯生成聚乙烯的方程式为:;
③、丙烯的聚合反应方程式:;
③、聚合反应是指由;若聚合反应是加成反应,这种
聚合反应叫作,简称
(六)、烯烃的命名
与烷烃命名方法相似,但有两点不同:一是主链中应含,且从的一端开始编号;二是要用阿拉伯数字标出位置,写出某烯烃字样
如:CH2-C-CH2=CH2
CH3
四、合作探究:
1、写出下列有关方程式:
①、CH2=CH2+H2
②、CH3CH2=CH2+HCl
③、CH2=CH2+H2O
④、CH3CH2=CH2+H2O
2、聚乙烯是乙烯的同系物吗?它是否属于饱和烃?
3、丙烯氰(CH2=CH-CN)是一种能发生加聚反应的高分子化合物,试写出产生聚丙烯
氰的方程式:
4、CH2—CH2= CH2—CH2—CH3的命名
CH3
写出2-甲基-2-丁烯的结构简式:
五、当堂测验
写出下列方程式的化学方程式,并判断反应类型
①、丙烯跟溴水反应:;
②、丙烯充分燃烧:;
③、丙烯聚合:;
④、乙烯跟H Br反应:;
⑤、乙烯跟水反应:;
乙烯烯烃
1、下列有关乙烯和乙烷比较的说法中,错误的是()
A、乙烯属于不饱和烃,乙烷属于饱和烃
B、乙烯的分子为平面结构,分子内原子间夹角为120。
C、乙烯分子比乙烷稳定
D、乙烯的化学性质比乙烷活泼
2、能使酸性高锰酸钾溶液褪色的有机物是()
A、氯乙烷B、二氧化硫C、乙烯D、乙烷
3、下列反应属于加成反应的是()
A、乙烷与溴蒸气在光照下产生油状物质
B、乙烯使酸性高锰酸钾溶液褪色
C、四氯化碳与溴水混合振荡,静置后溴水褪色
D、在磷酸作催化剂的条件下乙烯和水反应
4、甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有下列哪些试剂的洗气
瓶()
A、澄清石灰水、浓硫酸B、酸性高锰酸钾溶液、浓硫酸
C、溴水、烧碱溶液、浓硫酸D、浓硫酸、酸性高锰酸钾溶液
5、下列各反应中,可以证明烯烃具有不饱和结构的是()
A、燃烧反应B、加成反应C、取代反应D、加聚反应
6、下列有关烷烃、烯烃的说法中,不正确的是()
A、它们所含元素的种类相同,但通式不同
B、均能与氯气发生反应
C、烯烃分子中碳原子数≥2,烷烃分子中碳原子数≥ 1
D、碳原子数相同的烯烃和烷烃互为同分异构体
7、下列能使溴水褪色的是()
A、C2H4B、SO2CCH2=CH CH=CH2D、CH3—CH2—CH3
8、下列分子中,所有原子均在同一平面上的是()
A、CH4B、C2H6C、C2H4D、新戊烷
9、将乙烯与O2以1:4的物质的量之比相混合,在常温常压下取此混合气体aL ,电
火花点燃后,恢复至原理的状态时,混合气体的体积为()
A、aL B、0.6aL C、0.4aL D、0.8aL
10、1mol乙烯与氯气发生加成反应完全后,再与氯气发生取代反应,整个过程中最多
消耗氯气()
A、3mol B、4mol C、5mol D、6mol
11、下图是某同学设计的实验室用乙醇制乙烯的实验装置图,请完成下列问题:
(1)、指出装置中存在的错误:;
(2)、在反应器中发生的化学反应是;
(3)、反应中浓硫酸的作用;
(4)、在加热时,应注意使温度迅速升到170℃的理由是;(5)、在烧瓶中加入少量碎瓷片的作用是;
(6)、反应中常有少量的副产物SO2生成,SO2对乙烯的性质实验有无影响,试叙述除去SO2的方法:;
(7)、实验室,常用的方法收集乙烯气体,反应完毕后,应先再。
