原料药用量
替米考星兽用原料药

武汉贝尔卡生物医药有限公司产品简介中文名称替米考星通用名
含量98% Cas.No 108050-54-0
水溶性可溶于水外观性状淡黄色粉末
包装规格1kg/桶 10kg/桶 25k
g/桶
价格
用法用量牛:10-20mg/kg体重皮下或静脉注射一次。
(制剂可制成30%水针);
鸡、猪饮水: 100-200mg/L供鸡或猪连续饮用5天。
(制剂可制成100ml:25g、 100ml:10g的溶液)。
猪拌料:按200-400mg/kg饲料(净含量)拌料给药连续饲喂15天。
(预混剂可制成20%、10%的含量)
药理作用替米考星具有广谱抗病原体作用,对革兰阳性菌、某些革兰阴性菌(如巴氏杆菌、猪胸膜肺炎放线杆菌)、支原体(鸡败血支原体、猪肺炎支原体)、螺旋体等均有抑制作用,其对巴氏杆菌、胸膜肺炎放线杆菌及畜禽支原体的作用强于泰乐菌素。
替米考星与泰乐菌素相比,其用药量少、作用持久、副作用小、体内残留低、安全无毒,是一种经济、安全、有效的畜禽常用抗菌和促生长药物,是替代泰乐菌素、预防和治疗畜禽呼吸道感染的首选药物。
适应症猪:用于预防和治疗育肥猪由胸膜肺炎放线菌、猪肺炎霉形体,出血性巴氏杆菌、支原体和其他敏感细菌引起的肺炎等感染症状;
鸡:用于预防和治疗鸡的呼吸道感染,如支原体、副嗜血性杆菌、多杀性巴氏杆菌以及其他细菌引起的感染;牛:用于预防和治疗由溶血性巴氏杆菌和多杀性巴氏杆菌引起的呼吸道疾病。
注意事项替米考星禁止静脉注射,肌肉和皮下注射均可出现局部反应(如肿胀,坏死),替米考星的注射用药慎用于除牛以外的动物,休药期:牛皮下注射28天,猪内服7天。
本品禁止用于马。
详情。
辅料用量

辅料用量:每100kg药物,用麦麸10~15kg。
常用量为麦麸10kg。
药物每100kg,用米20kg。
药物每100kg,用灶心土25~30kg砂的用量以能掩盖所加药物为度药物每100kg,用蛤粉30~50kg药物每100kg,用滑石粉40~50kg。
辅料的一般用量为40kg酒炙用量:药物每100kg, 用酒10~20kg.酒黄连:黄连片每100kg,用黄酒12.5kg。
姜黄连:黄连片每100kg,用生姜12.5kg或干姜4kg,绞汁或煎汁。
吴萸连:黄连片每100kg,用吴茱萸10kg。
酒大黄:大黄片或块每100kg,用黄酒10kg。
熟大黄:大黄片或块每100kg,用黄酒30kg。
醋大黄:大黄片或块每100kg,用米醋15kg。
清宁片:大黄片或块每100kg,用黄酒75kg,炼蜜40kg。
酒当归:每100kg当归片,用黄酒30kg。
土炒当归:每100kg当归片,用灶心土粉30kg。
每10Okg蕲蛇肉,用黄酒20kg。
每10kg蟾酥,用白酒20kg。
醋炙用量:一般每100公斤药物加米醋20~30公斤,最多不超过50公斤。
延胡索每100kg,用米醋20kg。
乳香每100kg,用米醋10kg。
每10Okg净香附颗粒或片,用米醋20kg。
四制香附:每10Okg颗粒或片,生姜5kg(取汁)、米醋10kg、黄酒10kg、食盐2kg(清水溶化)。
酒香附每10Okg净香附颗粒或片,用黄酒20kg。
盐炙用量:一般每100公斤药物,用食盐2~3公斤,加入4~5倍量的水溶解后制成食盐水溶液备用。
盐黄柏:黄柏丝或块每100kg,用食盐2kg。
酒黄柏:黄柏丝或块每100kg,用黄酒10kg姜炙用量:100kg药物,用生姜10kg。
无生姜,可用干姜煎汁,用量为生姜的1/3。
一般所得姜汁与生姜比例为1:1。
蜜炙用量:一般每100kg药物,用炼蜜25kg①质地疏松、纤维多的药物用蜜量宜大,每100kg药物,通常用炼蜜20~25kg。
药品送检量参考表
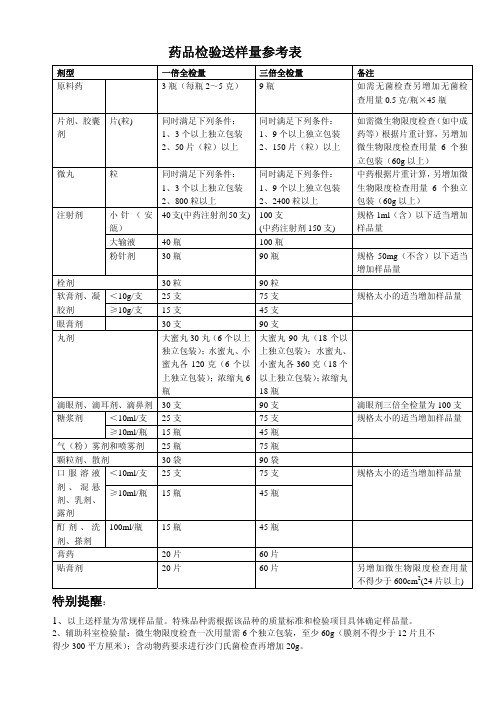
1、9 个以上独立包装 药等)根据片重计算,另增加
2、150 片(粒)以上 微生物限度检查用量 6 个独
立包装(60g 以上)
同时满足下列条件: 中药根据片重计算,另增加微
1、9 个以上独立包装 生物限度检查用量 6 个独立
2、2400 粒以上
包装(60g 以上)
100 支
规格 1ml(含)以下适当增加
规格太小的适当增加样品量
45 瓶
75 瓶
90 袋
75 支
规格太小的适当增加样品量
45 瓶
45 瓶
60 片 60 片
另增加微生物限度检查用量 不得少于 60特殊品种需根据该品种的质量标准和检验项目具体确定样品量。
2、辅助科室检验量:微生物限度检查一次用量需 6 个独立包装,至少 60g(膜剂不得少于 12 片且不 得少 300 平方厘米);含动物药要求进行沙门氏菌检查再增加 20g。
糖浆剂
<10ml/支
≥10ml/瓶
气(粉)雾剂和喷雾剂
颗粒剂、散剂
口 服 溶 液 <10ml/支 剂 、 混 悬 ≥10ml/瓶 剂、乳剂、
露剂
酊 剂 、 洗 100ml/瓶 剂、搽剂
膏药
贴膏剂
同时满足下列条件: 1、3 个以上独立包装 2、50 片(粒)以上
同时满足下列条件: 1、3 个以上独立包装 2、800 粒以上 40 支(中药注射剂 50 支)
40 瓶 30 瓶
30 粒 25 支 15 支 30 支 大蜜丸 30 丸(6 个以上 独立包装);水蜜丸、小 蜜丸各 120 克(6 个以 上独立包装);浓缩丸 6 瓶 30 支 25 支 15 瓶 25 瓶 30 袋 25 支
15 瓶
原料药管理制度

原料药管理制度一、目的和适用范围本制度的目的是为了规范化和规范公司对原料药的管理,并确保原料药的安全性和质量,适用于公司的所有生产、采购和使用原料药的部门和人员。
二、定义1.原料药:指用于制备药品的化学物质或生物制品,包括化学合成原料和生物制剂。
2.供应商:指向公司提供原料药的厂商、代理商或批发商。
3.质量控制:指对原料药进行检验、检测和验证的活动,以确保其符合规定的质量标准。
三、供应商管理1.公司必须建立供应商管理程序,并评估供应商的资质和质量管理体系。
2.供应商必须提供准确、完整和可靠的原料药质量信息,并配合公司的质量控制工作。
3.公司应对供应商进行定期的质量评估和监督,并与供应商建立长期合作关系。
四、原料药采购1.原料药采购必须符合法律法规的要求,并按照公司的采购管理流程进行。
2.采购部门必须明确采购的原料药种类、数量和质量要求,并与供应商签订书面合同。
3.采购的原料药必须附有合格证书和检验报告,并按照公司的质量控制要求进行验收和入库。
五、原料药储存与保管1.原料药必须储存在干燥、阴凉、通风良好、温度适宜且无害气体的地方,防止其受潮、受热和受污染。
2.原料药必须按照分类、批号和放置顺序进行储存,并定期进行库存盘点和质量检查。
3.原料药的保管人员必须具备相关的知识和技能,并严格遵守储存要求和操作规程。
六、原料药使用和记录1.原料药的使用必须按照公司的生产工艺和质量要求进行,禁止超过规定用量或使用过期的原料药。
2.使用原料药的部门必须建立使用记录,包括原料药的种类、批号、用量、使用人员等信息,并在使用后及时清点和记录剩余量。
3.对于出现异常情况或质量问题的原料药,必须立即上报质量管理部门,并采取措施防止扩散和影响产品质量。
七、质量控制和风险管理1.公司必须建立完善的质量控制体系,并制定相应的质量控制工艺和标准。
2.质量控制部门必须进行原料药的质量检验,并对不合格原料药进行处理或退货。
3.公司必须建立风险管理制度,对原料药的风险进行评估和分析,并采取相应的措施进行风险控制和预防。
原料药批生产记录模板格式

原料药批生产记录模板格式
1. 文档介绍
本文档为原料药批生产记录的模板格式,用于记录原料药批生产过程中的相关信息和数据。
2. 文档要素
2.1 批次信息
- 批次号:[填写原料药批次号]
- 批次日期:[填写原料药批次日期]
- 生产部门:[填写生产部门名称]
- 质量控制部门:[填写质量控制部门名称]
2.2 原料药配方
- 配方编号:[填写原料药配方编号]
- 原料药名称:[填写原料药名称]
- 原料药规格:[填写原料药规格]
- 原料药用量:[填写原料药用量]
2.3 生产过程记录
- 生产设备:[填写生产设备信息]
- 生产操作步骤:[填写生产操作步骤]
- 原料药加工过程记录:[填写原料药加工过程记录,包括操作员、开始时间、结束时间等信息]
2.4 质量检测记录
- 检测项目:[填写检测项目名称]
- 检测方法:[填写检测方法]
- 检测结果:[填写检测结果]
2.5 生产结束
- 生产结束时间:[填写生产结束时间]
- 生产结束记录:[填写生产结束时的记录和总结]
3. 使用说明
- 请根据实际生产情况填写批次信息、配方、生产过程记录和质量检测记录等内容。
- 每个部分的信息都应该准确、完整地填写,确保文档的可靠性和可追溯性。
- 对于不同的原料药批次,应新建一个对应的批生产记录模板,并以批次号和日期作为标识。
- 本文档可打印使用,并保存在档案中,以备查询和审查之需。
以上为原料药批生产记录模板格式,用于规范原料药批生产过
程的记录和管理。
请在生产过程中认真填写,并确保记录的准确性
和可靠性。
胶囊辅料配比计算公式

胶囊辅料配比计算公式胶囊是一种常见的给药方式,通常由胶囊壳和药物组成。
胶囊壳是由胶原蛋白或纤维素等材料制成的空心球状容器,药物则是填充在胶囊壳内的。
为了确保胶囊的质量和稳定性,我们需要根据药物的性质和配方要求来选择合适的胶囊辅料,并进行配比。
胶囊辅料通常包括胶囊壳原料、润滑剂、填充剂、稳定剂和着色剂等。
下面是胶囊辅料配比计算的一般步骤和公式:1.确定胶囊壳的种类和质量胶囊壳可以根据药物的需求选择胶原蛋白胶囊壳或纤维素胶囊壳。
胶囊壳的质量可以根据配方要求确定,一般使用重量(g)来表示。
2.确定润滑剂的用量润滑剂可以帮助减少胶囊壳和药物之间的摩擦,使胶囊易于开启。
润滑剂的用量可以通过以下公式计算:润滑剂用量(g)=药物总量(g)*润滑剂百分比(%)3.确定填充剂的用量填充剂可以帮助稳定药物在胶囊内的分布和形态,使药物更易于填充进胶囊壳中。
填充剂的用量可以通过以下公式计算:填充剂用量(g)=药物总量(g)*填充剂百分比(%)4.确定稳定剂的用量稳定剂可以提高胶囊壳的稳定性和耐腐蚀性,延长胶囊的保质期。
稳定剂的用量可以通过以下公式计算:稳定剂用量(g)=药物总量(g)*稳定剂百分比(%)5.确定着色剂的用量着色剂可以给胶囊壳和药物以适当的颜色,增加其识别性。
着色剂用量(g)=药物总量(g)*着色剂百分比(%)以上公式中的百分比可以根据配方要求进行调整。
需要注意的是,配方中润滑剂、填充剂、稳定剂和着色剂的百分比之和应等于100%。
在实际计算中,我们需要根据具体的药物配方和要求来确定各个辅料的用量,以及胶囊壳的种类和质量。
此外,还需要考虑配方的稳定性、耐受性和可操作性等因素来选择合适的辅料。
总之,胶囊辅料的配比计算需要根据具体要求和配方来确定,通过合理的计算和选择,可以制备出质量稳定、易于使用的胶囊产品。
7.限额领料管理规程

目的:保证各种物料有计划地领取。
范围:原辅料、包装材料。
职责::车间主任、工艺员、领料员、班长、质管科负责人、质监员、仓库保管员对本规程实施负责。
规程:
1.由车间副主任或工艺员根据配制指令单和下列限额原则开具领料单,领料单由车间主任签字同意,方可持此领料单到仓库领料。
2. 限额领料的数量必须符合下列原则:
2.1药品原料药的领用量为本批生产用量的105%,可整包装领,或按实际用量称量,领用后用减量法称量,剩余原料立刻返回仓库,经仓库复核后办理退库手续。
2.2药品辅料的领用量为每批生产用量的105%.
2.3针剂用安瓿领用量为每批生产用量的105%。
2.4标签、说明书、合格证、大盒、小盒、纸箱等包装材料领用量为每批生产用量的105%。
3.生产完毕,没有打批号的标签必须如数做好记录,(根据具体情况做出退还仓库或存放在专柜的决定),破损作废的标签由质监员监督销毁。
4.每批产品生产完毕后,将所剩余的零头物料按“零头物料管理规程”规定的程序处理,并做好记录。
5.生产车间必须遵照上述原则限额领料。
文件变更历史:
1、2013年3月,因《药品生产质量管理规范》(2010年修订)颁布实施重新修订本文件。
化学药品注射剂仿制药质量和疗效一致性评价技术要求

化学药品注射剂仿制药质量和疗效一致性评价技术要求一、总体要求申请人应全面了解已上市注射剂的国内外上市背景、安全性和有效性数据、上市后不良反应监测情况,评价和确认其临床价值。
二、参比制剂申请人应按照国家药监局发布的《化学仿制药参比制剂遴选与确定程序》科学选择参比制剂,参照本技术要求和国内外相关技术指导原则开展一致性评价研究工作。
三、处方工艺技术要求(一)处方注射剂中辅料种类和用量通常应与参比制剂(RLD)相同。
辅料的用量相同是指仿制药辅料用量为参比制剂相应辅料用量的95%—105%。
如附带专用溶剂,应与参比制剂的专用溶剂处方一致。
申请人可以提交与参比制剂抑菌剂、缓冲剂、pH调节剂、抗氧剂、金属离子络合剂不同的处方,但需标注不同之处,阐述选择的理由,并研究证明上述不同不影响所申请产品的安全性和有效性。
辅料的浓度或用量需符合FDAIID数据库限度要求,或提供充分依据。
过量投料建议参考ICHQ8相关要求。
(二)生产工艺1. 工艺研究注射剂灭菌/无菌工艺的研究和选择应参考国内外灭菌/无菌工艺相关的指导原则进行。
按相关指导原则开展工艺研究,确定生产工艺关键步骤和关键工艺参数。
注意以下方面:(1)为了有效控制热原(细菌内毒素),需加强对原辅包、生产过程等的控制,注射剂生产中建议不使用活性炭。
(2)根据生产工艺进行过滤器相容性研究。
根据溶液的特点和生产工艺进行硅胶管等直接接触药液容器的相容性研究。
(3)如参比制剂存在过量灌装,仿制药的过量灌装宜与参比制剂保持一致,如不一致需提供合理性论证。
2. 工艺验证(1)灭菌/无菌工艺验证对于终端灭菌药品,至少进行并提交以下验证报告:1)药品终端灭菌工艺验证;2)直接接触药品的内包材的除热原验证或供应商出具的相关证明资料;3)包装系统密封性验证,方法需经适当的验证;4)保持时间(含化学和微生物)验证。
对于无菌灌装产品,至少进行并提交以下验证报告:1)除菌工艺的细菌截留验证;2)如不采用过滤除菌而采用其他方法灭菌,提供料液/大包装药的灭菌验证;3)直接接触无菌物料和产品的容器密封系统的灭菌验证;4)直接接触药品的内包材的除热原验证或供应商出具的相关证明资料;5)无菌工艺模拟试验验证,并明确试验失败后需要采取的措施;6)包装系统密封性验证,方法需经适当的验证;7)保持时间(含化学和微生物)验证。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原料药的用量青霉素 1g:10kg 水1/万
新诺明90 0.1%-0.2%料,10/万
氨苄青霉素钠 1g:10-15kg水,1-1.5/万
磺胺二甲嘧啶80 0.1%-0.2%料,10/万
阿莫西林 1g:10-15kg水,1-1.5/万
磺胺五甲嘧啶200 0.05%-0.1%料 5-10/万
先锋6号 1g:10kg 水,1/万
磺胺六甲氧嘧啶300 0.1%-0.2%料,10-20/万
硫酸链霉素 1g:2-5kg水,5-25/万
TMP 1g:5kg料 ,2/万
硫酸庆大霉素 1g:25kg 水,0.4/万
醋酸TMP 1g:10kg水,1/万
硫酸卡那霉素 1g:10kg 水,1/万
乳酸TMP120 1g:10kg水,1/万
硫酸阿米卡星 1g:20kg 水,0.5/万
病毒唑420 1g:10kg水 ,1/万
土霉素 1g:0.5kg料,20/万
病毒灵25 1g:1-2kg水,10-20/万
盐酸土霉素 1g:1kg水,10/万
盐酸金刚烷胺220 1g:8kg水 ,1.25/万
盐酸强力霉素 1g:5-10kg水,1-2/万
乳酸诺氟沙星220 1g:5-10kg水, 1-2/万
甲砜霉素 0.01%-0.02%料 , 1-2/万
盐酸环丙沙星260 1g:20-30kg水,0.33-0.5/万
盐酸林可霉素 1g:5kg水,2/万
乳酸环丙沙星 1g:20-30kg水, 0.33-0.5/万
水溶性罗红霉素 1g:10kg水, 1/万
甲磺酸培氟沙星 1g:10kg水, 1/万
硫氰酸红霉素 1g:5-10kg水, 1-2/万
扑热息痛 1g:4只鸡水
硫酸新霉素 1g:15-20kg水, 0.5-0.67/万
氨基比林 1g:5只鸡水
泰乐菌素 1g:2kg水 , 5/万
丙硫咪唑 1g:30-40kg体重
烟酸诺氟沙星 1g:5-10kg水 , 1-2/万
吡喹酮950 畜10-35mg/kg体重禽10-20mg/kg体重盐酸左旋氧氟沙星 1g:20kg水 , 0.5/万
喹乙醇35 1g:30kg料 ,0.33/万
盐酸恩诺沙星 1g:10-20kg水, 0.5-1/万
安乃近 1 g:1kg水 ,10/万_
痢菌净 1g:10-15kg料,0.67-1/万
氨茶碱 10mg/kg体重
黄芪多糖 1g饮水5-10kg 黄连素:100公斤7-10克黄芪:1克10公斤水。
