RTPCR常见问题分析
PCR常见问题、原因分析及其对策

镁离子浓度不当
总结词
镁离子是PCR反应的重要成分,对PCR的效率和产物质量有 重要影响。
详细描述
镁离子浓度过高可能导致非特异性扩增和产物稳定性下降; 镁离子浓度过低则可能影响DNA聚合酶的活性,导致PCR失 败或扩增效率低下。因此,需要根据实验条件和试剂盒推荐 ,选择合适的镁离子浓度。
03
pcr问题对策
详细描述
模板质量的好坏直接影响到pcr的扩增 效果,因此需要确保模板的纯度和浓 度,避免使用降解严重的模板,以提 高pcr的产量和特异性。
优化pcr循环参数
总结词
pcr循环参数的优化可以显著提高pcr的效率和特异性。
详细描述
通过调整变性、退火、延伸等温度和时间,可以优化pcr循环参数,提高pcr的效率和特异性。同时, 合理设置预变性时间和循环数,可以有效避免非特异性扩增和产物积累。
优化引物设计
总结词
引物设计是pcr反应的关键,优化引物设计可以显著提高pcr的特异性和效率。
详细描述
引物设计时需考虑特异性、长度、GC含量、引物二聚体和发夹结构等因素,通过合理设计引物,可以避免非特 异性扩增和引物二聚体形成,提高pcr的特异性。
提高模板质量
总结词
模板质量对pcr结果的影响不容忽视, 提高模板质量可以提高pcr的产量和特 异性。
模板质量差
总结词
模板质量的好坏直接影响到PCR的效率和产物质量。
详细描述
模板中可能含有抑制剂、DNA聚合酶抑制剂或DNA聚合酶竞争性抑制剂等物质, 这些物质会影响DNA聚合酶的活性,导致PCR失败或扩增效率低下。此外,模 板的浓度过低或过高也可能影响PCR结果。
pcr循环参数不当
总结词
PCR循环参数包括变性、退火、延伸等步骤,这些步骤 的温度和时间设置对PCR结果有重要影响。
PCR常见问题及解决方案精品课件

适用范围
• 大规模基因检测 • 目的基因拷贝数极低的样本 • GC含量高,有二级结构的模板 • 复杂基因组样本 • 可直接检测菌落,基因点突变检测,
或者阳性克隆的筛选。
PCR技术简介 PCR常见问题、原因分析及其解决方案 提高PCR反应特异性的策略
PCR常见问题
• 无扩增产物 • 非特异性扩增 • 拖尾 • 假阳性
特点
产品
性能
高扩增效率 •天为时代:Taq Plus
• TaKaRa:Ex TaqTM
复杂模板扩增
高保真
•天为时代: Taq Platinum
• Invitrogen:Pfx Platinum Taq High Fidelity
保真度低于Pfu聚合酶 但扩增效率较高
长片段扩增
Байду номын сангаас
•天为时代:Long Taq
ddH2O
•pH值适当 •避免污染
PCR标准反应体系
• DNA模板 • 引物 • 反应缓冲液 • Mg 2+ • dNTP • ddH2O
• 耐热聚合酶
如何选择最合适的DNA聚合酶
• DNA 聚合酶的特性 • PCR 实验的不同需求
如何选择最合适的DNA聚合酶 -- DNA 聚合酶的特性
纯度 稳定性
PCR常见问题之一
• 无扩增产物
➢现象:正对照有条带,而样品则无;
原
因
1. 模板:含有抑制物,含量低
2. Buffer对样品不合适
3. 引物设计不当或者发生降
解
对
4. 反应条件:退火温度太高,延 策
伸时间太短
1. 纯化模板或者使用试剂盒提取 模板DNA或加大模板的用量
2. 更换Buffer或调整浓度 3. 重新设计引物(避免链间二聚
RTPCR合成目的cDNA中可能会遇到的问题及处理

RT-PCR合成目的cDNA中可能会遇到的问题及处理概述从真核生物的组织或细胞中提取mRNA,通过酶促反应逆转录合成cDNA的第一链和第二链,将双链cDNA和载体连接,然后转化扩增, 即可获得cDNA文库,构建的cDNA文库可用于真核生物基因的结构、表达和调控的分析;比较cDNA和相应DNA序列差异可确定内含子存在和了解转录后加工等一系列问题。
总之cDNA 的合成和已成为当今真核分子生物学的基本手段。
自70年代中叶首例cDNA问世以来,已发展了许多种提高cDNA合成效率的方法,并大大改进了载体系统,目前cDNA合成试剂已商品化。
cDNA合成及的基本步骤包括用反转录酶合成cDNA第一链,聚合酶合成cDNA第二链,加入合成接头以及将双链DNA到于适当载体(噬菌体或质粒)。
一、RNA制备模板mRNA的质量直接影响到cDNA合成的效率。
由于mRNA分子的结构特点,容易受RNA酶的攻击反应而降解,加上RNA酶极为稳定且广泛存在,因而在提取过程中要严格防止RNA酶的污染,并设法抑制其活性,这是本实验成败的关键。
所有的组织中均存在RNA酶,人的皮肤、手指、试剂、容器等均可能被污染,因此全部实验过程中均需戴手套操作并经常更换(使用一次性手套)。
所用的玻璃器皿需置于干燥烘箱中200℃烘烤2小时以上。
凡是不能用高温烘烤的材料如塑料容器等皆可用0.1%的焦碳酸二乙酯(DEPC)水溶液处理,再用蒸馏水冲净。
DEPC是RNA酶的化学修饰剂,它和RNA酶的活性基团组氨酸的咪唑环反应而抑制酶活性。
DEPC与氨水溶液混合会产生致癌物,因而使用时需小心。
试验所用试剂也可用DEPC处理,加入DEPC至0.1%浓度,然后剧烈振荡10分钟,再煮沸15分钟或高压灭菌以消除残存的DEPC,否则DEPC也能和腺嘌呤作用而破坏mRNA活性。
但DEPC 能与胺和巯基反应,因而含Tris和DTT的试剂不能用DEPC处理。
Tris溶液可用DEPC处理的水配制然后高压灭菌。
PCR实验常见失败原因、对策分析及体系优化

PCR实验常见失败原因、对策分析及体系优化PCR虽然为一个简单的实验,但在实际过程中可能会出现各种问题.产生问题的原因可能来源于以下几个方面:实验操作,试剂质量,PCR反应过程中各种试剂的含量,以及反应条件,温度设置等,本文对各个方面进行了讨论,大家遇到问题后可以对号入座的查一下.当然,具体问题的解决还依靠实验者就可能的原因逐项排除,并不断的摸索才能彻底解决.假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件.寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改.酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性.需注意的是有时忘加Taq酶或溴乙锭.引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带.反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
RealTimeRTPCR常见问题分析

Real-Time RT-PCR常见问题分析1.某一孔荧光信号特别强问题:同一批样品,其中某一个荧光信号特别强?原因:①试剂配制时反应液没完全溶化,导致探针量在一管中增多;②试剂配制时没有充分混匀致各管中各成分的量不同;③也可能是PCR仪热槽被荧光物质污染,这时就要清除热槽中的污染;2. 扩增曲线有一向上或向下的尖峰问题:扩增曲线有一向上或向下的尖峰?原因:①反应过程中电压不稳定;②可能在20循环左右仪器有停下或者仪器有开盖,使得光线突然增强;③如果尖峰向下,也可能是卤素灯老化所致,这时应更换;3. 部分样本扩增效率过低问题:部分样本扩增效率过低?原因:①提取液残留,一定程度抑制了PCR反应;②反应液未严格取量混匀或分装不均匀;③试剂失效;4.阴性对照或空白对照翘尾,可能原因:1、模板提取环境有污染。
2、模板提取操作有污染。
3、配液过程存在污染。
问题:阴性对照或空白对照翘尾?原因:①模板提取环境有污染;②模板提取操作有污染;③试剂配制过程存在污染;5. 直线型扩增曲线问题:直线型扩增曲线?原因:①探针部分降解(探针降解原因:a.探针反复冻融――稀释的探针可在4℃保存至少3个月,应避免反复冻融;b.探针在光线下暴露时间太长);②反应液中有PCR抑制物;6.没有扩增曲线问题:没有扩增曲线?原因:①PCR参数设置错误,在设计循环参数时将荧光信号读取时间设在反应的第一步,即stage 1阶段;②电脑设定了自动休眠;7.基线下滑问题:扩增曲线有一个下滑阶段?原因:基线选取范围不对,可试着将基线范围改大一些,这一问题常因试剂质量所致;8.扩增曲线断裂问题:扩增曲线断裂?原因:基线选取范围不对,基线终点大于Ct值,这通常是由于模板DNA浓度过高所致,因Ct值<15,而基线范围仍取3-15,其中包含部分扩增信号,导致标准差偏大,阈值过高,解决办法:减少基线终点至Ct值前4个循环,重新分析数据9.样品浓度跨度过大样品浓度过高,至阳性样品扩增曲线在后面循环中呈一向下的直线,原因及解决办法同“扩增曲线断裂”。
PCR常见问题分析及解决策略

荧光定量PCR常见问题
溶解曲线不止一个主峰:
引物设计不佳:设计特异性引物; 引物浓度不适:降低引物浓度; 退火温度低:调整退火温度;
镁离子浓度过高:降低镁离子浓度;
模板中有基因组污染:注意提取过程; 耗材仪器不匹配; 反应体系污染等:设置阳性阴性对照。
荧光定量PCR常见问题
扩增效率低:
提高PCR特异性最重要的方法之一。
策略之四使用PCR增强剂
甲酰胺、DMSO、甘油、甜菜碱等 都可充当PCR的增强剂。 其可能的机理是降低熔解温度,从而 有助于引物退火并辅助DNA聚合酶延伸 通过二级结构区。 增强剂浓度要适当。
荧光定量PCR常见问题
荧光定量PCR扩增效率确认: 相关系数(R2):大于0.98 标准曲线斜率:-3~-3.5 PCR扩增效率(E):0.9~1.2 重复性好:STD <0.2 特异性好
PCR常见问题、 原因分析及其对策
PCR技术简介 PCR常见问题、原因分析及其解决方案
提高PCR反应特异性的策略 定量PCR常见问题 临床PCR检测的常见问题
PCR标准反应体系
• DNA模板
• 引物
• 反应缓冲液 • Mg 2+浓度 • dNTPs • dH2O • 耐热聚合酶
反应体系对PCR扩增的影响
PCR常见问题之四-----假阳性
现象:空白对照出现目的扩增产物
原 因
靶序列或扩增产物的交叉污染
对 策
• • 操作时应小心轻柔,防止将靶序列吸入加样枪 内或溅出离心管外; 除酶及不能耐高温的物质外,所有试剂或器材 均应高压消毒。所用离心管及加样枪头等均应 一次性使用。 各种试剂最好先进行分装,然后低温贮存。
现象:正对照有条带,而样品则无
RTPCR常见问题分析

严格控制实验操作过程
总结词
实验操作过程的准确性和规范性对RTPCR实验结果具有重要影响,严格控制实验操作 过程可以有效提高实验的准确性和可靠性。
详细描述
遵循标准的RTPCR实验操作流程,确保每一步操作的准确性和规范性。在实验过程中, 注意避免交叉污染和误差传递,使用一次性吸头和离心管,避免使用污染的工具和容器。
谢谢观看
RTPCR常见问题分析
目录
• RTPCR技术概述 • RTPCR实验过程常见问题 • RTPCR结果解读常见问题 • RTPCR技术改进和优化建议
01
RTPCR技术概述
RTPCR技术简介
实时荧光定量PCR(Real-Time Quantitative PCR),简称RTPCR, 是一种在PCR反应过程中实时监测荧 光信号的分子生物学技术。
同时,对实验操作人员进行培训和考核,确保其具备足够的技能和经验。
完善扩增产物检测方法
总结词
扩增产物检测是RTPCR实验的关键环节,完善扩增产物 检测方法可以有效提高实验的准确性和可靠性。
详细描述
选择灵敏度高、特异性好的检测方法,如荧光定量PCR 、熔解曲线分析等。同时,采用内参基因对实验结果进 行校正和标准化处理,以排除实验过程中可能存在的误 差和干扰因素。此外,应定期对检测方法进行验证和优 化,以确保其性能的可靠性和稳定性。
04
RTPCR技术改进和优化 建议
优化样本采集和保存方法
总结词
详细描述
样本质量是影响RTPCR实验结果的重要因素, 优化样本采集和保存方法可以有效提高实验 的准确性和可靠性。
在采集样本时,应选择适当的采集时间、部 位和数量,避免样本受到污染或降解。采集 后应尽快将样本保存于适当的介质中,并保 持低温,以维持样本的稳定性和活性。
一文掌握RT-PCRqPCR原理、实验设计、数据分析、问题、技巧一网打尽qPCR常见问题及解...
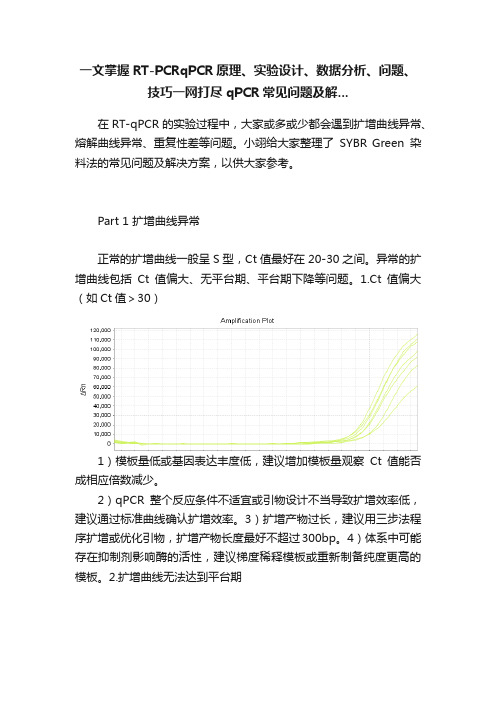
一文掌握RT-PCRqPCR原理、实验设计、数据分析、问题、技巧一网打尽qPCR常见问题及解...在RT-qPCR的实验过程中,大家或多或少都会遇到扩增曲线异常、熔解曲线异常、重复性差等问题。
小翊给大家整理了SYBR Green染料法的常见问题及解决方案,以供大家参考。
Part 1 扩增曲线异常正常的扩增曲线一般呈S型,Ct值最好在20-30之间。
异常的扩增曲线包括Ct值偏大、无平台期、平台期下降等问题。
1.Ct值偏大(如Ct值>30)1)模板量低或基因表达丰度低,建议增加模板量观察Ct值能否成相应倍数减少。
2)qPCR整个反应条件不适宜或引物设计不当导致扩增效率低,建议通过标准曲线确认扩增效率。
3)扩增产物过长,建议用三步法程序扩增或优化引物,扩增产物长度最好不超过300bp。
4)体系中可能存在抑制剂影响酶的活性,建议梯度稀释模板或重新制备纯度更高的模板。
2.扩增曲线无法达到平台期基因丰度低、循环数较少,建议增加循环数或选择适合低丰度基因定量的产品。
3. 扩增曲线平台期下降可能是基线范围设置不当,这种一般是由于模板量过高导致的。
建议减小基线的终点值(一般建议设置为Ct值-4),调整后见下图。
4.扩增曲线平台期锯齿状1)RNA纯度低,建议梯度加大模板稀释倍数看优化效果或重新制备高纯度RNA重新实验。
2)仪器长时间未校准,建议定期进行仪器校准保养。
5.扩增曲线杂乱无规律可能是ROX浓度和机型不匹配,建议调整ROX浓度,调整后见下图。
【注】可以在仪器上将参比染料设置由ROX更改为NONE,取消ROX的校正功能,查看扩增曲线是否恢复正常,即可判定是否是ROX 导致的。
6.有熔解曲线,无扩增曲线可能是扩增程序设置错误,未进行荧光信号搜集,建议重新实验,增加扩增程序中延伸阶段荧光信号的搜集。
7.扩增曲线有向上或向下的尖峰可能是仪器故障,建议维修仪器。
8. 阴性对照有扩增1)NTC有扩增,可能有以下两种情况:①Ct>35,熔解曲线Tm值<80℃(一般正常qPCR产物,大小在100-300bp之间,熔解曲线Tm大多在80℃以上),可能是引物二聚体导致,可进一步优化引物。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.用于合成 cDNA第一链 合成的引物 的退火不充分
1.确定退火温度适合实验 中所用的引物。对于随机 六聚体,建议在反应温度 保温之前先在25℃保温10 分钟。
2.对于基因特异性引物 (GSP),可以试以下其 他GSP,或换用oligo(dT) 或随即六聚体确定GSP是 反义序列。
4.起始RNA量 不够
3 提高RT-PCR反应的灵敏度与特异性:
3.1 首先应确定模板RNA完整性好,无DNA污染。
3.2 RNA模板中不应含有扩增反应抑制剂。
3.3 为了防止模板降解,可以在反应体系中加入 RNase抑制剂RNasin。
3.4 使用适量的模板RNA,模板量太多会降低特异性, 太少会导致扩增不出条带或条带太弱。
问题五:信号高于预期,在低于 预期的循环中即可检出产物?
1、 反应中加的样品太多:降低模板的浓度。 2、 模板或PCR残余污染:隔离污染来源,更换试
剂,使用专用的精致移液器。在无DNA区域准 备反应,使用抗气溶胶的吸头。
问题六:电泳后出现意外的条带 RNA?
原因
1.被基因组DNA污染
2.用于第一链合成的寡聚dT或随机 引物
11.富含GC的 模板
于GC含量>50%的模 板,使用PCRx Enhancer Solution。
12. 镁离子浓度 太低
从1mM到3mM,间隔 0.5mM进行一系列反 应,确定对于每个模 板和引物对的最佳镁 离子浓度。注意:对 实时定量PCR,使用 3mM到5mM的镁离子 浓度。
13.退火温度 太高
有可能是由于模板量过高而导致PCR结果产生了 高分子量的DNA胶状物。建议将第一链结果至少 稀释100倍再进行二次扩增。
另外,在二次PCR时使用的退火温度如果比引物 的Tm值低5℃,可以将退火温度适当增高或进行 热启动以提高特异性
3.在开始几个循环使用 较高的退火温度,然 后使用较低的退火温 度。
4.使用热启动Taq DNA 酶进行PCR,提高反 应的特异性。
2.基因特异性引 物设计较差
遵循用于扩增引物设 计的同样原则
3.RNA中有基 因组DNA的污染
1.使用扩增级DNase 1 处理RNA。
2.设置没有逆转录的对 照反应检测DNA污染
使用公式估算Tm,把 退火温度设定为低于 Tm 5℃。因为这些公 式只是估算Tm值,所 有真正的退火温度实 际会高些或低些。
问题二:产生非特异性条带
1.引物和模版 的非特异性 退火
1.避免引物3’端含有2 个到3个dG或dC’
2.在第一链合成中使用 基因特异性引物,而 不是随即引物或 oligo(dT)。
对两步法RT-PCR,不 要在PCR步骤中使用 超过1/5的逆转录反应 产物;
10.PCR引物设 计较差
避免在引物3'端含有互 补序列。避免可以形 成内部发卡结构的序 列。设计Tm类似的引 物。最佳引物浓度介 于0.1μM到0.5μM之间。 为了精确确定引物浓 度,在260nm测量光 密度,然后使用光吸 收值和消光系数计算 浓度。
4.形成引物二 聚体
5.镁离子浓度 太高
6.沾染外源 DNA
设计在3’端没有互补 序列的引物。
对于每一个模板和引 物组化优化镁离子浓 度。
使用抗气雾剂和UDG 酶。
问题三:产生弥散条带
原因
1.cDNA第一链产物的含 量过高 2. DNase降解DNA产生的 寡核苷酸的非特异性 扩增 3. PCR反应中引物过多 4. 循环数过多 5. 退火温度过低
RNA提取后,应储存在 100%甲酰胺中,如果使 用RNase抑制剂,加热时 <45℃;pH<8.0,否则 抑制剂会释放所有结合的 RNase。而且,在 ≥0.8mM DTT时加入 RNase抑制剂,一定要存 在DTT。
2. RNA中包含 逆转录抑制剂
过乙醇沉淀RNA除去抑制 剂。用70%(v/v)乙醇对 RNA沉淀进行清洗。可以 加入糖元(0.25μg到 0.4μg/μl)以帮助小量样品 RNA的恢复;逆转录抑制剂 包括:SDS,EDTA,甘 油,焦磷酸钠,亚精胺, 甲酰胺和胍盐;将对照RNA 同样品混合,同对照RNA 反应比较产量以检验抑制 剂;
5. 多糖同RNA 共沉淀
增加RNA量;对于 <50ng的RNA样品, 可以在第一链cDNA合 成中使用0.1μg到 0.5μg乙酰BSA;
使用氯化锂沉淀RNA 以除去多糖;
6.RNA模板 二级结构太多
将RNA和引物在不含盐及 缓冲液条件下变性/退火;
提高逆转录反应温度,对 SuperScriptⅡ可以到50℃, 对 ThermoScript可以到 65℃。注意:不要在 >60℃时使用oligo(dT)引 物,选择一个在反应温度 可以退火的GSP;对于
问题八: 在无反转录酶的情况下, 对照RNA获得扩增结果
通常是由于对照RNA中含有痕量DNA而导致的。 由于进行体外转录时不可能将所有的DNA模板消 除。建议可将第一链cDNA稀释1:10、1:100、 1:1000倍以消除DNA污染所造成的影响。
有可能是引物二聚体的条带
问题九: 扩增产物滞留在加样孔 中
3.PCR的低特异性
对策
1.用DNase I预处理RNA . 2.使用基因特异性引物 .
3.优化PCR条件.
问题七:产生大分子量的弥散条带
大多数情况下是由于退火温度过低而导致的非特 异性的起始及延伸产生的。对于长片段的PCR, 建议将反应体系中cDNA的浓度稀释至1:10(或 1:100-1:200)
1 RT-PCR反应步骤: 第一,RNA提纯; 第二,RT逆转录; 第三,PCR聚合酶反应
2 RT-PCR方法
一步法:即反转录和PCR扩增在同一管 内完成, 有助于减少污染,灵敏度更高
2.2 两步法:即反转录和PCR扩增分两步进 行,首先从RNA模板反转录得到cDNA, 得到的cDNA再进行一次或多次不同的PCR 反应。
2、 RNA被损害和降解:必要的话更换RNA。
3、 RNAse污染:维持无菌条件;加入RNase抑制 剂。
4、 无效的cDNA:通过增加70%乙醇清洗的次数 来去除制备RNA过程中的抑制剂。
5、 无效的PCR扩增:注意:反转录的抑制剂包 括SDS、EDTA、胍盐、甲酰胺、磷酸钠和亚精 胺。调整cDNA合成温度或引物设计。
>1kb的RT- PCR产物, 保持反应温度≤65℃。 不要在高于37℃时使 用M-MLV;如果不需要 全长cDNA,在第一链 反应中使用随机引物;
7.引物或模板 对残余的RNA 模板敏感
8.靶序列在分 析的组织中不 表达
9.PCR没有起 作用
在PCR前用RNaseH 处理。
尝试其他靶序列或组 织
RT-PCR常见问题分 析
一 、 RT-PCR反应原理与方法
RT-PCR是将RNA反转录(RT)和以反转 录产物cDNA为模板的聚合酶链式扩增(PCR) 相结合的技术。首先经反转录酶的作用从 RNA合成cDNA,再以cDNA为模板,扩增合 成目的DNA片段。RT-PCR技术灵敏而且用途 广泛,可用于检测细胞中基因的表达水平, 细胞中RNA病毒的含量和直接克隆特定基因 cDNA序列等研究。
3.5 如果由于模板有二级结构,导致扩增效果不好, 可提高逆转录反应温度。
3.6 设计引物时,避免在引物3´端含有互补序列,避 免可以形成内部发卡结构的序列。
RT-PCR常见问题
问题一:RT-PCR仅有少量或没有产物
1.RNA被降解物
分离无污染或高质量的 RNA;提取RNA材料要尽 量新鲜,防止RNA降解。
对策
1. 常规PCR步骤中减少模板 cDNA的量 2. 提取高质量RNA,防止被 DNA污染 3. 减少引物的用量 4. 优化PCR反应条件,减少 PCR的循环次数 5. 提高退火温度,防止非特 异性的起始及延伸
问题四:灵敏度低,须在比预期 更高的循环中检出产物?
1、 初始模板RNA不充分:增加模板RNA的浓度。
2.3 一步法与两步法区别:
一步法RT—PCR反应更加快速、灵敏, 操作简便,污染率低,RNA二级结构减少, 并且因为聚合酶有校正活性,从而降低了 PCR反应的错配率。而在两步法中,两步 法在选择聚合酶和引物时具有更大的灵活 性,同时可由一次反转录样品获得多个遗 传信息,并且由于在第一步中将RNA反转 录为cDNA,从而更易于保存。另外,两 步法的整个过程比一步法更节省费用。
