有机化学第十三章羧酸衍生物总结
大学有机化学第十三章羧酸

CH3-C CH-COOH CH3
4
3
2
1
3-甲基-2-丁烯酸
取代酸
CH
CHCOOH
3-苯基丙烯酸(肉桂酸) ( -苯基丙烯酸)
◆ 羧酸的物理性质
O R C
=
O
H O
H H H
R C
=
O
H O O
O H
O H
=
C R
羧酸是极性分子,能与水形成氢键,故低级一元酸可 与水互溶,但随M↑,在水中的溶解度↓,从正戊酸开始 在水中的溶解度只有3.7 %,>C10的羧酸不溶于水。
O CH3C OH + NH3
CH3COOH + NH3
O
CH3C O.NH4 200℃CH C NH 3 2
CH3COONH4 Δ CH3CONH2 + H2O
-+
O
二元酸的二铵盐受热则发生分子内脱水兼脱氨,
生成五元或六元环状酰亚胺。
C H2C O O NH 4 C H2C O O NH 4
O
300℃
回流
ClCH2COOH
Cl2 , P
一氯乙酸
Cl2CHCOOH
回流
Cl2 , P Cl3CCOOH
二氯乙酸
回流
三氯乙酸
α-卤代酸是一种重要的取代酸,它可以发生与卤代烃相 似的亲核取代或消去反应,从而转变成其它的取代酸。
如:
CH3COOH Br2 ,P BrCH2COOH NaCN NCCH2COOH α-氰基乙酸
b.p: 羧酸 > M 相同的醇。
IR谱:
OH伸缩振动—
二聚体:2500~3300cm-1(宽而散);
单体: 3550cm-1(气态或非极性溶剂的稀溶液)。 C=O伸缩振动——脂肪族羧酸:1700~1725cm-1 芳香族羧酸:1680~1700cm-1
第13章羧酸衍生物

例:
O 2 ( C H 3 C ) 2 O+H O
常 用 酰 基 化 试 剂
O
O HH 2 S O 4
9 3 %
C H 3 C O
O O C C H 3+2 C H 3 C O O H
酚 酯
O
O
H + , 9 4 %
C H 2 = C H - C - O C H 3 + C H 3 C H 2 C H 2 C H 2 O H
第13章羧酸衍生物cyclohexanecarboxylate
多元醇的酯,一般把”酸”名放在后面,称为” 某醇某酸酯”
O
CH2 O
C
CH3
CH2 O
C
CH3
乙二醇二乙酸酯
O
C H 2O N O 2
CHONO2
甘油三硝酸酯
C H 2O N O 2
第13章羧酸衍生物
酰胺的命名:RCONH2
• 酰胺 ×酸 →×酰胺 N-烃基×酰胺 • -ic acid → -amide
沸点: 酰卤、酸酐、酯的沸点低于羧酸; 伯酰胺的沸点高于羧酸。
第13章羧酸衍生物
IR光谱
例1:丙酸酐的红外光谱。 例2:乙酸乙酯的红外光谱。
NMR谱:
例:乙酸乙酯的第核13章磁羧酸共衍振生物谱。
(三) 羧酸衍生物的化学性质
(1)酰基上的亲核取代
(5) 与有机金属试剂的反应
(甲) 水解
(6) 酰氨氮原子上的反应
-carboxylic acid → -carboxamide
O CH 3C NH 2
O C
NH 2
O HCN(C3)H 2
乙酰胺 环戊烷羧酰胺 N,N-二甲基甲酰胺
有机化学第十三章 羧酸及其衍生物
2) 与羰基相连的基团(Y) 空间体积; 3) 与羰基相连的基团(Y)
离去能力; 4) 反应物稳定化程度。
离去基团的离去能力: X- > RCOO- > RO > H2N
O R C Y
OR C Y+
羧酸衍生物亲核取代反应活性顺序:
O O O O > RCNH2 ~ ~ RCN
RCX > RCOCR >
RCH2Cl3 + H2O RCH2CN + H2O RCH2COOR' + H2O ......
RCH2COOH
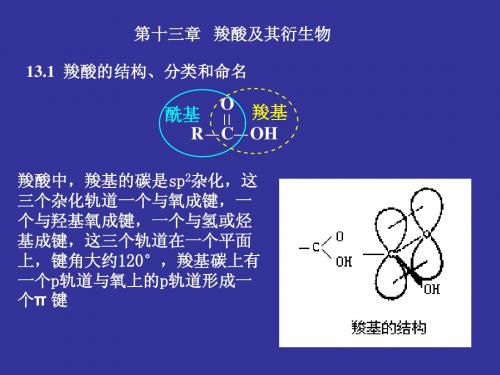
13.3 羧酸的物理性质(P309) 13.4 羧酸的化学性质(P311) 1、酸性和成盐
sp
2
自学
R C
O OH R C
O
O OH
O C O
R C O-
两个碳氧键键长不同
四电子三中心的分子轨道 两个碳氧键键长等同。
O HO HC HOH2C OH
O
CH3
OH
Erythromycin A (红霉素) A
Vitamin C
• 酰胺
CH3 O O HCN-CH3 CH3
N,3-二甲基戊酰胺 N,N-二甲基甲酰胺
COOH
CH3CH2CHCH2CNHCH3
NHCOCH3
4-乙酰氨基-1萘羧酸
氮原子上有取代基, 在取代基名称前加N标出。
O NH R O R-C-NH N O S CH3 CH3 COOH
R=C6H5CH2(penicillin G)
γ -内酰胺
青霉素 ( penicillin )
物理性质(自学)
13.9 羧酸衍生物的物理性质
有机化学第十三章 羧酸衍生物

△
O R-C-NR2 + H2O
四、羧酸衍生物的化学性质
O 由于羧酸衍生物都含有酰基( R-C- )的共同结构, 由于羧酸衍生物都含有酰基( 的共同结构, 羧酸衍生物都含有酰基 化学性质方面有很多相似之处 所以在化学性质方面有很多相似之处,但由于所连接的负 所以在化学性质方面有很多相似之处,但由于所连接的负 性基团的不同 而具有不同的性质 对于同一种反应, 的不同, 性质, 同一种反应 性基团的不同,而具有不同的性质,对于同一种反应,其 活性也有差别 也有差别。 活性也有差别。 羧酸衍生物的结构和反应性能
酯
C-O 伸缩振动: 1100~1300 伸缩振动: ~ N-H伸缩振动: 3300~3500(弱) 伸缩振动: 伸缩振动 ~ ( N-H弯曲振动: 1600 伯酰胺二 弯曲振动: 弯曲振动 ~ ~1640 个特征峰 C-N伸缩振动:~1400 伸缩振动: 伸缩振动
酰胺
1630 ~1690
}
核磁共振: 核磁共振: O CH3-C-Y
酰卤
脂肪: 脂肪:1800 ~ 1825 芳香或不饱和: 芳香或不饱和:1750~1785 ~ 1850~1800 ~ 1780~1740 }双峰 ~ 脂肪: 脂肪:1735~1750 ~ 芳香或不饱和: 芳香或不饱和:1715~1730 ~ C-O 伸缩振动: 1045~1300 伸缩振动: ~
酸酐
770 670
3005cm-1为 1640cm-1
C H 伸缩振动
1680cm-1为 C=O伸缩振动 伸缩振动
3500cm-1 为 N -H伸缩振动 伸缩振动 -1 为 C C 伸缩振动 -1 3200cm 1485cm 1400cm-1为 C-N弯曲振动 弯曲振动 -1 770cm 为 C H 一取代弯曲振动 1640cm-1 为 N -H弯曲振动 弯曲振动 670cm-1 -1 1600cm
有机化学:第十三章羧酸及其衍生物

2. 酸酐的生成
用P2O5作脱水剂制备酸酐
O CH3 C OH O O P2O5 CH3 C O O C CH3
+
HO
C CH3
+
H2O
用低沸点酸酐作脱水剂制备较高沸点的酸酐
O 2 COOH + (CH3CO)2O
(
C
) 2O + 2 CH COOH
3
能形成五元、六元环酸酐的二元羧酸可直接加热制备酸酐
羧酸与PX3 、PCl5(X=Cl、Br)、SOCl2反应
3CH3COOH + PCl3
3 CH3 COCl + H3PO3
COOH+PCl5
(CH3)2CHCH2COOH + SOCl 2
COCl + POCl3+ HCl
(CH3)2CHCH2COCl
+
SO2
+ HCl
注:HX不能与羧酸反应生成酰卤 。 应用:酰卤的反应活性比较高,广泛应于药物合成中 。
( 2)编号:从羧基碳原子开始用阿拉伯数字编号,按所含碳原
子数目称为某酸,取代基名称及位次写在某酸之前。
( 3)简单的酸酸,常用希腊字母表明取代基的位置,从羧基相 邻碳原子开始编号为 ,依次为 、 、 等,将编号写在取代基 名称前面。
CH3CH2CHCH2COOH CH3
-甲基戊酸(3-甲基戊酸)
第十三章
羧酸及其衍生物 主要内容
1、掌握羧酸和取代羧酸的结构、命名和化学性质 2、掌握羧酸衍生物的结构、分类及命名和化学性质
3、熟悉羧酸和取代羧酸的物理性质
4、掌握羟基酸、酮酸的命名及主要化学性质。
羧酸:
羧酸的衍生反应方程式总结

羧酸的衍生反应方程式总结羧酸是一类含有羧基(-COOH)的有机化合物,它们在化学反应中常常经历各种衍生反应。
羧酸的衍生反应方程式既包括它们与其他化合物之间的反应,也包括它们之间的内部反应。
本文将对羧酸的常见衍生反应方程式进行总结,以便更好地理解和应用这些反应。
一、酯化反应酯化反应是羧酸最常见的衍生反应之一,它与醇或酚反应生成酯。
酯化反应的方程式一般如下所示:RCOOH + R′OH → RCOOR′ + H2O其中RCOOH代表羧酸,R′OH代表醇或酚,RCOOR′代表酯,H2O 代表水。
在这个反应中,羧酸中的羧基(-COOH)与醇或酚中的氢氧根离子(-OH)发生酸碱中和反应,生成水,并生成一个酯分子。
二、酰氯化反应酰氯化反应是羧酸中的羧基与氯化物反应生成酰氯的反应。
它的方程式一般如下:RCOOH + SOCl2 → RCOCl + SO2 + HCl其中RCOOH代表羧酸,SOCl2代表硫酰氯,RCOCl代表酰氯,SO2代表二氧化硫,HCl代表盐酸。
在这个反应中,羧酸中的羧基与硫酰氯反应生成酰氯,并产生二氧化硫和盐酸作为副产物。
三、酰溴化反应酰溴化反应是羧酸中的羧基与溴化物反应生成酰溴的反应。
它的方程式一般如下:RCOOH + PBr3 → RCOBr + HBr + POBr3其中RCOOH代表羧酸,PBr3代表溴化亚磷,RCOBr代表酰溴,HBr代表溴化氢,POBr3代表溴化亚磷酸。
在这个反应中,羧酸中的羧基与溴化亚磷反应生成酰溴,并产生溴化氢和溴化亚磷酸作为副产物。
四、酰胺化反应酰胺化反应是羧酸中的羧基与胺反应生成酰胺的反应。
它的方程式一般如下:RCOOH + R′NH2 → RCONHR′ + H2O其中RCOOH代表羧酸,R′NH2代表胺,RCONHR′代表酰胺,H2O 代表水。
在这个反应中,羧酸中的羧基与胺反应生成酰胺,并产生水作为副产物。
五、羧酸的还原反应羧酸在还原剂的作用下可以发生还原反应,将羧基(-COOH)还原为醇(-OH)。
有机化学第13章 羧酸衍生物

35
另一方面,乙酰胺的水溶液能与氧化汞作用生成稳定的汞盐。
酰胺与金属钠在乙醚溶液中作用,也能生成钠盐,但它遇水即 分解。这些说明酰胺具有弱酸性。
O C NH C O
邻苯二甲酰亚胺
36
2.酰胺脱水
酰胺与强脱水剂共热或高温加热,则分子内脱水生成腈,这
是合成腈最常用的方法之一。常用的脱水剂有五氧化二磷和亚硫
10
IR:
11
酰卤的C=O伸缩振动在1815~1785cm-1区域有强吸收,其C—X
的面内弯曲振动在645 cm-1附近。
12
酸 酐的 C=O伸 缩 振动 吸 收 与其它 羰 基 化合物 明 显不 同 , 在 1850~1800cm-1和1780~1740 cm-1区域内有两个C=O伸缩振动的强 吸收峰。线型酸酐的高频峰强于低频峰,而环状酸酐则相反。酸酐
26
酰基化试剂中离去基团离去的难易,取决于离去基团(L)的碱 性。碱性愈弱,愈易离去。离去基团L的碱性由弱到强的次序是:
C1—<RCOO—<RO—<NH2—。因此氯原于是最容易离去的基团,
而氨基则是最难离去的基团。即酰氯是最活泼的酰基化试剂,而酰 胺是最弱者。 离去基团碱性的强弱,可从其共轭酸的酸性强弱得知(强酸的 共轭碱是弱碱):
酯的醇解亦称酯交换反应。例如:
21
腈的醇溶液和浓硫酸或盐酸共热,则发生醇解反应得到酯。 例如:
22
3.氨解
酰氯、酸酐和酯与氨或胺作用,都可以生成酰胺。例如:
23
N-未取代的酰胺与胺反应生成N-取代酰胺。例如:
以上这些反应对羧酸衍生物是发生了水解、醇解或氨解;但对 水、醇或氨则是发生了酰基化反应。酰氯、酸酐和酯都是酰基化试 剂,酰胺的酰化能力极弱,一般不用作酰基化试剂。
有机化学第十三章 羧酸衍生物1

要解决的问题:
① 断键方式;
② 反应历程。
1. 碱性水解
实验事实:
(1)断键方式:酰氧键断裂(同位素结果)
(2)反应历程:双分子历程(相关数据) v=k[RCOOR][OH-]
假设——两种可能的历程:
S N 2:
加成-消除:
O HO + R C OMe O R O C OH + OMe
[ R C OMe ] OH
三、酮酯缩合
O H CH2CCH3 O H CH2C OCH2CH3
α-H的活性:
O
酮>酯
O C2H5ONa
O O
CH3COC2H5 + H CH2CCH3
CH3CCH2CCH3
• 完成下列酯缩合反应。
O (1) (2) (3) O
+ C2H5O C OC2H5
O
C2H5ONa
C2H5ONa O + CH3C OC2H5 C6H5C H C6H5CH2CN + COOC2H5 COOC2H5 C2H5ONa
(2) O CH3C OC2H5 + - CH2
消 除 O H3C C CH2
O C OC2H5
O
CH2COOC2H5
-
C OC2H5 + C2H5O
O (3) H3C C
O CH2 C OC2H5 + C2H5ONa
O Na CH
+
O C OC2H5 + C2H5OH
生成乙酰乙酸乙酯促使平衡移动 H3C C
O C OR′ + HX O O C OR′ + HOCR O
H 或 OH R C OR′ + HOR △ O + H 或 OH R C OR′ + NH3 △
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
反应活性较差
叔醇
吡啶
O C OC(CH3)3
不仅起催化作用 还可吸收产生的HCl
2) 酯交换:由低级醇酯制高级醇酯
= H+
CH2 CHCOOCH3 + CH3(CH2)2CH2OH
b.p: 80.5℃ 低沸点酯
= CH2 CHCOO(CH2)3CH3 + CH3OH
b.p: 145℃
b.p: 64.7℃
R C =O > X
=
R C =O
O RC
O
> R C =O > R C =O
OR′
NH2
第二步——取决于离去基团的离去能力。
基团的离去能力:
! 试解释之
X > RCOO > RO > NH2
碱性越小离去能力越强。
碱性强弱:
X < RCOO < RO < NH2
结论:
羧酸衍生物的反应活性顺序为
R C =O > X
== =
== =
O C O C4H9_ n
C OH
O
邻苯二甲酸单正丁酯
O CH3 C O CH2 CH3 C O CH2
O
乙二醇二乙酸酯
CH2OCOR CHOCOR'
甘油三酯:脂肪和油
CH2OCOR''
O
H3C
CH3
H3C
HO H3CH2CH
OH O
O
CH3
CH3 OH HO O
O O
N(CH3)2
青霉素 ( penicillin )
酸酐:两个羧酸名加“酐”字。
O
OO
OO
COC
CH3COCCH2CH3
O
苯甲(酸)酐
乙(酸)丙(酸)酐
O
顺丁烯二酸酐
(马来酸酐)
酯:根据酸和醇名,称为“某酸某酯”。
多元醇酯称为某醇某酸酯。
O H C O CH2CH3
O C6H5 C O CH2C6H5
甲酸乙酯
苯甲酸苄酯
R C =O
NH2
接受质子的能力 ∴酰胺碱性很弱
碱性 NH3 > RCONH2
C =O
N
H
H
诱导效应的影响
使H原子解离的趋势
其酸性也很弱
酰胺是中性化合物 它不能使石蕊变色
= =
= =
RCONH2
乙醚
+ HCl(气体)
RCONH2 ·HCl ↓
=O
:N H
酰亚胺 酸性明显
O
=O
N H + KOH O
1790~1740
1300~1050 1300~1000
1400~1300 3350~3180
酰胺中氮上的质子,其吸收峰宽而矮,δ=5~9.4。
13.4 羧酸衍生物的化学性质
结构分析:
=
= == = =
O RCH2 C X
OO RCH2 C O C R
O RCH2 C OR'
O RCH2 C NH2(R')
环己基甲酰胺
CH3 C =O
NHCH 3
N _ 甲基乙酰胺
O H C N CH3
氮原子上有取代基, 在取 代基名称前加N标出
CH3
N,N-二甲基甲酰胺(DMF)
CO NH
CO
邻苯二甲酰亚胺
CH2 CO NCH3
CH2 CO
N_甲基丁二酰亚胺
O NH
R
γ-内酰胺
O R-C-NH
S CH3
N O
CH3 R=C6H5CH2COOH (penicillin G)
R C NH2
RCH2NH2
不还原 C、C不饱和键
= = C LiAlH4 ② H3O+
CH3CH
CHCH2CH2OH + CH3OH
活性 NaBH4 < LiAlH4 只还原酰卤为醇
O
RC
Cl
① NaBH4 ② H3O+
RCH2OH
2. 用金属钠-醇还原
O R C OR′ Na-C2H5OH RCH2OH + R′OH
OC
CH2
O
HN C O
2. 脱水反应
O R C NH2
P2O5
脱水剂: P2O5、 SOCl2 (分子内脱水)
RCN H3+ O RCOOH
可由酰胺制腈、酸
=
=
O
CH3CH2CH2CH2 CH C NH2
SOCl2 / C6H6 75~80℃
CH2CH3
3. Hofmann降解反应
CH3CH2CH2CH2 CH C N CH2CH3
O
H
C
OC2H5 +C2H5MgX
(1)干醚 (2)H3O+
? 与酮+R’MgX的区别
OH
H C C2H5
C2H5 对称仲醇
即:甲酸酯 → 制 2°醇. 两个烃基都来自R’MgX
其他羧酸酯 → 制 3°醇.其中的两个烃基来自R’MgX
酰氯与有机镉、二烷基铜锂作用合成酮。
酰胺的特殊反应 1. 酰胺的酸碱性
COOCH3
B>A>C>D
还原反应 1. LiAlH4还原
除酰胺 还原得到 1°、2°or 3°胺外,
酰卤、酸酐、酯
的还原
都得到醇。 O
R C Cl
RCH2OH + HCl
OO
R C O C R′ O
R C OR′ O
(1)LiAlH4 (2)H2O
RCH2OH + R′CH2OH RCH2OH + R′OH
?! 有何意义(反应多一步)
酯的醇解又有何意义
= =
=
O R C OH
天生我材 必有用
应用:1)制备用羧酸和醇或酚难得到的酯 ——
=
=
=
三级醇的酯、酚酯。用酰氯或酸酐:
(CH 3)3CCOOH 位阻大
SOCl2 (CH 3)3CCOCl
C6H5O H 吡啶
O (CH3)3C C OC6H5
O
C Cl + HOC(CH3)3
基—称酰基化反应。酰氯、酸酐的酰化能力最强,是常
用的酰基化试剂。
比较下列酯类水解的活性大小:
(1) (A) O2N
COOCH3
(B)
COOCH3
(C) H3CO
COOCH3
(D) Cl
COOCH3
A>D>B>C
(2) (A)
COOCH3
(B) O2N
COOCH3
(C) H3C
COOCH3
(D) H2N
第十三章 羧酸衍生物
13.1 羧酸衍生物的命名
酰卤和酰胺: 酰基名加卤素名或胺名;即将酸→酰卤
或酰胺。
CH3CH C =O Br CH3
2 _ 甲基丙酰溴 或 异丁酰溴
C =O
Cl
环戊基甲酰氯
CH3CH =CH C =O Cl 2 _ 丁烯酰氯 CH2=CH C =O NH2 丙烯酰胺
C =O
NH2
OH- RCOO- + R'OH
or H碱+ 性条件下水解—皂化反应
HCl
RCOOH + NH4Cl
NaOH
RCOONa + NH3
应用:利用碱性水解的现象和速度鉴别酰氯、
酰胺、酯。
鉴别
CH3COCl
AgNO3
立即AgCl
H2O ClCH2COOH
无
CH3CONH2 CH3COOCH3
O
L= -Cl, -OCR, -NH2, -OR'
影响反应速度的因素:
羰基碳上的正电性和空间效应; 离去基团是否易离去。
反应活性分析 第一步——取决于羰基碳原子的亲电性。
O
RC L
δ+
α C 连有吸电子基团 羰基反应活性
R基团体积 不利于Nu 的进攻 羰基反应活性
= == ==
=
诱导效应 电负性: Cl > O > N
=
H O NH
C
R
R
O =C N H
H
酰胺 > N - 一取代酰胺 > N - 二取代酰胺
引申
HCONH 2
HCONHCH 3
HCON(CH 3)2
b.p(℃)
198
180
153
解释:
氨基上H被取代,分子间的氢键削弱,以 致不能发生氢键缔合,其沸点必然↓。
溶解度
酰卤、酸酐和酯不溶于水,低级酰卤、酸酐遇水则 分解。低级酰胺溶于水,随着M↑,溶解度↓。
H2O OH-,
NH3(使石蕊试纸变蓝) 无现象
鉴 别: 乙酸、乙酰氯、乙酸乙酯、乙酰胺
2. 醇解:产物是酯
O
合成酯
R C Cl
HCl
OO
R C O C R′ O
R C OR′ O
O
O
H
△
R C OR″ + R′ C OH
+ H OR″ H or OH △
R′OH
酯交换
R C NH2
O
O
R C L R'OH R C OR'
共轭效应
O
OO
RC X RCO CR
O
O
R C OR' R C NH2(R')
p-π共轭效应强弱:
R C =O <
R
C =O
O
<R
C =O
