“干细胞及转化研究”试点专项2020 年度项目申报指南
干细胞重点专项2023年度申报指南

干细胞重点专项2023年度申报指南干细胞重点专项2023年度申报指南一、前言干细胞研究一直备受关注,因为它具有巨大的潜力,可以用于治疗许多疾病,重点专项2023年度申报指南正是针对干细胞研究领域的重要文件。
本文将针对该指南进行全面评估,并撰写有价值的文章,以帮助读者更深入地了解干细胞研究的相关内容。
二、干细胞重点专项2023年度申报指南的主要内容1. 申报范围根据干细胞重点专项2023年度申报指南,申报范围主要包括干细胞的基础研究、临床转化研究、临床应用研究等。
申报的研究内容必须与干细胞相关,并具有创新性和前瞻性。
2. 申报条件申报者必须具有相关领域的博士学位,并在相关领域具有一定的研究经验和成果。
申报团队应具备完善的研究条件和设施,保障研究工作的顺利进行。
3. 申报流程申报流程主要包括项目申报、专家评审、资金支持等环节。
申报者需要按照指南要求准备申报材料,并在规定时间内递交。
通过专家评审的项目将获得资金支持,用于开展相关研究工作。
三、干细胞重点专项2023年度申报指南的深度评估与讨论干细胞重点专项2023年度申报指南的发布,标志着我国对干细胞研究的重视和支持。
该指南的出台,有助于推动我国干细胞研究领域的发展,促进干细胞相关技术的应用和推广。
在申报范围方面,指南明确了申报范围,将干细胞的基础研究、临床转化研究、临床应用研究等纳入其中,有利于促进各个领域的交叉与融合。
这对于拓展干细胞研究的广度和深度具有积极意义,有助于挖掘干细胞的潜在应用价值。
在申报条件方面,指南对申报者具有明确的要求,要求申报者具有相关领域的博士学位、研究经验和成果。
这有助于选拔出具有一定研究实力和水平的团队,有利于确保项目的科学性和可行性。
对申报团队的条件和设施也提出了要求,有助于保障研究工作的进行,有利于项目的有效实施。
在申报流程方面,指南对申报流程进行了详细的规定,包括项目申报、专家评审、资金支持等环节。
这有助于提高申报工作的规范性和透明度,有利于确保申报工作的公平和公正。
(word完整版)国家重点研发计划干细胞与转化医学重点专项实施方案

国家重点研发计划干细胞与转化医学重点专项实施方案(征求意见稿)一、意义和必要性干细胞是能自我更新、高度增殖的一类细胞,可以进一步分化成为各种不同的组织细胞,干细胞研究及其转化应用为许多重大疾病的有效治疗提供了新的思路和工具,具有巨大的社会效益和经济效益.干细胞不仅可以用于组织器官的修复和移植治疗,还将促进基因治疗、基因组与蛋白质组研究、系统生物学研究、发育生物学研究、新药开发与药效、毒性评估等领域的发展。
目前,干细胞研究及其转化医学已经成为各国政府、科技和企业界高度关注和大力投入的重要研究领域,成为代表国家科技实力的战略必争领域。
尽管中国在干细胞研究领域已经取得了长足的进步,获得了一批创新性研究成果,但在干细胞基础理论、核心技术及转化应用方面与美国等发达国家还存在一定差距,亟需国家在干细胞基础与转化方面持续加强投入与布局,整体提升我国在干细胞及其转化应用领域的核心竞争力.二、国内外现状和发展趋势干细胞及其转化应用是生命科学与生物技术研究的前沿和制高点,具有重要的科学意义和广阔的应用前景.近年来,干细胞研究取得了许多重要成果,干细胞调控的基本原理不断丰富,相关技术不断更新,临床转化成果逐步涌现,论文和专利数量逐年上升.干细胞移植在治疗神经、血液、及自身免疫疾病等方面已经取得了一系列进展,逐渐呈现出两个明显的态势:一是干细胞的基础研究逐步深入,包括细胞命运调控、功能细胞获得、组织工程器官再造相关机理研究需求日益迫切;二是干细胞研究成果的转化步伐正在日益加快,一批干细胞相关产品已经进入临床实验,甚至已经上市,但是,规模化的干细胞转化应用在临床上尚未实现。
因此,系统化的干细胞基础研究、研究成果的产业化和临床转化研究亟待加强.我国在干细胞与再生医学领域经过多年发展,已经在细胞重编程、干细胞技术、特色性动物资源等领域打下了良好的基础,干细胞领域论文与专利在国际上排名大幅提升,但在干细胞转化研究领域的核心技术与成果略显不足,目前尚无规范化的干细胞转化应用和干细胞相关产品面世。
干细胞临床研究基地标准及申报说明

干细胞临床研究基地标准及申报说明第一篇:干细胞临床研究基地标准及申报说明来自干细胞之家最近看了干细胞临床研究基地遴选标准,发现够条件的医院不多,这意味着大部分医院不能开展干细胞临床治疗研究。
对于临床研究主要负责人的要求有些过严,既是临床正高医师,又是承担国家研究课题、发表干细胞相关SCI论文,这要求临床医师是研究型的医师,要有很高的研究能力,只有大型医院才具备条件。
部分遴选标准如下:干细胞临床研究基地遴选标准和申报说明一、遴选标准(一)基本条件1、三级甲等医院;2、已获得国家食品药品监督管理局颁发的《药物临床试验机构资格认定证书》,申请资格认定的专业应与药物临床试验机构资格认定的专业一致;3、临床研究主要负责人有干细胞或细胞研究的工作经历,具有正高级专业技术职称,其医师执业资格与申请资格认定的专业一致(二)优选条件1、具备独立开展干细胞制品质量评价鉴定能力,包括:1)具备开展干细胞制品质量评价、鉴定的实验室;2)承担干细胞制品质量评价、鉴定的人员必须具有通过相关培训并取得相关资格;2、申请资格认定的专业已被认定为国家重点学科;3、承担过“863”、“973”、国家自然科学基金或“国家科技重大专项”等国家级的干细胞相关研究课题;4、承担过国家食品药品监督管理局批准的干细胞临床试验;5、临床研究主要负责人具备下列条件之一:1)作为项目负责人主持过干细胞或细胞研究方面的国家级科研项目;2)以通讯作者或第一作者身份发表过有关干细胞或细胞研究的SCI文章;3)出版过干细胞或细胞研究的著作。
以下是需要的申报材料和申报程序,恐怕只有大型医院能开展干细胞临床试验研究了,一些干细胞公司只能和大医院合作啦,一些以营利为目的的小型医院看来不能开展干细胞临床治疗研究了,但是投资商已经投入了,GMP实验室也建好了,投资商该如何减少损失呢?二、申报材料1、干细胞临床研究基地的申报单位根据《干细胞临床研究基地管理办法》准备材料,并填写《干细胞临床研究基地资格认定申请表》(附件1)。
干细胞重点专项2023年度申报指南

干细胞重点专项2023年度申报指南
摘要:
一、干细胞研究的重要性和应用前景
二、2023 年度干细胞重点专项申报指南发布
三、申报指南的主要内容概述
四、申报要求与条件
五、申报截止时间和评审流程
六、干细胞研究的未来发展方向
正文:
干细胞研究在医学领域具有重要的价值和广泛的应用前景,可以用于治疗许多疾病,如糖尿病、心脏病、中风等。
为此,我国在干细胞研究方面加大了投入力度,并发布了干细胞重点专项2023 年度申报指南,以推动干细胞研究的进一步发展。
2023 年度干细胞重点专项申报指南的发布,旨在引导和鼓励国内相关领域的科研人员积极申报干细胞研究项目,提升我国干细胞研究的整体水平。
申报指南主要包括以下内容:研究目标、研究内容、申报要求、申报条件、申报截止时间、评审流程等。
首先,干细胞重点专项的研究目标集中在干细胞的生物学特性、干细胞与微环境相互作用、干细胞定向分化及调控等方面的基础研究,以及干细胞治疗、干细胞药物研发、干细胞移植等方向的应用研究。
其次,申报指南对申报要求进行了详细说明,包括项目申报单位的要求、
项目负责人资格、项目团队成员要求等。
同时,申报条件也进行了明确,如项目应具备一定的创新性、可行性、实用性,以及具备一定的科研基础等。
此外,申报截止时间和评审流程也在指南中进行了明确规定。
申报截止时间为2023 年X 月X 日,评审流程包括形式审查、专家评审、答辩评审等环节。
在未来,干细胞研究将继续深入挖掘其在医学领域的应用价值,同时在药物研发、组织工程等领域取得更多的突破。
怎么申请书干细胞

怎么申请干细胞?1. 引言干细胞是一种具有自我复制和分化能力的细胞,具有广泛的应用前景,如组织再生、疾病治疗等。
如果你对干细胞感兴趣,并希望申请相关的研究或治疗项目,本文将为你提供一些有关如何申请干细胞的指导。
2. 干细胞申请流程下面是一般干细胞申请的基本流程:2.1 寻找合适的研究或治疗项目在申请干细胞之前,首先需要寻找合适的研究或治疗项目。
可以通过以下途径进行搜索: - 学术期刊:阅读相关领域的学术期刊,了解最新的研究进展和项目信息。
- 学术会议:参加相关领域的学术会议,与专家学者交流,获取项目信息。
- 机构网站:浏览大学、医院等机构的官方网站,查找他们的研究或治疗项目。
2.2 联系相关机构或团队一旦找到感兴趣的项目,可以通过以下方式联系相关机构或团队: - 通过电子邮件或电话联系负责人:在项目介绍中通常会提供负责人的联系方式,可以直接与其沟通。
- 通过机构网站上的联系表格:填写相关信息,并说明你的兴趣和动机,提交给机构或团队。
2.3 提交申请材料一般而言,干细胞申请需要提交一些必要的材料,如: - 个人简历:包括学习经历、科研经历以及相关技能和成果。
- 推荐信:可以向老师、导师或领导申请推荐信,以证明自己的能力和潜力。
- 研究计划或个人陈述:详细说明自己对干细胞研究或治疗的兴趣和动机,以及自己的学术或专业背景。
- 学术成果:如发表的论文、参与的研究项目等,证明自己在相关领域有一定的能力和经验。
2.4 等待审批结果提交申请后,需要等待机构或团队的审批结果。
审批的时间可能会有所不同,一般会根据申请人的资质和项目需求来决定。
在等待的过程中,可以继续关注相关领域的学术动态,增加自己的专业知识。
3. 注意事项在申请干细胞时,还需要注意以下几点:3.1 合法合规确保申请的研究或治疗项目是合法合规的,符合相关的法律法规和伦理要求。
干细胞研究和治疗涉及到伦理和安全等方面的问题,因此必须要遵循相关的规定和标准。
国家重点研发计划干细胞与转化医学重点专项实施方案

国家重点研发计划干细胞与转化医学重点专项实施方案(征求意见稿)一、意义和必要性干细胞是能自我更新、高度增殖的一类细胞,可以进一步分化成为各种不同的组织细胞,干细胞研究及其转化应用为许多重大疾病的有效治疗提供了新的思路和工具,具有巨大的社会效益和经济效益。
干细胞不仅可以用于组织器官的修复和移植治疗,还将促进基因治疗、基因组与蛋白质组研究、系统生物学研究、发育生物学研究、新药开发与药效、毒性评估等领域的发展。
目前,干细胞研究及其转化医学已经成为各国政府、科技和企业界高度关注和大力投入的重要研究领域,成为代表国家科技实力的战略必争领域。
尽管中国在干细胞研究领域已经取得了长足的进步,获得了一批创新性研究成果,但在干细胞基础理论、核心技术及转化应用方面与美国等发达国家还存在一定差距,亟需国家在干细胞基础与转化方面持续加强投入与布局,整体提升我国在干细胞及其转化应用1领域的核心竞争力。
二、国内外现状和发展趋势干细胞及其转化应用是生命科学与生物技术研究的前沿和制高点,具有重要的科学意义和广阔的应用前景。
近年来,干细胞研究取得了许多重要成果,干细胞调控的基本原理不断丰富,相关技术不断更新,临床转化成果逐步涌现,论文和专利数量逐年上升。
干细胞移植在治疗神经、血液、及自身免疫疾病等方面已经取得了一系列进展,逐渐呈现出两个明显的态势:一是干细胞的基础研究逐步深入,包括细胞命运调控、功能细胞获得、组织工程器官再造相关机理研究需求日益迫切;二是干细胞研究成果的转化步伐正在日益加快,一批干细胞相关产品已经进入临床实验,甚至已经上市,但是,规模化的干细胞转化应用在临床上尚未实现。
因此,系统化的干细胞基础研究、研究成果的产业化和临床转化研究亟待加强。
我国在干细胞与再生医学领域经过多年发展,已经在细胞重编程、干细胞技术、特色性动物资源等领域打下了良好的基础,干细2胞领域论文与专利在国际上排名大幅提升,但在干细胞转化研究领域的核心技术与成果略显不足,目前尚无规范化的干细胞转化应用和干细胞相关产品面世。
上海市科委关于组织申报国家重点研发计划干细胞及转化研究等重点专项2017年度项目的通知-地方规范性文件

综合法律门户网站
法律家·法律法规大全提供最新法律法规、司法解释、地方法规的查询服务。
法律家 上海市科委关于组织申报国家重点研发计划干细胞及转化研究
等重点专项2017年度项目的通知
各有关单位:
根据《科技部关于发布国家重点研发计划干细胞及转化研究等重点专项2017年度项目申报指南的通知》(国科发资〔2016〕304号)、《科技部关于发布国家重点研发计划大气污染成因与控制技术研究等重点专项2017年度项目申报指南的通知》(国科发资〔2016〕305号)和《科技部关于发布国家重点研发计划新能源汽车等重点专项2017年度项目申报指南的通知》(国科发资〔2016〕308号)的有关要求(详见附件),为做好本市国家重点研发计划干细胞及转化研究等重点专项的申报及推荐工作,特通知如下。
请各申报单位按照科技部申报通知要求,完成网上申报,并将加盖申报单位公章的项目预申报书(网上通过系统直接生成打印,纸质,一式一份),按照下表要求的时间送达上海市钦州路100号1号楼上海市科委办事大厅。
我委将按照申报通知要求完成审核工作。
审核通过的,预申报书不需再取回;对未通过审核的,我委将通知申报负责人,退回预申报书。
(注:办事大厅不接收以邮寄或快递方式送达的书面材料。
工作日办公时间:9:00-16:30,联系人:曹飞宇,电话:8008205114(座机)4008205114(手机))
来源: /fg/detail2029235.html。
关于国家重点研发计划重点专项-中国生物技术发展中心
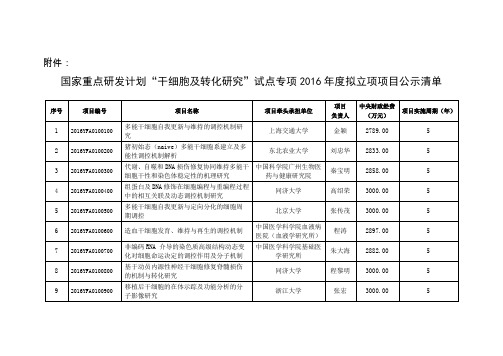
附件:国家重点研发计划“干细胞及转化研究”试点专项2016年度拟立项项目公示清单序号项目编号项目名称项目牵头承担单位项目负责人中央财政经费(万元)项目实施周期(年)1 2016YFA0100100 多能干细胞自我更新与维持的调控机制研究上海交通大学金颖2789.00 52 2016YFA0100200 猪初始态(naive)多能干细胞系建立及多能性调控机制解析东北农业大学刘忠华2833.00 53 2016YFA0100300 代谢、自噬和DNA损伤修复协同维持多能干细胞干性和染色体稳定性的机理研究中国科学院广州生物医药与健康研究院秦宝明2858.00 54 2016YFA0100400 组蛋白及DNA修饰在细胞编程与重编程过程中的相互关联及动态调控机制研究同济大学高绍荣3000.00 55 2016YFA0100500 多能干细胞自我更新与定向分化的细胞周期调控北京大学张传茂3000.00 56 2016YFA0100600 造血干细胞发育、维持与再生的调控机制中国医学科学院血液病医院(血液学研究所)程涛2897.00 57 2016YFA0100700 非编码RNA 介导的染色质高级结构动态变化对细胞命运决定的调控作用及分子机制中国医学科学院基础医学研究所朱大海2882.00 58 2016YFA0100800 基于动员内源性神经干细胞修复脊髓损伤的机制与转化研究同济大学程黎明3000.00 59 2016YFA0100900 移植后干细胞的在体示踪及功能分析的分子影像研究浙江大学张宏3000.00 510 2016YFA0101000 干细胞移植的分子免疫调控机理与关键技术在免疫相关疾病临床转化治疗中的新策略及应用中国医学科学院基础医学研究所赵春华3000.00 511 2016YFA0101100 基于自体干细胞心脏瓣膜的构建华中科技大学董念国2892.00 512 2016YFA0101200 组织干细胞的正常发育、变异及肿瘤干细胞形成机制中国人民解放军第三军医大学卞修武2732.00 513 2016YFA0101300 神经系统和心脏相关重大疾病组织干细胞和病理组织库同济大学康九红3000.00 514 2016YFA0101400 靶向基因编辑建立神经系统疾病猴模型及干细胞治疗研究昆明理工大学牛昱宇2915.00 515 2016YFA0101500 临床级别干细胞标准化评估体系中国食品药品检定研究院袁宝珠2707.00 5国家重点研发计划“干细胞及转化研究”试点专项2016年度拟立项项目公示清单(青年科学家项目)序号项目编号项目名称申报单位项目负责人中央财政经费(万元)项目实施周期(年)1 2016YFA0101600 血管微环境对肺干细胞在再生中的调控四川大学丁楅森600.00 52 2016YFA0101700 成体干细胞诱导分化角膜上皮样干细胞与角膜重建中山大学欧阳宏500.00 5序号项目编号项目名称申报单位项目负责人中央财政经费(万元)项目实施周期(年)3 2016YFA0101800 多能干细胞Naive与Primed状态的表观遗传调控机制研究复旦大学蓝斐589.00 54 2016YFA0101900 多能干细胞的干性维持和神经分化过程中囊泡转运的分子机理及调控机制的研究清华大学姚骏476.00 55 2016YFA0102000 病理性骨髓微环境中造血干细胞的生物学行为及命运决定的规律研究上海交通大学段才闻578.00 56 2016YFA0102100 组织特化内皮祖细胞与肝血窦微环境相互作用及其调控机制的研究中国人民解放军第四军医大学王琳536.00 57 2016YFA0102200 利用体内微环境实现糖尿病中胰岛细胞转分化再生的机制研究同济大学李维达600.00 58 2016YFA0102300 多能干细胞向内皮前体分化的协同调控机制研究中国医学科学院基础医学研究所杨隽600.00 59 2016YFA0102400 肿瘤干细胞命运决定中表观遗传调控机制的研究天津医科大学王艳416.00 510 2016YFA0102500 利用iPSC 来源干细胞探讨微环境在ALS 疾病发生与损伤修复中的作用华中科技大学同济医学院附属同济医院陈红359.00 5。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
“干细胞及转化研究”试点专项
2020年度项目申报指南
干细胞及转化研究试点专项是根据《国家中长期科技发展规划纲要(2006~2020年)》部署和《国务院关于深化中央财政科技计划(专项、基金等)管理改革的方案》的安排率先设立的国家重点研发计划专项,按创新链部署了8个方面的任务。
2020年,拟优先支持9个研究方向。
同一指南方向下,原则上只支持1项,仅在申报项目评审结果相近,技术路线明显不同时,可同时支持2项,并建立动态调整机制,根据中期评估结果,再择优继续支持。
国拨总经费2.40亿元(其中,拟支持青年科学家项目6个,国拨总经费不超过3600万元)。
申报单位根据指南支持方向,面向解决重大科学问题和突破关键技术进行一体化设计。
鼓励围绕一个重大科学问题或重要应用目标,从基础研究到应用研究全链条组织项目。
鼓励依托国家重点实验室等重要科研基地组织项目。
项目应整体申报,须覆盖相应指南方向的全部考核指标。
项目执行期一般为5年。
一般项目下设课题数原则上不超过4个,每个项目参与单位数控制在4个以内。
青年科学家项目不再下设课题,可参考指南支持方向(标*的
—1—
方向)组织项目申报,但不受研究内容和考核指标限制。
本专项所有涉及人体被试和人类遗传资源的科学研究,须尊重生命伦理准则,遵守《涉及人的生物医学研究伦理审查办法》《中华人民共和国人类遗传资源管理条例》等国家相关规定,严格遵循技术标准和伦理规范。
涉及实验动物和动物实验,要遵守国家实验动物管理的法律、法规、技术标准及有关规定,使用合格实验动物,在合格设施内进行动物实验,保证实验过程合法,实验结果真实、有效,并通过实验动物福利和伦理审查。
1.多能干细胞的建立与干性维持
1.1多能干细胞的谱系分化过程与细胞命运决定*
研究内容:体内多能干细胞谱系发生的动态过程、关键节点及调控机制。
考核指标:建立多能干细胞谱系分化的在体模型,对体内2~3种多能干细胞(涉及3种以上子代细胞)命运决定过程进行单细胞分辨率的全谱系追踪;建立动态的谱系与功能检测及关联分析方法;鉴定上述过程中细胞命运决定的关键节点并揭示其调控机制。
1.2细胞命运调控中的间质状态和上皮状态间转变*
研究内容:重编程、分化、转分化以及其他生理病理过程中细胞在间质和上皮状态间的转变及功能。
考核指标:在上述过程中,研究细胞在间质和上皮状态间转变调控细胞命运、细胞周期、细胞代谢、细胞功能等的潜在新机制,阐明3~5种关键因子的功能及其调控网络;发现可以调控细—2—
胞在间质和上皮状态间转变的4~6种小分子化合物;发现并鉴定2~3种新的细胞类群;建立调控特殊细胞类群功能的3~5种新技术,并进行潜在应用的验证。
1.3胚层特异干细胞的建立与调控*
研究内容:建立胚层特异干细胞的获取和维持方法,阐明干细胞类型转换的基本调控模式。
考核指标:建立从多能干细胞获取并维持某种功能完整的胚层特异干细胞的技术方法,该细胞至少能继续分化为功能完整的两种下游细胞;发现上述胚层特异干细胞与其母细胞的关键差异调控因子4~6个,阐述3~5个染色质结构、相分离调控和表观遗传等差异调控机制,总结出基本调控模式。
2.基于干细胞的组织和器官的功能再造
2.1干细胞模拟发育*
研究内容:利用干细胞在体外构建模拟胚胎发育和器官发生形成的系统。
考核指标:通过上述体外系统,阐明2~3种胚胎发育、器官发生形成的机制,指导干细胞体外建成具有胚胎、器官性质的复杂功能单元;通过体内体外分化以及损伤、重建、修复等手段,评估其功能及模拟胚胎和器官的效果,揭示系统形成中不同细胞间的协同调节机制。
2.2干细胞治疗产品规范化生产及质量评价的转化研究
研究内容:基于安全、有效和质量可控的原则,建立几类治疗
—3—
用干细胞的生产工艺,确定工艺的关键质量参数(CQA)及关键工艺控制点(CPP),建立各工艺阶段的评价指标及评价标准。
结合生产工艺研制干细胞治疗产品规模化制备装备。
针对不同适应症,发掘能用于评价治疗效能的分子标志,对工艺和装备进行系统评价。
考核指标:至少完成3种干细胞的生产工艺的规范化研究,并确定3~5个生产工艺关键控制点及关键质量参数,获得1~2种可用于评价与适应症相关的有效性标志分子;至少形成1~2种可公开、可共享的用于临床研究的干细胞生产工艺共识或技术要求;自主研制1种干细胞治疗产品自动化、封闭式、规模化制备的设备,并初步应用于至少1种干细胞制备;至少完成2~3种干细胞治疗产品的质量评价及临床前安全性评价;至少有1~2种干细胞产品申请临床研究或临床试验。
有关说明:由具有干细胞生产基础且已有产品用于临床研究备案或申报药品的企业牵头申报,其它经费(包括地方财政经费、单位出资及社会渠道资金等)与中央财政经费比例不低于2:1。
3.利用动物模型开展高效的干细胞临床前评估
3.1重大疾病干细胞治疗的临床前研究
研究内容:建立与人类重大疾病进程更为相似的动物模型,开展干细胞治疗的在体安全性、有效性评价和治疗机制研究,为干细胞产品开发和临床方案制定提供支撑。
考核指标:针对2种重大疾病,建立适合开展干细胞治疗临床前评价研究的大动物模型,形成具有自主知识产权的模型制备—4—
方法,获得相关专利;开展疾病致病机制研究,结合模型建立该系统疾病进程和治疗效果的评估体系,发现可能的新机制和新方法;评价2种以上干细胞治疗产品或者干细胞疗法的有效性和安全性,形成可用于申报干细胞产品注册或临床研究备案的系统化、规范化数据资料。
4.干细胞临床研究
4.1细胞移植治疗消化系统或代谢系统重大疾病
4.2细胞移植治疗自身免疫性重大疾病
4.3细胞移植治疗罕见病/单基因遗传病
研究内容:针对指南方向4.1、4.2、4.3的重大疾病或罕见病,以研制细胞治疗药物为目标,利用自体功能细胞、临床级干细胞或基因工程改造细胞等开展合规的临床前及临床研究。
考核指标:针对目标疾病,建立治疗用细胞治疗产品的生产工艺;在对细胞治疗产品安全性和有效性进行系统临床前评价基础上,实施至少1种细胞治疗产品的临床研究,形成细胞移植治疗重大疾病的标准化方案,获得不少于1项细胞治疗产品临床试验批件,申请或获得1项新药注册。
有关说明:申报单位中至少一家是国家卫生与健康委员会/药品监督管理局或军委后勤保障部卫生局公布的干细胞临床研究备案机构;在同等条件下,在上述机构已备案的项目优先;鼓励产、学、研、医联合申报;其它经费(包括地方财政经费、单位出资及社会渠道资金等)与本项目资助经费比例不低于2:1。
—5—。
