元素及其化合物转化关系图
铝三角及其图像

Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0 1 2 3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3— n[Al(OH)3] ↓ 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
铝及其重要化合 物之间的转化
Al
① ②
Al2O3
④ ⑥ ⑨ ⑧ Al3+ ③ Al(OH)3 ⑿ ⒀
⑤ ⑦
⑩ ⑾ AlO2
点燃
①4Al+3O === 2 Al O 2 2 3
② 2Al O =4Al+ 3O ↑ 2 3 2 △ ③ ④ 2Al+6H+=2Al3++3H2↑
电解
2Al(OH)3=Al2O3+3H2O
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量 若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。 (1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
溶液用于溶解 Al(OH) ∴ c(HCl) = n/V =3。 0.800mol/0.10L = 8.00mol/L
(2)8.00 mol· L
(1) 、由题意可知 m[Al(OH)3]=(19.4—11.6)g =7.8g , m[Mg(OH)2] =11.6g,则铝的质量分数为:
元素化合物的转化关系网络图

元素化合物的转化关系、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
(WH 或 AHCIHC1写出图中标号反应的化学方程式或离子方程式。
① 2Na + 02,Na 2O 2 (淡黄色)② 2Na 2O 2 + 2H 2O = 4NaOH + 0 2? 2Na + 2H 2O = 2Na ++ 20H - + H z f③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2?2血2。
2 + 2H 2O = 4Na ++ 4OH -+ O 2 ?④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤ 2NaCl +2 H 2O 通电 2NaOH + H 2 ? + CI 2 ?(氯碱工业) 2C 「+2 H 2O 通电 2OH - + H 2 ? + CI 2 ? ⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3CO 3 + H 2O +CO 2 = 2HCO 3⑦ 2 NaCIO + H 2O +CO 2 = Na 2CO 3+ HCIO 2、铝及其重要化合物间的转化关系。
HC1 出, 通暫熔融陋'NaOHAJ 7冷浓HNOj或浓HjSO, NaOH②钝化④HC1△NaA10a — 或 ⑦NaOH写出图中标号反应的化学方程式或离子方程式。
- 点燃 ① 4AI + 3O 2 2AI 2O 3 ② 2AI + 2NaOH + 2H 2O = 2NaAIO 2 + 3H 2 ? ③ 2AI 2O 3 通电 4AI+3O 2 ? ④ AI 2O 3+6HCI = 2AICI 3+3H 2O⑤ AI 2O 3 + 2NaOH = 2NaAIO 2 +H 2O咼温2AI + Fe 2O 3 2Fe + AI 2O 32AI +2OH - +2H 2O = 2AIO 2 +3H 2 ?+3+AI 2O 3 + 6H = 2AI 3+ 3H 2O AI 2O 3 + 2OH - = 2AIO 2- + H 2O点燃* N«CK>CO Z . H 屮⑥NaCl 工C 2H 5OHC ?H 5ONaC»(OH )2 HCIAICI 3+3NH 3 H 2O = AI(OH) 3 J + 3NH 4CI AICI3 +3NaOH = AI(OH) 3J + 3NaCI AI(OH) 3 +NaOH =NaAIO 2 +2 H 2O AI 3+ +3 AIO 2- +6H 2O = 4AI(OH) 铁及其重要化合物间的转化关系。
硫及其重要化合物框图

硫及其重要化合物一、硫及其化合物转化关系图H3Na SO4 223H22SO4O,燃烧O,催化剂,△NaOH O2BaCl2H2OBaCl2位置---第3周期第ⅥA族物理性质---淡黄色固体;不溶于水,微溶于酒精,易溶于CS2;硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
与金属反应几乎所有金属(重点掌握Na、Al、Fe、Cu、Ag、Hg)与非金属反应(氧气、氢气、碳)硫化学性质与热强碱反应---3S+6NaOH=2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)与氧化性酸反应(浓HNO3、浓H2SO4)黑火药(S+2KNO3+3C=K2S+N2↑+3CO2↑)用途---大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
制法:Fe+H2SO4(稀)=FeSO4+H2S↑(不能用浓H2SO4或硝酸)物理性质---是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
A.可燃性:(两种反应物的量不同,产物不同)B.强还原性:常见氧化剂Cl2、Br2、Fe3+、HNO3、KMnO4、SO2等。
化学性质C.不稳定性D.H2S的水溶液叫氢硫酸,是二元弱酸。
E.特殊性(可用于检验)H2S+Pb(Ac)2=PbS↓+2HAc H2S+CuSO4=CuS↓+H2SO4物理性质---无色、刺激性、有毒气体,密度大,容易液化,易溶于水。
是酸性氧化物,其水溶液叫亚硫酸,亚硫酸是中强酸。
有强还原性(与Cl 2、Br 2、Fe 3+、HNO 3、KMnO 4、HNO 3等氧化剂反应)有一定的氧化性 2H 2S + SO 2 == 3S ↓ +2H 2O有漂白性,红色品红→无色→加热→恢复红色(可逆、非氧化还原反应)工业制法: S+O 2=SO 2 或4FeS 2+11O 2=2Fe 2O 3+8SO 2制法 实验室制法:Na 2SO 3+ H 2SO 4(浓) == Na 2SO 3 + H 2O +SO 2↑或Cu + 2H 2SO 4(浓) === CuSO 4 + 2H 2O + SO 2↑亚硫酸和亚硫酸盐------主要体现是强还原性。
高三化学一轮复习——框图推断

第40讲 必修化学—框图推断[复习目标]通过框图、流程图的推断,加强对元素化合物性质、用途的熟练掌握。
【知识点一】物质转化框图推断——元素及其化合物与化学基本概念、理论综合考查。
[例1].(2011天津)图中X 、Y 、Z 为单质,其他为化合物,它们之间存在着如下转化关系(部分产物已略去)。
其中,A 俗称磁性氧化铁;E 是不溶于水的酸性氧化物,能与氢氟酸反应。
(1)组成Y 的元素在周期表中的位置是 ;M 中存在的化学键类型为 ;R 的化学式为 。
(2)一定条件下,Z 与H 2反应生成ZH 4。
ZH 4的电子式为 。
(3)已知A 与1mol Al 反应转化为X 时(所有物质均为固体),放出a kJ 热量,写出该反应的热化学方程式: 。
(4)写出A 与D 的稀溶液反应生成G 的离子方程式: 。
(5)向含4mol D 的溶液中,逐渐加入X 粉末至过量。
假设生成的气体只有一种,请在坐标系中画出n (X 2+)随n (X )变化的示意图,并标出n (X 2+)的最大值。
[变式练习]1.室温下,单质A ,B ,C 分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。
又知E 溶液是无色的,请回答:(1)A 是 、B 是 、C 是 (请填化学式)。
(2)反应①的化学方程式为: 。
(3)反应④的离子方程式为: 。
n (X 2+)/mol O n (X )/mol(4)简述E溶液中溶质的检验方法:。
[核心突破] 解答无机框图推断题的解题方法:[规律总结1] 具有特征颜色和状态的常见物质1.淡黄色固体:Na2O2、S、AgBr;黑色固体:MnO2、C、CuO、FeO、Fe3O4;紫(黑)色固体:KMnO4、I2;红色固体:Cu、Cu2O、红棕:Fe2O3;绿色:Cu2(OH)2CO3。
有色沉淀:①白色沉淀:H2SiO3、AgCl、BaSO4(不溶于酸)、BaSO3、Mg(OH)2、Fe(OH)2、Al(OH)3、BaCO3、CaCO3、MgCO3等;②(浅)黄色沉淀:AgBr、AgI、S; ③红褐色沉淀:Fe(OH)3;④蓝色沉淀:Cu(OH)2。
铁及其化合物之间的转化关系

知识铺垫
新知预习
自主测试
1.绘制铁及其化合物的“价—类”二维图,并表示各物质之间的转 化关系,示例如下:
知识铺垫
新知预习
自主测试
1.下列物质中,不能由两种单质直接化合得到的是 ( )
A.FeCl2 答案:A
B.CuCl2 C.HCl
D.Na2O2
解析:Fe和Cl2反应生成FeCl3,所以FeCl2不能由两种单质直接化合 得到,A项符合题意;Cu与Cl2反应生成CuCl2,CuCl2能由两种单质直 接化合得到,B项不符合题意;H2、Cl2点燃生成HCl,HCl能由两种单 质直接化合得到,C项不符合题意;Na与O2在加热时生成 Na2O2,Na2O2能由两种单质直接化合得到,D项不符合题意。
知识铺垫
新知预习
自主测试
2.补铁剂中铁元素价态的检验 (1)Fe3+的检验方法很多,但在没有特殊要求的条件下,最好选择 KSCN溶液,此法灵敏且现象明显。 (2)检验Fe2+的最好方法是加KSCN溶液(无明显现象),然后加氯水 (溶液变红色)。 【微思考1】如何检验某铁的氧化物中含有Fe2+? 提示:取少量固体置于试管中,向其中加入稀盐酸配制成溶液,加 入酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明氧化物中含有Fe2+。 【微思考2】碱性氧化物是否都能与水反应生成相应的碱?FeO 与硝酸(具有强氧化性)反应是氧化还原反应吗? 提示:碱性氧化物不一定都能溶于水与水反应,如FeO、Fe2O3都 难溶于水,与水不反应,因此不能与水反应生成相应的碱。FeO具有 还原性,与硝酸反应生成硝酸铁和氮的氧化物,属于氧化还原反应。
铁及其化合物之间的转化关系-PPT课件

探究1
探究2
素养脉络
随堂检测
知识归纳 (1)若溶液中只存在Fe2+,加入氢氧化钠溶液,溶液中出现白色沉 淀并迅速变成灰绿色,最后变成红褐色。若同时存在Fe3+,加入氢 氧化钠溶液生成红褐色沉淀,会掩盖Fe2+的检验。故溶液中有 Fe2+和Fe3+同时存在时不能用氢氧化钠溶液检验Fe2+。 (2)检验某未知溶液中是否含Fe2+时,不能先滴加氯水,后滴加 KSCN溶液。因为若未知溶液中含有Fe3+,滴加KSCN溶液时,溶液 变成红色,会干扰Fe2+的检验。
探究1
探究2
素养脉络
随堂检测
(4)Fe3+→Fe2+:加还原剂,如 Fe、Cu、I-等。Fe+2Fe3+ 3Fe2+,Cu+2Fe3+ Cu2++2Fe2+,2Fe3++2I- 2Fe2++I2。
(5)Fe2+→Fe:加强还原剂,如 Zn、Al、C、CO 等。Zn+Fe2+
Zn2++Fe,CO+FeO Fe+CO2。
知识铺垫
新知预习
自主测试
2.补铁剂中铁元素价态的检验 (1)Fe3+的检验方法很多,但在没有特殊要求的条件下,最好选择 KSCN溶液,此法灵敏且现象明显。 (2)检验Fe2+的最好方法是加KSCN溶液(无明显现象),然后加氯 水(溶液变红色)。 【微思考1】如何检验某铁的氧化物中含有Fe2+? 提示:取少量固体置于试管中,向其中加入稀盐酸配制成溶液,加 入酸性高锰酸钾溶液,高锰酸钾溶液褪色,证明氧化物中含有Fe2+。 【微思考2】碱性氧化物是否都能与水反应生成相应的碱?FeO 与硝酸(具有强氧化性)反应是氧化还原反应吗? 提示:碱性氧化物不一定都能溶于水与水反应,如FeO、Fe2O3都 难溶于水,与水不反应,因此不能与水反应生成相应的碱。FeO具有 还原性,与硝酸反应生成硝酸铁和氮的氧化物,属于氧化还原反应。
元素化合物转化关系图(高中)
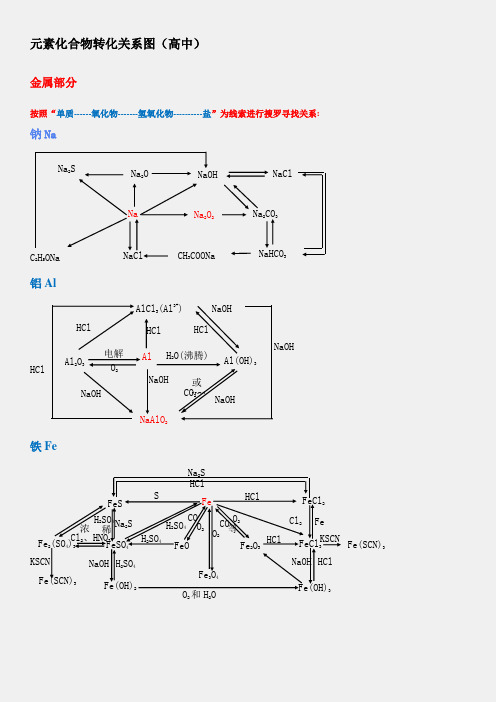
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。
氮及其化合物的转化关系-高考化学复习

二、氮及其化合物的转化与物质推断
3.下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是 强酸还是强碱时都有如下转化关系(其他产物及反应所需条件均已略去),当X是强碱 时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法不正确的是 A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4 B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
关键能力
一、氮在自然界中的循环
1.自然界中氮的循环如图所示。下列说法不正确的是 A.工业合成氨属于人工固氮 B.雷电作用下N2与O2发生了化学反应
√C.在氮的循环中不涉及氧化还原反应
D.含氮无机物与含氮有机化合物可相互转化
工业合成氨是氮气和氢气在高温、高压和催 化剂条件下生成氨气,属于人工固氮,故A 正确; 雷电作用下N2与O2发生反应生成NO,故B 正确; 在氮的循环中,工业合成氨、雷电作用过程
B.用装置乙作为反应过程的安全瓶 C.制备水合肼时从装置丙的a口通入NH3 D.用装置丁吸收反应中过量的NH3
浓氨水需受热或加入碱性物质才能分解产生NH3,CaCl2不能使浓氨水分解,A 项错误; 化学实验装置中的安全瓶的进气管和出气管均较短,B项正确; 氨气密度比空气小,为了利于氨气与NaClO溶液反应,应从装置丙的a口通入 氨气,C项正确; 氨气会污染环境,用装置丁可吸收过量的NH3,并能防倒吸,D项正确。
C.装置D使用冰水浴 D.装置F中所用试剂可为NH4Cl与熟石灰
A装置为碳酸钙与盐酸反应制备CO2的简易装置,该装置的优点是能够随时控 制反应的发生和停止,A正确; 氨基甲酸铵易水解,进入装置D的气体必须是干燥纯净气体,左侧装置B、C试 剂 可 分 别 为 饱 和 碳 酸 氢 钠 溶 液 、 浓 硫 酸 , 制 备 纯 净 干 燥 的 CO2 , 装 置 F 可 用 NH4Cl与熟石灰制备氨气,E中试剂需干燥氨气,可以选用碱石灰,但不能选 用P2O5固体,B错误、D正确; 制备氨基甲酸铵的反应为放热反应,制得的物质易分解,所以装置D需降温, 使用冰水浴,C正确。
