华东师范大学至学年无机化学上期末考试测试试题A
华东师范大学无机化学末A卷(2013级)

华东师范大学期末试卷(A)2013—2014 学年第一学期课程名称:__无机化学_学生姓名:___________________ 学号:___________________专业:___________________ 年级/班级:__________________注:请将所有的答题过程和答案全部写在答题纸上。
一.选择题(14分,每小题2分)1.对于合成氨放热反应来说,()能增大其平衡常数K。
A.加入催化剂,B.升高温度,C.降低温度,D.从体系中移走氨。
2.胶粒组成中,无()。
A.胶核,B.吸附层,C.反离子,D.扩散层。
3.()不属于稀溶液的通性。
A.溶液的稀释,B.溶液具有渗透压,C.溶液的沸点升高,D.溶液的蒸气压降低。
4.下列说法错误的是()。
A.绝对温度0 K是不可能达到的,B.所有ΔS> 0的过程都为自发过程,C.热只能从高温物体自发地传向低温物体,D.并不是所有的放热过程都是自发的。
5.下列说法正确的是()。
A.通过环境对系统的做功,可以使原来的非自发过程得以实现,B.通过控制催化剂的加入量,可以控制化学平衡的平衡点,C.理想气体是一种十分理想化的气体,只存在于标准状态下,D.胶体溶液的稳定性在于它是一种均相系统。
6.下列溶液中,()不是缓冲溶液。
A.过量HAc + NaOH ,B.过量NaAc + HCl ,C.过量HCl + NH3·H2O ,D.过量NH3·H2O + HCl。
7.下列各种量子数组合正确的是()。
A.n=3,l=3,m=-3,B.n=3,l=2,m=-2,C.n=3,l=1,m= 2,D.n=3,l=0,m=-1。
二.填充题(26分,每空格1分)13.三.配平题(4分)KMnO4 + H2O2 +H2SO4=MnSO4 + O2(注:生成物中所缺少的未发生氧化还原的物质需自行添加)四.解答题(18分)1.系统命名下列各配合物:(4分)①[CoCl2(H2O)4]Cl ②Li[AlH4] (注:②式中为H-)2.何谓沉淀的转化?请举一例说明沉淀的转化。
华东师范大学2005至2006学年无机化学上期末考试试题B

华东师范大学2005至2006学年无机化学上期末考试试题B一、单选题(30分,每题各2分)1.1.0 dm3 0.10 mol×dm-3 H2CO3溶液用等体积水稀释后,溶液中 CO32-浓度为(已知H2CO3:K a1 = 4.3×10-7,K a2 = 5.6×10-11 ) ()(A) 2.8×10-2 mol×dm-3 (B) 5.6×10-11 mol×dm-3(C) 4.3×10-7 mol×dm-3 (D) 7.6×10-6 mol×dm-32.20 cm3 0.10 mol×dm-3 HCl 和 20 cm3 0.20 mol×dm-3 NH3×H2O混合,其pH为(已知NH3: K b = 1.76×10-5 ) ()(A) 11.25 (B) 4.75 (C) 9.25 (D) 4.253.La2(C2O4)3的饱和溶液中, La2(C2O4)3的浓度为 1.1 ′ 10-6 mol·dm-3,该化合物的溶度积常数为()。
(A) 1.2′10-12; (B) 1.6′10-30; (C) 1.6′10-34; (D) 1.7′10-28。
4.pH值改变,电极电势变化的电对是( )。
(A) Ag+ / Ag (B) I2 / I– (C) MnO4– / MnO2 (D) Hg2+ / Hg5.已知金属 M 的标准电极电势数值为:M2+ + 2e–? M E q1=–0.40 VM3+ + 3e–? M E q2=–0.04 V则 M3+ + e–? M2+的E q值为 ( )。
(A)0.96 V (B) 0.68 V (C) –0.44 V (D) 1.00 V6.已知电对Pb2+ + 2e– ? Pb 的E q=–0.13 V及 PbSO4的K sp=1.3 ′ 10–8,则下列电对的E q为( )。
《无机及分析化学》期末考试A卷(10-11)
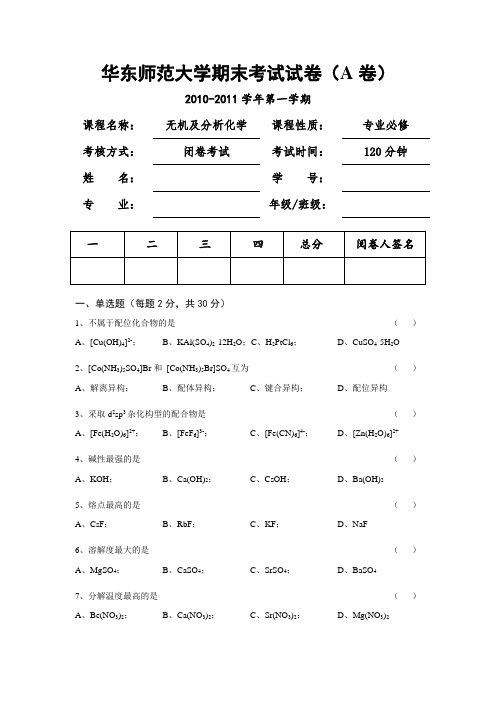
华东师范大学期末考试试卷(A卷)2010-2011学年第一学期课程名称:无机及分析化学课程性质:专业必修考核方式:闭卷考试考试时间:120分钟姓名:学号:专业:年级/班级:一、单选题(每题2分,共30分)1、不属于配位化合物的是()A、[Cu(OH)4]2-;B、KAl(SO4)2·12H2O;C、H2PtCl6;D、CuSO4·5H2O2、[Co(NH3)5SO4]Br和[Co(NH3)5Br]SO4互为()A、解离异构;B、配体异构;C、键合异构;D、配位异构3、采取d2sp3杂化构型的配合物是()A、[Fe(H2O)6]2+;B、[FeF6]3-;C、[Fe(CN)6]4-;D、[Zn(H2O)6]2+4、碱性最强的是()A、KOH;B、Ca(OH)2;C、CsOH;D、Ba(OH)25、熔点最高的是()A、CsF;B、RbF;C、KF;D、NaF6、溶解度最大的是()A、MgSO4;B、CaSO4;C、SrSO4;D、BaSO47、分解温度最高的是()A、Be(NO3)2;B、Ca(NO3)2;C、Sr(NO3)2;D、Mg(NO3)28、在水中不发生歧化反应的卤素分子是()A、F2;B、Cl2;C、Br2;D、I29、氧化性最强的是()A、HOCl;B、HClO2;C、HClO3;D、HClO410、焦磷酸正确的分子式为()A、H3PO3;B、H4P2O7;C、H5P3O10;D、H3PO211、不属于等电子体的是()A、BO33-;B、CO32-;C、NO3-;D、SO32-12、有关6s2惰性电子对效应叙述错误的是()A、第六周期元素都具有惰性电子对效应;B、惰性电子对效应使得PbO2具有强氧化性,可将Mn(II)氧化到Mn(VII);C、由于惰性电子对效应铋元素主要表现+3氧化态;D、惰性电子对效应是由于f和d电子的离散性使其屏蔽效应减小所致13、显两性的物质是()A、HgO;B、Ag2O;C、ZnO;D、Cu2O14、测定氨基酸中的含氮量可采用的滴定方式是()A、直接滴定法;B、返滴定法;C、置换滴定法;D、间接滴定法15、不属于系统误差的是()A、滴定过程中指示剂选择不当;B、所选择试剂不纯;C、容量瓶未经校正;D、称量时掉进灰尘二、填空题(每空1分,共20分)1、六氯合铂(IV)酸钾的化学式为。
《无机化学》期末考试试卷附答案

《无机化学》期末考试试卷附答案一、单选(共20小题,每小题3分,共60分)1、在标准状态下, 1.0 dm3氢气的质量应为()A、0.089 gB、0.11 gC、9.0 gD、11.2 g2、扩散速率三倍于水蒸气的气体是()A、HeB、H2C、CO2D、CH43、欲配制 pH = 13.00 的溶液 10.0 dm3, 所需 NaOH 固体的质量是()(相对原子质量: Na 23 )A、 40 gB、 4.0 gC、 4.0×10-11 gD、 4.0×10-12 g4、有一种称“墨海”的带盖砚台,其结构如图所示,当在砚台中加入墨汁,在外圈加入清水,并盖严,经过足够的时间,开盖看到的情况是()A、砚中墨汁干枯,外圈水成淡墨B、砚中墨汁变淡,外圈水成淡墨,且二者浓度相同C、砚中墨汁变淡,外圈水干枯D、没有发生变化5、下列说法正确的是()A、当液体与其蒸气处于平衡时,蒸气的压力称为液体的饱和蒸气压B、液体混合物的蒸气压等于各纯组分液体的蒸气压之和C、非电解质稀溶液中某一液体组分的蒸气分压等于它在相同温度下的饱和蒸气压与其在溶液中的摩尔分数之积D、蒸气压的大小与容器体积的大小有关6、已知:2H2(g) + S2(g)2H2S(g) K p12Br2(g) + 2H2S(g)4HBr(g) + S2(g) K p2H2(g) + Br2(g)2HBr(g) K p3则K p3 等于()A、(K p1 / K p2 )1/2B、(K p2·K p1)1/2C、K p2 /K p1D、K p2·K p17、氢硫酸电离常数K1 = 1 ⨯ 10-7,K2 = 1 ⨯ 10-13,在0.1 mol·dm-3 H2S水溶液中溶液的pH值是()A、10-2B、 2C、 3D、48、用0.20 mol·dm-3 HAc和0.20 mol·dm-3 NaAc溶液直接混合(不加水),配制1.0 dm3pH = 5.00的缓冲溶液,需取0.20 mol ·dm -3HAc 溶液为( ) (p K a (HAc) = 4.75)A 、6.4 ⨯ 102cm 3B 、6.5 ⨯ 102 cm 3C 、3.5 ⨯ 102cm 3 D 、3.6 ⨯ 102cm 39、钒的电势图为 1.000.360.25()()()()VVVV V V IV V III V II ++-已知: ϕ(Zn 2+/Zn) = -0.76 V , ϕ(Sn 4+/Sn 2+) = +0.15 Vϕ(Fe 3+/Fe 2+) = +0.77 V , ϕ(S/H 2S) = +0.14 V欲将V(V) 还原到V(IV),在下列还原剂中应选用( ) A 、FeSO 4 B 、Zn C 、SnCl 2 D 、H 2S10、对于下面两个反应方程式,说法完全正确的是( )2Fe 3+ + Sn 2+Sn 4+ + 2Fe 2+Fe 3+ + 21Sn2+21Sn 4+ + Fe 2+A 、两式的 E ,m r G ∆,K C 都相等 B 、两式的 E , m r G ∆,K C 不等 C 、两式的 m r G ∆相等, E ,K C 不等 D 、两式的 E 相等, m r G ∆,K C 不等11、铅蓄电池在充电时,阳极反应是( )A 、PbSO 4 + H 2O =PbO 2 + 4H ++ SO -24+ 2e -B 、Pb + SO -24= PbSO 4+ 2e -C 、PbSO 4+ 2e -= Pb + SO -24D 、PbO 2+ 4H ++ SO -24+ 2e -= PbSO 4 + 2H 2O12、已知金属 M 的下列标准电极电势数据:( )(1) M 2+ (aq) + e - =M +(aq)1ϕ= -0.60 V(2) M 3+(aq) + 2e -= M +(aq)2ϕ= 0.20 V 则M 3+(aq) + e -= M 2+ (aq) 的ϕ是A 、0.80 VB 、-0.20 VC 、-0.40 VD 、1.00 V13、对于一个一级反应,如其半衰期t 1/2在0.0100 s 以下即称为快速反应,此时它的速率常数k 值在( )A 、 69.3 s -1以上 B 、6.39 s -1以上 C 、0.0693 s -1以上D 、6.39 s -1以下14、反应2A −→−B 为二级反应,若A 的起始浓度为1.00 mol ·dm -3,在开始反应1 h 之后减少了一半,那么2 h 后,A 的浓度将为( ) A 、 0.125B 、0.333C 、0.250D 、0.49115、在各种不同的原子中3d 和4s 电子的能量相比时( ) A 、3d 一定大于4s B 、 4s 一定大于3d C 、3d 与4s 几乎相等D 、不同原子中情况可能不同16、下列关于屏蔽效应的说法中,正确的一个是( )A 、4s 电子的屏蔽常数σ 4s 反映了4s 电子屏蔽原子核作用的大小B 、当n 和Z 相同时,某电子的σ 值愈大,该电子的能量就愈低C 、主量子数n 相同,角量子数l 不同;随l 增大,电子的屏蔽作用增大D 、当屏蔽电子数目愈多或被屏蔽电子离核愈远时,σ 值也愈大 17、下列各对分子型物质中,沸点高低次序不正确的是( ) A 、HF > NH 3 B 、 S 2(g) > O 2 C 、NH 3 > PH 3 D 、SiH 4 > PH 3 18、已知金刚石晶胞是类似于立方 ZnS 型的面心立方晶格 ,则晶胞中碳原子数是 ( ) A 、4B 、8C 、12D 、619、按分子轨道理论,-2O 的键级是 ( ) A 、1 B 、2 C 、1 D 、220、下列分子和离子中,中心原子的价层电子对几何构型为四面体,且分子(离子)空间构型为角形(V 形)的是( ) A 、+4NH B 、SO 2C 、H 3O +D 、OF 2二、填空(共20空,每空2分,共40分)1、0℃ 和标准压力下,1 dm 3水能溶解49.0 cm 3O 2 和23.5 cm 3N 2,在相同的条件下,1 dm 3水约能溶解空气 ________________________ cm 3。
2023-2024学年上海市华东师范大学第三附属中学高二上学期期末考试化学试卷(等级考)含详解

上海市华东师大三附中2023学年高二上学期期末考试化学试卷(等级考)时间:60分钟满分:100分可能用到的相对原子质量:H—1C—2O—6S—32Cu—64一,微观与宏观(共20分)物质所表现出来的宏观性质,都有相应的微观本质原因。
宏观辩识与微观探析是我们认识物质的两个视角。
1.回答下列问题(1)下列Mg 原子的核外电子排布式中,能量最高的是。
a .224131s 2s 2p 3s 3p b .223231s 2s 2p 3s 3p c .226111s 2s 2p 3s 3p d .22621s 2s 2p 3s (2)下列各组多电子原子的能级能量比较不正确的是。
a .2p 3p=b .4s 2s>c .4p 4f>d .4d 3d>(3)可用焓变和熵变来判断化学反应进行的方向,下列都是能自发进行的化学反应,其中是吸热反应且反应后熵增的是。
a .222Na 2H O 2NaOH H +=+↑b .2343Fe 2O Fe O +=c .()434332NH CO NH HCO NH =+↑d .2NaOH HCl NaCl H O+=+(4)某反应过程中的能量变化如图所示:①若加入催化剂,则b (填“增大”,“减小”或“不变”)。
②根据图像,该反应H ∆=(用含a,b 的代数式表示)。
(5)写出基态P 原子价电子排布式,该基态原子中能量最高的电子所占的轨道形状是。
(6)已知:在25℃,101kPa 时。
反应Ⅰ.2212Na(s)O (g)=Na O(s)2+1H k o 412J m l -∆⋅=-.反应Ⅱ.2222Na(s)O (g)=Na O (s)+1H 511kJ mol -∆=-⋅。
写出22Na O 与Na 反应生成2Na O 的热化学方程式。
(7)2CaCl 在火焰上灼烧时火焰的颜色为砖红色,试从原子光谱角度解释原因。
二,氨的工业合成(共20分)氨的用途十分广泛,是现代工业,农业生产最基础的化工原料之一,氨可作为一种较易储运的储氢载体,是破解氢大规模储运难题的有效手段。
《无机化学》(上册)期末考试试卷及答案

《无机化学》(上册)期末考试试卷及答案9.离子的结构特征一般包括: 离子电荷、、三个方面.10.已知:2A+B=2C为简单反应,此反应对A物质反应级数为___________,总反应为____________级反应.11.共价键按共用电子对来源不同分为_____________和_______________;共价键按轨道重叠方式不同分为_______________和________________。
12.亚氯酸可用_____________________反应而制得水溶液,它极不稳定迅速分解,反应式为:。
13.在化学反应方程式2KMnO4+5H2O2+6HNO3=2Mn(NO3)2+2KNO3+8H2O+5O2↑中,氧化产物为___________, 还原产物为____________14.O2分子中有_________________________键,依公式_________________ 可以算出O2的磁矩.15.A,B两种气体反应,设A的浓度增加一倍,速度增加一倍,B的浓度增加一倍,则反应速度增加三倍,若总压力减小为原来的1/2时,反应速度将变为原来的_________倍,该反应的总反应级数为____________.16.稀有气体的第一个化合物—————————,,是由————————于————————年制备的。
17.写出具有下列指定量子数的原子轨道符号:A. n = 4, l = 1B. n = 5, l = 318.某种只含C 、H 、Cl的化合物在298 K和101.3 kPa压力下, 其蒸汽密度为3.965g·L-1, 如果化合物分子中C:H:Cl = 1:1:1, 则该化合物的分子量为_______ , 分子式为__________ .19.缓冲容量表示缓冲溶液___________________的大小,缓冲剂的浓度越大,则缓冲容量越____________.20.为防止水在仪器中结冰, 可以加入甘油C3H8O3以降低凝固点。
《无机化学》期末试题题库
无机化学水平测试题(Ⅰ)一、选择题(在下列各题中,选择出符合题意的1个或2个答案,将其代号写在括号中,每题1.5分,共24分)1.下列物质中可以认为具有最大摩尔熵的是( ) A.Li(g)B.Li(s)C.LiCl ·H 2O(s)D.LiCO 3(s)2.已知在一定温度下:SnO 2(s)+2H 2(g) === Sn(s)+2H 2O(g) 1K Θ= 21.0 CO(g)+H 2O(g) === CO 2(g)+H 2(g)2K Θ=0.034因此,下列反应SnO 2(s)+2CO(g) === Sn(s)+2CO 2(g)的3K Θ=( )A.21.0B.0.714C.0.024 3D.21.63.下列化合物中,既有离子键又有共价键的物质是( ) A.NaOHB.CaCl 2C.CH 4D.NH 4Cl4.已知φΘ(Cu 2+/Cu) === 0.34 V ,φΘ(Cu +/Cu)= 0.52 V ,则φΘ(Cu 2+/Cu +)为( ) A.–0.18 V B.0.16 VC.0.86 VD.0.18 V5.下列元素原子半径排列顺序正确的是( ) A.Mg>B>Si>Ar B.Ar>Mg>Si>B C.Si>Mg>B>ArD.B>Mg>Ar>Si6.反应3A 2++2B === 3A+2B 3+在标准状态下电池的电动势E Θ为1.8 V ,某浓度时,反应的电池电动势E 为1.6 V ,则此时该反应的lg K Θ值为( )A.3×1.8/0.059 2B.3×1.6/0.059 2C.6×1.6/0.059 2D.6×1.8/0.059 27.下列离子的原子序数分别是25、26、27、28,其电子构型可以用[Ar]3d 6表示的是( ) A.Mn 2+B.Fe 2+C.Co 3+D.Ni 2+8.已知H 2S 的1a K Θ=1.0×10–7,2a K Θ=1.0×10–13,在饱和的H 2S 水溶液中c (S 2–)应为( )mol ·L –1A.1.0×10–7B.1.0×10–13C.1.0×10–4D.1.0×10–209.下列叙述正确的是 ( ) A.放热反应均为自发反应B.I 2(g)的∆f m G Θ (298.15)=0C.某反应的∆r G m >0,并不表示该反应在任何条件下都不能自发进行D.若反应的m H ∆Θr 和m G ∆Θr 均为正值,则升高温度m G ∆Θr 将增大10.配合物K 3[FeF 6]的磁矩为5.9玻尔磁子,而K 3[Fe(CN)6]的磁矩为1.9玻尔磁子,这种差别的原因是( )A.Fe 在这两种配合物中具有不同的氧化值B.K 3[Fe (CN) 6]不是配合物C.F 原子比C 原子的电负性大,使CN -比F -有更强的配位能力 D.在配体CN -的影响下,中心离子d 轨道的电子发生了重排11.某白色固体易溶于水,加入BaCl 2有白色沉淀产生,用HCl 酸化,沉淀完全溶解,再加入过量NaOH 至强碱性,加热有刺激性气体逸出。
华东师范大学期末试卷
华东师范大学期末试卷2005~2006学年无机化学(上)A一、单选题(30分,每题2分)1.下列关于晶格能的说法正确的是()(A) 晶格能是指气态阳离子与气态阴离子生成 1 mol 离子晶体所释放的能量;(B) 晶格能是由单质化合成1mol离子化合物时所释放的能量;(C) 晶格能是指气态阳离子与气态阴离子生成离子晶体所释放的能量;(D) 晶格能就是组成离子晶体时,离子键的键能。
2.下列物质熔点变化顺序中,不正确的是()(A) NaF > NaCl > NaBr > NaI (B) NaCl < MgCl2 < AlCl3 < SiCl4(C) LiF > NaCl > KBr > CsI (D) Al2O3 > MgO > CaO > BaO3.能和钠形成最强离子键的单质是()(A) H2 (B) O2(C) F2(D) Cl24.用分子轨道理论来判断下列说法,不正确的是()(A) N2+的键能比N2分子的小(B) CO+的键级是2.5(C) N2-和O2+是等电子体系(D) 第二周期同核双原子分子中只有Be2不能稳定存在5.下列分子中的电子为奇数的分子是()(A) F2O (B) NO2(C) CO (D) Cl2O76.ClO3F分子的几何构型属于()(A) 直线形(B) 平面正方形(C) 四面体形(D) 平面三角形7.下列各组双原子分子中,均具有顺磁性的是()(A) O2,B2(B) C2,O2(C) B2,Be2(D) Be2,O28.下列分子中,两个相邻共价键间夹角最小的是()(A) BF3(B) H2S (C) NH3(D) H2O9.凡是中心原子采用sp3d2杂化轨道成键的分子,其空间构型可能是()(A) 八面体(B) 平面正方形(C) 四方锥(D) 以上三种均有可能10.下列分子中,偶极矩大于0 的分子是()(A) SF4(B) PF5(C) SnF4(D) BF311.下列各对分子型物质中,沸点高低次序不正确的是()(A) HF > NH3(B) S2(g) > O2(C) NH3 > PH3(D) SiH4 > PH312.下列各对物质中,分子间作用力最弱的是()(A) NH3和PH3(B) He和Ne (C) N2和O2(D) H2O和CO213.下列叙述中正确的是()(A) 反应物的转化率不随起始浓度而变;(B) 一种反应物的转化率随另一种反应物的起始浓度而变;(C) 平衡常数不随温度变化;(D) 平衡常数随起始浓度不同而变化。
华东师范大学期末考试试卷(A卷).doc
D、MgA 、Ca(OH)2;B 、LiOH ;C、Be(OH)2;D、Mg(OH)2A 、AgF>AgI ;B 、NaC104>KC104;C、Mg(OH )2>Ca(OH)2:D、NaI>KIA^ Li-Be ;B 、Mg-Al ;C、Na-Be ;D、Be-Al华东师范大学期末考试试卷(A 卷)2009-2010学年第一学期课程名称: 无机及分析化学课程性质:专业必修考核方式: 闭卷考试考试时间: 120分钟姓名:学 号专 业:年级/班级:一二三四总分阅卷人签名一、单选题(每题2分,共30分)1、下列元素不属于p 区元素的是() A 、铝;2、在氧气屮燃烧得不到正常氧化物的元素是() A 、Na ;B 、Li ;C^ Ca ;3、氢氧化物碱性最强的是()4、有关溶解性比较错误的是()5、下列符合对角线规则的一组元素是()6、[Co (NH3)5NO2严和[C O (NH 3)5ONO ]2+B 于结构异构现象中的() A 、解离异构;B 、配体异构;C^键合异构;D 、配位异构7、治疗血钙过高时可用EDTA 螯合剂将Ca*移出,使钙经肾脏扌非出体外,llt [Ca (EDTA )]2+ 螯合物中含有几个五元环?() A 、2;B 、3;C 、4:D 、5久属于内轨型配合物的是()A 、[Ag (CN )2]';B 、[Zn (NH 3)4]2+;C 、[Co (H 2O )6]2+;D 、[Fc (CN )6]3-9、卤索氢化物沸点最高的是()A、HF;B、HC1;C、HBr;D、HI10、酸性最强的是()A、H5IO6;B、HBrOq;C、HCIO4;D、H2SO411、不含离域兀键的分子是()A、O3;B、HNO3;C、CO2;D、B2H612、氧化性最强的分了是()A、PbC)2;B、SnCh;C、PbO;D、SnO13、由热力学知Cf在水溶液中不稳定,会发生歧化反应,要使水溶液屮的Cf+转化为Cf, 可加入()A、OH';B、「C、S2_;D、NH3H2O14、有关铁系元素性质叙述不正确的是()A、可用KSCN鉴定F尹;B、氧化能力Ni2O3>Co2O3>Fe2O3;C、稳定性Fe(OH)3>Co(OH)3>Ni(OH)3;D、黄血盐与Fc”生成的普鲁士蓝和赤血盐与F(?+生成的滕氏蓝是两种不同物质的沉淀15、假设樱桃河水屮Ca*浓度0.0250mol・L",河水的平均密度为1.002g・mL",则樱桃河小钙离子的含量为()A、lOOOppm;B、500ppm;C> 200ppm;D、1 OOppm二、填空题(每空1分,共20分)1、反应[F C(C2O4)3]23-+6CN=[F C(CN)6]3-+3C2O42-的平衡常数为K= _____________________ 。
华东师大《无机及分析化学》期末考试A卷(13-14)
2013-2014 学年第一学期
课程名称: 考核方式: 姓 名: 无机及分析化学 闭卷考试 课程性质: 考试时间: 学 号: 专业必修 120 分钟
一
二
三
四
总分
阅卷人签名
说明:答案请全部写在试卷上!
一、单选题(每题 2 分,共 34 分)
1、下列离子化合物中熔点最低的是 A)NaF; B)KFl; 2、离子极化力最小的电子构型是 A)18e; B)18+2e; ( C)RbF; D)CsF ( C)9~17e; D)8e ( D)原子晶体 ( D)配位异构 ( ) ) ) ) )
( C、Ca(OH)2; D、Ba(OH)2 ( C、Ba(NO3)2; D、BaSO4 ( B、第五周期 p 区金属元素化合物; D、第五周期 s 区金属元素化合物 HClO4 ( C、NO3 ;
-
)
)
)
)
D、苯环 ( D、Ba2+ ( ) )
13、当金属离子与碳酸根反应时,产物为碱式碳酸盐的是 A、Ag+; B、Fe3+; C、Cu2+; 14、ds 区元素中唯一能与碱反应的金属是 A、Au; B、Zn; 15、将 Cu(II)转化为 Cu(I)可加入下述试剂 A、H2SiO3; B、NaNO2;
di2 (0.032 0.012 0.02 2 0.032 0.012 ) % 0.02%(0.022%) n 1 6 1 s 0.02% CV 100% 100% 0.2%(0.26%) x 8.50% Ea 8.50% 8.50% 0 Er Ea
2、选择合适方法鉴别下列各组物质并写出现象差别: (a)Be(OH)2 和 Mg(OH)2; (b)KNO2 和 AgNO3;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
华东师范大学2005至2006学年无机化学上期末考试试题A————————————————————————————————作者:————————————————————————————————日期:2华东师范大学2005至2006学年无机化学上期末考试试题A 一、单选题(30分,每题2分)1.下列关于晶格能的说法正确的是()(A) 晶格能是指气态阳离子与气态阴离子生成 1 mol 离子晶体所释放的能量;(B) 晶格能是由单质化合成1mol离子化合物时所释放的能量;(C) 晶格能是指气态阳离子与气态阴离子生成离子晶体所释放的能量;(D) 晶格能就是组成离子晶体时,离子键的键能。
2.下列物质熔点变化顺序中,不正确的是()(A) NaF > NaCl > NaBr > NaI (B) NaCl < MgCl2 < AlCl3 < SiCl4(C) LiF > NaCl > KBr > CsI (D) Al2O3 > MgO > CaO > BaO3.能和钠形成最强离子键的单质是()(A) H2 (B) O2(C) F2(D) Cl24.用分子轨道理论来判断下列说法,不正确的是()(A) N2+的键能比N2分子的小(B) CO+的键级是2.5(C) N2-和O2+是等电子体系(D) 第二周期同核双原子分子中只有Be2不能稳定存在5.下列分子中的电子为奇数的分子是()(A) F2O (B) NO2(C) CO (D) Cl2O76.ClO3F分子的几何构型属于()(A) 直线形(B) 平面正方形(C) 四面体形(D) 平面三角形7.下列各组双原子分子中,均具有顺磁性的是()(A) O2,B2(B) C2,O2(C) B2,Be2(D) Be2,O28.下列分子中,两个相邻共价键间夹角最小的是()(A) BF3(B) H2S (C) NH3(D) H2O9.凡是中心原子采用sp3d2杂化轨道成键的分子,其空间构型可能是()(A) 八面体(B) 平面正方形(C) 四方锥(D) 以上三种均有可能10.下列分子中,偶极矩大于 0 的分子是()(A) SF4(B) PF5(C) SnF4(D) BF311.下列各对分子型物质中,沸点高低次序不正确的是()(A) HF > NH3(B) S2(g) > O2(C) NH3 > PH3(D) SiH4 > PH312.下列各对物质中,分子间作用力最弱的是()(A) NH3和PH3(B) He和Ne (C) N2和O2(D) H2O和CO213.下列叙述中正确的是()(A) 反应物的转化率不随起始浓度而变;(B) 一种反应物的转化率随另一种反应物的起始浓度而变;(C) 平衡常数不随温度变化;(D) 平衡常数随起始浓度不同而变化。
14.已知∶ 2H2(g) + S2 (g) 2H2S(g) K p12Br2 (g) + 2H2S(g) 4HBr(g) + S2 (g) K p2H2(g) + Br2 (g) 2HBr(g) K p3则K p3等于()(A) (K p1/K p2 )1/2(B) (K p2·K p1 )1/2(C) K p2/K p1 (D) K p2·K p115.在一容器中,反应 2SO2 (g) + O2 (g) 2SO3 (g),达到平衡,加一定量N2 气体保持总压力不变,平衡将会()(A) 向正方向移动 (B) 向逆方向移动(C) 无明显变化(D) 不能判断二、填空题(16分)1.在离子晶体中,离子的电荷越高,晶格能;离子的半径越大,晶格能____。
2.NO+分子是N2分子的等电子体,NO-分子是O2分子的等电子体,则NO+和NO-的键级分别为和。
3.BaO,CaO,NaI,MgO,NaBr的晶格能大小顺序为。
4.H3O+离子的中心原子采用杂化,该中心原子的价层电子对构型为,分子的几何构型为。
5.液态 HBr,HCl,HF,HI的沸点大小顺序为。
6.BF3,NH3,H2O,PCl4+的键角由大到小的顺序为,中心原子杂化轨道中不含有孤对电子的有。
7.原子晶体,其晶格结点上的微粒之间的力是__________________,这类晶体一般熔沸点较高,例如__________ 和 __________两种晶体就是原子晶体。
8.合成氨反应 3H2(g)+N2 (g) 2NH3(g)为放热反应,当达到平衡后,再适当降低温度,平衡将向________方向移动,平衡常数将________________。
9.根据电负性的概念,判断下列化合物: AlCl3 ,Al2 O3,Al2S3,AlF3 中,键的极性大小顺序是______________________________________。
三、问答题(34分)1.试从分子轨道理论作出预言,O2+的键长与O2的键长哪个较短,N2+的键长与N2的键长哪个较短?为什么?(8分)2.画出下列各分子(或离子)的路易斯电子结构式。
(4分)(1) CH2O (2) HO2-(3) BrF3(4) PCl53.根据价层电子对互斥理论画出下列各分子(或离子)的空间结构,并指出中心原子的杂化方式。
(8分)(1) H2Se (2) ClO2-(3) ICl3(4) SF64.二甲醚 (CH3-O-CH3)和乙醇 (CH3CH2OH)为同分异构体,它们的沸点分别是-23︒C和78.5︒C,为什么差别这样大?(4分)5. 为什么石墨是好的导体,而金刚石不是?(4分)6.判断下列各组中同种或异种分子之间存在什么形式的分子间作用力。
(1) H2O (2) Ne 和CH3OH (3) CO2(6分)四、计算题(20分)1. 金属钠为体心立方点阵,晶胞参数a=429 pm,已知钠的原子量为22.99。
计算钠原子的半径和金属钠的理论密度。
(6分)2.可逆反应H2O + CO H2 + CO2在密闭容器中建立平衡,在749K时该反应的平衡常数Kc=2.6。
(1)求n水/n一氧化碳为1时,CO的平衡转化率;(2)求n水/n一氧化碳为3时,CO的平衡转化率;(3)从计算结果说明浓度对化学平衡移动的影响。
(7分)3.五氯化磷的气相反应为:PCl5(g) PCl3(g) + Cl2 (g)。
在250︒C时100 kPa下达到平衡,测得混合物的密度为2.695g/dm-3,求(1) 250︒C时PCl5的解离度α;(2) 该反应在250︒C时的K p。
(原子量: P 31.0 Cl 35.5) (7分)华东师范大学2005~2006学年无机化学 (上)A答案一、单选题(30分,每题2分)1. A;2.C;3.C;4.D;5.B;6.C;7.A;8.D;9.D;10.A;11.D;12.C;13.B;14.B;15.B二、填空题(16分)1.越大;越小。
2.3 和2。
3.MgO > CaO > BaO > NaBr > NaI4.sp3 杂化,四面体,三角锥。
5.HF>HBr>HCl>HI6.BF3>PCl4+>NH3>H2O;BF3、PCl4+7.共价键;金刚石和白硅石8.正反应方向;发生改变9.AlF3>Al2O3>AlCl3 >Al2S3三、问答题(34分)1.答:O2+:(σ1s)2 (σ1s*)2 (σ2s)2(σ2s*)2(σ2p)2(π2p)4 (π2p*)1 BO=2.5 O2:(σ1s)2 (σ1s*)2 (σ2s)2(σ2s*)2(σ2p)2(π2p)4 (π2p*)2 BO=2,故O2+的键长短N2+:(σ1s)2 (σ1s*)2 (σ2s)2(σ2s*)2 (π2p)4(σ2p)1 BO=2.5N2:(σ1s)2 (σ1s*)2 (σ2s)2(σ2s*)2 (π2p)4(σ2p)2 BO=3,故N2的键长短2.答:(1) CH2O: (2) HO2-:(3) BrF3: (4) PCl5:3.答: (1) H2Se sn=(6+2)/2=4,sp3 (2) ClO2-:sn=(7+1)/2=4,sp3(3) ICl3sn=(7+3)/2=5,sp3d (4)SF6:sn=(6+6)/2=6,sp3d24.答:二甲醚 (CH3-O-CH3)的极性比乙醇 (CH3CH2OH)小,并且乙醇分子之间可以形成氢键。
5. 答:石墨中碳采用sp2杂化,剩下的p轨道形成庞大的π键,p电子可以在整个π键中运动,因此具有导电性;而金刚石中碳采用sp3杂化。
6.(1) H2O:取向力、诱导力、色散力、氢键(2) Ne 和CH3OH :诱导力、色散力(3) CO2:色散力四、计算题(20分)1. 解:由于金属钠为体心立方点阵,则有,r=185.8pm,,体心立方晶胞中有两个Na原子,g2.解: H2O + CO H2 + CO2Kc=2.6(1) 起始 1 1平衡1-x 1-x x x,x=0.62,α=62%(2) 起始 1 3平衡3-x 1-x x x,x=0.865,α=86.5%(3) 说明通过增加反应物H2O的量,促使平衡向正反应方向移动,从而提高CO 的转化率。
即为了尽可能地利用某一反应物,经常用过量的另一物质与它作用。
3.解:(1)混合气体的平均分子量为PCl5(g) PCl3(g) + Cl2 (g)起始 1平衡1-x x x根据题给条件,117.2,x=0.80,α=80% (2) =0.11 (atm),=0.44 (atm)。
