药物警戒和用药安全监测
药物警戒对临床用药安全的重要性分析

药物警戒对临床用药安全的重要性分析随着医学水平的不断提高,药物在临床应用中起到了至关重要的作用。
然而,药物使用不当或错误可能会导致严重的不良反应和药物事件。
为了确保患者的安全,药物警戒成为了临床用药过程中不可或缺的环节。
本文将对药物警戒在临床用药安全中的重要性进行分析。
首先,药物警戒可以帮助医护人员避免用药错误。
在复杂的临床环境中,药物的种类繁多、剂量复杂且常有变化,医护人员很容易犯错误。
药物警戒系统能够及时提醒医护人员有关药物相互作用、剂量限制、禁忌症等重要信息,帮助他们减少用药错误的发生,从而保证用药的安全性和有效性。
其次,药物警戒有助于防止药物不良反应的发生。
药物不良反应是指在正常剂量下,由于个体差异、药物相互作用等原因导致的意外不良反应。
药物警戒系统通过识别不同药物的风险因素,提供预警信息,帮助医护人员评估患者的风险,并采取相应的措施避免不良反应的发生。
这可以减少不必要的痛苦,改善患者的治疗体验,并最终提高患者的治疗效果。
第三,药物警戒可以提供实时的药物监控。
药物使用过程中,对药效和不良反应的监测十分重要,特别是在一些需要频繁调整剂量的情况下。
药物警戒系统能够实时监测患者的药物使用情况,并根据预设的标准进行报警和提示。
这有助于医护人员了解患者对药物的反应情况,及时调整用药方案,提高疗效。
此外,药物警戒还可以提供及时的药物信息共享和教育。
药物警戒系统汇集了大量的药物信息数据库,医护人员可以通过系统查询药物的相关信息,了解药物的特点、副作用等。
同时,药物警戒系统还可以提供药物教育材料,帮助医护人员不断更新药物知识,提高用药水平。
这有助于减少因医护人员知识不足导致的用药错误,保障患者的安全。
然而,药物警戒系统也存在一些局限性。
首先,药物警戒系统的准确性和完善性主要取决于药物信息的更新和维护。
如果药物信息没有及时更新或有错误,将影响系统的可靠性和准确性。
其次,药物警戒系统仅起到提醒和警示的作用,医护人员仍需要有临床判断能力来进行决策。
药学综合知识与技能:药物警戒与药品不良反应监测
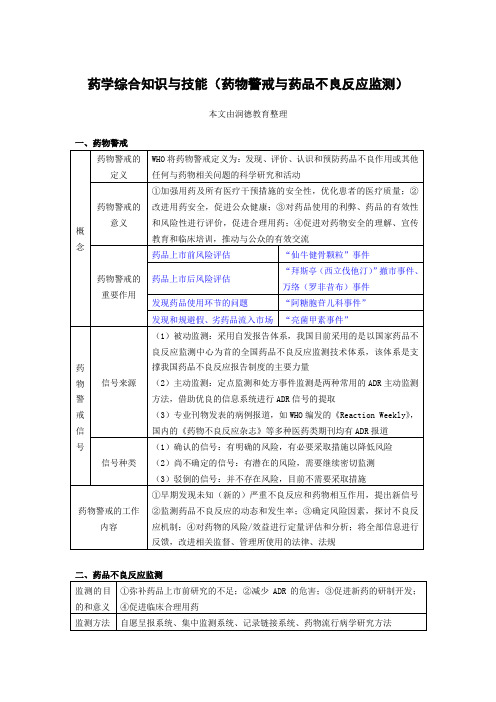
药学综合知识与技能(药物警戒与药品不良反应监测)
本文由润德教育整理
二、药品不良反应监测
【小试牛刀】
1.[最佳选择题]下列不良事件中,属于假劣药事件是
A.“康泰克PPA事件”
B.“万洛(罗非昔布)事件”
C.“亮菌甲素事件”
D.“拜斯亭(西立伐他汀)事件”
E.“阿糖胞苷儿科事件”
2.[最佳选择题]患者因扁桃体炎给予头孢拉定治疗。
服用4小时后。
面部出现皮疹。
无其他
不适,停药后皮疹消失,排除其他疾病可能。
该病例用药与不良反应因果关系评价结果是A.肯定 B.很可能
C.可能
D.可能无关
E.无法评价
上一期小试牛刀答案:1.C 2.B。
中药药物警戒的工作内容

中药药物警戒的工作内容
中药药物警戒是指对中药药物的使用进行监测和评估,以及提供相应的安全警示和建议。
以下是中药药物警戒的主要工作内容:
1. 药物安全监测:对中药药物的安全性进行监测和评估,收集、整理和分析有关中药药物的不良反应、药物相互作用、药物滥用等信息。
2. 药物信息管理:建立和维护中药药物的信息数据库,包括药物的成分、性质、功效、用法用量、适应症、禁忌症等,以及相关的警示信息。
3. 药物警示发布:及时发布中药药物的安全警示信息,包括药物的不良反应、禁忌使用、特殊人群的用药注意事项等,以提醒医务人员和患者注意药物的安全使用。
4. 评估和监控研究:对中药药物进行临床疗效评估和安全性监测研究,了解中药药物在实际应用中的效果和安全性。
5. 专业指导和咨询:向医务人员和患者提供关于中药药物的安全使用指导和咨询服务,解答相关疑问,提供合理用药建议。
6. 协调与合作:与相关部门、研究机构、医院等开展合作,共同开展中药药物的安全监测、研究和宣传工作。
中药药物警戒的目标是保障患者用药安全,减少药物的不良反应和风险,提高中药药物的合理使用水平。
通过开展中药药物警戒工作,可以促进中药药物的科学、安全和有效应用。
药物警戒之药品重点监测

20XX年9月7日
XX药业有限责任公司
药物警戒
药品重点监测
XXXXX药业有限责任公司
药品重点监测管理的实施方案
为加强我公司药品重点监测工作,进一步建立健全从监管到监测,从监测到预警,从预警到风险控制的长效监测机制,有效降低药品安全风险,结合我公司实际,以XXXXX颗粒为重点监测品种,制定本方案。
一、不良反应监测室负责全公司药品重点监测的业务指导工作。
各相关部门负责本部门所接收到的XXXXX颗粒不良反应信息反馈工作,对XXXXX颗粒进行重点监测、监督管理。
发现不良反应及时上报不良反应监测室。
不良反应监测室应当加强XXXXX 颗粒不良反应信息收集、整理和报告工作,保障人民用药安全。
二、XXXXX颗粒重点监测实行半年汇总上报制度。
不良反应监测室对所销售的的XXXXX颗粒,进行重点跟踪监测,并将每半年XXXXX颗粒的监测情况,于下半年第一个月进行汇总,上报质量部备案。
对XXXXX颗粒的质量风险管理与重点安全监测工作、与公司质控体系相结合,强化责任意识,积极主动开展监测工作,加强风险管理,预防重大药害事件发生。
三、要求和相关部门加强XXXXX颗粒不良反应信息收集和监测工作,特别要加强XXXXX颗粒的严重不良反应监测工作。
建立早预防、早发现、早报告、早控制的“四早”监测预警机制。
四、药品使用中出现的严重或突发性群体不良反应事件,按照逐级报告的原则,立即报告所在地药监部门。
药物警戒的名词解释

药物警戒的名词解释药物警戒(Pharmacovigilance),又称药物监测或药物安全监测,是指通过监测和评估药物的使用情况,及时发现、评估和预防药物的不良反应(Adverse Drug Reactions,简称ADR)及其他药品相关问题的科学活动。
其目的是确保药物的安全性和有效性,并通过采取相应的预防和控制措施,降低患者因药物治疗造成的风险。
药物警戒的重要性不言而喻。
在现代医疗体系中,通过合理的用药来治疗和预防疾病已经成为常态。
然而,任何药物都存在一定概率的不良反应发生,这种不良反应可能会给患者的生命和健康带来威胁。
药物警戒的存在,就是为了及时发现和处理这些不良反应,确保用药的安全性。
药物警戒的核心内容是药物的监测和评估。
药物的监测是指通过系统收集和纪录药物使用者的信息,特别是感知和收集药物不良反应的信息,建立药物不良反应报告系统,以及进行药物使用者回访等方式获得相关数据。
药物的评估是指对所收集到的数据进行分析和评估,判断药物使用过程中出现的不良反应与该药物的关联性,以及不良反应的程度和严重性。
这些评估的结果将对药物的使用指导和管理提供决策依据。
药物警戒的工作依赖于多方的合作和参与。
首先是医疗卫生机构,包括医院、诊所和药店等,这些机构需要建立和完善药物不良反应的报告和记录制度,以及提供准确的药品使用信息;其次是药品制造企业和药品监管机构,这些机构需要积极配合药物警戒工作,及时回应和处理药物的安全问题,并对药物的监管进行加强;还有重要的一方是患者,他们需要主动报告和提供使用药物过程中的感受和不适等信息,以及配合医生和药师的指导,正确使用药物。
药物警戒不仅关注已上市和广泛使用的药物,也需要对新的药物进行监测和评估。
在新药审批过程中,充分的临床试验是药物安全性的基础,但是一些低发生率、严重或长期不良反应可能在临床试验中未被发现。
因此,药物监测需要实施长期跟踪,对于新的药物或新途径的药物使用风险需要高度警惕。
药物监测和警戒制度

药物监测和警戒制度一、目的为加强用药及所参与医疗救治干预措施的可靠性,优化病人的治疗效果,加大改进安全用药力度,促进提高公众健康意识,制定《药物监测和警戒制度》。
二、参考文件1.《药物警戒质量管理规范》国家药监局2020年12月3日2.医疗机构药物警戒体系建设专家共识[J].中国药物应用与监测,2022,No.3, June 2022:135-1443.《中华人民共和国药品管理法》中华人民共和国主席令第31号2019年12月1日4.《医疗机构高警示药品风险管理规范》(T/CMEAS 012-2023)中国医药教育协会三、名词定义1.药品:是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药、化学药和生物制品等。
2.药物警戒:是关于发现、评价、理解和预防与药物使用相关的不良反应或其他问题的科学研究与活动。
3.治疗药物监测:是指在临床进行药物治疗过程中,观察药物疗效的同时,定时采集患者的血液(有时采集尿液、唾液等液体),测定其中的药物浓度,探讨药物的体内过程,以便根据患者的具体情况,以药动学和药效学基础理论为指导,借助先进的分析技术与电子计算机手段,并利用药代动力学原理和公式,使给药方案个体化。
四、内容(一)一般性原则医院应当规范记录药物警戒活动的过程和结果,妥善管理药物警戒活动产生的记录与数据。
记录与数据应当真实、准确、完整,保证药物警戒活动可追溯。
对关键的药物警戒活动记录和数据,应当进行确认与复核。
(二)疑似药品不良反应的监测与管理1.医务人员在发现疑似药品不良反应后,应收集患者基本情况、用药情况和疑似药品不良反应发生况,并填写药品不良反应/事件报告表或用药错误报告表,及时交药物警戒工作组进行评价。
2.对于一般的药品不良反应/事件,药物警戒负责人须30日内上报至国家药品不良反应监测系统。
对于新的、严重的药品不良反应/事件,药物警戒负责人接到报告后,须立即对患者情况进行调查和评估,15日内上报;同时组织相关人员讨论,并将讨论结果作为随访材料及时上报。
药物警戒的意义与实施方法

药物警戒的意义与实施方法药物警戒是指在使用药物时要注意可能出现的不良反应和药物相互作用,并且采取相应的预防措施,以确保患者的用药安全。
药物警戒的意义在于保护患者的健康和生命安全,并有效避免药物引起的不良反应和药物相互作用导致的药物治疗失败。
药物警戒的实施方法包括以下几个方面:1. 了解药物的特性和副作用:在使用任何药物之前,医务人员应该对该药物的药理作用、适应症、不良反应和禁忌症等方面进行充分了解。
只有了解了药物的特性,才能更好地进行药物警戒。
2. 严格执行用药方案:在使用药物时,一定要按照医生开具的处方进行用药,不可自行调整剂量或停药。
同时,要确保患者服药的时间和用量准确无误。
3. 监测药物疗效和不良反应:在用药过程中,医务人员需要定期监测患者的疗效和不良反应情况。
对于无效或者出现严重不良反应的药物,要及时调整用药方案或者更换其他合适的药物。
4. 了解药物相互作用:药物之间存在相互作用的情况,有些药物可能增加或减弱其他药物的疗效,甚至产生严重的不良反应。
因此,在用药时要注意同时使用的其他药物,并与药师或医生进行咨询,以避免药物相互作用的风险。
5. 加强患者教育:提供给患者关于药物的相关知识,如何正确服药、可能出现的不良反应和该如何应对等,以便患者能够主动参与用药管理,提高用药安全性。
6. 建立完善的药物警戒制度:医疗机构应建立健全的药物警戒制度,包括制定用药管理标准、培训医务人员的警戒意识和技能,以及建立药物不良反应的报告和记录机制,及时处理和分析药物不良事件。
药物警戒的意义不可小视,只有正确实施药物警戒,才能更好地保护患者的用药安全,提高药物治疗的效果。
医务人员应该认真履行自己的职责,不断提升自身的专业水平,提高对药物的警戒意识,做好药物管理工作,以减少药物治疗上可能出现的风险和问题。
同时,患者在用药过程中也要积极主动配合医生的治疗方案,遵循医嘱,及时向医生反馈用药情况和不良反应,共同维护良好的用药安全。
药物警戒与用药安全的关联分析

药物警戒与用药安全的关联分析引言药物警戒是指医疗机构、药店以及公众对于药物使用过程中的不良反应和药物相关问题的监测和控制措施。
药物使用的安全性是公众所关注的重要问题之一。
在药物使用过程中,我们需要认识到药物的潜在风险和副作用,并且采取适当的措施来确保用药的安全性。
本文将分析药物警戒与用药安全的关联,并探讨如何提升用药安全性。
药物警戒的意义药物警戒是保障用药安全的重要环节。
通过药物警戒,我们可以及时了解到药物使用过程中可能出现的不良反应和药物相关问题,以便制定相应的措施来降低药物带来的风险。
药物警戒的意义如下:1. 发现药物安全问题:通过药物警戒,我们能够更好地发现药物使用过程中的不良反应和问题。
这有助于医疗机构及时采取措施,如停药、调整用药剂量等,以减轻患者的痛苦和避免进一步的伤害。
2. 监测药物疗效:药物警戒还可以用于监测药物的疗效。
通过对药物的监测,可以了解到药物是否达到预期的疗效,从而及时调整治疗方案,提高药物的有效性。
3. 数据积累与研究:药物警戒可以为药物研究提供数据支持。
通过对药物使用过程中的不良反应和问题进行收集和分析,可以为相关研究提供参考,从而促进药物的发展与改进。
药物警戒与用药安全的关联药物警戒与用药安全之间存在着密切的关联。
药物警戒旨在发现和解决用药过程中的安全问题,以确保患者和公众的用药安全。
以下是药物警戒与用药安全的关联:1. 提醒用药风险:药物警戒可以提醒患者和公众有关药物的潜在风险和副作用。
人们往往只关注药物的治疗效果,而忽视了药物的风险。
药物警戒提醒我们在用药过程中要注意不良反应和药物相互作用,从而避免出现意外情况。
2. 促进合理用药:药物警戒可以促使医生和患者在用药过程中更加注重合理用药。
合理用药包括用药剂量、用药时间、用药途径等方面的合理选择。
药物警戒可通过提供相关信息与建议,引导医生和患者在用药过程中遵循合理用药的原则,提高用药安全性。
3. 提高药物监管与管理:药物警戒是药物监管与管理工作的重要组成部分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
撤市前的市售时间
其中有87个产品查到了上市的时间
0-1 y 17% 1-2 y 14%
2-5 y 18%
20+ 14%
1970’s的中位时间 = 12.3 y 1980’s的中位时间= 6.2 y 1990’s的中位时间= 2.6 y • 总的中位时间是5.4 y
10-20 y 21%
药物警戒是从 药品研制开始ቤተ መጻሕፍቲ ባይዱ到使用结束的 全过程
药物警戒Pharmacovigilance
60年代,欧美国家建立药物监测体系 1974年法国人首创药物警戒概念,赋予药物安 全新内涵 最终目的是 提高合理、安全用药水平 评估和交流上市药品的风险和效益 教育和告知病人,保障公众用药安全
李一石 从COX-2 抑制剂事件看新药的安全性问题 中国医学论坛报2005-3-31
我国新药临床安全评价存在的问题
临床试验中研究人员知识欠缺,ADR并不被每 位研究人员所掌握
缺乏临床医师进行安全性评价工作
罕见的不可预知的ADR
缺乏IV期安全性评价的研究资料
缺乏新药上市后的再评价体系:
1972-1994年间在英国市场撤市的59种新活性物质的原因37%为安全原因
temafloxacin
Man Fung, Anna Thornton EVALUATION OF THE CHARACTERISTICS OF SAFETY WITHDRAWAL OF PRESCRIPTION DRUGS FROM THE WORLDWIDE PHARMACEUTICAL MARKETS - 1960 TO 1999
Redux (dexfenfluramine) Rezulin (troglitazone) flosequninan zimeldine nomifensine ticrynafen Pondimin (fenfluramine) Propulsid (cisapride) triparanol isoxicam triazolam zomepirac
2003
2004
2005
2006
中国新药杂志2008,17(8):643
撤市药品数量
400 350 300 250 200 150 100 50 0 1994 1995 1996 1997 1998 1999 191 226 304 248 177 362
近年来因为安全原因从市场 上撤出的药品
Duract (bromfenac) Posicor (mibefradil) Seldane (terfenadine)
100,000 50,000 0
83,310 83,517 68,448
1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999
50000 0
Calendar Year
Manufacturer Periodic Reports & Others Direct Reports Manufacturer 15-Day (expedited) Reports
危害用药安全的因素
药品不良反应、药源性损害 药物生产和经营的合理性,与药相关的安全 隐患 错用、滥用、无足够科学根据的说明书外用 法 与药物相关的急慢性中毒 药物-药物、药物-食物相互作用
不良反应种类出现率
统计发现-在所有的药物临床试验与应用中,不良 反应种类出现率
在一般动物毒性试验中只占35%左右 在I期人体耐受试验中只有20%
药物警戒和用药安全监测
-药物预警信息的提取和报告
提纲
引题 我国情况 系统安全 国际有关情况介绍 FDA预警报告、处置方式及举例 仿制药质量与安全 小结
绝对安全的药物 是不存在的
Post-Marketing Adverse Event Reports
300,000
258,125 246,821
terodiline
分布图
在撤市的121种处方药中 42.1% 仅在欧洲市场撤出 5.0% 在北美市场撤出 3.3% 从亚太市场撤出 49.6% 从多个市场撤出 法国、德国和英国撤市的较多
近年来,从多国市场上撤出的情况越来越多
Man Fung, Anna Thornton EVALUATION OF THE CHARACTERISTICS OF SAFETY WITHDRAWAL OF PRESCRIPTION DRUGS FROM THE WORLDWIDE PHARMACEUTICAL MARKETS - 1960 TO 1999
我国年度ADR报告 情况
400000 350000 369000
250,000 200,000 150,000
117,718 136,836 143,597 154,558 189,073
228,611
Number
300000 250000 200000 150000 100000 70000 17000 2002 36800 173000
新药安全性评价监管力度不够
李一石 从COX-2 抑制剂事件看新药的安全性问题 中国医学论坛报2005-3-31
药品供应链- 我们所期待的工作模式
Hospital
Manufacturer
Wholesaler/ Distributor Community Pharmacy
在II、III期临床试验的出现率是35%
在IV期临床试验时出现70% 到市场销售时、用于以前未试过的人群(儿童、
老人、孕妇、重病人等)全部副作用才陆续出现
李一石 从COX-2 抑制剂事件看新药的安全性问题 中国医学论坛报2005-3-31
新药临床试验安全性评价的特殊性
种属差异性: 长期性: 隐匿性: 不可预知性: 种族差异性: 食物、药物的相互影响:
5-10 y 16%
Man Fung, Anna Thornton EVALUATION OF THE CHARACTERISTICS OF SAFETY WITHDRAWAL OF PRESCRIPTION DRUGS FROM THE WORLDWIDE PHARMACEUTICAL MARKETS - 1960 TO 1999
