notch信号通路 PPT课件
Notch信号通路与肿瘤研究进展

段唐海
主要内容
一、Notch信号通路概述 二、Notch信号通路与肿瘤 三、Notch信号通路与肿瘤发生和转移的机制 四、针对 Notch信号通路的靶向治疗 五、展望
一、Notch信号通路概述
• 1916年近代遗传学家Morgan在果蝇体内发现了一 种新基因,当该基因发生突变时会造成部分果蝇 翅膀边缘出现缺刻( Notch ),因此将该基因命 名为Notch基因。1980年Notch基因首次被克隆出 来。
• Notch 信号能增强蛋白激酶 Cθ ( PKCθ ) 的活性及 其膜易位能力。从而通过 IKKɑ/IKKβ/NIK 复合物 增强 NF-κB 的活性,诱导 p50 /p65 异源二聚体 入核, 启动 CyclinD1、Bcl2-A1以及 L7 受体 ɑ 基因,最终增强 NF-κ乳腺癌
• Suruchi 等研究发现, Notch1 在正常乳腺组织中 低表达,而在乳腺癌组织中其表达增加了 3 倍以 上。
• Chen 等研究表明,在乳腺癌细胞株中, Notch1、 Notch2 及 Notch 配体Jagged1 都 有 不 同 程 度 的 表 达, 同时发现 Notch 的靶基因HES1 高表 达。
Notch信号通路的活化
三次酶切:第一次在高尔基体内被furin蛋白酶切割为2个片断,转运到细胞膜形 成异二聚体。当配体结合到胞外区,Notch蛋白又发生两次断裂,首先,ADAM 家族的蛋白酶在靠近胞膜外的部位催化肽键断裂,然后,由早老素(PS)依赖 的γ-分泌酶(γ-secretase)在靠近胞膜内的部位切割,释放 Notch胞内区 (NICD),进入细胞核与转录因子CSL结合, 形成NICD/CSL转录激活复合体, 从而激活HES、HEY、HERP等碱性-螺旋-环-螺旋( basichelix-loop- helix, bHLH )转录抑制因子家族的靶基因,发挥生物学作用。
Notch 信号

Notch基因最早发现于果蝇,部分功能缺失导致翅缘缺刻(notches,图8-36)。
在胚胎发育中,当上皮组织的前体细胞中分化出神经元细胞后,其细胞表面Notch配体Delta与相邻细胞膜上的Notch结合,启动信号途径,防止其它细胞发生同样的分化,这种现象叫作侧向抑制(lateral inhibition)。
Notch突变的半合子[9]或纯合子在胚胎期死亡,其胚胎中神经组织取代了上皮组织从而使神经组织异常丰富。
Notch信号途径由Notch、Notch配体(DSL蛋白)和CSL(一类DNA结合蛋白)等组成。
Notch及其配体均为单次跨膜蛋白,当配体(如Delta)和相邻细胞的Notch结合后,Notch 被蛋白酶体切割,释放出具有核定位信号的胞质区ICN(intracellular domain of Notch),进入细胞核与CLS结合,调节基因表达。
可概括为(图8-37):Delta→Notch→酶切→ICN→进入细胞核→CLS-ICN复合体→基因转录。
图8-36 Notch缺陷引起果蝇翅缘缺刻Notch:为分子量约300KD的蛋白质,果蝇只有1个Notch基因,人类4个(Notch1-4)。
Notch的胞外区是结合配体的区域,具有不同数量的EGF样重复序列(EGF-R)和3个LNR (Lin/Notch repeats)。
胞内区由RAM(RBP-J kappa associated molecular)结构域、6个锚蛋白(cdc10/ankyrin,ANK)重复序列、2个核定位信号[10](NLS)和PEST结构域。
RAM 结构域是与CSL结合的区域,PEST结构域与Notch的降解有关。
Notch蛋白要经过三次切割,第一次在高尔基体内被furin切割为2个片断,转运到细胞膜形成异二聚体。
当配体结合到胞外区,Notch蛋白又发生两次断裂,先是被肿瘤坏死因子-α-转化酶(TNF-α-converting enzyme,TACE)切割,然后被γ-促分泌酶(γ-secretase)切割,后者需要早老蛋白(presenilin,PS)参与。
notch - 概述

notch - 概述
Notch信号传导途径在无脊椎动物和脊椎动物中广泛存在且高度保守。
此途径介导由局部细胞间相互作用而产生的、对多种不成熟细胞分化的抑制信号, 在胚胎发育中起重要作用。
哺乳类动物中Notch途径的功能复杂多样, 参与造血、T细胞发育、血管生成等重要生理过程,并与肿瘤形成和某些神经系统疾病有密切关系。
在多细胞生物的发育中, 需要通过邻近细胞间的相互作用对各谱系细胞分化潜能进行精确的调控。
近年来,首先在果蝇发育的研究中,发现了一条在多种细胞的特化(specification)中起关键作用的传导细胞间相互作用信号的途径, 称为Notch信号途径【1】;随后证实该途径广泛存在于多种动物体内,在进化过程中高度保守,主要介导细胞的分化抑制信号,在胚胎发育、血细胞发育、肿瘤形成等生理病理过程中起重要作用。
参与Notch信号传导的蛋白分子除Notch及其配体Delta/Jagged外,还包括Su(H)/CBF1、Enhancer of split/HES和Groucho/TLE等(斜线前为首先在果蝇中发现的分子,斜线后是哺乳类动物中的同源分子)。
此外还有一类与Groucho/TLE部分同源的分子Grg/hAES(GAM), 也可能参与Notch信号传导的调节。
目前对Notch信号途径的研究已不仅局限于发育生物学领域,而成为一个涉及多个基础医学学科的热门课题。
notch

• 途径可概括为:Delta →Notch→酶切 →ICN→进入细胞核→CLS-ICN复合体 →otch信号通路的激活需要经过3步酶切过程, 有S1、 S2、 S3三个蛋白性裂解位点。S1裂解发生于分泌途径, Notch受体分子前体被高尔基体内的Furin蛋白酶切,形成二 聚体转运到细胞表面 。S2裂解发生在与配体结合之后, Notch受体被金属蛋白酶解离素 (a disintegrin and metalloprotease,ADAM)家族的金属蛋白酶水解,释放胞 外片段,胞内部分黏连在细胞膜上 。后者经 y-促分泌酶(ysecretase) 在S3位点酶切后释放可溶性的Notch胞 内 段 (Notch intracellular domain, NICD)。NICD转移至核内,与转 录因子CSL结合并招募MAML(mastermind-like) 和组蛋白 乙酰基转移酶P300/cAMP反应序列结合 蛋 白(CREB) 结 合 蛋 白(CREB binding protein, CBP) 从而激活靶基因的表 达。
• Notch信号途径由Notch、Notch配体(DSL蛋白) 和CSL(一类DNA结合蛋白)等组成。Notch及 其配体均为单次跨膜蛋白。 • 已知的Notch受体有4种,Notch1、Notch2、 Notch3表达于多种组织器官,其中Notch1的表达更 为广泛。脊椎动物Notch配体分为Delta-like与 Jagged两类,前者包括delta-like1,delta-like3和 delta-like4(又称Delta1,Delta3,Delta4或 Dll1,Dll3,Dll4),后者包括Jagged (Serrate) 1和 Jagged (Serrate) 2
Notch信号通路调节Th1/Th2细胞分 化
角膜损伤修复与notch信号通路

综㊀㊀述 角膜损伤修复与Notch信号通路李宗源㊀综述㊀黄一飞㊀王丽强㊀审校解放军总医院第一医学中心眼科ꎬ北京100853通信作者:王丽强ꎬEmail:liqiangw301@163.com㊀㊀ʌ摘要ɔ㊀Notch信号通路在胚胎期细胞命运转归和成体组织稳态的维持中起重要作用ꎮ各种研究已经证明Notch信号通路在角膜损伤后修复及角膜生理性稳态的维持中有重大意义ꎬ角膜缘干细胞主要通过抑制Notch信号通路来抑制细胞的分化和增生ꎻ在角膜上皮早期修复阶段生理性下调促进细胞迁移和伤口覆盖ꎬ后期修复阶段生理性上调与防止角膜上皮细胞过度分层和维持细胞分化相关ꎻ角膜基质损伤后纤维化与Notch信号通路相关ꎻ角膜内皮损伤后转化生长因子 ̄β(TGF ̄β)诱导的内皮-间质转化(EnMT)过程有Notch信号通路的直接参与ꎻ此外ꎬNotch信号通路与14 ̄3 ̄3σ㊁表皮生长因子受体(EGFR)㊁Sirt6㊁微小RNA(miRNA)㊁基质金属蛋白酶(MMPs)在角膜上皮稳态维持㊁角膜上皮分化㊁角膜基质过度炎症反应㊁角膜新生血管生成等存在相互作用ꎮ本文就Notch信号通路在角膜各层损伤修复中的功能进行综述ꎮʌ关键词ɔ㊀角膜疾病ꎻ修复ꎻ再生ꎻ信号转导ꎻNotch通路基金项目:国家重点研发计划项目(2017YFA0103200)ꎻ北京市自然科学基金项目(18L2195)DOI:10.3760/cma.j.issn.2095 ̄0160.2020.02.013CornealwoundhealingandtheNotchsignalingpathwayLiZongyuanꎬHuangYifeiꎬWangLiqiangDepartmentofOphthalmologyꎬPLAGeneralHospitalꎬBeijing100853ꎬChinaCorrespondingauthor:WangLiqiangꎬEmail:liqiangw301@163.com[Abstract]㊀TheNotchsignalingpathwayplaysanimportantroleincellfateandhomeostasis.VariousstudieshaveprovedthattheNotchsignalingpathwayhasstrongeffectsoncornealwoundhealingandthemaintenanceofcornealhomeostasis.LimbalstemcellsinhibitdifferentiationandproliferationbyinhibitingtheNotchsignalingpathway.Physiologicdownregulationpromotescellmigrationandwoundcoverageintheearlystageofcornealepithelialrepairꎬandphysiologicupregulationinthelatestageofcornealepithelialrepairisrelatedtopreventingexcessivestratificationofcornealepithelialcellsandmaintainingcelldifferentiation.FibrosisiscorrelatedwithNotchaftercornealstromalinjury.TheNotchsignalingpathwayisdirectlyinvolvedintheendothelial ̄to ̄mesenchymaltransitioninducedbytransforminggrowthfactor ̄βaftercornealendothelialinjury.InadditionꎬthereareinteractionsbetweentheNotchsignalingpathwayand14 ̄3 ̄3sigmaꎬepidermalgrowthfactorreceptorꎬSirt6ꎬmicroRNAꎬandmatrixmetalloproteinasesinmaintainingcornealepithelialhomeostasisꎬcornealepithelialdifferentiationꎬcornealstromalexcessiveinflammatoryresponseꎬcornealneovascularizationꎬetc.ThisreviewsummarizesthefunctionoftheNotchsignalingpathwayincornealwoundhealing.[Keywords]㊀CornealdiseaseꎻRepairꎻRegenerationꎻSignalingtransductionꎻNotchsignalingpathwayFundprogram:NationalKeyR&DProgramofChina(2017YFA0103200)ꎻBeijingMunicipalNaturalScienceFoundation(18L2195)DOI:10.3760/cma.j.issn.2095 ̄0160.2020.02.013㊀㊀角膜盲是全球第二大致盲疾病ꎬ而全球供体角膜的匮乏制约着角膜移植手术的普及ꎬ因此角膜损伤修复机制的研究对于发现潜在的治疗靶点尤为重要ꎮNotch信号通路是胚胎发育和组织稳态中发挥细胞间信号传递和决定细胞命运转归的一条高度保守的信号通路ꎬ是调节多种组织和细胞增生㊁分化和凋亡的关键通路[1]ꎮNotch信号通路包括经典和非经典通路[2-3]ꎮ经典Notch信号通路是由相邻细胞间的配体-受体相互作用引发的ꎬ通过Notch胞内区(NotchintracellulardomainꎬNICD)㊁RBP ̄Jκ家族核蛋白复合基因[哺乳动物的RBP ̄J㊁果蝇的Su(H)和秀丽隐杆线虫的Lag ̄1]和Mastermind活化Hes1基因ꎮ非经典Notch信号通路广义上包括不通过RBP ̄Jκ和Hes/Hey基因活化的几种Notch表达活性的模式[2]ꎮNotch信号异常与各种疾病综合征和恶性疾病相关ꎬ包括发育畸形㊁神经退行性疾病㊁代谢紊乱等ꎮ角膜由5层构成ꎬ各层来源不同ꎮ角膜上皮来源于表皮外胚层ꎬ角膜基质层和内皮层来源于神经外胚层ꎬ前弹力层由基质前层前部细纤维形成ꎬ后弹力层由内皮细胞分泌形成[4]ꎮ角膜透明ꎬ无血管ꎬ有弹性ꎬ具有较大的屈光度ꎬ表面被泪膜覆盖ꎮ角膜作为前部屏障可保护眼表免受各种来自物理㊁化学以及微生物感染的损伤ꎬ因此角膜需要强大的持续自我更新能力和快速的伤口愈合反应ꎬ这一过程需要细胞增生㊁迁移㊁分化和凋亡之间的协调作用ꎮ正常情况下角膜上皮1 5mm的损伤可在24h内愈合[5]ꎬ这种损伤后快速修复对于维持视力和角膜屏障功能至关重要ꎮ目前研究表明多种信号通路和生长因子参与角膜稳态和伤口愈合的调节[6]ꎬ但精确的分子机制仍未完全明确ꎮ本研究就角膜损伤修复过程中Notch经典通路的作用进行综述ꎬ并展望了角膜损伤修复的新靶点和新策略ꎮ1㊀Notch信号通路Notch信号通路是广泛使用的细胞间通信通路ꎬ决定着不同细胞的命运转归ꎮNotch基因最早在1917年黑腹果蝇中发现ꎬ因其功能缺失造成果蝇翅膀边缘缺刻(Notch)而命名ꎮ过去几十年的研究认为Notch信号通路是一种进化上广泛存在㊁高度保守且复杂的信号传导通路ꎮ与其他细胞间信号通路相比ꎬNotch通路有其独特性ꎮ首先ꎬ经典Notch信号以近分泌的方式传递信号ꎬ意味着信号传递发生在相邻细胞之间并且需要细胞直接接触ꎬ而大多数信号通路ꎬ如Wnt通路是依赖旁分泌传递信号ꎬ通过扩散和/或主动运输将分泌的配体运至远处靶细胞ꎮ这一独特性与经典Notch通路嵌入细胞膜中的跨膜蛋白相关ꎮ其次ꎬNotch信号通路缺乏信号放大和二次利用信号能力ꎬ因此对细胞表面传递到细胞核的信号强度非常敏感ꎬ在生理环境中Notch通路各级联信号的严格调节对最佳信号传递起到至关重要的作用ꎮ例如ꎬNotch信号通路在果蝇发育中利用侧抑制来决定细胞命运转归㊁选择细胞分化方向等[7]ꎮ另外ꎬ调节Notch信号通路可引起细胞广泛的增生㊁分化或凋亡ꎮ1.1㊀Notch信号通路的组成及激活Notch信号通路包括Notch受体㊁Notch配体㊁DNA结合蛋白(CBF ̄1SuppressorofhairlessLagꎬCSL)㊁相关调节因子和靶基因等ꎮNotch受体(Notch1㊁2㊁3和4)是由胞外区㊁跨膜区和NICD组成的一种单次跨膜糖蛋白ꎻNotch配体包括Delta ̄like家族(DLL1㊁DLL3和DLL4)㊁Jagged家族(Jagged1和Jagged2)和DSL蛋白(Delta㊁Serrate和Lag ̄2)ꎮ近期研究发现ꎬDelta ̄like配体属于频率调控ꎬDLL1触发活动脉冲信号ꎬ随后信号衰减ꎬDLL4维持Notch的长期活性[8]ꎮ转录因子CSL在Notch信号通路中识别并结合Notch诱导基因启动子特定的DNA序列ꎮNotch下游靶基因包括E/sp1㊁HES㊁HEY㊁细胞周期蛋白D1㊁NRARP和survivin等ꎮNotch信号通路激活过程为:(1)Notch蛋白经过3次剪切(S1㊁S2㊁S3)ꎬ由NICD释放入细胞质ꎻ(2)进入细胞核与转录因子CSL结合ꎬ形成NICD/CSL转录激活复合体ꎻ(3)HES㊁HEY㊁HERP等碱性-螺旋-环-螺旋转录抑制因子家族靶基因的激活ꎮ1.2㊀Notch基因在角膜中的表达目前的研究已广泛认同Notch信号通路是一条在发育过程中决定细胞命运的重要通路ꎬ在组织和细胞中参与分化㊁增生和迁移等重要功能ꎮNotch基因在角膜中研究源自小鼠皮肤Notch1条件性敲除模型中角膜上皮出现了异常增生和角质化改变ꎮ最新研究表明Notch信号通路与角膜发育㊁增生㊁分化㊁迁移㊁损伤修复等直接相关ꎮ通过逆转录聚合酶链反应分析人角膜上皮细胞Notch信号通路相关基因的表达ꎬNotch1㊁Notch2㊁DELTA1㊁Jagged1㊁Jagged2㊁HES1和HES5高表达ꎻDelta4㊁HES2㊁HEY1㊁HEY2和HEY低表达ꎬ且不能排除非上皮来源的可能ꎻ在人角膜上皮中未检测到Notch3㊁Notch4㊁Delta3和Hes3的表达[9]ꎮ在角膜不同部位Notch基因的表达也不尽相同ꎬ通过比较人角膜缘和中央角膜上皮Notch相关基因表达发现ꎬNotch1受体和Jagged1配体在角膜缘的表达高于角膜中央上皮ꎬ且主要表达于角膜上皮的基底层ꎻNotch下游靶基因HES1和HES5在中央角膜上皮的表达显著高于角膜缘ꎻNotch2㊁Delta1和Jagged2表达在两者之间差异均无统计学意义[9]ꎮ也有研究认为在成年大鼠角膜中ꎬNotch受体仅在上皮基底层表达ꎬ可能是由于一抗的选择或样品保存处理差异导致的Notch在时间和空间表达的改变[10]ꎮ2㊀角膜损伤修复与Notch信号通路角膜损伤修复是一个涉及细胞凋亡㊁迁移㊁增生㊁分化和细胞外基质(excetralcellularmatrixꎬECM)重塑的复杂过程[11]ꎮ角膜上皮细胞㊁角膜基质细胞㊁角膜神经和免疫细胞之间的自分泌和旁分泌细胞因子介导的固有级联反应控制着这一过程[12]ꎮ角膜上皮细胞㊁基质细胞和内皮细胞的损伤修复过程有一定相似性ꎬ如3种不同层细胞修复均与细胞迁移相关ꎬ依赖生长因子和ECM的重塑ꎮ角膜上皮与角膜基质修复之间还存在交叉影响ꎬ如基质细胞生成的基质细胞生长因子(keratinocytegrowthfactorꎬKGF)和肝细胞生长因子(hepatocytegrowthfactorꎬHGF)影响上皮修复ꎻ上皮细胞分泌的白细胞介素 ̄1(interleukin ̄1ꎬIL ̄1)和血小板衍生生长因子(plateletderivedgrowthfactorꎬPDGF)调节基质损伤后反应ꎻ胰岛素样生长因子(insulinlikegrowthfactorsꎬIGF)和转化生长因子β(transforminggrowthfactor ̄βꎬTGF ̄β)可调节上皮细胞和基质细胞向肌成纤维细胞转化等[6]ꎮ除此之外ꎬ角膜各层细胞还存在特异性差异ꎮ2.1㊀角膜上皮损伤修复2.1.1㊀角膜上皮修复的生理过程㊀角膜上皮是一种外胚层衍生㊁无角质化㊁有独特角蛋白ꎬ有自我更新能力的组织ꎬ厚度为48~53μm[13]ꎮ角膜上皮是由一系列紧密连接细胞组成的屏障ꎬ厚7~8层ꎬ包括微绒毛㊁表层细胞㊁翼状细胞㊁基底细胞等附着在基底膜ꎮ细胞间通过桥粒彼此连接ꎬ通过缝隙连接在层与层之间传递信号ꎮ角膜上皮作为最外层ꎬ易于受伤且需要快速修复以防止更深层感染ꎮ角膜上皮修复是通过位于角膜缘的角膜缘干细胞(limbalstemcellsꎬLSCs)功能来实现的ꎬ解剖学上角膜缘为LSCs提供了独特的角膜缘微环境ꎮ功能上ꎬ角膜缘栅栏结构被血管网包围ꎬ血管网可阻断T淋巴细胞和抗原递呈细胞浸润ꎬ也可为LSCs提供充足营养和氧气ꎮ目前关于角膜上皮损伤修复的主流假说包括角膜缘上皮干细胞(corneallimbalepithelialstemcellsꎬLESCs)假说和角膜上皮干细胞假说ꎮ临床研究中发现ꎬ在角膜缘干细胞缺陷的情况下ꎬ单纯的穿透角膜移植必将失败[14]ꎬ表明LESCs对于角膜上皮的长期再生具有重要作用ꎮ因此LESCs假说仍是解释角膜上皮稳态和损伤修复较合理的机制ꎮ角膜上皮损伤后修复很大程度上取决于角膜缘干细胞和基底膜重塑ꎬ包括初始潜伏期和闭合期2个动力学阶段[15]ꎮ初始阶段无细胞运动ꎬ细胞数量也无明显变化ꎬ但代谢活动增加ꎬ可观察到细胞微结构重组ꎮ这一阶段伴随细胞骨架蛋白和整合蛋白ꎬ如α6和β4的合成增加[16]ꎮ闭合阶段包括细胞迁移㊁增生和分化ꎮ细胞迁移是伤口周边细胞迁移后覆盖缺损区域ꎻ细胞增生㊁分化是指上皮细胞经这2个过程后通过分层恢复原始复层结构ꎬ并与基底建立连接ꎮ上述阶段并非单一有序进行ꎬ覆盖受伤区域㊁恢复细胞密度和细胞附着建立是同步的ꎮ当角膜上皮再生机制失效时ꎬ会发生角膜上皮持续缺损ꎮ2.1.2㊀角膜上皮的损伤修复与Notch信号通路㊀Notch信号通路与角膜上皮损伤修复有密切联系ꎬ但Notch影响上皮细胞增生的机制至今仍不明ꎮNotch基因功能具有双向性ꎬ一方面增强Notch活性可刺激上皮细胞增生ꎬ从而有效地促进角膜创伤愈合ꎻ另一方面Notch可以抑制角膜上皮增生ꎮ这种特性可能与Notch信号通路所在部位和信号强度相关ꎮ生理状态下ꎬNICD的过表达不会引起角膜上皮细胞增生和分化异常ꎬ但增强Notch1活性可在损伤后早期刺激角膜上皮细胞增生ꎬ通过改变角膜上皮动力学有效促进角膜创伤愈合ꎮ在损伤修复中增加Notch1活性有助于角膜上皮细胞增生ꎬ这可能是某些创伤反应因子提高了靶细胞对Notch信号的敏感性[5]ꎮ在体内损伤模型中ꎬHes1的表达与细胞增生活性呈正相关ꎬ而在体外三维培养模型中Hes1的过表达却抑制细胞增生[17]ꎮ这种看似矛盾的现象正是Notch通路双向性的体现ꎮ通过进一步建立体内和体外Notch抑制模型ꎬ发现抑制Notch通路加速角膜上皮细胞迁移和伤口闭合ꎬ但这一过程与细胞迁移相关ꎬ与细胞增生无关ꎮ此外ꎬ抑制Notch信号通路还将降低细胞-基质黏附和肌动蛋白细胞骨架改变ꎬ这些都与促进细胞迁移相关[5]ꎮNotch1基因敲除小鼠(Notch1-/-)角膜上皮损伤后细胞再生延迟㊁紧密连接形成延迟且无法恢复角膜上皮的屏障功能ꎮ除此之外ꎬNotch1-/-小鼠出生后4~6周ꎬ角膜基质开始混浊ꎬ组织病理学检查提示有明显的炎症㊁溃疡和新生血管形成[18-19]ꎮNotch信号通路在不同损伤修复阶段表现不同ꎮNotch1表达水平在角膜损伤早期明显下调ꎬ在损伤后期恢复ꎮ角膜伤口愈合早期阶段(4h)ꎬ抑制Notch信号通路对伤口周边上皮细胞形态和层数无显著影响ꎮ在上皮损伤修复的后期阶段(24h)ꎬ抑制Notch信号通路则显著促进上皮细胞分层和再上皮化ꎮ由此可见ꎬNotch信号通路在角膜上皮早期修复阶段生理性下调会促进细胞迁移和伤口覆盖ꎬ在后期修复阶段生理性上调可能与防止角膜上皮细胞过度分层和维持细胞的分化相关ꎮ在角膜上皮损伤修复过程中ꎬNotch通路与其他基因和小分子化合物具有联系和交叉作用ꎮ(1)14 ̄3 ̄3σ与P63㊀14 ̄3 ̄3σ是stratifin蛋白家族中一员ꎬ特异性表达在分化的鳞状上皮中ꎬ在细胞信号转导和细胞周期调节中起重要作用ꎬ与皮肤上皮分层和分化相关[20]ꎮ在表皮基底祖细胞中14 ̄3 ̄3σ表达被p63抑制ꎬ当表皮祖细胞分化时p63表达减少ꎬ进而诱导14 ̄3 ̄3σ表达增加ꎮ通过对14 ̄3 ̄3σ突变Er小鼠模型的研究ꎬ确定了14 ̄3 ̄3σ在调控表皮上皮发育和分化中的作用[21]ꎮ14 ̄3 ̄3σ是角膜上皮细胞稳态的关键调节因子ꎬ对于调控角膜上皮细胞增生和分化是必需的ꎮ当14 ̄3 ̄3σ活性被抑制时ꎬNotch1和Notch2转录减少ꎬ同时出现上皮细胞增生和分化异常ꎻ当以过表达方式恢复Notch活性时ꎬ上皮细胞增生和分化异常均得到改善[22]ꎮ由此说明在角膜上皮干前体细胞分化过程中ꎬ14 ̄3 ̄3σ调控上游Notch1的表达ꎬ在调节角膜上皮细胞分化中起重要作用[23]ꎮ(2)表皮生长因子受体(epidermalgrowthfactorreceptorꎬEGFR)与p53㊀EGFR是表皮生长因子受体家族成员之一ꎬ通过下调p53基因转录负调控Notch1基因表达ꎬ抑制EGFR信号可增强Notch通路并增强上皮细胞分化ꎮ若改变角膜上皮EGFR通路ꎬ将导致细胞凋亡增加㊁细胞增生减少ꎬ伤口愈合延迟[24]ꎮ(3)Sirt6㊀组蛋白去乙酰化酶Sirt6是角膜炎症反应的关键调控因子ꎬ与角膜上皮损伤修复㊁维持上皮完整性和角膜透明度相关ꎮSirt6缺乏将导致角膜上皮伤口不完全愈合和愈合时间延迟ꎻ还与角膜基质的过度炎症反应和Notch通路异常相关ꎬ这些最终导致角膜上皮角质化和角膜混浊的发生[25]ꎮ(4)微小RNA(microRNAꎬmiRNA)㊀miRNA在干细胞的维持和分化中发挥作用ꎮ角膜上皮以丰富的糖原储备为主要能量来源ꎮmiR ̄31通过负调控抑制缺氧诱导因子(factorinhibitinghypoxiainduciblefactor ̄1ꎬFIH ̄1)维持角膜上皮细胞中糖原的代谢[26]ꎮNotch通路部分通过miR ̄31/FIH ̄1来影响上皮细胞分化ꎬFIH ̄1对Notch羟基化ꎬ下调Notch通路ꎬ负调节角膜上皮细胞分化[27]ꎮ由于FIH ̄1蛋白在角膜缘上皮细胞中大量存在ꎬ但在角膜上皮细胞中几乎不存在ꎬ还可推断在角膜缘中低水平miR ̄31和高水平FIH ̄1(其减弱Notch通路信号)可能是维持角膜缘上皮祖细胞未分化表型的一种机制[27]ꎮmiR ̄184参与细胞发育㊁增生和迁移等重要过程ꎮmiR ̄184的不同突变与晶状体㊁角膜营养不良和家族性圆锥角膜等相关ꎮ最近研究表明ꎬmiR ̄184在角膜上皮细胞中通过调节Notch和p63之间的平衡ꎬ在Notch通路及其上游抑制上皮细胞的增生作用ꎬ也可直接抑制K15和FIH1加强Notch依赖性的上皮细胞分化作用[28]ꎮ(5)基质金属蛋白酶(matrixmetalloproteinaseꎬMMPs)㊀MMPs是一种维持ECM重塑和血管生成平衡的关键因子ꎮ除了参与形成ECM外ꎬ角膜在修复过程中还会合成多种MMPsꎬ包括MMP ̄1㊁MMP ̄2㊁MMP ̄3㊁MMP ̄9和MMP ̄14[29]ꎮMMP ̄12通过增强上皮细胞迁移和中性粒细胞浸润促进角膜上皮损伤后早期修复过程ꎬ在涉及角膜全层损伤的化学损伤模型中ꎬ对预防角膜纤维化也具有积极作用[30]ꎮMMP ̄14是一种跨膜MMPꎬ主要参与ECM蛋白水解㊁外泌体运输和细胞迁移等功能ꎬ对角膜新生血管的生成至关重要ꎮ在小鼠角膜受损模型中MMP ̄14的过度表达可降低Ⅲ型胶原和α平滑肌肌动蛋白(α ̄smoothmuscleactinꎬα ̄SMA)的表达来预防角膜纤维化ꎬ维持角膜的透明性[29]ꎮMMP ̄14对Notch信号有负调控作用ꎬMMP ̄14通过切割Notch配体DLL1ꎬ抑制Notch1信号ꎻ抑制MMP ̄14增强了Notch信号ꎬ表明MMP ̄14与Notch之间存在负反馈调节通路ꎮ2.1.3㊀角膜上皮损伤修复与角膜基质的联系㊀角膜基质细胞表达许多对上皮细胞具有特异性作用的生长因子和细胞因子ꎬ如表皮生长因子(epidermalgrowthfactorꎬEGF)㊁PDGF㊁TGF ̄α㊁TGF ̄β㊁成纤维细胞生长因子1(fibroblastgrowthfactor ̄1ꎬFGF ̄1)㊁FGF ̄2㊁IGF ̄I㊁KGF㊁HGF㊁胸腺素㊁IL ̄1㊁IL ̄6㊁IL ̄10ꎬ以及肿瘤坏死因子αꎬ这些因子也与角膜上皮损伤修复密切相关[11]ꎮ这些小分子是角膜上皮细胞的强有丝分裂原ꎬ临床上也以滴眼液或药物与角膜接触镜相结合的形式局部促进角膜上皮细胞增生ꎬ加速上皮伤口愈合[12]ꎮ2.2㊀角膜基质的损伤修复角膜基质细胞和角膜成纤维细胞产生大量的ECM成分ꎬ如巢蛋白 ̄1㊁巢蛋白 ̄2和基底膜蛋白ꎬ这些成分对于正常生理状态维持和基质完全再生是必要的[31]ꎮ角膜基质损伤后修复通常取决于损伤类型和程度ꎮ角膜基质损伤后首要变化是损伤部位周围基质细胞群凋亡ꎬ细胞凋亡是由细胞因子ꎬ如上皮细胞分泌的IL ̄1诱导ꎮ角膜基质修复早期阶段ꎬ伤口周围基质细胞活化为成纤维细胞ꎬ重新获得迁移能力并进入细胞周期ꎬ这些损伤后产生的成纤维细胞分泌的ECM不同于正常基质细胞ꎬ如肌腱蛋白和纤维连接蛋白仅在修复组织中合成[32]ꎮ这些成纤维细胞通过肌动蛋白细胞骨架重塑ꎬ从星状变为细长状并获得应力ꎮ成纤维细胞还将下调基质细胞蛋白的表达ꎬ并分泌重塑ECM所需的蛋白酶ꎬ主要是MMP[32]ꎮ到达损伤部位后ꎬ成纤维细胞开始表达α ̄SMA和肌间线蛋白并上调波形蛋白表达ꎬ最终转化为介导伤口闭合具有高度运动能力的肌成纤维细胞[33]ꎮ肌成纤维细胞的角膜晶体蛋白表达减少ꎬ分泌异常ECMꎬ是导致角膜基质纤维化和角膜混浊的主要病理过程[34]ꎮ一旦肌成纤维细胞介导的基质伤口愈合后ꎬ基质中肌成纤维细胞数量会缓慢减少ꎮ在受伤数月或数年后ꎬ这些肌成纤维细胞及其产生的混浊基质在上皮基底膜(epithelialbasementmembraneꎬEBM)完全再生后ꎬ被规则的角膜ECM缓慢取代[35]ꎬ逐渐恢复角膜透明性ꎮ这一过程中肌成纤维细胞和基质细胞相互竞争ꎬ最终角膜基质细胞将吸收杂乱无序的细胞外基质并重新组成前基质[36]ꎮEBM的再生是决定角膜基质是否完全再生的关键因素ꎬ包括透明性和视力恢复[36]ꎮ再生EBM的异常结构和功能使上皮来源的生长因子ꎬ如PDGF和TGF ̄β(只有TGF ̄β1和TGF ̄β2在这个过程中具有活性[37]ꎬTGF ̄β3具有抗瘢痕形成的效果[38-39])长期进入角膜基质ꎬ这两者在前基质细胞中持续存在ꎬ诱导前体细胞分化为肌成纤维细胞[11]ꎮ根据目前的研究认为ꎬNotch信号可能与角膜基质损伤后纤维化相关ꎬ但总体看Notch信号在角膜基质细胞损伤修复过程中调节能力有限[10]ꎮ2.3㊀角膜内皮的损伤修复2.3.1㊀角膜内皮修复的生理过程㊀角膜内皮由单层大小均匀㊁低阻力紧密连接的六边形细胞组成ꎮ角膜内皮细胞维持正常形态特征ꎬ保持完整紧密连接和正常细胞密度ꎬ对于保持角膜脱水化㊁透明和维持视力至关重要[40]ꎮ成人角膜内皮细胞(cornealendothelialcellsꎬCECs)在体内具有低丝分裂活性ꎬ原因是缺乏有丝分裂刺激ꎬ细胞接触抑制和房水中抗有丝分裂因子存在ꎮ角膜内皮细胞ꎬ特别是人角膜内皮细胞ꎬ增生能力差ꎬ体外难以培养ꎬ易发生内皮间质转化(endothelialtomesenchymaltransitionꎬEnMT)和细胞衰老[41]ꎬ近年研究表明ROCK抑制剂Y ̄27632对于包括兔㊁灵长类和人的角膜内皮细胞的迁移㊁黏附起增强作用[42-43]ꎮ角膜内皮损伤修复与上皮和基质显著不同ꎮ内皮损伤后不同动物的修复方式不同ꎬ在兔中损伤周围的内皮细胞通过细胞移行和有丝分裂修复伤口ꎬ在成人角膜内皮受伤后仅依靠角膜缘内皮细胞向中心移行和损伤周围细胞扩大愈合伤口ꎬ当角膜内皮密度<500/mm2时会发生角膜内皮失代偿ꎬ出现大泡性角膜病变[40]ꎮ近些年研究表明ꎬCECs在受到化学㊁机械或其他损伤后发生EnMTꎬ主要通过TGF ̄β介导细胞迁移和扩大愈合伤口ꎮEnMT包括内皮细胞形态特征和分泌ECM改变ꎮECM改变包括钙黏蛋白下调ꎬⅣ型胶原基底膜转变为Ⅰ型胶原基底膜和肌成纤维细胞引起的α ̄SMA表达增加等ꎮ已知作为有丝分裂原影响内皮细胞移行以促进内皮迁移和伤口愈合的生长因子包括EGF㊁PDGF ̄BB和FGF ̄2等ꎮ此外ꎬIL ̄1β和血管内皮生长因子(vascularendothelialgrowthfactorꎬVEGF)也促进内皮细胞迁移ꎻIGF ̄Ⅰ和IGF ̄Ⅱ对细胞迁移无明显影响ꎬIL ̄4会降低细胞的迁移能力ꎮ2.3.2㊀角膜EnMT与Notch信号通路㊀近期研究表明胚胎时期Notch信号通路在有效区域激活EnMT[44]ꎬNotch信号通路激活后内皮细胞发生与EnMT相一致的形态学和功能改变ꎮ体外培养人内皮细胞第1代可检测Jagged1㊁Jagged2㊁Notch1㊁Notch2和Hes1等Notch相关基因表达ꎬ并在后续代数中更为显著ꎬNotch抑制剂DA几乎完全阻断TGF ̄β诱导的EnMT也证实Notch通路位于TGF ̄β信号下游的观点ꎮTGF ̄β诱导在CECs的EnMT和角膜后纤维膜(retrocornealfibrousmembraneꎬRCFM)形成中起重要作用ꎮ抑制这一靶点可预防损伤性角膜内皮纤维化ꎮ在体外培养内皮细胞过程中ꎬVEGF可诱导Notch1受体和Notch配体DLL4的表达ꎮNotch通过上调MMP ̄9和MMP ̄14在VEGF下游起作用ꎬMMP ̄14通过切割Notch配体DII1ꎬ负调节Notch信号传导[29]ꎮ在体冻伤模型中ꎬ局部应用DAPT可显著减轻角膜水肿ꎬ提高透明度ꎬ后期RCFM的形成明显减少ꎬ可能与DAPT抑制EnMTꎬCECs密度升高改善角膜内皮功能相关[45]ꎮ以上体内体外均证实了EnMT与Notch信号通路的相关性ꎮ由于角膜植片来源匮乏ꎬ通过抑制Notch信号通路减轻CECs的EnMT可为组织工程角膜内皮植片提供可靠的内皮种子细胞ꎬ也为预防内皮损伤后RCFM形成提供新的治疗思路ꎮ3 展望Notch信号通路调节全身各器官组织发育和出生后细胞命运转归以及维持体内稳态起到至关重要作用ꎮNotch信号通路在不同时间㊁不同组织㊁不同水平中起作用ꎮ此外ꎬNotch信号通路在调节细胞命运上存在物种和组织特异性差异ꎮ例如Notch信号通路在肌肉祖细胞自我更新㊁胚胎发育分化和成年组织稳态中发挥不同功能[46]ꎻ在调节视网膜前体细胞分化为视网膜神经节细胞过程中起着重要的作用[47]ꎻ在角膜损伤修复不同阶段Notch信号通路相关蛋白表达量㊁表达部位和功能均不同[11ꎬ35ꎬ48]ꎮ由于Notch通路调节 双向性 ꎬ时间和信号强度在不同组织稳态维持中具有特异性ꎮ同一组织中ꎬNotch又与p63㊁p53㊁14 ̄3 ̄3σ㊁EGFR㊁Sirt6㊁miRNA㊁MMPs等基因或小分子化合物存在交叉作用ꎮ由此可见ꎬNotch信号通路对于机体组织的调控远比我们目前认识的复杂ꎮXiang等[49]报道了Notch抑制剂DAPT与其他4种小分子化合物联用(腺苷酸环化酶激活剂FSK㊁TGF ̄β抑制剂SB43㊁Wnt抑制剂IWP2和BMP抑制剂LDN193189)实现了体外抑制EMT并维持终末分化细胞特性ꎮ在角膜研究中发现体外大鼠LESCs主要通过抑制Notch信号通路抑制细胞的分化和增生[50]ꎮ以上为角膜损伤修复再生提供了新的思路ꎬ多条通路的靶点共同干预是否比单一通路靶点进行干预更有效促进组织损伤后修复和再生仍不清楚ꎮ在未来研究中ꎬ可以将Notch通路和其他经典通路的交互作用作为研究重点ꎬ研究多通路协同修复损伤的机制以发现新的潜在治疗靶点ꎬ为预防和治疗角膜盲提供新的策略ꎮ利益冲突㊀所有作者均声明不存在利益冲突参考文献[1]BraySJ.Notchsignalling:asimplepathwaybecomescomplex[J].NatRevMolCellBiolꎬ2006ꎬ7(9)ʒ678-689.DOI:10.1038/nrm2009. [2]KopanRꎬIlaganMX.ThecanonicalNotchsignalingpathway:unfoldingtheactivationmechanism[J].Cellꎬ2009ꎬ137(2)ʒ216-233.DOI:10.1016/j.cell.2009.03.045.[3]SanalkumarRꎬDhaneshSBꎬJamesJ.Non ̄canonicalactivationofNotchsignaling/targetgenesinvertebrates[J].CellMolLifeSciꎬ2010ꎬ67(17)ʒ2957-2968.DOI:10.1007/s00018 ̄010 ̄0391 ̄x. [4]GrawJ.Thegeneticandmolecularbasisofcongenitaleyedefects[J].NatRevGenetꎬ2003ꎬ4(11)ʒ876-888.DOI:10.1038/nrg1202. [5]LuHꎬLuQꎬZhengYꎬetal.Notchsignalingpromotesthecornealepitheliumwoundhealing[J].MolVisꎬ2012ꎬ18ʒ403-411. [6]YuFSꎬYinJꎬXuKꎬetal.Growthfactorsandcornealepithelialwoundhealing[J].BrainResBullꎬ2010ꎬ81(2-3)ʒ229-235.DOI:10.1016/j.brainresbull.2009.08.024.[7]LaydenMJꎬMartindaleMQ.Non ̄canonicalNotchsignalingrepresentsanancestralmechanismtoregulateneuraldifferentiation[J/OL].Evodevoꎬ2014ꎬ5ʒ30[2019-02-01].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4335385/.DOI:10.1186/2041 ̄9139 ̄5 ̄30. [8]MegasonSG.Dynamicencodinginthenotchpathway[J].DevCellꎬ2018ꎬ44(4)ʒ411-412.DOI:10.1016/j.devcel.2018.02.006. [9]DjalilianARꎬNamavariAꎬItoAꎬetal.Down ̄regulationofNotchsignalingduringcornealepithelialproliferation[J].MolVisꎬ2008ꎬ14ʒ1041-1049.[10]MaAꎬZhaoBꎬBoultonMꎬetal.AroleforNotchsignalingincornealwoundhealing[J].WoundRepairRegenꎬ2011ꎬ19(1)ʒ98-106.DOI:10.1111/j.1524 ̄475X.2010.00648.x.[11]LjubimovAVꎬSaghizadehM.Progressincornealwoundhealing[J].ProgRetinEyeResꎬ2015ꎬ49ʒ17-45.DOI:10.1016/j.preteyeres.2015.07.002.[12]ZiaeiMꎬGreeneCꎬGreenCR.Woundhealingintheeye:Therapeuticprospects[J].AdvDrugDelivRevꎬ2018ꎬ126ʒ162-176.DOI:10.1016/j.addr.2018.01.006.[13]OieYꎬNishidaK.Regenerativemedicineforthecornea[J/OL].BiomedResIntꎬ2013ꎬ2013ʒ428247[2019-03-01].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3876767/.DOI:10.1155/2013/428247.[14]LangSJꎬBöhringerDꎬGeerlingGꎬetal.Long ̄termresultsofallogenicpenetratinglimbo ̄keratoplasty:20yearsofexperience[J].Eye(Lond)ꎬ2017ꎬ31(3)ʒ372-378.DOI:10.1038/eye.2016.217. [15]LiuCYꎬKaoWW.Cornealepithelialwoundhealing[J].ProgMolBiolTranslSciꎬ2015ꎬ134ʒ61-71.DOI:10.1016/bs.pmbts.2015.05.002.[16]HynesRO.Integrins:bidirectionalꎬallostericsignalingmachines[J].Cellꎬ2002ꎬ110(6)ʒ673-687.DOI:10.1016/s0092 ̄8674(02)00971 ̄6. [17]NakamuraTꎬOhtsukaTꎬSekiyamaEꎬetal.Hes1regulatescornealdevelopmentandthefunctionofcornealepithelialstem/progenitorcells[J].StemCellsꎬ2008ꎬ26(5)ʒ1265-1274.DOI:10.1634/stemcells.2007 ̄1067.[18]VauclairSꎬMajoFꎬDurhamADꎬetal.CornealepithelialcellfateismaintainedduringrepairbyNotch1signalingviatheregulationofvitaminAmetabolism[J].DevCellꎬ2007ꎬ13(2)ʒ242-253.DOI:10.1016/j.devcel.2007.06.012.[19]MovahedanAꎬAfsharkhamsehNꎬSaghaHMꎬetal.LossofNotch1disruptsthebarrierrepairinthecornealepithelium[J/OL].PLoSOneꎬ2013ꎬ8(7)ʒe69113[2019-02-13].https://www.ncbi.nlm.nih.gov/pubmed/23874882.DOI:10.1371/journal.pone.0069113. [20]PellegriniGꎬDellambraEꎬGolisanoOꎬetal.p63identifieskeratinocytestemcells[J].ProcNatlAcadSciUSAꎬ2001ꎬ98(6)ʒ3156-3161.DOI:10.1073/pnas.061032098.[21]LiQꎬLuQꎬEstepaGꎬetal.Identificationof14 ̄3 ̄3sigmamutationcausingcutaneousabnormalityinrepeated ̄epilationmutantmouse[J].ProcNatlAcadSciUSAꎬ2005ꎬ102(44)ʒ15977-15982.DOI:10.1073/pnas.0508310102.[22]LuQꎬXinYꎬYeFꎬetal.14 ̄3 ̄3σcontrolscornealepitheliumhomeostasisandwoundhealing[J].InvestOphthalmolVisSciꎬ2011ꎬ52(5)ʒ2389-2396.DOI:10.1167/iovs.09 ̄4981.[23]XinYꎬLuQꎬLiQ.14 ̄3 ̄3sigmacontrolscornealepithelialcellproliferationanddifferentiationthroughtheNotchsignalingpathway[J].BiochemBiophysResCommunꎬ2010ꎬ392(4)ʒ593-598.DOI:10.1016/j.bbrc.2010.01.084.[24]XuKꎬYuFS.ImpairedepithelialwoundhealingandEGFRsignalingpathwaysinthecorneasofdiabeticrats[J].InvestOphthalmolVisSciꎬ2011ꎬ52(6)ʒ3301-3308.DOI:10.1167/iovs.10 ̄5670.[25]HuXꎬZhuSꎬLiuRꎬetal.Sirt6deficiencyimpairscornealepithelialwoundhealing[J].Aging(AlbanyNY)ꎬ2018ꎬ10(8)ʒ1932-1946.DOI:10.18632/aging.101513.[26]PengHꎬHamanakaRBꎬKatsnelsonJꎬetal.MicroRNA ̄31targetsFIH ̄1topositivelyregulatecornealepithelialglycogenmetabolism[J].FASEBJꎬ2012ꎬ26(8)ʒ3140-3147.DOI:10.1096/fj.11 ̄198515. [27]PengHꎬKaplanNꎬHamanakaRBꎬetal.microRNA ̄31/factor ̄inhibitinghypoxia ̄induciblefactor1nexusregulateskeratinocytedifferentiation[J].ProcNatlAcadSciUSAꎬ2012ꎬ109(35)ʒ14030-14034.DOI:10.1073/pnas.1111292109.[28]NagosaSꎬLeeschFꎬPutinDꎬetal.microRNA ̄184inducesacommitmentswitchtoepidermaldifferentiation[J].StemCellReportsꎬ2017ꎬ9(6)ʒ1991-2004.DOI:10.1016/j.stemcr.2017.10.030. [29]ChangJHꎬHuangYHꎬCunninghamCMꎬetal.Matrixmetalloproteinase14modulatessignaltransductionandangiogenesisinthecornea[J].SurvOphthalmolꎬ2016ꎬ61(4)ʒ478-497.DOI:10.1016/j.survophthal.2015.11.006.[30]WolfMꎬMaltsevaIꎬClaySMꎬetal.EffectsofMMP12oncellmotilityandinflammationduringcornealepithelialrepair[J].ExpEyeResꎬ2017ꎬ160ʒ11-20.DOI:10.1016/j.exer.2017.04.007.[31]WilsonSE.Cornealmyofibroblastbiologyandpathobiology:generationꎬpersistenceꎬandtransparency[J].ExpEyeResꎬ2012ꎬ99ʒ78-88.DOI:10.1016/j.exer.2012.03.018.[32]West ̄MaysJAꎬDwivediDJ.Thekeratocyte:cornealstromalcellwithvariablerepairphenotypes[J].IntJBiochemCellBiolꎬ2006ꎬ38(10)ʒ1625-1631.DOI:10.1016/j.biocel.2006.03.010.[33]SinghVꎬJainiRꎬTorricelliAAꎬetal.TGFβandPDGF ̄Bsignalingblockadeinhibitsmyofibroblastdevelopmentfrombothbonemarrow ̄derivedandkeratocyte ̄derivedprecursorcellsinvivo[J].ExpEyeResꎬ2014ꎬ121ʒ35-40.DOI:10.1016/j.exer.2014.02.013. [34]TorricelliAAꎬSinghVꎬAgrawalVꎬetal.Transmissionelectronmicroscopyanalysisofepithelialbasementmembranerepairinrabbitcorneaswithhaze[J].InvestOphthalmolVisSciꎬ2013ꎬ54(6)ʒ4026-4033.DOI:10.1167/iovs.13 ̄12106.[35]MimuraTꎬYamagamiSꎬAmanoS.Cornealendothelialregenerationandtissueengineering[J].ProgRetinEyeResꎬ2013ꎬ35ʒ1-17.DOI:10.1016/j.preteyeres.2013.01.003.[36]TorricelliAAꎬSanthanamAꎬWuJꎬetal.Thecornealfibrosisresponsetoepithelial ̄stromalinjury[J].ExpEyeResꎬ2016ꎬ142ʒ110-118.DOI:10.1016/j.exer.2014.09.012.[37]GuoXꎬHutcheonAEꎬZieskeJD.MolecularinsightsontheeffectofTGF ̄β1/ ̄β3inhumancornealfibroblasts[J].ExpEyeResꎬ2016ꎬ146ʒ233-241.DOI:10.1016/j.exer.2016.03.011.[38]SinghVꎬBarbosaFLꎬTorricelliAAꎬetal.Transforminggrowthfactorβandplatelet ̄derivedgrowthfactormodulationofmyofibroblastdevelopmentfromcornealfibroblastsinvitro[J].ExpEyeResꎬ2014ꎬ120ʒ152-160.DOI:10.1016/j.exer.2014.01.003.[39]KaramichosDꎬHutcheonAEꎬZieskeJD.ReversaloffibrosisbyTGF ̄β3ina3Dinvitromodel[J].ExpEyeResꎬ2014ꎬ124ʒ31-36.DOI10.1016/j.exer.2014.04.020.[40]DelMonteDWꎬKimT.Anatomyandphysiologyofthecornea[J].JCataractRefractSurgꎬ2011ꎬ37(3)ʒ588-598.DOI:10.1016/j.jcrs.2010.12.037.[41]HongoAꎬOkumuraNꎬNakaharaMꎬetal.Theeffectofap38mitogen ̄activatedproteinkinaseinhibitoroncellularsenescenceofcultivatedhumancornealendothelialcells[J].InvestOphthalmolVisSciꎬ2017ꎬ58(9)ʒ3325-3334.DOI:10.1167/iovs.16 ̄21170.[42]OkumuraNꎬUenoMꎬKoizumiNꎬetal.EnhancementonprimatecornealendothelialcellsurvivalinvitrobyaROCKinhibitor[J].InvestOphthalmolVisSciꎬ2009ꎬ50(8)ʒ3680-3687.DOI:10.1167/iovs.08 ̄2634.[43]KinoshitaSꎬKoizumiNꎬUenoMꎬetal.InjectionofculturedcellswithaROCKinhibitorforbullouskeratopathy[J].NEnglJMedꎬ2018ꎬ378(11)ʒ995-1003.DOI:10.1056/NEJMoa1712770.[44]LeongKGꎬNiessenKꎬKulicIꎬetal.Jagged1 ̄mediatedNotchactivationinducesepithelial ̄to ̄mesenchymaltransitionthroughSlug ̄inducedrepressionofE ̄cadherin[J].JExpMedꎬ2007ꎬ204(12)ʒ2935-2948.DOI:10.1084/jem.20071082.[45]LiCꎬDongFꎬJiaYꎬetal.Notchsignalregulatescornealendothelial ̄to ̄mesenchymaltransition[J].AmJPatholꎬ2013ꎬ183(3)ʒ786-795.DOI:10.1016/j.ajpath.2013.05.025.[46]BröhlDꎬVasyutinaEꎬCzajkowskiMTꎬetal.ColonizationofthesatellitecellnichebyskeletalmuscleprogenitorcellsdependsonNotchsignals[J].DevCellꎬ2012ꎬ23(3)ʒ469-481.DOI:10.1016/j.devcel.2012.07.014.[47]王迎彬ꎬ朱益华ꎬ徐国兴.Notch信号通路与视网膜神经节细胞的发育[J].中华实验眼科杂志ꎬ2007ꎬ25(10)ʒ797-800.WangYBꎬZhuYHꎬXuGX.Notchsignalingpathwayanddevelopmentofretinalganglioncells[J].ChinJExpOphthalmolꎬ2007ꎬ25(10)ʒ797-800.[48]BukowieckiAꎬHosDꎬCursiefenCꎬetal.Wound ̄healingstudiesincorneaandskin:parallelsꎬdifferencesandopportunities[J/OL].IntJMolSciꎬ2017ꎬ18(6)ʒ1257[2019-02-20].https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5486079/.DOI:10.3390/ijms18061257. [49]XiangCꎬDuYꎬMengGꎬetal.Long ̄termfunctionalmaintenanceofprimaryhumanhepatocytesinvitro[J].Scienceꎬ2019ꎬ364(6438)ʒ399-402.DOI:10.1126/science.aau7307.[50]LiJꎬChenSYꎬZhaoXYꎬetal.Ratlimbalnichecellspreventepithelialstem/progenitorcellsfromdifferentiationandproliferationbyinhibitingnotchsignalingpathwayinvitro[J].InvestOphthalmolVisSciꎬ2017ꎬ58(7)ʒ2968-2976.DOI:10.1167/iovs.16 ̄20642.(收稿日期:2019-09-22㊀修回日期:2019-11-30)(本文编辑:刘艳)读者 作者 编者本刊稿件处理流程㊀㊀本刊实行以同行审稿为基础的三级审理制度(编辑初审㊁专家外审㊁编委会终审)稿件评审ꎮ编辑部在稿件审理过程中坚持客观㊁公平㊁公正的原则ꎬ郑重承诺审稿过程中尊重和保护审稿专家㊁作者及稿件的私密权ꎮ专家审理认为不宜刊用的稿件ꎬ编辑部将告知作者专家的审理意见ꎬ对稿件处理有不同看法的作者有权向编辑部申请复议ꎬ但请写出申请理由和意见ꎮ稿件审理过程中作者可通过 中华医学会杂志社远程稿件管理系统 查询稿件的审理结果ꎮ作者如需要采用通知或退稿通知可与编辑部联系ꎮ编辑部发给作者修改再审的稿件ꎬ如2个月没有修回ꎬ视为作者自行撤稿ꎮ编辑部的各种通知将通过Email发出ꎬ投稿后和稿件审理期间请作者留意自己的电子信箱ꎮ作者自收到采用通知之日起ꎬ即视为双方建立合约关系ꎬ作者如撤稿必须向编辑部申诉理由并征得编辑部同意ꎮ一旦稿件进入编排阶段ꎬ作者不应提出自撤稿件ꎬ在此期间因一稿两投或强行撤稿而给本刊造成不良影响和/或经济损失者ꎬ编辑部有权给以公开曝光㊁通报并实施经济赔偿ꎬ作者自行承担一切责任和后果ꎮ根据«中华人民共和国著作版权法»的相关条文ꎬ本刊编辑可对待发表的来稿按照编辑规范和专业知识进行文字加工㊁修改和删减ꎬ修改后的稿件作者须认真校对核实ꎬ修改涉及文章的核心内容时双方应进行沟通并征得作者同意ꎮ除了编辑方面的技术加工以外ꎬ作者对已经发表论文的全部内容文责自负ꎮ稿件编辑流程中编辑退回作者修改的稿件逾期2个月不修回者ꎬ视作自行撤稿ꎮ(本刊编辑部)。
10.Wnt与Notch信号传导(正式)

★ Wnt信号参与生长锥的重建和多突触球 状环 (苔状神经纤维与颗粒细胞相接触时) 的形成。 参与轴突形成的起始过程:
• Wnt 7 a能诱导苔状神经纤维中轴突和生 长锥的重建 • Wnt 7a能诱导突触素Ⅰ的汇集
★ Wnt信号参与脊椎动物的肢体起始和顶 端外胚层脊的形成 • 三种Wnt信号分子( Wnt2b、Wnt3a、 Wnt8c)是信号转导的关键诱导者。 • 依赖于与FGF信号通路的对话 • FGF与Wnt 信号的信息交流也与内耳的 形成有关。
说明:
• β-连环蛋白的稳定性与其磷酸化状态有关
• Dsh/Dvl蛋白可抑制GSK-3β活性
• CKⅠε是调节β-连环蛋白稳定的一个关键 正性调控分子 • 核内的β- 连环蛋白与Tcf/Lef家族的转录因 子相互作用,激活Wnt靶基因转录 • 已知的Wnt靶基因有50多个
Modulators of Wnt- signaling
2.平面细胞极性通路 (the planar cell polarity pathway
• 激活JNK并指导非对称细胞骨架形成及细 胞形态的协同极化 • 不依赖于β- 连环蛋白
• 涉及GTP酶Rho和JNK相关级联分子
• Nkd蛋白是Wnt信号的拮抗分子
但能激活JNK
Wnt
Fz/dFz2
• 金属蛋白酶(metalloprotease)等
Notch信号靶分子:
• Hairy/En(spl) — 果蝇
• Hes1和Hes5 — 人类
(二) 配体诱导的Notch信号通路 • 相邻细胞相互交流信息 • 参与许多发育过程 • Notch的受体作用和转录因子相连蛋 白的功能
Notch信号通路
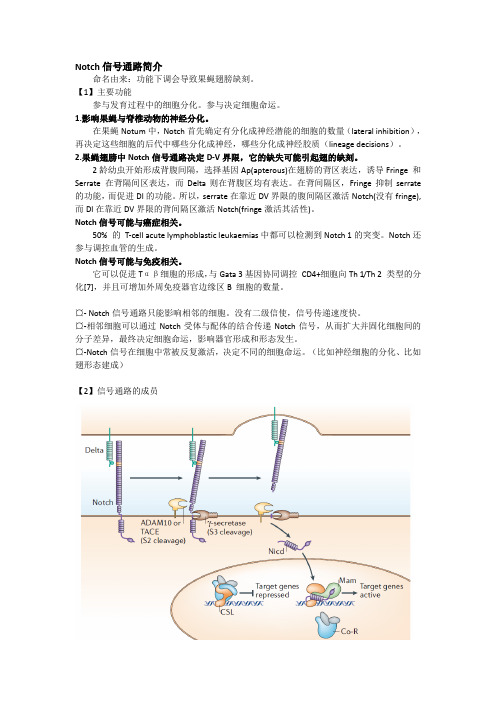
Notch信号通路简介命名由来:功能下调会导致果蝇翅膀缺刻。
【1】主要功能参与发育过程中的细胞分化。
参与决定细胞命运。
1.影响果蝇与脊椎动物的神经分化。
在果蝇Notum中,Notch首先确定有分化成神经潜能的细胞的数量(lateral inhibition),再决定这些细胞的后代中哪些分化成神经,哪些分化成神经胶质(lineage decisions)。
2.果蝇翅膀中Notch信号通路决定D-V界限,它的缺失可能引起翅的缺刻。
2龄幼虫开始形成背腹间隔,选择基因Ap(apterous)在翅膀的背区表达,诱导Fringe 和Serrate 在背隔间区表达,而Delta则在背腹区均有表达。
在背间隔区,Fringe抑制serrate 的功能,而促进Dl的功能。
所以,serrate在靠近DV界限的腹间隔区激活Notch(没有fringe),而Dl在靠近DV界限的背间隔区激活Notch(fringe激活其活性)。
Notch信号可能与癌症相关。
50% 的T-cell acute lymphoblastic leukaemias中都可以检测到Notch 1的突变。
Notch还参与调控血管的生成。
Notch信号可能与免疫相关。
它可以促进Tαβ细胞的形成,与Gata 3基因协同调控CD4+细胞向Th 1/Th 2 类型的分化[7],并且可增加外周免疫器官边缘区B 细胞的数量。
¤- Notch信号通路只能影响相邻的细胞。
没有二级信使,信号传递速度快。
¤-相邻细胞可以通过Notch受体与配体的结合传递Notch信号,从而扩大并固化细胞间的分子差异,最终决定细胞命运,影响器官形成和形态发生。
¤-Notch信号在细胞中常被反复激活,决定不同的细胞命运。
(比如神经细胞的分化、比如翅形态建成)【2】信号通路的成员Serrate (Jagged1、Jagged2 in mammals) ★功能:Notch配体,激活受体细胞Notch信号通路。
Notch信号通路与Th9IL-9轴在慢性淋巴细胞白血病中的表达及临床意义演示稿件

03
Notch信号通路与 Th9IL-9轴在慢性淋巴细 胞白血病中的表达
Notch信号通路与Th9IL-9轴的表达模式
Notch信号通路
Notch信号通路是一种高度保守的细胞间信号转导系统,通过配体-受体相互作用,调 控细胞分化、增殖和凋亡等生物学过程。在慢性淋巴细胞白血病中,Notch信号通路的
预后影响
Notch信号通路与Th9IL-9轴的表达水平可以作为慢性淋 巴细胞白血病预后的评估指标。通过监测Notch信号通 路与Th9IL-9轴的表达情况,可以评估患者的病情进展和 预后情况,为制定治疗方案和调整治疗方案提供依据。
预后评估
根据Notch信号通路与Th9IL-9轴的表达情况,结合患者 的临床表现、实验室检查结果和生存期等指标进行综合 评估,以预测患者的预后情况。同时,根据预后评估结 果,医生可以制定更加个性化的治疗方案,以提高患者 的生存质量和生存期。
采用免疫组织化学、基因测序等技术检测 Notch信号通路与Th9IL-9轴相关蛋白和基 因的表达水平,结合临床表现和实验室检查 结果进行综合分析,以明确诊断。
Notch信号通路与Th9IL-9轴对慢性淋巴细胞白血病治疗 的意义
治疗意义
治疗方法
Notch信号通路与Th9IL-9轴的表达水平可 以作为慢性淋巴细胞白血病治疗的参考指标 。根据Notch信号通路与Th9IL-9轴的表达 情况,医生可以选择更合适的治疗方案,如 针对Notch信号通路的抑制剂或针对Th9IL9轴的免疫治疗等,以提高治疗效果和患者 的生存率。
根据Notch信号通路与Th9IL-9轴的表达情 况,选择针对性的治疗方案。例如,对于
Notch信号通路过度激活的患者,可以使用 Notch抑制剂进行治疗;对于Th9IL-9轴过 度活跃的患者,可以采用针对Th9细胞的免
