无菌检查法验证要点
无菌检查方法学验证

无菌检查方法学验证1. 概述将规定量的供试品按无菌检查法中的薄膜过滤法进行操作,并接种小于100cfu 的试验菌,同时设置阳性对照,按规定温度培养3~5 天,与各相应的阳性对照管比较: 如含供试品各管中的试验菌均生长良好,则供试品的该检验量在该检验条件下无抑菌作用,可按此法进行供试品的无菌检查;如含供试品的任一管中的试验菌生长微弱、缓慢或不生长,则说明供试品的该检验量在该检验条件下有抑菌作用,应采用增加冲洗量或使用中和剂等方法消除供试品的抑菌作用,并再重新进行验证试验。
2. 验证前提条件供试品的选择原则:相同配方,不同规格的制品,选择其中装量最大的制品进行验证。
种类相同,含量不同的制品,选择含量最高的制品进行验证。
照此原则,多规格制品按下表选择供试品进行验证。
3. 验证方法3.1菌液制备3.1.1细菌菌液制备程序①取金黄色葡萄球菌、枯草芽抱杆菌、铜绿假单胞菌的冻干菌种管各一支,分别在无菌操作下打开,以毛细吸管加入适量营养肉汤,轻柔吹吸数次,使菌种融化分散后,吸出滴入营养琼脂斜面上,使均匀分布,置30~35C培养18h~24h。
用接种环取适量第1代培养菌苔,划线接种于营养琼脂培养基斜面上,于30~35C培养18h~24h o 同法操作,培养得第3代培养物。
②取生抱梭菌的冻干菌种管一支,在无菌操作下打开,以毛细吸管加入适量营养肉汤,轻柔吹吸数次,使菌种融化分散后,吸出滴入胃酶肉肝疱斜面上,使均匀分布,置30~35C培养18h~24h o用接种环取适量第1代培养菌苔,划线接种于胃酶肉肝疱斜面上,于30~ 35°C培养18h~24h。
取生抱梭菌的第二代新鲜培养物至硫乙醇酸盐流体培养基中,30~35C培养18h~24h,得第3代培养物。
③分别取金黄色葡萄球菌、枯草芽抱杆菌、铜绿假单胞菌的第3代营养琼脂斜面新鲜培养物,用5.0ml吸管吸取3.0ml~5.0ml稀释液加入斜面试管内,反复吹吸,洗下菌苔。
无菌检验方法验证

YOUR SITE HERE
LOGO
无菌检验阳性结果调查
实验室调查:一个合适的调查程序和记录是必要的
YOUR SITE HERE
LOGO
无菌检验阳性结果调查
若产品不合格,必须通过该批生产过程回顾找出污染 原因和污染源 –人 – 物料 – 环境 – 设备 – 方法和工艺
YOUR SITE HERE
LOGO
方法二:用实验确定是否具有抑菌性的方法 在规定量的供试液中加入实验用微生物10~100个,
如微生物生长良好,即说明供试品对该种微生物无抑 菌活性。如已用药典规定的各试验菌试验,结果均能 生长良好,说明供试品无抑菌性,可用常规方法检验 之。将这些试验记录在案——就是证明该供试品无抑 菌性的验证试验部分;如加入的微生物不生长或生长 缓慢,说明供试品有抑菌性,将这些试验记录在案— —就是证明该供试品有抑菌性的验证试验部分;如加 入的微生物中有某一种菌最不能生长或生长最缓慢, 这一种菌就是该样品的敏感菌。
LOGO
验证试验和对验证结果技术评价的判断为:如平行3 次的试验中,各管微生物均生长良好,说明供试品 已消除了抑菌活性。可以确定按该方法进行该品种 的无菌检查;如有供试品管的微生物生长微弱、缓 慢或不生长,说明供试品仍有抑菌活性,应考虑进 一步增加冲洗量或中和剂的用量以消除抑菌活性, 并重新验证,直至验证证明已充分消除或有效降低 抑菌活性。
条件 无菌检查应在环境洁净度10000级下的局部洁净 度100级的单向流空气区域内或隔离系统中进行, 其全过程应严格遵守无菌操作,防止微生物污 染,防止污染的措施不得影响供试品中微生物 的检出。
无菌检验方法验证

无菌检验方法验证无菌检查方法是为了检查药典要求无菌的制剂及其他制品是否无菌而建立的试验方法!至于无菌检查具体有哪些验证方法呢?下面就随店铺一起来了解下吧!无菌检验方法验证无菌检查方法验证一般分为前验证和再验证两种。
前验证,也称预验证,指在无菌分析方法正式使用前,按照预定验证方案进行的验证。
如果没有充分的理由,任何检查方法必须进行前验证。
再验证,指某一检查方法经过验证并在使用一段时间后进行的,旨在证实已验证状态没有发生飘移而进行的重新验证及对检查方法进行修订、改变时进行的验证。
通常一个无菌产品的检查流程为:首先基于产品的剂型、溶解度等性质,按照药典的要求确定是否需要进行前处理;然后根据产品的特性是否有抑菌性,确定是否需要增加去除产品抑菌性的方法;最后验证整个检查方法中用到的一切及试验过程中的每一个环节包括样品的预处理方式、检查过程、培养条件等均不影响样品中微生物的生长。
前处理方法直接影响后续步骤的效果和重现性,应是验证的重点。
供试品中抑菌活性的去除是当前验证工作的重点,尤其强调应充分验证供试品本身对微生物生长的影响。
(一)具体的验证方法如下:1. 菌种的选择无菌检查方法验证中通常选择以下6种试验中常用的控制菌的标准菌株,它们分别代表不同类型的菌种:枯草芽孢杆菌[CMCC(B)63 501]代表药品中常见的污染菌——芽孢杆菌、金黄色葡萄球菌[CMCC(B)26 003]代表革兰阳性菌、生孢梭菌 [CMCC(B)64 941]代表厌氧菌、大肠埃希菌[CMCC(B)44 102]代表革兰阴性菌、白色念珠菌[CMCC(F)98 001]代表酵母菌、黑曲霉菌 [CMCC(F)98 003]代表霉菌。
2. 菌液的制备接种金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中或营养琼脂培养基上,接种生孢梭菌的新鲜培养物至硫乙醇酸盐流体培养基中,30~35 ℃培养18~24h;接种白色念珠菌的新鲜培养物至改良马丁培养基中或改良马丁琼脂培养基上,23~28℃培养24~48h,上述培养物用0.9%无菌氯化钠溶液制成每1ml含菌数小于100cfu的菌悬液。
无菌检查法及其验证

• 进行供试品无菌检查时,所采用的检查方法和 检验条件应与验证的方法相同。
• 薄膜过滤法可以提高无菌检验的检出率,特别 是抑菌性供试品,采用薄膜过滤法可以有效消 除供试品的抑菌性,提高检出率。
编辑ppt
供试品的无菌检查法--直接接种法
• 0.1%蛋白胨水溶液 • PH7.0氯化钠-蛋白胨缓冲液
如需要可加入表面活性剂或中和剂,应经方法验证证明 其有效性,并对细菌存活无影响。
编辑ppt
供试品溶液的制备
①水溶液供试品 • 取规定量,直接过滤,或混合至含适量稀释液的
无菌容器内,混匀,立即过滤。 • 如供试品具有抑菌作用或含防腐剂,须用适量的
• 样品直接移入无菌培养基中。 • 每个容器中培养基的用量应符合接种的供试品
体积不得大于培养基体积的10%。 • 同时硫乙醇酸盐流体培养基每管装量不少于
15ml,改良马丁培养基每管装量不少于10ml。 培养基的用量和高度同方法验证试验。 • 每种培养基接种的管数同供试品的检验数量。
编辑ppt
供试品的无菌检查法--薄膜过滤法
编辑ppt
培养及观察
• 供试品无菌检查培养温度和时间非常重要,只 有在合适的温度和时间内微生物才能生长良好。
• 培养14天,如果培养基浑浊或培养14天后从 外观不能判断是否长菌,可取该培养液适量转 种至同种培养基或划线接种于斜面培养基上, 培养细菌2天、真菌3天,观察有无菌生长,或 镜检进行判断。
• 药品要么是无菌的,要么就是非无菌的。药品是 否无菌的结论一直是以药典规定的无菌检查抽样 和试验方法的结果作为判断依据。
• 无菌检查存在着很多局限性,最明显的是无菌检 查方法本身。不管样品是否有好的代表性,它的 结果总是存在不确定性。它是一个破坏性的试验, 它与整个批的一个随机样品的统计选择性有关。
无菌检查方法验证
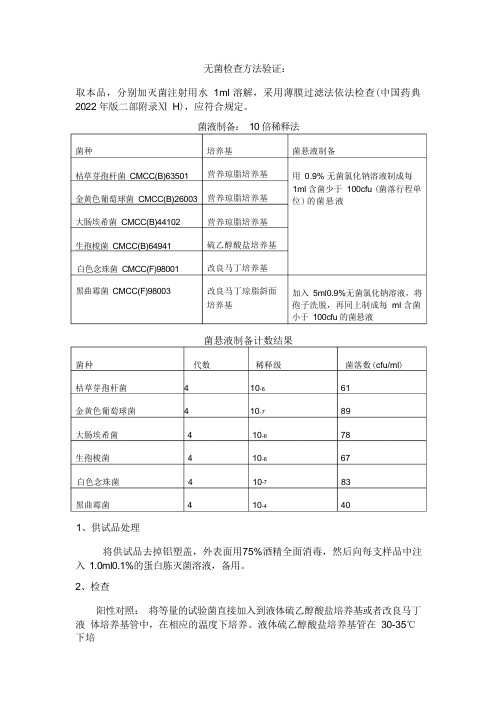
无菌检查方法验证:取本品,分别加灭菌注射用水 1ml 溶解,采用薄膜过滤法依法检查(中国药典 2022 年版二部附录Ⅺ H ),应符合规定。
菌液制备: 10 倍稀释法培养基 营养琼脂培养基营养琼脂培养基营养琼脂培养基硫乙醇酸盐培养基改良马丁培养基改良马丁琼脂斜面 培养基菌悬液制备计数结果菌种 代数 稀释级 菌落数(cfu/ml )枯草芽孢杆菌 4 10-6 61金黄色葡萄球菌 4 10-7 89大肠埃希菌 4 10-6 78生孢梭菌 4 10-6 67白色念珠菌 4 10-7 83黑曲霉菌 4 10-4 401、供试品处理将供试品去掉铝塑盖,外表面用75%酒精全面消毒,然后向每支样品中注 入 1.0ml0.1%的蛋白胨灭菌溶液,备用。
2、检查阳性对照: 将等量的试验菌直接加入到液体硫乙醇酸盐培养基或者改良马丁液 体培养基管中,在相应的温度下培养。
液体硫乙醇酸盐培养基管在 30-35℃下培菌种枯草芽孢杆菌 CMCC(B)63501 金黄色葡萄球菌 CMCC(B)26003 大肠埃希菌 CMCC(B)44102生孢梭菌 CMCC(B)64941白色念珠菌 CMCC(F)98001黑曲霉菌 CMCC(F)98003菌悬液制备用 0.9% 无菌氯化钠溶液制成每 1ml 含菌少于 100cfu (菌落行程单 位)的菌悬液加入 5ml0.9%无菌氯化钠溶液,将 孢子洗脱,再同上制成每 ml 含菌 小于 100cfu 的菌悬液养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
阴性对照:将灭菌的液体硫乙醇酸盐培养基或者改良马丁液体培养基管直接放在相应的温度下培养。
液体硫乙醇酸盐培养基管在30-35℃下培养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
样品 (薄膜过滤法):每种实验菌取10 支处理好的供试品溶液,将溶液合并后加入制备好的菌悬液1ml,用0.1%的蛋白胨灭菌溶液稀释至100ml,按薄膜过滤法过滤,取出滤膜,将其分为3 等份,分别置于含硫乙醇酸盐流体培养基及改良马丁培养基的容器中,其中一份作为阳性对照用。
无菌、微生物限度检查及方法验证

01
02
03
直接接种法
将样品接种在培养基上, 观察是否有微生物生长。
薄膜过滤法
将样品通过薄膜过滤,收 集滤膜上的微生物,再进 行培养。
离心沉淀法
将样品离心,收集沉淀物 中的微生物,再进行培养 。
无菌检查的注意事项
确保环境洁净
无菌检查需要在洁净的环境中进行,以避免 外界微生物的污染。
避免样品中防腐剂的影响
方法验证
方法验证的定义与目的
定义
方法验证是对检测方法的可靠性、准确性和可重复性的评估过程,以确保该方 法能够满足预期的检测要求。
目的
方法验证的目的是确保所采用的无菌、微生物限度检查方法具有足够的灵敏度 、特异性、重现性和可操作性,以保证检测结果的准确性和可靠性。
方法验证的流程
准备验证计划
制定详细的验证计划,包括验 证实验的设计、实验步骤、数 据收集和分析等内容。
进出口检验
进出口药品需要进行严格的微生物限度检查,以确保药品符合进口 国或地区的质量标准,保障公众健康。
方法验证在药品质量控制中的应用
验证无菌、微生物限度检查方法的可靠性
通过方法验证可以确保无菌、微生物限度检查方法的准确性和可靠性,提高药品质量控制 水平。
评估检测方法的性能指标
方法验证过程中需要对检测方法的性能指标进行评估,如灵敏度、特异性、重现性等,以 确保检测结果的准确性和可靠性。
如果样品中含有防腐剂,可能会抑制微生物 的生长,因此需要进行相应的处理。
正确选择培养基
根据待测样品的特性,选择适合的培养基, 以确保微生物能够正常生长。
定期进行方法验证
无菌检查方法需要定期进行验证,以确保其 可靠性。
0义与目的
药典无菌检查方法验证及操作要点

2. 培养基
2.1 培养基的灭菌 配制后应采用验证合格的灭菌程序灭菌。
2.2 培养基的保存 制备好的培养基应保存在2~25℃、避光的
环境。培养基若保存于非密闭容器中,一般在三 周内使用;若保存于密闭容器中一般可在一年内 使用。
•
2.3 培养温度 硫乙醇酸盐流体培养基置30~35℃培养
。改良马丁培养基置23~28℃培养。 2.4 培养基的适用性检查
•
黑曲霉
改良马丁琼脂斜面培养基上, 23~28℃培养5~7天,
加入3~5ml 0.9%无菌氯化钠溶液,将孢子洗
脱
吸出孢子悬液(用管口带有薄的无菌
棉花或纱布能过滤菌丝的无菌毛细吸管)至无菌
试管内
用0.9%无菌氯化钠溶液制成每lml含孢
子数小于l00cfu的孢子悬液。 •
4.3 薄膜过滤法 将规定量的供试品按薄膜过滤法过滤,冲
药典无菌检查方法验证 及操作要点
2020年4月29日星期三
1 前言 1.1 定义
无菌检查法系用于检查药典要求无菌的药
品、原料、辅料及其他品种是否无菌的一种方
法。若供试品符合无菌检查法的规定,仅表明
了供试品在该检验条件下未发现微生物污染。
•
1.2 实验环境条件要求
无菌检查应在环境洁净度10 000级下的 局部洁净度100级的单向流空气区域内或隔 离系统中进行,其全过程必须严格遵守无 菌操作,防止微生物污染。单向流空气区、 工作台面及环境应定期按《医药工业洁净 室(区)悬浮粒子、浮游菌和沉降菌的测试方 法》的现行国家标准进行洁净度验证。隔 离系统按相关的要求进行验证,其内部环 境的洁净度须符合无菌检查的要求。
3)枯草芽孢杆菌
(Bacillussubtilis)[CMCC(B)63 501]
无菌检查法验证要点

浙江红雨医药用品有限公司无菌检验方法验证方案及报告验证方案申请人: 日期: 年月日验证方案审核人: 日期: 年月日验证方案审批人: 日期: 年月日1 概述无菌检查法是为了检查药典要求无菌的医疗器械产品是否无菌而建立的检查法,是作为批准无菌产品放行的检验或监督部门对无菌产品质量监督中的一个重要项目。
它是根据用于实验的培养基中是否有微生物生长来判定样品的无菌性,液体培养基变浑浊一般表明样品受微生物的污染。
基于微生物污染的不均匀性,使无菌检查法结果的可信度受许多因素制约,如抑菌因素、检查法、检验量、检查用的培养基质量、操作环境、无菌技术等。
检验方法的验证是现代质量保证体系中关系到质控技术、方法、手段的科学性、准确性的重要组成部分,是保证检验结果的公正、科学、准确的基础。
2 验证目的对本公司所采用的直接接种无菌检查法进行分析验证,以证明所采用的方法适合于本公司产品的无菌检查。
3 实验原理直接接种法是通过加入一定的抑菌中和剂,以方便而快捷地中和抑菌剂,消除抑菌作用,从而消除抑菌作用对无菌检查的影响。
本实验通过设计对照试验对直接接种法所加入的抑菌剂的中和效果进行验证,从而得出直接接种法无菌检验的有效性。
4 验证范围实用于本公司所采用的直接接种法进行的无菌检验过程验证。
56 职责7 验证内容建立样品组、对照组及菌种活性检查组,接种菌株到指定培养基,培养24~72小时,比较观察菌落的生长状况,得出结论。
8 验证指示物本实验所用菌种为购于浙江省食品药品检验研究所标准菌株:金黄色葡萄球菌、白色念球菌、大肠埃希菌及生孢梭菌。
9 实验过程(1)培养基的配制用于大肠埃希菌、金黄色葡萄球菌的营养琼脂培养基用于白色念球菌的改良马丁培养基用于生孢梭菌的流体硫乙醇酸盐培养基(2)供试品的制备创可贴供试品:将包装好的创可贴打开,用剪刀将创可贴剪碎,放入100mlpH7.0氯化钠—蛋白胨缓冲液中浸泡1小时,取水层作为供试品。
无菌敷贴供试品:将包装好的无菌敷贴打开,用剪刀将无菌敷贴剪碎,放入100mlpH7.0氯化钠—蛋白胨缓冲液中浸泡1小时,取水层作为供试品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙江红雨医药用品有限公司
无菌检验方法验证
方案及报告
验证方案申请人:验证方案审核人:验证方案审批人:日期:
日期:
日期:
年
年
年
月
月
月
日
日
日
浙江红雨医药用品有限公司
1 概述
无菌检查法是为了检查药典要求无菌的医疗器械产品是否无菌而建立的检查法,是作为批准无菌产品放行的检验或监督部门对无菌产品质量监督中的一个重要项目。
它是根据用于
实验的培养基中是否有微生物生长来判定样品的无菌性,液体培养基变浑浊一般表明样品
受微生物的污染。
基于微生物污染的不均匀性,使无菌检查法结果的可信度受许多因素制约,如抑菌因素、检查法、检验量、检查用的培养基质量、操作环境、无菌技术等。
检验方法的
验证是现代质量保证体系中关系到质控技术、方法、手段的科学性、准确性的重要组成部分,是保证检验结果的公正、科学、准确的基础。
2 验证目的
对本公司所采用的直接接种无菌检查法进行分析验证,以证明所采用的方法适合于本
公司产品的无菌检查。
3 实验原理
直接接种法是通过加入一定的抑菌中和剂,以方便而快捷地中和抑菌剂,消除抑菌作
用,从而消除抑菌作用对无菌检查的影响。
本实验通过设计对照试验对直接接种法所加入的抑菌剂的中和效果进行验证,从而得
出直接接种法无菌检验的有效性。
4 验证范围
实用于本公司所采用的直接接种法进行的无菌检验过程验证。
5
6 职责
7 验证内容
建立样品组、对照组及菌种活性检查组,接种菌株到指定培养基,培养24~72小时,比
较观察菌落的生长状况,得出结论。
8 验证指示物
本实验所用菌种为购于浙江省食品药品检验研究所标准菌株:金黄色葡萄球菌、白色
念球菌、大肠埃希菌及生孢梭菌。
9 实验过程
(1)培养基的配制
用于大肠埃希菌、金黄色葡萄球菌的营养琼脂培养基 用于白色念球菌的改良马丁培养基 用于生孢梭菌的流体硫乙醇酸盐培养基
(2)供试品的制备
创可贴供试品:将包装好的创可贴打开,用剪刀将创可贴剪碎,放入 100ml pH7.0 氯化钠—蛋白胨缓冲液中浸泡 1 小时,取水层作为供试品。
无菌敷贴供试品:将包装好的无菌敷贴打开,用剪刀将无菌敷贴剪碎,放入 100mlpH7.0 氯化钠—蛋白胨缓冲液中浸泡 1 小时,取水层作为供试品。
(3)供试菌液的制备
大肠埃希菌菌液:取经 35℃培养 19 小时的大肠埃希菌培养物 1ml ,加 9ml 生理盐水,
10 倍稀释至约 10 ~10 之间,混匀备用。
金黄色葡萄球菌菌液:取经 35℃培养 19h 小时的金黄色葡萄球菌培养物 1ml ,加 9ml
生理盐水,10 倍稀释至约 0 ~10 之间,混匀备用。
白色念球菌菌液:取经 25.5℃培养 72 小时的白色念珠菌真菌斜面培养物,加入生理盐
水 4ml 洗下孢子,吸出转移至空试管作为原液,取 1ml 加 9ml 生理盐水,10 倍稀释至 10
- 6 ,取 1.2ml 加生理盐水 9ml ,混匀备用。
生孢梭菌菌液:取经 35℃培养 18h 的生孢梭菌硫乙醇酸盐流体培养基培养物 1ml ,加
9ml 生理盐水,10 倍稀释至 10 ,混匀备用。
(3)实验设计
实验样品组:按照本公司常规微生物检验方法进行,加入抑菌中和剂,最后接入已知 量的菌株(≤100cfu ),培养观察。
阳性对照组:以 0.1%的蛋白胨代替供试品,加入抑菌中和剂,最后接入同样量的菌株, 培养观察。
阴性对照组:取与实验样品组等量的供试品,加入与中和剂等量的生理盐水,最后接 入已知量的菌株(≤100cfu ),培养观察
菌种活性检查组:直接将菌种接种到培养基上,培养观察。
10 标准与判断
1. 如果实验样品组与阳性对照组的微生物计数相似,表明所用中和剂(中和剂类别及 用量)具有足够的中和效力;
2. 如果阳性对照组与菌种活性检查组的微生物生长数量相似,表明所用的中和剂不影 响微生物的生长。
3. 阴性对照组微生物生长量应低于实验组,才能证明供试剂有抑菌性,否则该实验无 意义。
4. 样品组的平均菌检计数结果不得低于对照组的 70%,否则直接否定无菌检验方法。
-5 -8 -5 -8 -6
11 检验与记录
无菌检查验证实验数据表(菌落数/皿)
日期:年月日
浙江红雨医药用品有限公司
12 编写验证报告
(1)根据验证方案设计实验;
(2)统计实验数据编写验证报告。
13 再验证周期及日常监测
(1)无菌检查按所生产的每批次进行日常监测;
(2)当无菌检查日常监测出现不符合标准时,必须进行再验证;
(3)当无菌检查方法发生改变和生产工艺发生改变时,必须重新验证;
(4)本验证方案有效期为1年。
14 验证结果与评价
实验人对验证实验结果做好相关记录并进行科学性评价;
15 验证方案的批准
验证小组审阅所有结果及评价分析意见,同意验证结果,签字并按此结论实施。
直接接种无菌检查法验证报告
一 实验目的
对本公司所采用的直接接种无菌检查法进行分析验证,以证明所采用的方法适合于 本公司产品的无菌检查。
二 实验原理
直接接种法是通过加入一定的抑菌中和剂,以方便而快捷地中和抑菌剂,消除抑菌作 用,从而消除抑菌作用对无菌检查的影响。
本实验通过设计对照试验对直接接种法所加入的抑菌剂的中和效果进行验证,从而得 出直接接种法无菌检验的有效性。
三 实验步骤
1、.培养基的配制
大肠埃希菌、金黄色葡萄球菌用的营养琼脂培养基:准确称取营养琼脂培养基 16.5g ,加入 500ml 纯化水,缓慢加热使其完全溶解。
白色念球菌用的改良马丁培养基:准确称取改良马丁培养基 14.5g ,加入 500ml 纯化 水,在加入 6g 琼脂粉,加热使其溶解。
生孢梭菌用的流体硫乙醇酸盐培养基:准确称取流体硫乙醇酸盐培养基 14.5g ,加入 500ml 纯化水,在加入 6g 琼脂粉,加热使其溶解。
将上述配制好的培养基放入高压蒸汽灭菌锅中 115℃,30min 。
2、供试品的制备
创可贴供试品:将包装好的创可贴打开,用剪刀将创可贴剪碎,放入 100ml pH7.0 氯 化钠—蛋白胨缓冲液中浸泡 1 小时,取水层作为供试品。
无菌敷贴供试品:将包装好的无菌敷贴打开,用剪刀将无菌敷贴剪碎,放入 100ml pH7.0 氯化钠—蛋白胨缓冲液中浸泡 1 小时,取水层作为供试品。
3、供试菌液的制备:
大肠埃希菌菌液:取经 35℃培养 19 小时的大肠埃希菌培养物 1ml ,加 9ml 生理盐水,
10 倍稀释至约 10 ~10 之间,混匀备用。
金黄色葡萄球菌菌液:取经 35℃培养 19h 小时的金黄色葡萄球菌培养物 1ml ,加 9ml
生理盐水,10 倍稀释至约 10- ~10 之间,混匀备用。
白色念球菌菌液:取经 25.5℃培养 72 小时的白色念珠菌真菌斜面培养物,加入生理 盐水 4ml 洗下孢子,吸出转移至空试管作为原液,取 1ml 加 9ml 生理盐水,10 倍稀释至 10 ,混匀备用。
生孢梭菌菌液:取经 35℃培养 18h 的生孢梭菌硫乙醇酸盐流体培养基培养物 1ml ,加
9ml 生理盐水,10 倍稀释至 10 -6
,混匀备用。
4、分别取上述两种供试品 100ml ,加入抑菌中和剂,接入≤100cfu 菌株(大肠埃希菌、
金黄色葡萄球菌、白色念球菌及生孢梭菌分别进行实验),再接种到每种菌株所需的上述
培养基中,作为实验样品组。
5、用 0.1%的蛋白胨溶液代替供试品进行同上步骤操作,作为实验阳性对照组。
6、取与实验样品组等量的供试品,加入与中和剂等量的生理盐水,再同第 4 步操作,作
为 阴性对照组。
4、 取 100ml 0.1%蛋白胨溶液,不加中和剂直接接种等量菌株,再接种到培养基上,作为 菌种活性检查组。
-5 -8 5 -8 -6
8 、将接种好的培养皿放入恒温培养箱中,大肠埃希菌、金黄色葡萄球菌及生孢梭菌培养温度为35℃,白色念球菌培养温度为25.5℃,培养数天后,观察并记录菌落数。
四实验结果记录
无菌检查验证实验数据表(菌落数/皿)
:
日期:年月日
:
日期:年月日
:
日期:年月日
:
日期:年月日
:
日期:年月日
:
日期:年月日
12 验证结果与评价
实验人:
日期:年月日13 验证报告批准
检验人:审核人:批准人:日期:
日期:
日期:
年
年
年
月
月
月
日
日
日。
