(完整版)盐类的水解(高考题)
高考化学试题含解析——盐类的水解

畅享淘宝天猫京东拼多多百万张大额内部优惠券,先领券后购物!手机应用市场/应用宝下载花生日记APP邀请码NJBHKZO,高佣联盟官方正版APP邀请码2548643跟踪检测(二十七)盐类的水解1.在0.1 mol·L-1K2CO3溶液中,由于CO2-3的水解,使得c(CO2-3)<0.1 mol·L-1。
如果要使c(CO2-3)更接近0.1 mol·L-1,可以采取的措施是()A.加入适量水B.加入少量盐酸C.加入适量KOH固体D.加热解析:选C K2CO3溶液中存在CO2-3的水解平衡:CO2-3+H2O HCO-3+OH-。
加入适量水,平衡正向移动,且溶液的体积增大,则c(CO2-3)减小,A错误;加入少量盐酸,CO2-3与H+结合生成HCO-3,则c(CO2-3)减小,B错误;加入适量KOH固体,溶液中c(OH-)增大,水解平衡逆向移动,溶液中c(CO2-3)增大,更接近0.1 mol·L-1,C正确;加热,促使CO2-3的水解平衡正向移动,c(CO2-3)减小,D错误。
2.(2018·长沙一模)在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O HS-+OH-。
下列说法正确的是()A.稀释溶液,水解平衡常数增大B.加入CuSO4固体,HS-浓度减小C.升高温度,c(HS-)/c(S2-)减小D.加入NaOH固体,溶液pH减小解析:选B稀释溶液,水解平衡向正反应方向移动,但水解平衡常数只与温度有关,温度不变,水解平衡常数保持不变,A项错误;加入CuSO4固体,发生沉淀反应:Cu2++S2-===CuS↓,c(S2-)减小,S2-的水解平衡向逆反应方向移动,HS-浓度减小,B项正确;水解过程吸热,升高温度,水解平衡向正反应方向移动,c(HS-)增大,c(S2-)减小,c(HS-)/ c(S2-)增大,C项错误;加入NaOH固体,c(OH-)增大,pH增大,D项错误。
word完整版盐类水解高考题

2. 【2016年高考海南卷】(双选)由反应物法正确的是( )A .由X —反应的△ H=E5-E2B .由一:二反应的△ H<0C.降低压强有利于提高Y的产率D .升高温度有利于提高Z的产率3. 【2016年高考江苏卷】通过以下反应均可获下列有关说法正确的是( )①太阳光催化分解水制氢:2H2O(I) = 2H2 ( g) + O2 (g) △ H仁+571.6kJ • mol-1②焦炭与水反应制氢: C (s) + H2O(g) = CO (g) + H2 (g) △ H2=+131.3kJ - mol-1③甲烷与水反应制氢:CH4 ( g) + H2O(g) = CO (g) +3H2 (g) △H3=+206.1kJ - mol-1A .反应①中电能转化为化学能B .反应②为放热反应C .反应③使用催化剂,△ H3减小D .反应CH4 (g )= C (s) +2H2 (g )的△ H=+74.8kJ • mol -14. 【2016年高考新课标n卷】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:(1) ____________________________ 联氨分子的电子式为______ ,其中氮的化合价为。
(2 )实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 ___________ 。
(3[① 2O2(g)+N2(g)=N2O4(l) AH1②N2(g)+2H2(g)=N2H4(l) A H2③O2(g)+2H2(g)=2H2O(g) △H3④ 2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) AH4= -1048.9kJ/mol上述反应热效应之间的关系式为厶日4= ______________ ,联氨和N2O4可作为火箭推进剂的主要原因为______________________________________________________ 6. [ 2015 广东理综】用O2将HCI转化为Cl2,可提高效益,减少污染。
2021届高考一轮化学基础题盐类的水解附答案
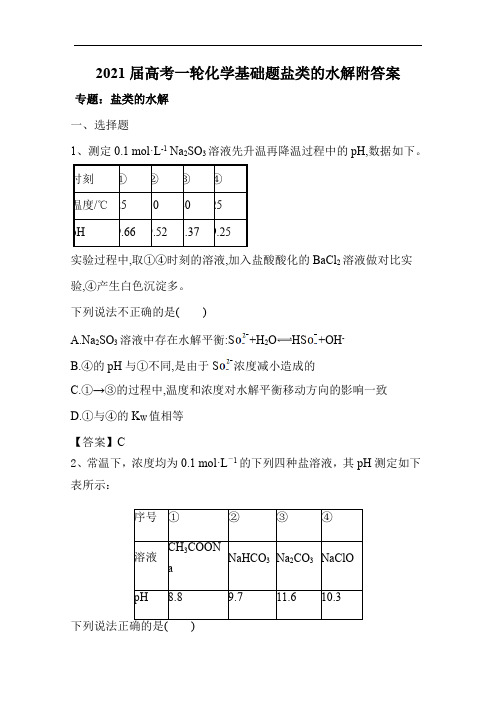
2021届高考一轮化学基础题盐类的水解附答案专题:盐类的水解一、选择题1、测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻①②③④温度/℃25304025pH9.669.529.379.25实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是()A.Na 2SO3溶液中存在水解平衡:S+H2O HS+OH-B.④的pH与①不同,是由于S浓度减小造成的C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D.①与④的K W值相等【答案】C2、常温下,浓度均为0.1 mol·L-1的下列四种盐溶液,其pH测定如下表所示:序号①②③④溶液CH3COONaNaHCO3Na2CO3NaClOpH8.89.711.610.3A.四种溶液中,水的电离程度①>②>④>③B.Na2CO3和NaHCO3溶液中,粒子种类相同C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO D.Na2CO3溶液中,c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)答案:B解析:A.该溶液为四种盐溶液,均促进了水的电离,根据越弱越水解,水解显碱性,水解程度越大,pH越大,则四种溶液中,水的电离程度③>④>②>①,A错误;B.Na2CO3和NaHCO3溶液中都存在着H+、OH-、CO2-3、HCO-3、H2CO3、Na+、H2O,B正确;C.醋酸的酸性强于次氯酸,在物质的量浓度相等的条件下,pH小的是醋酸,C错误;D.根据物料守恒,Na2CO3溶液中,c(Na+)=2c(CO2-3)+2c(HCO-3)+2c(H2CO3),D错误。
3、室温下,在pH都等于9的NaOH和CH3COONa两种溶液中,设由水电离产生的OH-浓度分别为amol·L-1与bmol·L-1,则a和b关系为()A.a>bB.a=10-4bC.b=10-4aD.a=b答案B4、向一定量的Fe、FeO、Fe2O3混合物中加入350 mL 2 mol·L-1稀硝酸恰好使混合物完全溶解,放出2.24 L(标准状况下)NO,往所得溶液中加入KSCN溶液,无红色出现。
高中化学盐类的水解(含答案解析)

3.3盐类的水解1.下列对盐类水解过程的说法正确的是( )A.属于氧化还原反应B.溶液的pH一定发生改变C.水的电离程度增大D.是放热的过程2.下列说法中正确的是( )A.HCO-3在水溶液中只电离,不水解B.硝酸钠溶液水解后呈中性C.可溶性的铝盐都能发生水解反应D.可溶性的钠盐都不发生水解反应3.在一定条件下发生下列反应,其中属于盐类水解反应的是( )A.Cl2+H2O H++Cl-+HClOB.NH+4+2H2O NH3·H2O+H3O+C.HS-+H+===H2SD.HCO-3+H2O H3O++CO2-34.下列离子方程式的书写正确的是( )A.硫化钠水解:S2-+2H2O H2S↑+2OH-B.亚硫酸氢钠水解:HSO-3+H2O H3O++SO2-3C.硫化钾水解:S2-+H2O===HS-+OH-D.硫酸铝溶液跟偏铝酸钠溶液反应:Al3++3AlO-2+6H2O===4Al(OH)3↓5.0.1 mol·L-1 NaHCO3溶液的pH最接近于( )A.5.6 B.7.0 C.8.4 D.13.06.pH=4的醋酸和pH=4的氯化铵溶液相比,水的电离程度较大的是( ) A.前者B.后者C.等于D.无法确定7.常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:(1)从①组情况分析,HA 是强酸还是弱酸________。
(2)②组情况表明,c ________0.2(填“>”、“<”或“=”,下同)。
混合溶液中离子浓度c (A -)________c (Na +)。
(3)从③组实验结果分析,说明HA 的电离程度______NaA 的水解程度(填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是_______________。
(4)从以上实验分析,将pH =11的NaOH 溶液与pH =3的HA 溶液等体积混合,所得混合溶液中c (OH -)____________ __c (H +)(填“>”、“<”或“=”)。
高二化学盐类的水解试题答案及解析

高二化学盐类的水解试题答案及解析1.(1)把NH4Cl晶体溶入水中,得到饱和NH4Cl溶液。
若在该溶液中加入镁条,观察到有气泡产生,点燃有爆鸣声,此气体是,产生该气体的原因是(用离子方程式表示),微热后,能放出有刺激性气味的气体,它能使湿润的红色石蕊试纸变蓝,该气体是,产生该气体的原因是,总的离子反应方程式为。
(2)NH4Cl溶于重水后,产生的一水合氨和水合氢离子均正确的是()A.NH2D·H2O和D3O+B.NH3·D2O和HD2O+C.NH3·HDO和D3O+D.NH2D·HDO和H2DO+【答案】(1)H2N+H2O NH3·H2O+H+、Mg+2H+Mg2++H2↑;NH3因为c(H+)减少,使水解平衡右移,产生的NH3·H2O增多,加热使NH3·H2O分解放出NH3Mg+2NMg2++H2↑+2NH3↑(2)C【解析】(2)NH4Cl水解的实质是其电离出的N与重水电离出的OD-结合生成一水合氨。
即D2O D++OD-,N+OD-NH3·HDO,D+再与D2O结合生成D3O+。
【考点】盐类水解的原理2.25 ℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:①;②;③。
(2)溶液中共有种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01 mol·L-1的是,浓度为0.002 mol·L-1的是。
(4)和两种粒子物质的量之和等于0.01 mol。
【答案】(1)①CH3COO-+H2O CH3COOH+OH-②CH3COOH CH3COO-+H+③H2O H++OH-(2)7(3)Na+Cl-(4)CH3COOH CH3COO-【解析】溶液中存在CH3COO-,则有水解平衡:CH3COO-+H2O CH3COOH+OH-;溶液中含有CH3COONa与HCl生成的弱电解质CH3COOH,则有CH3COOH的电离平衡:CH3COOHCH3COO-+H+;溶液中还存在水的电离平衡:H2O H++OH-。
高考盐类水解离子浓度经典习题(含答案)

盐类水解离子浓度经典习题1、向三份0.1 mol/LCH 3COON溶液中分别加入少量NHNO、NaSO、FeCl3固体(忽略溶液体积变化),则CH3COO浓度的变化依次为()A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大2、有①NaCO溶液②CHCOON籀液③NaOH^(各25 mL物质的量浓度均为0.1 mol - L \下列说法正确的是() A.3种溶液pH的大小顺序是③下②〉①B.若将3种溶液稀释相同倍数,pH变化最大的是②C.若分别加入25 mL 0.1 mol - L 1盐酸后,pH最大的是①D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③下①〉② 13、有①NaCO溶椒②CHCOON金披③NaOH§^④CHCOONHt披各25mL物质的量浓度均为0. 1mol • L ,下列说法正确的是()A.四种溶液的pH大小顺序是③ >②>①>④B.若分别加入25mL0.1mol • L-1盐酸充分反应后,pH最大的是①C.若将四种溶液稀释相同倍数,pH变化最大的是④D.升高温度,四种溶液的pH均减小4、25 C时,0.1 mol/L 的HA溶液中c(H +)/c(OH ) = l X 10 6,下列叙述正确的是()A.该溶液中由水电离出的c(H + ) =l X 10 13 mol/LB.由pH=4 的HA与pH= 10 的NaOH§液等体积混合,溶液中c(Na + )>c(A )>c(OH 一)>c(H +)C.浓度均为0.1 mol/L 的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A ) >c(HA) >c(Na+) >c(H+) >c(OHI )D.0.1 mol - L-1 HA溶液与0.05 mol • L—1 NaOH溶液等体积混合后所得溶液中c(H + ) + c(Na+) = c(OH ) + c(A ) 5、下列溶液中有关微粒的物质的量浓度关系正确的是()A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c (Na+) >c (CHCOOH ,则:c (Ns+) > c (CHCOO > c (OH > c (H)B.NaHSO和NaHCO勺中性混合溶液中(S和C均用R表示):C (Na+) =c (HRO) +2c (RO2-)C.常温下,物质的量浓度和体积都相等的①N K SO②NaSO③NaHSOE种溶液中离子总数:①〈②〈③D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液② pH=3的HCl溶液③pH=11的氨水中由水电离出的c (H):①》③〉②6、下列溶液中有关微粒的物质的量浓度关系正确的是 ()A.NaHSO 和NaHCO 勺中性混合溶液中(S 和C 均用R 表示):c (Na +) =c (HRO) +c (RO 2-) B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中: C (Na +) v C (Cl -) v C (CHCOOHC.常温下物质的量浓度相等的①(NH 2CQ ②(NH) 2SQ 、③(NH) 2Fe ( SQ) 2三种溶液中c ( NH +):①〈③〈②D.等体积等物质的量浓度的 NaClO (aq)与NaCl (aq)中离子总数多少:N 前<N 后 7、下列溶液中,微粒的物质的量浓度关系正确的是()A.等体积等物质的量浓度 NaF 溶液与HF 混合:2c (Na) =c ( F -) +c (HF)B.0.1mol ?L -1pH 为 4 的 NaHB 溶液中:c (HB) > c (H 2B) > c (B 2-) C.在 NaHA§液中一定有:c (Na +) +c (H +) =c (HA) +c (OH) +c (A 2-)D.等物质的量浓度的(NH) 2SO 和(NH) 2CO 溶液中的c (NH +):前者〈后者 8、下列溶液中微粒的物质的量浓度关系正确的是A.Na z CO 溶液:C(OH )+ C(H +尸C(HCQ )+2 C(H 2CO)B.0.1 \mol-L^.'初CQ ;溶液:/(二)>c(0H)C .室温下,向0.01羽司, £'A 刃斗那04溶液中滴加.W0H 溶液至中性:W) >> 人NH ;) >D .25 c 时,pH 二4,75、浓度均为°」阴小上"的CH £O0R CH 3C00\a 混合溶液: 幽,)+画-)< c(CH<00H)+时)9、下列各溶液中,微粒物质的量浓度关系正确的是()A .O.lmol 溶液中[0H-] = [HC0.]+[H-]>[C0r]B .2国:施JS04溶液中:[SO ;-]>[NH ;]>[H-]>[OH-] c.g ^NaHCO^溶液中:[>V]>[OH-]>[HCOr]>[HJ D .1-2$溶液中:=半,+ 2晔]+2此§]10、下列各溶液中,微粒物质的量浓度关系正确的是 ()11、下列有关溶液中微粒浓度关系的叙述正确的是()。
高考试题汇编盐类的水解(有答案)

盐类水解基础考点梳理 最新考纲1.理解盐类水解的原理,掌握盐类水解的规律和应用。
2.了解盐溶液的酸碱性,会比较盐溶液中离子浓度的大小。
自主复习一、盐类水解的定义和实质 1.盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解。
2.盐类水解的实质盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成难电离的物质,使水的电离平衡被破坏而建立起了新的平衡。
3.盐类水解反应离子方程式的书写盐类水解一般程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般不用“↑”或“↓”。
盐类水解是可逆反应,除发生强烈双水解的盐外,一般离子方程式中不写===号,而写号。
4.盐类的水解与溶液的酸碱性 ①NaCl ②NH 4Cl ③Na 2CO 3 ④CH 3COONa ⑤AlCl 3 五种溶液中呈酸性的有:②⑤。
呈碱性的有:③④。
呈中性的有:①。
二、盐类水解的影响因素及应用 1.内因:盐本身的性质(1)弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
2.外因(1)温度:升高温度,水解平衡正向移动,水解程度增大。
(2)浓度①增大盐溶液的浓度,水解平衡正向移动,水解程度减小,但水解产生的离子浓度增大,加水稀释,水解平衡正向移动,水解程度增大,但水解产生的离子浓度减小。
②增大c (H +),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c (OH -),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
3.盐类水解的应用(写离子方程式) (1)明矾净水:Al 3++3H 23+3H+。
(2)制备Fe(OH)3胶体:Fe 3++3H 2O=====△Fe(OH)3(胶体)+3H +。
(3)制泡沫灭火剂:Al 3++3HCO -3===Al(OH)3↓+3CO 2↑。
(4)草木灰与铵态氮肥混施:NH +4+CO 2-3+H 23·H 2O +HCO -3。
(完整word版)盐类的水解经典习题含解析

第三节盐类的水解一、单项选择题1. 水中加入下列溶液对水的电离平衡不产生影响的是()A . NaHS04溶液B. KF溶液C. KAl(SO 4)2 溶液 D . NaI 溶液解析:厂、Al3+的水解能促进水的电离;NaHS04电离出的H*能抑制水的电离,厂对应的酸(HI)为强酸,故Nal溶液对水的电离平衡无影响。
答案:D1 —1.(双选)25 C时,某浓度的氯化铵溶液的pH = 4,下列叙述中正确的是()A .溶液中的c(OH —)= 1 X 10—10 mol L—1B. 溶液中的c(NH 才)>c(CI—)>c(H +) >c(OH —)C. 溶液中的c(H +)+ c(NH才)=c(Cl—) + c(OH —)D•溶液中的c(NH3 H2O) = c(NH才)解析:A项中由K w可计算出c(OH —)= 1 X 10—10 mol L —1,所以A项正确,B项中因为NH才水解,故c(CI—)>c(NH才),所以B项错误;C项中符合电荷守恒,所以C项正确;D 项中NHf的水解程度较小,故c(NH3 H2O)小于c(NH才),所以D项错误。
答案:AC2. 已知某溶液中只存在OH、Cl、NH 4、H四种离子,下列说法不正确的是()A •若溶液中c(NH4) = c(Cl—),则该溶液一定显中性B•若溶液中c(NH4 )>c(Cl—)>c(OH —)>c(H +),则溶液中一定含有NH4CI 和NH3 H2OC.若溶液中c(Cl—)>c(NH;)>c(H +)>c(OH —),则溶液中可能含有NH4CI或可能含有NH4CI 和HClD •若溶液中c(CI—)> c(H +)> c(NH;)>c(OH —),则溶液中含有大量的NH4CI和少量的HCI解析:A项,若溶液中c(NH才)=c(CI —),由电荷守恒知c(OH —) = c(H +),则该溶液一定显中性;B项,溶液呈碱性,溶质只能是NH4CI和NH3H2O; C项,溶液呈酸性,溶质可能含有NH4CI或可能含有NH4CI和HCI,但若溶质是大量的NH4CI和少量的HCI,则c(CI —)>c(NH才)>c(H + )>c(OH —), D 项错误。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐类的水解盐类的水解综合1、下列有关电解质溶液的说法正确的是()A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中减小B.将CH3COONa溶液从20℃升温至30℃,溶液中增大CD2、向1L34、25ABCD53晶体,B.C.D.c(Cl-)>c(NH)>c(HCO)>c(CO)6、室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是()A.向0.10mol·L-1NH4HCO3溶液中通CO2:c(NH)=c(HCO)+c(CO)B.向0.10mol·L-1NaHSO3溶液中通NH3:c(Na+)>c(NH)>c(SO)C.向0.10mol·L-1Na2SO3溶液中通SO2:c(Na+)=2[c(SO)+c(HSO)+c(H2SO3)]D.向0.10mol·L-1CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)7、下列说法不正确...的是()A.Na与H2O的反应是熵增的放热反应,该反应能自发进行B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液8、下列关于0.10mol·L-1NaHCO3溶液的说法正确的是()A.溶质的电离方程式为NaHCO3===Na++H++COB.25℃时,加水稀释后,n(H+)与n(OH-)的乘积变大C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO)+c(CO)D.温度升高,c(HCO)增大9、一定温度下,下列溶液的离子浓度关系式正确的是()A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol·L-1B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O) D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③10、室温下,下列关系正确的是()A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O)+2c(H2C2O4)C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO)+c(OH-)D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) 11.下列溶液中粒子的物质的量浓度关系正确的是()A.0.1mol·L-1NaHCO3溶液与0.1mol·L-1NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO)>c(HCO)>c(OH-)B.c(CH3Cc(Cl-)+cD.)>c(H+)+c(CH312.25A.c(Na+)=B.c(NH3·H2C.c(Na+)=c(CO)+c(HCO)+c(H2CO3)D.0.1mol·L-1Na2C2O4溶液与0.1mol·L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O)+c(HC2O)+c(OH-)=c(Na+)+c(H+)图像分析1、室温下向10mL0.1mol·L-1NaOH溶液中加入0.1mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
下列说法正确的是()A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)B.a、b两点所示溶液中水的电离程度相同C.pH=7时,c(Na+)=c(A-)+c(HA)D.b点所示溶液中c(A-)>c(HA)2、40℃,在氨-水体系中不断通入CO2,各种离子的变化趋势如下图所示。
下列说法不正确...的是()A.在pH=9.0时,c(NH)>c(HCO)>c(NH2COO-)>c(CO)B.不同pH的溶液中存在关系:c(NH)+c(H+)=2c(CO)+c(HCO)+c(NH2COO-)+c(OH-)C.随着CO2的通入,不断增大D.在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成3、室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是()A.三种酸的电离常数关系:K HA>K HB>K HDB.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)4、H2C2O4为二元弱酸。
20℃时,配制一组c(H2C2O4)+c(HC2O)+c(C2O)=0.100mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。
下列指定溶液中微粒的物质的量浓度关系一定正确的是(双选)()A.pH=2.5的溶液中:c(H2C2O4)+c(C2O)>c(HC2O)B.c(Na+)=0.100mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O)C.c(HC2O)=c(C2O)的溶液中:c(Na+)>0.100mol·L-1+c(HC2O)D.pH=7.0的溶液中:c(Na+)>2c(C2O)5、溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是()A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.60℃时溴酸银的K sp约等于6×10-4D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯6、常温下向25mL0.1mol·L-1NaOH溶液中逐滴滴加0.2mol·L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的K a=10-4.7)。
下列说法正确的是() A.水电离出的c(H+):A点小于B点B.在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(N)C.在C点,滴加的V(HN3溶液)=12.5mLD.在D点,c(Na+)=2c(HN3)+2c(N)7、25℃时,取浓度均为0.1mol·L-1的醋酸溶液和氨水各20mL,分别用0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。
下列说法正确的是()A.曲线Ⅰ,滴加10mL溶液时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)B.曲线Ⅰ,滴加20mL溶液时:c(Cl-)=c(NH)>c(H+)=c(OH-)C.曲线Ⅱ,所滴加溶液在10~20mL之间时存在:c(NH)=c(Cl-)>c(OH-)=c(H+)D.曲线Ⅱ,滴加10mL溶液时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]8、25℃,有c(CH 3COOH)+c(CH 3COO -)=0.1mol ·L -1的一组醋酸和醋酸钠混合溶液,溶液中c(CH 3COOH)、c(CH 3COO -)与pH 值的关系如图所示。
下列有关离子浓度关系叙述不正确的是()A.pH =5.5溶液中:c(CH 3COOH)>c(CH 3COO -)>c(H +)>c(OH -)B.W 点表示溶液中:c(Na +)+c(H +)=c(CH 3COO -)+c(OH -)C.pH =3.5溶液中:c(Na +)+c(H +)-c(OH -)+c(CH 3COOH)=0.1mol ·L -1D.向W 点所表示溶液中通入0.05molHCl 气体(溶液体积变化可忽略):c(H +)=c(CH 3COOH)+c(OH -) 9、浓度均为0.10mol/L 、体积均为V 0的MOH 和ROH 溶液,分别加水稀()释至体积V,pH 随0lg V V 的变化如图所示,下列叙述错误的是A .MOH 的碱性强于ROH 的碱性B .ROH 的电离程度:b 点大于a 点C .若两溶液无限稀释,则它们的c(OH -)相等D .当0lg V V =2时,若两溶液同时升高温度,则c(M +)/c(R +)增大 10、常温下,用0.1000mol·L 1-NaOH 溶液滴定1-3CH COOH 溶液所得滴定曲线如右图。
下列说法正确的是()A .点①所示溶液中:B .点②所示溶液中:C .点③所示溶液中:D .滴定过程中可能出现:()()()()()33CH COOH CH COO H Na OH c c c c c -++->>>> 11、常温下将NaOH 溶液滴加到己二酸(H 2X )溶液中,混合溶液的pH 与离子浓度变化的关系如图所示。
下列叙述错误的是()A .K a2(H 2X )的数量级为10–6B .曲线N 表示pH 与2(HX )lg (H X)c c -的变化关系 C .NaHX 溶液中(H )(OH )c c +->D .当混合溶液呈中性时,2(Na )(HX )(X )(OH )(H )c c c c c +---+>>>=12、改变0.11mol L -⋅二元弱酸2H A 溶液的pH ,溶液中的2H A 、HA -、2A -的物质的量分数(X)δ随pH 的变化如图所示[已知22(X)(X)(H A)(HA )(A )c c c c δ--=++]。
下列叙述错误的是()A .pH=1.2时,2(H A)(HA )c c -=B .22lg[(H A)] 4.2K =-C .pH=2.7时,22(HA )(H A)(A )c c c -->=D .pH=4.2时,2(HA )(A )(H )c c c --+==。
