铝及其重要化合物转化关系
高考化学一轮复习(第二辑)考点26 铝的冶炼及含铝化合物之间的转化(含解析)
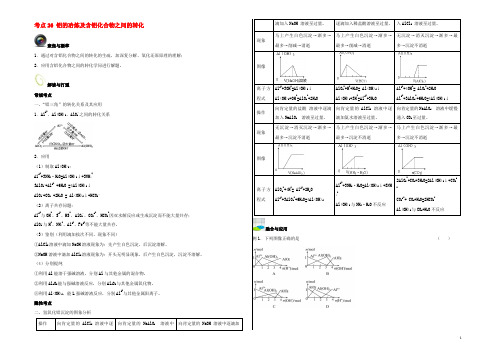
考点26 铝的冶炼及含铝化合物之间的转化聚焦与凝萃1.通过对含铝化合物之间的转化的生疏,加深复分解、氧化还原原理的理解;2.应用含铝化合物之间的转化学问进行解题。
解读与打通常规考点一、“铝三角”的转化关系及其应用1.Al3+、Al(OH)3、AlO-2之间的转化关系2.应用(1)制取Al(OH)3:A13++3NH3·H2O=Al(OH)3↓+3NH4+3AlO-2+Al3+ +6H2O =4Al(OH)3↓AlO-2+CO2 +2H2O = Al(OH)3↓+HCO3-(2)离子共存问题:Al3+与OH-、S2-、HS-、AlO-2、CO32-、HCO3-因双水解反应或生成沉淀而不能大量共存;AlO-2与H+、NH4+、Al3+、Fe3+等不能大量共存。
(3)鉴别(利用滴加挨次不同,现象不同)①AlCl3溶液中滴加NaOH溶液现象为:先产生白色沉淀,后沉淀溶解。
②NaOH溶液中滴加AlCl3溶液现象为:开头无明显现象,后产生白色沉淀,沉淀不溶解。
(4)分别提纯①利用Al能溶于强碱溶液,分别Al与其他金属的混合物。
②利用Al2O3能与强碱溶液反应,分别Al2O3与其他金属氧化物。
⑧利用Al(OH)3,能L强碱溶液反应,分别Al3+与其他金属阳离子。
隐性考点二、氢氧化铝沉淀的图象分析操作向肯定量的AlCl3溶液中逐向肯定量的NaAlO2溶液中向肯定量的NaOH 溶液中逐滴加滴加入NaOH 溶液至过量。
逐滴加入稀盐酸溶液至过量。
入AlCl3溶液至过量。
现象马上产生白色沉淀→渐多→最多→削减→消逝马上产生白色沉淀→渐多→最多→削减→消逝无沉淀→消灭沉淀→渐多→最多→沉淀不消逝图像离子方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+2H2OAlO2-+H++H2O= Al(OH)3↓Al(OH)3+3H+=Al3++3H2OAl3++4OH-= AlO2-+2H2OAl3++3AlO2-+6H2O=4Al(OH)3↓操作向肯定量的盐酸溶液中逐滴加入NaAlO2溶液至过量。
铝三角及其图像

Al3+ + 3AlO2—+ 6H2O = 4Al(OH)3↓
0 1 2 3 n(AlCl3)
9.往NaAlO2溶液中通入CO2 (或过量) 或AlO2—+CO2 +2H2O =Al(OH)3↓+HCO3— n[Al(OH)3] ↓ 2AlO2— +CO2 +3H2O =2Al(OH)3↓+CO32—
铝及其重要化合 物之间的转化
Al
① ②
Al2O3
④ ⑥ ⑨ ⑧ Al3+ ③ Al(OH)3 ⑿ ⒀
⑤ ⑦
⑩ ⑾ AlO2
点燃
①4Al+3O === 2 Al O 2 2 3
② 2Al O =4Al+ 3O ↑ 2 3 2 △ ③ ④ 2Al+6H+=2Al3++3H2↑
电解
2Al(OH)3=Al2O3+3H2O
n(OH-) ≥ 4n(Al3+) 时,n[Al(OH)3)]=0,无沉淀
(2).求反应物强碱的物质的量 若碱不足:n(OH-) = 3n[Al(OH)3] 若碱过量:n(OH-) = 4n(Al3+)-n[Al(OH)3] (3).可溶性铝盐与强碱(如NaOH溶液)反应后Al元素存在形态
例3
在50 mL b mol·L-1的AlCl3溶液中加入50 mL a mol/L NaOH溶液。 (1)、当a≤3b时,生成Al(OH)3沉淀的物质的量为________。
溶液用于溶解 Al(OH) ∴ c(HCl) = n/V =3。 0.800mol/0.10L = 8.00mol/L
(2)8.00 mol· L
(1) 、由题意可知 m[Al(OH)3]=(19.4—11.6)g =7.8g , m[Mg(OH)2] =11.6g,则铝的质量分数为:
元素化合物的转化关系网络图

元素化合物的转化关系、常见金属元素(Na 、Al 、Fe 、Cu )单质及其重要化合物。
1、钠及其重要化合物间的转化关系。
(WH 或 AHCIHC1写出图中标号反应的化学方程式或离子方程式。
① 2Na + 02,Na 2O 2 (淡黄色)② 2Na 2O 2 + 2H 2O = 4NaOH + 0 2? 2Na + 2H 2O = 2Na ++ 20H - + H z f③ 2Na 2O 2 + 2H 2O = 4NaOH + O 2?2血2。
2 + 2H 2O = 4Na ++ 4OH -+ O 2 ?④ 2Na 2O 2 + 2CO 2 = 2Na 2CO 3 + O 2⑤ 2NaCl +2 H 2O 通电 2NaOH + H 2 ? + CI 2 ?(氯碱工业) 2C 「+2 H 2O 通电 2OH - + H 2 ? + CI 2 ? ⑥ Na 2CO 3 + H 2O +CO 2 = 2NaHCO 3CO 3 + H 2O +CO 2 = 2HCO 3⑦ 2 NaCIO + H 2O +CO 2 = Na 2CO 3+ HCIO 2、铝及其重要化合物间的转化关系。
HC1 出, 通暫熔融陋'NaOHAJ 7冷浓HNOj或浓HjSO, NaOH②钝化④HC1△NaA10a — 或 ⑦NaOH写出图中标号反应的化学方程式或离子方程式。
- 点燃 ① 4AI + 3O 2 2AI 2O 3 ② 2AI + 2NaOH + 2H 2O = 2NaAIO 2 + 3H 2 ? ③ 2AI 2O 3 通电 4AI+3O 2 ? ④ AI 2O 3+6HCI = 2AICI 3+3H 2O⑤ AI 2O 3 + 2NaOH = 2NaAIO 2 +H 2O咼温2AI + Fe 2O 3 2Fe + AI 2O 32AI +2OH - +2H 2O = 2AIO 2 +3H 2 ?+3+AI 2O 3 + 6H = 2AI 3+ 3H 2O AI 2O 3 + 2OH - = 2AIO 2- + H 2O点燃* N«CK>CO Z . H 屮⑥NaCl 工C 2H 5OHC ?H 5ONaC»(OH )2 HCIAICI 3+3NH 3 H 2O = AI(OH) 3 J + 3NH 4CI AICI3 +3NaOH = AI(OH) 3J + 3NaCI AI(OH) 3 +NaOH =NaAIO 2 +2 H 2O AI 3+ +3 AIO 2- +6H 2O = 4AI(OH) 铁及其重要化合物间的转化关系。
铝及其化合物知识点

铝及其化合物一、铝的构造:1、原子构造表示图:2、周期表中地点:第三周期Ⅲ A族镁原子核外有三个电子,在化学反响中,简单失掉最外层的三个电子,显+3价。
二、铝单质的性质1、物理性质:银白色金属,硬度和密度小,拥有优秀的导电导热△性和延展性。
在空气中拥有很好的耐腐化性。
2、化学性质:(1)与非金属单质反响:A、2Al+3Cl2====2AlCl3B、铝在空气中迟缓氧化,在氧气中点燃激烈焚烧。
点4Al+3O2=========2AlO3思虑:在金属开朗性次序中铝排在铁的前方,那为何铁在空气中易生锈而铝在空气中不易被腐化呢?铝与空气中的氧气反响生成致密的氧化膜并坚固地覆盖在铝表面,阻挡了内部的铝与空气接触。
(2)与盐溶液反响:2Al+3CuSO4=3Cu+Al2(SO4)3(3)与某些氧化物反响—铝热反响:2Al+Fe O==2Fe+Al3铝热剂[现象]:发出刺眼的光辉、放出大批的热、有熔融物生成。
[试一试]:写出Al分别与△MnO2、V2O5的反响方程式4)与开水轻微反响:2Al+6H2O=========2Al(OH)3+3H2↑5)与酸反响::2Al+6HCl======2AlCl3+H2↑2Al+3H 2SO4======Al2(SO4)3+3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,进而阻挡内部金属进一步发生反响,这类现象称为钝化。
(6)与碱反响:2Al+2NaOH+2HO=2NaAlO+3H2↑化合价高升,被氧化,1)2Al+6H2O======2Al(OH)3+3H2↑失6e—反响的本质:分两步进行: 化合价降低,被复原,(2 )Al(OH)3+NaOH ========NaAlO2+2H2O失2×32Al+6H2O+2NaOH=2NaAlO+3H2↑得6×三、铝的重要化合物1、氧化铝(Al2O3)物理性质:白色固体、熔点高(2054℃)、不溶于水,不与水化合。
常见金属元素及其重要化合物
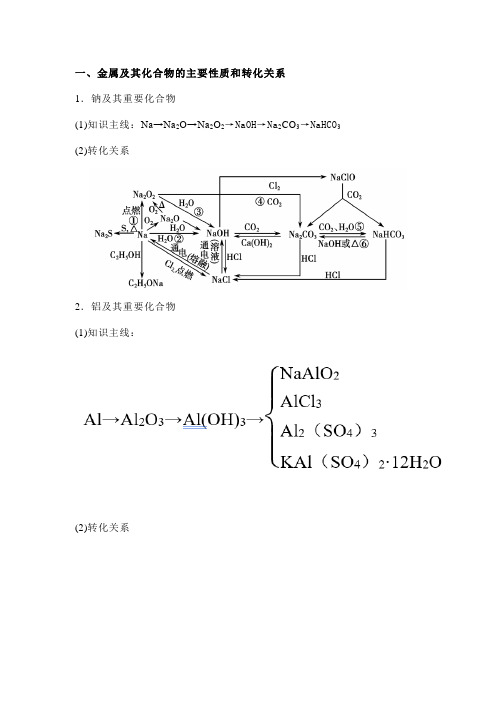
一、金属及其化合物的主要性质和转化关系1.钠及其重要化合物(1)知识主线:Na→Na2O→Na2O2→NaOH→Na2CO3→NaHCO3(2)转化关系2.铝及其重要化合物(1)知识主线:(2)转化关系3.铁及其重要化合物(1)知识主线(2)转化关系4.铜及其重要化合物(1)知识主线:(2)转化关系:二、常见阳离子的检验与判断常见阳离子的检验1.用NaOH溶液检验Cu2+产生蓝色沉淀Fe3+产生红褐色沉淀Fe2+产生白色沉淀,迅速变成灰绿色,最后变成红褐色Al3+产生白色沉淀,继续加入NaOH溶液,白色沉淀溶解NH4+共热生成能使湿润的红色石蕊试纸变蓝的气体2.特殊检验法Fe3+加入KSCN溶液呈红色,加苯酚溶液呈紫色Fe2+加入KSCN溶液无现象,滴加新制氯水或双氧,水后溶液呈红色3.焰色反应用焰色反应可检验出溶液中的K+和Na+K+火焰呈紫色(透过蓝色钴玻璃观察)Na+火焰呈黄色三、金属元素单质及其化合物1.无机化工流程题常见设问方向(1)反应速率与平衡理论的运用;(2)氧化还原反应的判断、化学方程式或离子方程式的书写;(3)利用控制pH分离除杂;(4)化学反应的能量变化;(5)实验基本操作:除杂、分离、检验、洗涤、干燥等;(6)流程中的物质转化和循环,资源的回收和利用;(7)环境保护与绿色化学评价。
2.无机化工流程题的审题技能化工生产流程题中经常会出现一些表述性词语,这些表述性词语就是隐性信息,它可以暗示我们审题所应考虑的角度。
常见的有:(1)“控制较低温度”——常考虑物质的挥发,物质的不稳定性和物质的转化等。
(2)“加过量试剂”——常考虑反应完全或增大转化率、产率等。
(3)“能否加其他物质”——常考虑会不会引入杂质或是否影响产品的纯度。
(4)“在空气中或在其他气体中”——主要考虑O2、H2O、CO2或其他气体是否参与反应或达到防氧化、防水解、防潮解等目的。
(5)“判断沉淀是否洗净”——常取少量最后一次洗涤液于试管中,向其中滴加某试剂,以检验其中的某种离子。
必修1_物质转化关系图及相应化学方程式

必修1 物质转化关系图及相应化学方程式一、金属钠及其重要化合物的相互转化(括号内写离子方程式)1、4 Na + O 2 === 2 Na 2O2、2 Na +O 2△Na 2O 23、2 Na +2 H 2O===2 NaOH +H 2↑ (2 Na +2 H 2O===2 Na ++2 OH -+H 2↑)4、Na 2O + H 2O===2 NaOH (Na 2O +H 2O===2 Na ++2 OH -) *5、2Na 2O 2 +2H 2O === 4 NaOH +O 2↑ (2Na 2O 2+2 H 2O =4Na ++4OH -+O 2↑) *6、2 Na 2O 2 + 2 CO 2 === 2 Na 2CO 3+O 27、2 NaOH + CO 2 === Na 2CO 3+H 2O (CO 2+ 2 OH - = CO 32-+H 2O ) 8、NaOH + HCl === NaCl +H 2O (OH — + H += H 2O)9、Na 2CO 3+2HCl =2NaCl +CO 2↑+H 2O (CO -23+ 2H + = CO 2↑ + H 2O )10、NaHCO 3+HCl =NaCl +CO 2↑+H 2O (HCO -3+ H + = CO 2↑ + H 2O )11、Na 2CO 3+CO 2+H 2O= 2 NaHCO 3 (CO 32— + CO 2 + H 2O= 2 HCO 3—)12、NaHCO 3+NaOH =Na 2CO 3+H 2O (HCO -3+OH - = CO -23 + H 2O )2 NaHCO 3△Na 2CO 3+CO 2↑+H 2ONa 2O Na ①NaCl NaHCO 3Na 23Na 2O 2 ② ③ ④ ⑤ ⑥⑦ ⑧ ⑨⑩ ⑾ ⑿二、非金属氯及其化合物的相互转化(括号内写离子方程式)1、H 2 + Cl 2点燃2HCl 2、2Na + Cl 2 点燃2NaCl3、Cu + Cl 2 点燃CuCl 24、2Fe + 3Cl 2点燃2FeCl 35、HCl +AgNO 3 = AgCl↓+HNO 3 (Cl -+Ag +=Ag Cl↓)6、NaCl +AgNO 3 = AgCl↓+NaNO 3 (Cl -+Ag +=AgCl↓)7、CuCl 2+2AgNO 3 = 2AgCl↓+Cu(NO 3)2 (Cl -+Ag +=AgCl↓)8、FeCl 3+3AgNO 3 = 3AgCl↓+Fe(NO 3)3 (Cl -+Ag +=AgCl↓)9、Cl 2 + 2NaOH = NaCl + NaClO + H 2O (Cl 2 + 2OH - = Cl - + ClO - + H 2O) 10、2Cl 2 + 2Ca(OH)2 = CaCl 2+ Ca(ClO)2 +2 H 2O(Cl 2 + 2OH - = Cl - + ClO - + H 2O)11、Cl 2 + H 2O = HCl + HClO (Cl 2 + H 2O = H ++Cl -+ HClO) 12、NaClO +HCl = NaCl + HClO (ClO - +H += HClO)2NaClO+H 2O+CO 2= Na 2CO 3+ 2HClO (2ClO -+H 2O+CO 2= CO 32-+ 2HClO) 13、Ca(ClO) 2+2HCl = CaCl 2 + 2HClO (ClO - +H += HClO)Ca(ClO)2+H 2O+CO 2=CaCO 3↓+2HClO (Ca 2++2ClO -+H 2O+CO 2=CaCO+ 2HClO)14、2HClO 2HCl+O 2↑NaCl 23AgCl⑤ ⑥ ⑦ ⑧光照三、金属铝及其重要化合物的相互转化(括号内写离子方程式)1.4Al +3O 2点燃2Al 2O 3 2.2 Al (OH )3△Al 2O 3 +3H 2O3.2Al +6HCl==2AlCl 3+3H 2↑ ( 2Al +6H +==2 Al 3++3H 2↑) 4.2Al +2NaOH +2H 2O==2NaAlO 2+3H 2↑ (2 Al +2OH -+2H 2O =2AlO 2-+3 H 2↑)5.Al 2O 3+6HCl =2AlCl 3+3H 2O ( Al 2O 3+6H +=2Al 3++3H 2O ) 6. Al 2O 3+2NaOH =2Na AlO 2+H 2O (Al 2O 3+2OH -=2 AlO 2-+H 2O )7、Al (OH )3+3HCl =AlCl 3+3H 2O ( Al (OH )3+3H + = Al 3++3H 2O )8、Al (OH )3+NaOH =NaAlO 2+2H 2O ( Al (OH )3+OH - = AlO 2-+2H 2O )9、实验制取Al (OH )3: AlCl 3+3NH 3·H 2O = Al (OH )3↓+3NH 4Cl (Al 3++3 NH 3·H 2O = Al (OH )3 ↓+ 3NH 4+ )AlAl (OH )3NaAlO 2Al 2O 3AlCl 3①②③④ ⑤ ⑥⑦ ⑧四、金属铁及其化合物的相互转化(括号内写离子方程式)1、3Fe +2O2 点燃Fe3O42、Fe+2HCl=FeCl2+H2↑(Fe+2H+=Fe2++H2↑)Fe+CuCl2=FeCl2+Cu (Fe+Cu2+=Fe2++Cu)3、FeO+2HCl=FeCl2+H2O(FeO+2H+=Fe2++H2O)4、Fe2O3+6HCl=2 FeCl3+3H2O (Fe2O3+6H+=2Fe2++3H2O)5、FeCl2+2NaOH =Fe(OH)2↓+2NaCl (Fe2++2OH-=Fe(OH) 2)↓6、Fe(OH)2 + 2HCl=FeCl2+2H2O(Fe(OH)2+2H+=Fe2++2H2O)7、FeCl3+3NaOH =Fe(OH)3↓+3NaCl ( Fe3++3OH-=Fe(OH) 3↓)8、Fe(OH) 3+3HCl=FeCl3+3H2O (Fe(OH) 3+3H+=Fe3++3H2O)9、2FeCl2+Cl2=2FeCl3 (2Fe2++Cl2=2 Fe3++2Cl—)10、属于化合反应的:Fe+2FeCl3 =3FeCl2(Fe +2 Fe3+=3 Fe2+) 印刷腐蚀电路板:Cu+2FeCl3 =CuCl2+2FeCl2 (Cu+2 Fe3+=Cu2++2 Fe2+)11、2 Fe(OH)3△Fe2O3+3H2O12、白色沉淀,然后迅速变为灰绿色,最后变为红褐色4 Fe(OH)2+ O2 + 2 H2O ═ 4 Fe(OH) 3①Fe3O4②23⑾⑿。
铝的重要化合物

铝的重要化合物(一)氧化铝与氢氧化铝 1.物理性质 (1)Al 2O 3为白色固体,难溶于水,熔、沸点很高,可用作耐火材料。
(2)Al(OH)3为白色胶状不溶于水的固体,有较强的吸附性。
2.化学性质 Al(OH)3的电离: AlO -2+H ++H 2O酸式电离Al(OH)3碱式电离Al 3++3OH -(1)Al 2O 3与Al(OH)3的两性[注意] ①两性氧化物是指既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物;②两性氢氧化物是指既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物。
(2)Al(OH)3的不稳定性2Al(OH)3=====△Al 2O 3+3H 2O(用于制备Al 2O 3)3.Al(OH)3的制备 (1)向铝盐溶液中加入氨水,离子方程式为 Al 3++3NH 3·H 2O ===Al(OH)3↓+3NH +4。
(2)向NaAlO 2溶液中通入足量CO 2,离子方程式为 AlO -2+CO 2+2H 2O===Al(OH)3↓+HCO -3。
(3)NaAlO 2溶液与AlCl 3溶液混合: 3AlO -2+Al 3++6H 2O===4Al(OH)3↓。
[注意] ①用铝盐与碱液反应制取Al(OH)3时,采用弱碱溶液氨水而不用强碱溶液。
①用偏铝酸盐与酸反应制取Al(OH)3时,一般通入CO 2,而不使用强酸。
(二)常见的铝盐——明矾[KAl(SO 4)2·12H 2O ] 1.明矾的组成与应用 (1)硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
(2)化学式为KAl(SO 4)2。
(3)电离方程式为KAl(SO 4)2===K ++Al 3++2SO 2-4。
(4)应用:净水。
净水原理为明矾电离出的Al 3+在水中水解生成Al(OH)3胶体,吸附水中悬浮物而沉淀,使水净化,其离子方程式为Al 3++3H 2OAl(OH)3(胶体)+3H +。
Al及其化合物

铝及其化合物1.化学性质 铝及化合物的相互转化关系①②③④⑤⑥⑦⑧⑨Al Al 2O 3 Al(OH)3 AlCl 3NaAlO 2⑩(1)和氧气反应。
铝极易和氧气发生反应,生成一层致密的氧化膜。
这层氧化膜保护里边的金属不易和氧气反应而被腐蚀。
铝和氧气反应的化学方程式为223432Al O Al O +加热或点燃。
加热铝箔实验时,融化的铝并不滴落,原因是Al 2O 3薄膜将熔化的Al 承接住了,这个实验也说明氧化铝的熔点比铝高。
(2)铝也能和其他非金属反应,写出下列反应方程式:①铝在氯气中燃烧23232Al Cl AlCl +点燃;②铝粉和硫粉混合加热2323Al S Al S +点燃。
(2)和酸反应。
写出下列反应方程式和对应的离子方程式:①HCl 反应:化学反应方程式322623Al HCl AlCl H ++=↑,离子反应方程式322623Al H Al H +++=+↑②H 2SO 4反应:化学反应方程式242432232()3Al H SO Al SO H +=+↑,离子反应方程式322623Al H Al H +++=+↑;(3)和NaOH 溶液反应:化学反应方程式22222223Al NaOH H O NaAlO H ++=+↑,离子反应方程式22222223Al OH H O AlO H --++=+↑。
等质量的铝粉分别和足量的盐酸和氢氧化钠溶液反应,产生的氢气相等,等浓度等体积的盐酸和氢氧化钠溶液和足量的铝粉反应,产生的氢气NaOH 的多。
(4)铝和盐溶液的反应。
写出下列反应方程式和对应的离子方程式:铝投入硫酸铜溶液中:化学反应方程式4243233()Al CuSO Cu Al SO +=+,离子反应方程式232332Al CuCu Al +++=+; (5)铝热剂的反应。
写出下列反应方程式:①铝粉和四氧化三铁粉末混合加热34238349Al Fe O Al O Fe ++高温;②铝粉和三氧化二铬粉末混合加热232322Al Cr O Al O Cr ++高温。
