[精品]初三上化学计算题训练2及答案
九年级化学化学计算题题20套(带答案)及解析
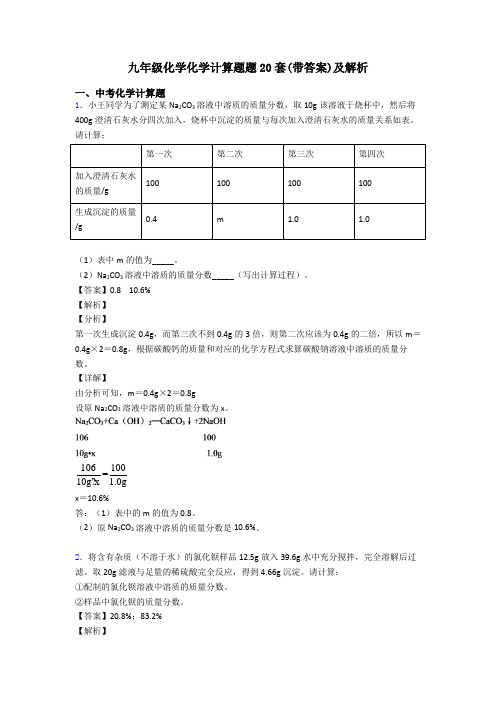
九年级化学化学计算题题20套(带答案)及解析一、中考化学计算题1.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。
请计算:第一次第二次第三次第四次加入澄清石灰水100100100100的质量/g生成沉淀的质量0.4m 1.0 1.0/g(1)表中m的值为_____。
(2)Na2CO3溶液中溶质的质量分数_____(写出计算过程)。
【答案】0.8 10.6%【解析】【分析】第一次生成沉淀0.4g,而第三次不到0.4g的3倍,则第二次应该为0.4g的二倍,所以m=0.4g×2=0.8g,根据碳酸钙的质量和对应的化学方程式求算碳酸钠溶液中溶质的质量分数。
【详解】由分析可知,m=0.4g×2=0.8g设原Na2CO3溶液中溶质的质量分数为x。
106100=10g?x 1.0gx=10.6%答:(1)表中的m的值为 0.8。
(2)原Na2CO3溶液中溶质的质量分数是10.6%。
2.将含有杂质(不溶于水)的氯化钡样品12.5g放入39.6g水中充分搅拌,完全溶解后过滤。
取20g滤液与足量的稀硫酸完全反应,得到4.66g沉淀。
请计算:①配制的氯化钡溶液中溶质的质量分数。
②样品中氯化钡的质量分数。
【答案】20.8%;83.2%【解析】【详解】①设参加反应的氯化钡的质量为x 。
2244BaCl +H SO =BaSO +2H 208233x4Cl.66g208233=x 4.66gx= 4.16g则配制的氯化钡溶液中溶质的质量分数为 :4.16g20g×100%=20.8% ②由于20g 溶液中含有4.16g 氯化钡,则可设样品中氯化钡的质量为y 。
则4.16g y=20g-4.16g 39.6gy=10.4g样品中氯化钡的质量分数为:10.4g12.5g×100%=83.2%答:①氯化钡溶液中溶质的质量分数为20.8% ②样品中氯化钡的质量分数为83.2%。
(精校版)九年级上册期末化学计算题专项训练(含答案)

98g=2.0g,
物质量与氯酸钾质量差即为二氧化锰的质量.
答:反应后剩余的物质有氯化钾、二氧化锰质量分别为 59.6 g、2 g.
由于二氧化锰在反应中为催化剂,反应前后质量不变,本题也可以
反应前后的质量差即为反应生成氧气的质量,根据氧气的质量可以
由氧气质量计算反应生成氯化钾的质量,而由反应后固体求出二氧
实验次数
1
2
3
4
加入的稀盐酸的质量/g
10 10
10 10
剩余固体的质量/g
(直打版)九年级上册期末化学计算题专项训练(含答案)(word 版可编辑修改)
4
m
2
1。5
(1)反应生成氧气的质量为 ______ g;
求(1)表中 m 的值为 ______ 克. (2)该石灰石样品的纯度.
(2)求混合物中氯酸钾质量?(写出计算步骤) (3)反应后剩余的物质有 ______ ;其质量分别为 ______ .
故答案为:3;
答:生成二氧化碳的质量为 88g,体积为 44 升.
(2)由表中数据可知第 4 次固体的质量减少小于 1g,所以杂质的
5。 (1)由图表可知,第三次和第四次剩余固体的质量相等,说明,第 三次反应已是完全反应.由于生成的气体逸出,所以根据质量守恒
质量为 1。5g,
5g - 1.5g
所以石灰石的质量分数=
析知第三次加入稀盐酸时碳酸钙已无剩余,故杂质的质量为 0.3g;
11。煅烧 125 t 含杂质 20%的石灰石,最多可得到生石灰和二氧化 碳各多少吨?
(2)由图表分析知第三次剩余的固体即为杂质的量,故有:
2g - 0.3g
石灰石中碳酸钙的纯度为:
×100%=85%
【化学】中考化学化学计算题及其解题技巧及练习题(含答案) (2)

【化学】中考化学化学计算题及其解题技巧及练习题(含答案)一、中考化学计算题1.马英同学取某地石灰石样品12g进行测定实验,现将100g稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:第1次第2次第3次第4次第5次加入稀盐酸的质量/g2020202020生成气体的总质量/g 1.1 2.2m 4.4 4.4试求:(1)m的值为______g。
(2)12g石灰石样品中碳酸钙的质量是_____。
(3)所用稀盐酸溶液中溶质的质量分数是_____。
(4)反应完全后最终溶液中氯化钙的质量分数是____。
(结果保留小数点后一位小数)【答案】3.3g。
10g 9.1% 10.5%【解析】【详解】(1)分五次加入盐酸后,前两次,每次都增加1.1g二氧化碳,第四、五都生成4.4g二氧化碳,说明第三次没有完全反应,也增加1.1g,所以m值是3.3g;故填:3.3;(2)设参加反应的碳酸钙质量为x;第4次反应完全后用去稀盐酸的溶质的质量为y;第4次反应完全后生成氯化钙的质量为z,10073111==x y z解得x=10g,y=7.3g,z=11.1g,故填10g;(3)稀盐酸的溶质质量分数:7.3g×100%9.1%80g≈,故填9.1%;(4)反应完全后最终溶液中氯化钙的质量分数:11.1g100%10.5%10g+100g-4.4g≈⨯,故填10.5%;答:m的值为3.3g;12g石灰石样品中碳酸钙的质量是10g;所用稀盐酸溶液中溶质的质量分数9.1%;反应完全后最终溶液中氯化钙的质量分数10.5%。
2.某氢氧化钠样品中含有少量的碳酸钠杂质。
现取20g 样品于烧杯中,加入180g 水使其完全溶解,再向其中逐滴加入稀盐酸至过量,测得生成气体质量与所加稀盐酸质量关系如图所示,请回答下列问题:(1)下图中0—A 无气体产生,说明盐酸优先跟样品中的_____(填化学式)发生反应。
(化学)初三化学化学计算题的基本方法技巧及练习题及练习题(含答案)含解析 (2)

(化学)初三化学化学计算题的基本方法技巧及练习题及练习题(含答案)含解析一、中考化学计算题1.为测定某样品中锌的质量分数,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设锌的样品中杂质不与稀硫酸反应,且不溶于水),每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:第一次第二次第三次第四次第五次加入稀硫酸的质量/g1010101010剩余固体质量/g8.4 6.8 5.2 3.6 3.6请认真分析表中的数据,回答下列问题:(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;(2)计算样品中锌的质量分数;(3)计算实验中所用稀硫酸的溶质质量分数。
【答案】(1)4(2)锌的质量分数(3)设恰好完全反应时消耗硫酸的质量为x【解析】本题考查的是实验数据处理的探究和根据化学反应方程式的计算。
(1)根据金属活动性,锌在活动性顺序中处于H之前,能与稀硫酸反应,而锌的样品中杂质不与稀硫酸反应,且不溶于水。
由记录数据表可知:第五次加入10g稀硫酸时,剩余固体质量不变仍为3.6g,说明混合物中的锌在第四次加酸后就已完全反应,剩余固体为不与硫酸反应的杂质。
另据上表可见,前三次中每加入10g的稀硫酸,都消耗1.6g的锌,二者结合分析故知第四次恰好完全反应。
(2)则样品中锌的质量分数m=(3)设恰好完全反应时消耗硫酸的质量为x65 98(10﹣3.6) X65/98=(10﹣3.6)/xX=9.6g∴所用稀硫酸的溶质质量分数==24℅2.我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质。
现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。
试求:(1)该纯碱样品的纯度_________________。
(2)所得溶液中溶质的质量分数_________。
(化学)初三化学化学计算题专项训练100(附答案) (2)

(化学)初三化学化学计算题专项训练100(附答案)一、中考化学计算题1.我市东部山区盛产石灰石,某校课外活动小组为了解石灰石资源的品质,采用两种方案对当地石材进行化学分析:方案一: 取10g 石灰石粉末样品置于下图所示装置,充分加热至质量恒定,冷却后称得固体质量为8.12g方案二:另取10g 同质地石灰石颗粒样品,置于烧杯中加足量稀盐酸,充分反应后称得混合物的总质量减少了4.27g 相关资料:当地石灰石含有的主要杂技为二氧化硅,其化学性质稳定,加热不易分解且不与盐酸发生化学反应.计算出两种方案测得的石灰石中碳酸钙的质量分数: (1)方案一中碳酸钙的质量分数是_______________________;(2)方案二中碳酸钙的质量分数是_______________________.(精确到0.1%) 比较两方案测量的结果,分析两方案误差较大的可能原因?______【答案】42.7% 97% 石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大. 【解析】 【分析】 【详解】(1)生成二氧化碳的质量为10g-8.12g=1.88g 设生成1.88g 二氧化碳需碳酸钙的质量为x32CaCO CaO +10044x1.88CO g高温10044=x 1.88gx=4.27g石灰石样品中碳酸钙的质量分数为4.27g100%=42.7% 10g⨯(2)混合物的总质量减少了4.27g说明生成了4.27g二氧化碳设样品中的碳酸钙的质量为y3222CaCO+2HCl=CaCl+H O+CO10044y 4.27g↑10044=y 4.27gy=9.7g石灰石样品中碳酸钙的质量分数为9.7g100%=97% 10g⨯石灰石分解需要高温,两方案误差较大的原因可能是酒精灯火焰温度偏低,石灰石粉末未能充分分解,引起误差较大。
2.化学兴趣小组的同学用一瓶含有少量氯化钠和氯化钙的固体混合物进行下列实验:取样品14 g,放入烧杯中,加入96 g碳酸钠溶液恰好完全反应后过滤,称得滤液的总质量为100 g。
(化学)初三化学化学计算题试题(有答案和解析)含解析

(化学)初三化学化学计算题试题(有答案和解析)含解析一、中考化学计算题1.有一份锌粉与铜粉的混合物样品,为确定其组成,某同学将32.5g样品加入100g稀硫酸中,恰好完全反应,放出气体的质量与反应时间的关系如图所示。
试求:(1)样品中金属铜的质量是____g。
(2)所用稀硫酸的溶质质量分数____(写出计算过程)。
【答案】19.519.6%【解析】混合物中只有锌能够和稀硫酸反应生成氢气,题目给出了氢气的质量,所以可以根据氢气的质量和对应的化学方程式求算参加反应的锌的质量和消耗的稀硫酸中溶质的质量,进而求算铜的质量和硫酸中溶质的质量分数。
设参加反应的锌的质量为x,所消耗的硫酸中的溶质的质量为y。
Zn+ H2SO4 = ZnSO4 + H2↑65 98 2x y 0.4g659820.4x y g==x=13gy=19.6g混合物中铜的质量为32.5g-13g=19.5g所以稀硫酸中溶质的质量分数为19.6g0010019.600 100g⨯=答:(1)样品中金属铜的质量是19.5g。
(2)所用稀硫酸中溶质的质量分数为19.6%。
2.某小组同学将530 g碳酸钠溶液加入到280 g石灰乳(水和氢氧化钙的混合物)中,使之恰好完全反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数。
【答案】2%【解析】【详解】设原碳酸钠溶液中溶质的质量为xNa2CO3+ Ca(OH)2=CaCO3↓+ 2NaOH106 100 80X则解得x =10.6g所以加入的碳酸钠溶液中溶质的质量分数为答:加入的碳酸钠溶液中溶质的质量分数为2%。
3.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在 20℃时,称取5g 样品,加入27g 水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去 10%的稀盐酸 36.5g。
(该反应的化学方程式为:NaOH+HCl=NaCl+H2O)试计算:(1)样品中氢氧化钠的质量分数。
初三化学化学计算题题20套(带答案)

初三化学化学计算题题20套(带答案)1. 假设有一块铁块,其质量为56克。
求该铁块中含有的铁原子数。
解答:我们需要知道铁的摩尔质量。
铁的摩尔质量约为56克/摩尔。
因此,该铁块中含有的铁原子数为56克 / 56克/摩尔 = 1摩尔。
由于1摩尔物质中含有6.022 x 10²³个原子,所以该铁块中含有的铁原子数为1摩尔x 6.022 x 10²³个/摩尔= 6.022 x 10²³个。
2. 某化学反应中,反应物A和反应物B的化学计量比为2:3。
如果反应物A的质量为24克,求反应物B的质量。
解答:我们需要根据化学计量比计算出反应物B的质量。
由于反应物A和反应物B的化学计量比为2:3,所以反应物B的质量为24克x (3/2) = 36克。
3. 在一定条件下,一定量的氧气与一定量的氢气完全反应,了36克水。
求反应中消耗的氧气和氢气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
因此,36克水的物质的量为36克 / 18.016克/摩尔 = 2摩尔。
由于水的化学计量比为2:1,所以反应中消耗的氢气的物质的量为2摩尔,质量为2摩尔 x 2.016克/摩尔 = 4.032克。
同样,消耗的氧气的物质的量为1摩尔,质量为1摩尔 x 32.00克/摩尔 = 32.00克。
4. 某溶液中,溶质的质量分数为10%。
如果该溶液的质量为500克,求溶质的质量。
数为10%,即溶质的质量占溶液总质量的10%。
因此,溶质的质量为500克 x 10% = 50克。
5. 在一定条件下,一定量的氢气和一定量的氧气完全反应,了水。
如果反应中消耗的氢气的质量为2克,求反应中消耗的氧气的质量。
解答:我们需要根据水的化学式H₂O计算出水的摩尔质量。
水的摩尔质量为2 x 1.008克/摩尔 + 16.00克/摩尔 = 18.016克/摩尔。
初三化学考试 计算题25道(附答案)

25基础计算1.在一个实验室中发现一橡胶球可以漂浮在0.5mol/L的NaCl溶液表面,求该NaCl溶液的密度。
答案:1.018g/mL。
解析:根据阿威休斯定律得到:Fb=FgρVg=m*gρ=m/V=(Vg*g)/V=(Fg/Ag*g)/V=(4πr^3/3*g)/[(4/3)*π*r^3]=3/4*r*g=7.35*10^-5*g其中,Ag为橡胶球跟水接触的面积,r为橡胶球半径,g为重力加速度。
因此,NaCl溶液的密度为:ρNaCl=ρwater+ρball=1.000g/mL+7.35*10^-5*g/mL=1.018g/mL。
2.一种饱和食盐水的密度为1.20g/mL,问在哪个温度下它的浓度为26%。
答案:56.8°C。
解析:首先,要知道饱和食盐水在不同温度下的密度变化情况,参考表格得出如下数据:温度(°C)密度(g/mL)01.091101.078201.064301.049401.033501.015600.996700.975800.951900.9241000.895然后,根据浓度的定义可知:浓度=质量/总质量总质量=质量/浓度因为食盐水是饱和的,所以其浓度为100%。
设实验时食盐水的质量为m,则总质量为m/1.20,其中1.20为食盐水的密度。
根据题意,浓度为26%,所以食盐的质量为0.26*(m/1.20)。
由此0.26*(m/1.20)=m/(1.20+Δρ)其中Δρ为实验时食盐水的密度与需要求的密度的差值。
将参考表格中的数据代入上式计算,得到Δρ为0.325g/mL。
解方程得出:Δρ=0.325=0.26*m/(1.20+Δρ)m=68.45g因此,实验时食盐水的质量为68.45g。
而在哪个温度下其密度为1.20*0.26=0.312g/mL呢?查表可得,在56.8°C时,食盐水的密度约为0.312g/mL,因此答案为56.8°C。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
[精品]初三上化学计算题训练2及答案初三化学方程式的简单计算
1、对 100 克氧化铁和碳粉的混合物高温加热,反应的化学方程式为:
高温
,充分反应后所得固体质量为 67 克(其中含少量的2Fe2O3+3C====4Fe+3CO2?
未反应完的氧化铁)。
试求: ?反应生成的 CO2 的质量。
?参加反应的氧化铁的质量。
(3)反应后生成铁的质量。
(Fe-56 C-12 O-16)
2,小芳为测定Vc药片中维生素C,化学式为CHO,的质量分数,进行了如下实验:反应原理: 686
CHO+I==CHO+2HI,I不和Vc药片中的其他成分反应,实验数据:取Vc药片2 g,共消耗I的质686266622量为2.54 g。
请你帮助小芳计算该Vc药片中维生素C的质量分数。
3,含锌32.5%的锌粒100g与足量的稀硫酸反应,可以制得标准状态下氢气多
少升,
(标准状况下氢气的密度是0.09g/L; Zn+H2SO4=ZnSO4+H2?)
4,某同学为了测定黄铜屑,由锌和铜形成的合金,样品组成,分四次取样品与
,其实验数据记录如下表,
稀硫酸反应,只发生一个反应Zn+H2SO4=ZnSO4+H2?
1 2 3 4
取样品质量,g, 50.0 50.0 50.0 50.0
取稀硫酸质量,g, 40.0 80.0 120.0 160.0
产生气体质量,g, 0.4 0.8 1.0 1.0
试计算:,1,黄铜中锌的质量分数;
5,将8.4g表面有氧化铜的粗铜丝在加热条件下与足量的氢气充分反应后得到
8.0g的铜,
试求参加反应的氢气及反应后生成铜的质量。
6, 碳酸氢钠用于焙制糕点,在270度时分解,生成碳酸钠,水,二氧化碳,
现取(NaHCO3)16.8g在敞口容器中加热到质量不再改变为止,减少的质量多少,
7. CO是大气污染物之一,用氯化钯可以测定微量CO的存在,该反应的化学方程
若反应后得到Pd的质量为 1.06g,则测得CO的质式为PdCl+CO+HO=Pd?22+2HCl+CO,
量为多少克?,已知Pd的相对原子质量为106,2
8. 一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物
的质量不变,则
原混合物中铜粉和碳粉的质量比为多少,
9. 将足量的锌片加入到100g稀硫酸中至反应完全,取出锌片,所得溶液质量
为106.3g。
则生成H2的质量为多少,
10. (08福建三明)(6分)三明市民新水泥厂化验室,为了测定某矿山石灰石中
碳酸钙的质量分数,取石灰石样品与足量稀盐酸在烧杯中反应(假设石灰石样品中杂质不与稀盐酸反应也不溶于水。
)有关实验数据如下表:
反应前反应后
烧杯和稀盐酸的质量石灰石样品的质量烧杯和其中混合物的质量实验数据150 g 12 g 157.6 g
相对原子质量: C 12 , O 16 , Ca 40,
(1)根据质量守恒定律可知,反应中生成二氧化碳的质量为 g。
(2)求该石灰
石中碳酸钙的质量分数。
(有关反应的化学方程式为:CaCO+2HCl==CaCl+HO+CO?) 3222
11. 2008年5月26日上午,北京奥运圣火在我市传递。
奥运祥云火炬在工艺
上采用了高品质的铝合金外壳和中空塑件设计。
请根据下列材料,回答有关问题: (1)铝合金材料中的铝是通过下列反应制得的:2A1O(熔融)4Al,3O?。
其中,冰晶232石作熔剂,可使AlO更易离解成自由离子。
冰晶石的化学式为NaAlF,则其中氟元素的化合价2336为________。
(2)祥云火炬所用的燃料是丙烷(化学式为CH),它与甲烷(CH)、丁烷(CH)属于同一系列的有机物――烷烃。
烷384410
烃系列中还有戊烷(CH)、己烷(CH)等许多物质。
根据上述几种烷烃的化学式与
名称,可知分子中含两个碳原子的烷512614
烃的化学式是___________,所有烷烃中含氢量最高的物质是____________。
(3)丙烷完全燃烧生成二氧化碳和水,则其化学反应方程式为
______________________。
(4)若将丙烷完全燃烧后产生的CO气体,通入一定量的澄清石灰水中,产生的沉淀与通入CO气体的质量关系如下图所示,22则产生沉淀的最大质量是________g,请计算原石灰水中所含溶质的质量。
[已
,Ca(HCO)易溶于水 3223232
知:CaCO+CO+HO,Ca(HCO)
12. 黄铜是铜和锌的合金,在20g黄铜样品中加入足量稀盐酸使其完全反应,
生成氢气0.2g,求样品中铜的质量。
(提示:铜不与稀盐酸反应,而锌能与稀盐酸
反应Zn + 2HCl==ZnCl + H?) 22
13. 2007年9月11日,我省清流县一辆满载浓硫酸的罐车翻倒,导致26吨溶质的质量分数为98,的浓硫酸泄露,流入附近小溪中。
闻讯赶来的武警官兵立即垒
坝并用石灰浆(主要成分是氢氧化钙)中和稀释后的硫酸。
计算:中和泄漏的硫酸,理论上需要多少吨氢氧化钙?(精确到0.1)
反应的化学方程式:
14. 长久使用的热水壶底部有一层水垢,主要成分是CaCO和Mg(OH)。
某学校化学研究性学习小组的同学通过实验测定水32
垢中CaCO的含量:取200g水垢,加入过量的稀盐酸,同时测量5分钟内生成CO的质量,结果如下表:32
时间,分钟 1 2 3 4 5
质量/g 30 50 60 66 66
试回答下列问题:
(1)4分钟后,水垢中CaCO是否反应完全? (填已或未) 3
(2)该水垢中CaCO的质量分数是多少? 3
答案
1,(1)33g(2)80g(3)56g 详见教材完全解读110页例1 2,解:设药品中维生素C的质量为X
×100%=88% 详见教材完全解读111页例2
3. 11.1L 详见教材完全解读111页例3
4, 65% 详见教材完全解读112页例4
5, 0.05g 1.6g 详见教材完全解读112页例5 6. 6.2g
7. 0.28g
8. 碳在空气中充分灼烧达到燃点后会燃烧生成二氧化碳气体(碳粉完全消
失),铜粉在空气中充分灼烧会生成氧化铜(铜粉质量增加)。
所以完全灼烧后的固
体成分只有氧化铜。
根据题意,完全灼烧后得到固体质量与原混合物相同,所以
原混合物中碳粉的质量就等于与铜粉发生反应的氧气的质量。
C,O2==点燃==CO2? 2Cu,O2==加热==2CuO 128 : 32 128 : 32 = 4 : 1 所以原混合物中铜粉与碳粉质
量之比为4 : 1。
9.解:设生成氢气的质量为Xg.
Zn + H2SO4 = ZnSO4 + H2?
98 161 2
X
液体增重 161-98=63
106.3g-100g=6.3g 63:6.3=2:x x=0.2g
10. (08福建三明.(2小题,共6分)
(1) 根据质量守恒定律,二氧化碳的质量为:150 g+12 g,157.6 g = 4.4 g……………………(2分)
(2) 解:设该石灰石样品中碳酸钙的质量为x。
CaCO+2HCl==CaCl+HO+CO? 3222
100 44
x 198 g
……………………………………………………(2分)
此石灰石中碳酸钙的质量分数为: ……………………(2分)
答:(略)
11. (1)-1(2)CH,甲烷(或CH)(3)CH+5O CO+4HO (4)10 26438222解:设原石灰水中所含溶质氢氧化钙的质量为x,则有
CO+Ca(OH),CaCO?+HO 2232
74 100
x 10g
74:100=x:10g
解之得x,7.4g
答:原石灰水中所含溶质氢氧化钙的质量为7.4g。
12. 解:设生成0.2g氢气,需锌的质量为X
Zn + 2HCl==ZnCl + H? 22
65 2
X 0.2g 65/X==2/0.2g X==6.5g 铜的质量==20g,6.5g==13.5g 答:铜的质量为13.5g
13. 解:设理论上需要氢氧化钙的质量为。
硫酸溶液中溶质的质量=26t×98,=25.48t
98 74
25.48t
答:略。
教材完全解读116页 14. 解:(1)已反应完全。
(2)因CaCO完全反应生成的CO质量为66g,设水垢中CaCO的质量为x 323则有 CaCO + 2HCI === CaCI + CO ? + HO 32 22
100 44
x 66g 解得x==150g
水垢中CaCO的质量分数为: 答:略。
3。
