物质结构1
物质结构第一章习题(上)

9.一个自由实物粒子的波长为λ,求其能量,须用哪个公式( )
(A) (B) (C) A,B都可以
10.对一个运动速率 的自由粒子,有人作了如下推导:
①②③④⑤
结果得出 的结论。问错在何处?说明理由。
11.测不准关系是_______,它说明了_____________________。
41.作为近似,苯可以视为边长为0.28 nm的二维方势阱,若把苯中电子看作在此二维势阱中运动的粒子,试计算苯中成键电子从基态跃迁到第一激发态的波长。
42.函数 是不是一维势箱中粒子的一种可能状态?如果是,其能量有没有确定值(本征值)?如有,其值是多少?如果没有确定值,其平均值是多少?
43.在长为l的一维势箱中运动的粒子,处于量子数为n的状态,求:①在箱的左端1/4区域内找到粒子的概率;②n为何值时,上述概率最大?③当n→∞时,此概率的极限是多少?④③的结果说明了什么?
55.对
56. ,故 是本征函数,本征值为-m
57.光子能量
58.
59.
60.
61. (C) (D)
62. (A)
63.光子:
自由电子:
小球:
64.计算下列各种情况下的de Bröglie波长。
①在电子显微镜中,被加速到1000kV的电子;
②在300K时,从核反应堆发射的热中子(取平均能量为kT/2)
(A)16.5×10-24J(B)9.5×10-7J(C)1.9×10-6J(D) 8.3×10-24J
30.一个在一维势箱中运动的粒子,
①其能量随着量子数n的增大( )
(A)越来越小(B)越来越大(C)不变
②其能级差 随着势箱长度的增大( )
基础化学1第一章 物质结构基础

元素的氧化数(或称氧化值)是指某元素一个原子的形 式电荷数。这种电荷数是假设化学键中的电子指定给电负性 较大原子而所求得的。
氧化数反映元素的氧化状态,可为正、负、零或分数。 周期表中元素的最高氧化值呈周期性变化 ⅠA~ⅦA族(F除外)、ⅢB~ⅦB族元素:
最高氧化数=价电子总数=族序数
说明:其他主、副族元素的最高氧化数变化不规律
26Fe2+的核外电子分布是
[Ar]3d6
而不是
[Ar]3d44s2。
请写出25Mn2+核外电子分布的原 子实表示式。
三、元素性质的周期性变化
1.电负性(X)
原子在分子中吸引成键电子的能力,称为元素电负性。 元素电负性越大,原子在分子中吸引成键电子能力越强。
鲍林电负性值是指定最活泼非金属元素氟的电负性为4.0, 然后,借助热化学数据计算求得其他元素电负性(见表2-3)。
能级组
7p
7
6d 5f
(7s5f6d7p)
7s
6p 5d 4f
6s
6 (6s4f5d6p)
5p
能 量
4d 5s
4p 3d
4s
5 (5s4d5p)
4 (4s3d4p)
周期 . 七
六 五 四
3p 3s
2p 2s
3
(3s3p)
三
2
(2s2p)
二
1
1s
(1s)
一
n= 1 n= 2 n= 3 n= 4 n= 5 n= 6 n= 7
相同电子层,l值越大,电子能量越高。 不同亚层,其原子轨道(或电子云)的形状不同,如图2-3、 2-4所示,s亚层为球形;p亚层为无柄哑铃形;d亚层为四瓣花 形。 3.磁量子数(m) 磁量子数就是描述原子轨道(或电子云)在空间伸展方向 的量子数。 m取值是从+l到-l包括0在内的任何整数值。即
物质结构与性质知识点总结(1)

物质结构与性质知识点总结(1)
物质结构与性质是物理学中的重要内容,它们是决定一个物质属性和行为的根本。
在
实际研究中,研究者需要采用各种技术手段来研究其结构和性质,例如原子尺度下的量子
力学理论、电子显微镜、X射线衍射、核磁共振等。
原子尺度的量子力学理论是非常有用的工具,可以用来研究物质的结构、性质等。
它
由哈密顿量子力学、统计力学、薛定谔方程和弛豫理论组成,最重要的是建立了一种系统
的方法,将微观世界的粒子的动力学和结构描述。
这里面的力学模型表示原子间的作用力,并用来描述它们的结构和反应特性。
电子显微镜是一种极其重要的实验手段,可用于观察比宏观尺度更小的物质结构,如
原子和分子的图像。
它通常依靠电子束的衍射现象来实现,可以用来分析物质的表面和内
部结构,同时也可以研究物质的化学性质和物理性质等。
X射线衍射法可用于研究物质的结构状态,它依靠X射线散射成像来进行检测。
在实
验中,X射线通过与物质相互作用,产生在衍射特征谱上可读的数据,最后得到物质的分
子结构信息。
核磁共振可以用来测定物质的结构,它的原理基于磁学力学。
在实验中,会利用已知
的强静态磁场来激发磁子的频率,当涉及的分子波函数完全收敛时,原子的结构信息就可
以从质子空间投影图中获得。
第一章物质结构基础
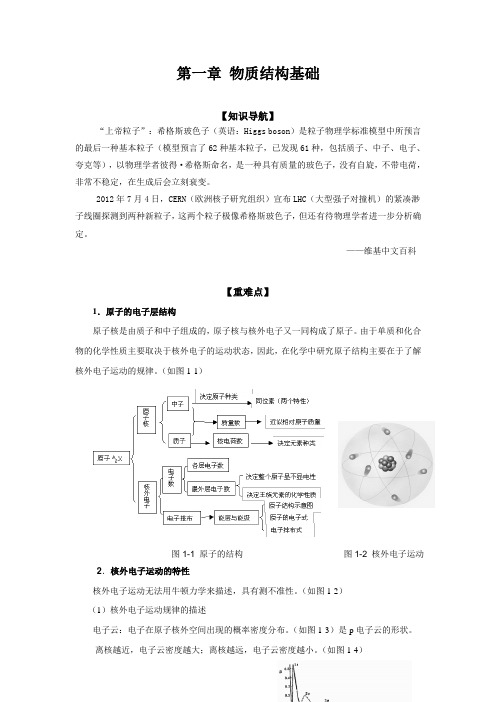
第一章物质结构基础【知识导航】“上帝粒子”:希格斯玻色子(英语:Higgs boson)是粒子物理学标准模型中所预言的最后一种基本粒子(模型预言了62种基本粒子,已发现61种,包括质子、中子、电子、夸克等),以物理学者彼得·希格斯命名,是一种具有质量的玻色子,没有自旋,不带电荷,非常不稳定,在生成后会立刻衰变。
2012年7月4日,CERN(欧洲核子研究组织)宣布LHC(大型强子对撞机)的紧凑渺子线圈探测到两种新粒子,这两个粒子极像希格斯玻色子,但还有待物理学者进一步分析确定。
——维基中文百科【重难点】1.原子的电子层结构原子核是由质子和中子组成的,原子核与核外电子又一同构成了原子。
由于单质和化合物的化学性质主要取决于核外电子的运动状态,因此,在化学中研究原子结构主要在于了解核外电子运动的规律。
(如图1-1)图1-1 原子的结构图1-2 核外电子运动2.核外电子运动的特性核外电子运动无法用牛顿力学来描述,具有测不准性。
(如图1-2)(1)核外电子运动规律的描述电子云:电子在原子核外空间出现的概率密度分布。
(如图1-3)是p电子云的形状。
离核越近,电子云密度越大;离核越远,电子云密度越小。
(如图1-4)图1-3 p亚层结构图1-4 核外电子概率分布(2)核外电子运动状态的描述——四个量子数(n、l、m、m s)多电子原子中,决定能量的量子数是n、l。
(3)核外电子的排布遵循能量最低原理、泡利不相容原理及洪特规则。
根据n+0.7l的整数部分相同,近似分成若干近似的能级组。
3.原子结构与周期律元素周期律:元素的性质(原子半径、电离能、电负性、金属性等)随着核电荷数的递增而呈现周期性的变化。
一般而言,同一周期元素,从左到右原子半径逐渐减小,电离能和电负性逐渐增大,金属性减弱,非金属性增强。
同一族元素,从上到下原子半径逐渐增大,电离能和电负性逐渐减小,金属性增强,非金属性减弱。
周期表中共有7个周期,16个族(7个主族、7个副族、1个0族、1个第Ⅷ族)。
物质结构第一章训练题
1.下列说法正确的是A .镧系元素在周期表中占据同一格,它们互为同位素B .原子序数相差8的两种短周期元素一定是同主族元素C .价电子排布为245s 5p 的元素位于第五周期VIA 族,是p 区元素D .某基态原子的2p 能级上电子排布为,仅违反了泡利不相容原理2.下列化学用语表示正确的是A .基态O 原子的电子排布式为[]24Ne 2s 2pB .基态2Mg +的电子排布式为22621s 2s 2p 3sC .激发态碳原子的电子排布图可能为D .2S -的结构示意图为3.依诺沙星(结构简式如图)具有广谱的抗菌作用,尤其是对需氧的革兰氏阴性杆菌抗菌活性好,用于敏感细菌引起的感染。
下列关于依诺沙星涉及的元素C 、N 、O 、F 的说法错误的是A .最高正价:O N C >>B .电负性:F O NC >>>C .稳定性:234HF H O NH CH >>>D .酸性:323HNO H CO >4.据《科学网》报道,德国科学家发现P 3N 5、PN 2、PN 6 ,首次证明PN 6为正八面体。
下列叙述错误的是A .氮的电负性大于磷是因为N 原子半径小于PB .N 、P 的第一电离能大于同周期右邻元素C .基态P 原子未成对电子数大于基态N 原子D .在元素周期表中,N 、P 元素都位于p 区5.下列说法一定正确的是A .最外层电子数为2的元素在周期表中的位置是第ⅡA 族B .第一电离能是指原子失去核外第一个电子需要的最低能量C .3p 能级含有3个相互垂直、能量不同的轨道D .根据电负性可以判断元素金属性和非金属性强弱6.下列化学用语表达错误的是A .22S Cl 的结构式:Cl S S Cl ---B .3Fe +的结构示意图:C .基态Cr 原子的价层电子轨道表示式:D .N 原子核外电子有7种空间运动状态7.a 、b 、c 、d 均为短周期元素,原子序数依次增大,其基态原子的结构特点如下:a 最高能级的电子占据3个轨道,且自旋平行;b 的最外层电子数是其电子层数的3倍;c 有2个未成对电子;d 的核外电子总数是其最外层电子数的3倍。
高中化学 《第一章 物质结构》练习竞赛辅导

现吨市安达阳光实验学校高中化学竞赛辅导《第一章物质结构》练习及答案第一章物质结构1、在有机溶剂里令n摩尔五氯化磷与n摩尔氯化铵量地发生完全反,释放出4n摩尔的氯化氢,同时得到一种白色的晶体A。
A的熔点为113℃,在减压下,50℃即可升华,在1Pa下测得的A的蒸汽密度若换算成状况下则为15.5g/L。
(1)通过计算给出A的分子式。
(2)分子结构测的结论表明,同种元素的原子在A分子所处的环境毫无区别,试画出A的分子结构简图(即用单键一和双键=把分子里的原子连接起来的路易斯结构式)。
2、PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成状况)为9.3g/L, 极性为零,P—Cl键长为204pm 和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P—Cl的键长为198pm和206pm 两种。
(P、Cl相对原子质量为31.0、35.5)回答如下问题:(1)180℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
(2)在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。
(3)PCl5熔体为什么能导电?用最简洁的方式作出解释。
(4)PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测其中只存在一种P-Br键长。
PBr5熔体为什么导电?用最简洁的形式作出解释。
3、NO的生物活性已引起家高度。
它与超氧离子(O2—)反,该反的产物本题用A为代号。
在生理pH值条件下,A的半衰期为1~2秒。
A被认为是人生病,如炎症、中风、心脏病和风湿病引起大量细胞和组织毁坏的原因。
A在巨噬细胞里受控生成却是巨噬细胞能够杀死癌细胞和入侵的微生物的重要原因。
家用生物拟态法探究了A的基本性质,如它与硝酸根的异构化反。
他们发现,当16O 标记的A在18O标记的水中异构化得到的硝酸根有11% 18O,可见该反历程复杂。
第一章 物质结构元素周期律(知识点总结)
Z 第一章物质结构元素周期律班级姓名一、原子结构质子(Z个)原子核注意:中子(N个)质量数(A)=质子数(Z)+中子数(N) 1.原子(A X)原子序数=质子数= 核电荷数=原子的核外电子数核外电子(Z个)2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层:一(能量最低)二三四五六七对应表示符号: K L M N O P Q3.元素、核素、同位素元素:具有相同核电荷(质子)数的同一类原子的总称。
核素:具有一定数目质子和一定数目中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素(对于原子来说)二、元素周期表1.编排原则:①按原子序数递增的顺序从左到右排列;②将电子层数相同......的各元素从左到右排成一横行..③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..(注意:周期序数=原子的电子层数;主族序数=原子最外层电子数)2.结构特点:核外电子层数元素种类第一周期 1 2种元素短周期第二周期 2 8种元素周期第三周期 3 8种元素元(7个横行)第四周期 4 18种元素素(7个周期)长周期第五周期 5 18种元素周第六周期 6 32种元素期不完全周期:第七周期 7 未填满(已有26种元素)表主族:7个主族族副族:7个副族(18个纵行)第Ⅷ族:三个纵行(16个族)零族:稀有气体三、元素周期律1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电..........子排布的周期性变化.........的必然结果。
2.同周期元素性质递变规律(从左到右):电子层数相同,最外层电子数依次增加,原子半径依次减小,金属性减弱,非金属性增强,与H2的化合由难到易,氢化物的稳定性由弱到强。
1 物质结构基础
蛋白质代 谢
生物进 基因控 化在分 制蛋白 子生物 质合成 学上的 证据
①多样性 氨基酸种 类 氨基酸数 量 氨基酸排 列顺序 空间结构 ②变构作 用 ③变性作 用
生命活动的 体现者① 体现者①肌 肉蛋白② 肉蛋白② 酶——生物 生物 催化剂③ 催化剂③抗 体蛋白—— 体蛋白 特异性免疫 ④血红蛋 白——O2 载体⑤ 载体⑤纤维 蛋白原—— 蛋白原 凝血功能⑥ 凝血功能⑥ 胰岛素—— 胰岛素
2、为什么不同生物体的化学元素种类大体相同, 含量相差很大? 出病毒外,所有的生物都是由细胞构成,不同种类 的细胞的物质组成大致相同,功能有差异 3、细胞中的糖类有哪些?有哪些功能?有哪些代 谢途径? 细胞壁;纤维素 细胞膜:糖被(识别、免疫等) 细胞质:葡萄糖(氧化分解供能) 细胞核:核糖、脱氧核糖(RNA、DNA组成物质)
①食物中 蛋白质供 给②消化 吸收④ ③吸收④ 运输⑤ 运输⑤合 成代谢⑥ 成代谢⑥ 分解代谢 ⑦代谢终 产物排出 体外⑧ 体外⑧肝 脏解毒 NH2→尿 尿 素
①细胞 ①转录 色素 C ②翻译 ②血红 ③中心 蛋白( 蛋白( 法则 Hb) )
蛋白质的特 点
蛋白质结 构
基因控 蛋白质主要 蛋白质代谢 制蛋白 功能 质合成
5、细胞中那些地方含有蛋白质?都有哪些种类? 这些蛋白质的结构是怎样的?特点是什么?具体 有哪些功能?参与那些代谢?基因如何控制它们 合成?蛋白质在生物进化中起什么作用?
蛋白质的特 点
蛋白质结 蛋白质主要 功能 构 ①基本 单位— 单位 —氨基 氨基 酸 ②化学 结构— 结构 —多肽 多肽 ③空间结 构 二级结构 三级结构 四级结构
生物进 化在分 子生物 学上酸排 列顺序 空间结构 ②变构作 用 ③变性作
第1章物质结构基础课件
1.1.4 概率密度和电子云
电子运动有规律,但无法确定其运动轨迹,而是 按一定的几率在空间出现。
概率-电子在某一区域出现的次数。 核外空间某些区域电子出现的机会多,概率大 核外空间某些区域电子出现的机会少,概率小
概率密度-电子在原子核外某处单位体积内出现的概
率。
电子云:|ψ |2的空间图象。通常用小黑点的疏密来表示。
直角坐标( x, y, z)与球坐标 (r,θ,φ) 的转换
r : 径向坐标, 决定了球面的大小
θ: 角坐标, 由 z轴沿球面延伸至 r 的弧线 所表示的角度.
φ: 角坐标, 由 r 沿球面平行xy面延伸至xz 面的弧线所表示的角度.
Ψ x, y, zΨ r,, RrY ,
↓
↓
径向波函数 角度波函数
具有波粒二象性的电子,已不再遵守经典力学规律,它 们的运动没有确定的轨道,只有一定的空间几率分布,即电 子的波动性与其微粒行为的统计性规律相联系。
1926年,奥地利物理学家薛定谔(E.schroding)提出了微 观粒子运动规律的波动方程:
2 2 2 82m x2 y2 z2 h2 (E V) 0
电子填入能级的顺序
多电子体系决定原子轨道能量的因素不仅与主
量子数 n 有关,还与角量子数 l 有关。
(1)当 l 相同时,轨道能级随 n 增加而升高。如: E1s < E2s < E3s < E4s, E2p < E3p < E4p
(2)当 n 相同时,轨道能级随 l 增加而升高。如: Ens < Enp< End < Enf。
(3)当 n 和 l 都不相同时,会出现能级交错现象。如: E4s < E3d。
物质结构知识点归纳
高一专题复习 物质结构一、原子结构原子的组成二、元素、核素、同位素1.元素是具有相同 的总称;核素是具有___________________的一种原子;同一元素不同核素之间互称为__________。
2.标号为X AZ 的核素,其质子数为___,中子数为_____,质量数为__ ___。
三、原子核外电子的排布规律核外电子是由里向外,分层排布的,其排布规律是:1 .电子层最多容纳 个电子。
2 .最外层电子数目不超过 个(K 层为最外层时不超过 个)3 .次外层电子数目不超过 个,倒数第三层电子数目不超过 个。
4 .电子总是尽先排布在 的电子层里,然后依次排布在 的电子层里。
以上四条是相互联系的,不能孤立地理解。
四、元素的原子、离子半径大小比较规律1 .同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
2 .同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
3 .电子层结构相同的离子,核电荷数越大,则离子半径越小。
4 .同种元素的微粒半径:阳离子<原子<阴离子。
5 .稀有气体元素的原子半径大于同周期元素原子半径.五、“10电子”、“18电子”的微粒小结(一)“10(二)“18注:其它诸如C2H6、N2H5、N2H6等亦为18电子的微粒。
六、针对性练习1.据报道,1994年12月科学家发现了一种新元素,它的原子核内有161个中子,质量数为272.问该元素的原子序数为( )A.111 B.161 C.272 D.4332.(08·广东)20XX年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。
下列关于20278Pt的说法正确的是()A.20278Pt和19878Pt的质子数相同,互称为同位素B.20278Pt和19878Pt的中子数相同,互称为同位素C.20278Pt和19878Pt的核外电子数相同,是同一种核素D.20278Pt和19878Pt的质量数不同,不能互称为同位素3.一些科学家预言,存在稳定的超重元素,如114个质子和184个中子的原子,它位于元素周期表的第七周期IVA族,由此下列说法正确的是()A.第七周期元素共有50种B.该元素原子的质量数是184C.该元素的相对原子质量是298D.该元素的原子核外有114个电子,最外层有4个电子4.X元素的阳离子和Y元素的阴离子具有与氩原子相同的电子层结构,下列叙述正确的是A.X的原子序数比Y的小B.X原子的最外层电子数比Y的大C.X的原子半径比Y的大D.X元素的最高正价比Y的大5.X、Y、Z和R分别代表四种元素.如果aX m+、bY n+、cZ n-、dR m-四种离子的电子层结构相同(a、b、c、d为元素的原子序数),则下列关系正确的是( )A.a-c=m-n B.a-b=n-m C.c-d=m+n D.b-d=n+m 6.(06·四川)已知1—18号元素的离子a W3+、b X+、c Y2-、d Z-都具有相同的电子层结构,下列关系正确的是()A.质子数:c>b B.离子的还原性:Y2->Z-C.氢化物的稳定性:H2Y>HZ D.原子半径X<W7.X和Y属短周期元素,X原子的最外层电子数是次外层电子数的一半,Y位于X的前一周期,且最外层只有一个电子,则X和Y形成的化合物的化学式可表示为( ) (A)XY(B)XY2(C)XY3(D)X2Y38.(08北京理综)X 、Y 均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是( )A .由m X a +与n Y b -得,m +a=n -bB .X 2-的还原性一定大于Y -C .X 、Y 一定不是同周期元素D .若X 的原子半径大于Y ,则气态氢化物的稳定性H m X 一定大于H n Y9.(07北京理综)X 、Y 为短周期元素,X 位于I A 族,X 与Y 可形成化合物X 2Y ,下列说法正确的是( )A .X 的原子半径一定大于Y 的原子半径B .X 与Y 的简单离子不可能具有相同的电子层结构C .两元素形成的化合物中,原子个数比不可能为1:1D .X 2Y 可能是离子化合物,也可能是共价化合物10.根据中学化学教材所附元素周期表判断,下列叙述不正确的是 ( )A .K 层电子为奇数的所有元素所在族的序数与该元素原子的K 层电子数相等B .L 层电子为奇数的所有元素所在族的序数与该元素原子的L 层电子数相等C .L 层电子为偶数的所有主族元素所在族的序数与该元素原子的L 层电子数相等D .M 层电子为奇数的所有主族元素所在族的序数与该元素原子的M 层电子数相等11.下列说法中正确的是( )A .非金属元素呈现的最高化合价不超过该元素原子的最外层电子数B .非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数C .最外层有2个电子的原子都是金属原子D .最外层有5个电子的原子都是非金属原子12.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
物质结构1
1.(2019江西九校联考)(20分)蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。
回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为(用元素符号表示)。
(2)N3-的立体构型是形,与N3-互为等电子体的一种分子是(填分子式)。
(3)将足量的氨水逐滴地加入到CuSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物
[Cu(NH3)4]SO4,配位化合物中的阳离子结构式为。
S O42-中的硫原子杂化方式为。
用价层电子对互斥理论解释S O42-的键角大于S O32-的原因
是。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图。
晶胞中与Zn原子距离最近的Te原子围成。
与Te原子距离最近的Te原子有个。
若Zn与距离最近的Te 原子间距为a pm,则晶体密度为g·cm-3。
(已知相对原子质量:Zn—65、Te—128)
2.(2019吉林长春联考)(20分)中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。
建造航母需要大量的新型材料,航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,基态Ni2+的核外电子排布式为,铬元素在周期表中区。
(2)海洋是元素的摇篮,海水中含有大量的卤族元素。
①根据下表数据判断,最有可能生成较稳定的单核阳离子的卤素原子是(填元素符号)。
②根据价层电子对互斥理论,预测Cl O3-的空间构型为形,写出一个Cl O3-的等电子体的化学符号。
3.(2019辽宁抚顺一模)(20分)金属钛(Ti)被誉为21世纪金属,具有良好的生物相容性,它兼具铁的高强度和铝的低密度,其单质和化合物具有广泛的应用价值。
氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。
以TiCl4为原料,经过一系列反应可以制得Ti3N4和纳米TiO2(如图1)。
图1
图2
图3
图中的M是短周期金属元素,M的部分电离能如下表:
请回答下列问题:
(1)Ti的基态原子外围电子排布式为。
(2)M是(填元素符号),该金属晶体的堆积模型为六方最密堆积,配位数
为。
(3)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图2所示。
化合物甲的分子中采取sp2方式杂化的碳原子有个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为。
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如图3所示,该晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为g·cm-3(N A为阿伏加德罗常数的值,只列计算式)。
该晶体中与N原子距离相等且最近的N原子有个。
(5)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且已知
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序为。
