个性化信号通路图不愁,这个网站上就有
完整word版,PI3K信号通路详解
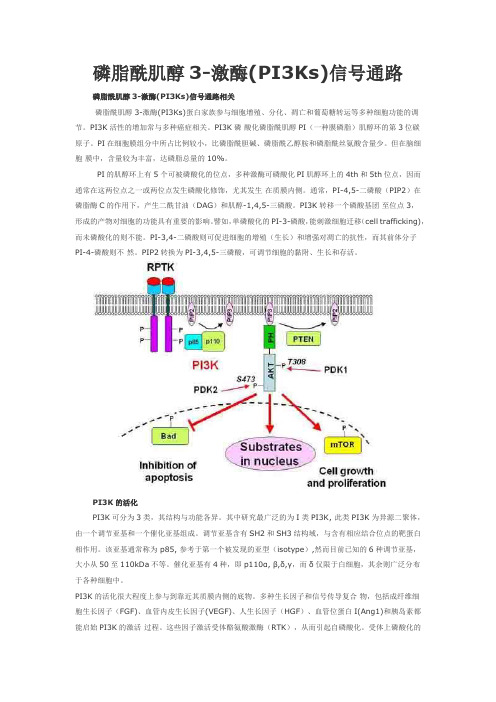
磷脂酰肌醇3-激酶(PI3Ks)信号通路磷脂酰肌醇3-激酶(PI3Ks)信号通路相关磷脂酰肌醇3-激酶(PI3Ks)蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。
PI3K活性的增加常与多种癌症相关。
PI3K磷酸化磷脂酰肌醇PI(一种膜磷脂)肌醇环的第3位碳原子。
PI在细胞膜组分中所占比例较小,比磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰丝氨酸含量少。
但在脑细胞膜中,含量较为丰富,达磷脂总量的10%。
PI的肌醇环上有5个可被磷酸化的位点,多种激酶可磷酸化PI肌醇环上的4th和5th位点,因而通常在这两位点之一或两位点发生磷酸化修饰,尤其发生在质膜内侧。
通常,PI-4,5-二磷酸(PIP2)在磷脂酶C的作用下,产生二酰甘油(DAG)和肌醇-1,4,5-三磷酸。
PI3K转移一个磷酸基团至位点3,形成的产物对细胞的功能具有重要的影响。
譬如,单磷酸化的PI-3-磷酸,能刺激细胞迁移(cell trafficking),而未磷酸化的则不能。
PI-3,4-二磷酸则可促进细胞的增殖(生长)和增强对凋亡的抗性,而其前体分子PI-4-磷酸则不然。
PIP2转换为PI-3,4,5-三磷酸,可调节细胞的黏附、生长和存活。
PI3K的活化PI3K可分为3类,其结构与功能各异。
其中研究最广泛的为I类PI3K, 此类PI3K为异源二聚体,由一个调节亚基和一个催化亚基组成。
调节亚基含有SH2和SH3结构域,与含有相应结合位点的靶蛋白相作用。
该亚基通常称为 p85, 参考于第一个被发现的亚型(isotype),然而目前已知的6种调节亚基,大小从50至110kDa不等。
催化亚基有4种,即p110α, β,δ,γ,而δ仅限于白细胞,其余则广泛分布于各种细胞中。
PI3K的活化很大程度上参与到靠近其质膜内侧的底物。
多种生长因子和信号传导复合物,包括成纤维细胞生长因子(FGF)、血管内皮生长因子(VEGF)、人生长因子(HGF)、血管位蛋白I(Ang1)和胰岛素都能启始PI3K的激活过程。
【信号通路解析】Hippo信号通路

Hippo信号通路一、Hippo信号通路概述Hippo 信号通路,也称为Salvador / Warts / Hippo(SWH)通路,命名主要源于果蝇中的蛋白激酶Hippo(Hpo),是通路中的关键调控因子。
该通路由一系列保守激酶组成,主要是通过调控细胞增殖和凋亡来控制器官大小。
Hippo信号通路是一条抑制细胞生长的通路。
哺乳动物中,Hippo信号通路上游膜蛋白受体作为胞外生长抑制信号的感受器,一旦感受到胞外生长抑制信号,就会激活一系列激酶级联磷酸化反应,最终磷酸化下游效应因子YAP和TAZ。
而细胞骨架蛋白会与磷酸化后的YAP和TAZ结合,使它滞留在细胞质内,降低其细胞核活性,从而实现对器官大小和体积的调控。
二、Hippo信号通路家族成员虽然Hippo信号通路在各个物种中保守性很高,但是相同功能的调控因子或效应因子在不同物种间还是存在着差异,下表中我们对比了果蝇与哺乳动物中Hippo信号通路相同功能的关键因子[1]。
三、Hippo信号通路的功能近十年相关研究结果表明,无论是果蝇还是哺乳动物,Hippo信号通路都可以通过调节细胞增殖、凋亡和干细胞自我更新能力实现对器官大小的调控。
Hippo信号通路异常会导致大量组织过度生长。
此外,大量研究证实,Hippo信号通路在癌症发生、组织再生以及干细胞功能调控上发挥着重要功能[2][3][4]。
a.Hippo信号通路在器官大小控制中的作用起初,关于Hippo信号通路的研究主要集中在器官大小的调控。
大量研究表明,Hippo 途径主要通过抑制细胞增殖并促进细胞凋亡,继而实现对器官大小的调控。
激酶级联反应是该信号传导的关键。
Mst1/2激酶与SA V1形成复合物,然后磷酸化LATS1/2;活化后的LATS1/2激酶随即磷酸化Hippo信号通路下游关键效应分子——Y AP和TAZ,同时抑制了YAP和TAZ的转录活性。
反之,未磷酸化的YAP/TAZ会进入细胞核与TEAD1-4或其他转录因子结合,继而诱导促增值和抑凋亡的基因表达上调。
五步法让你研究分子机制再也不愁!

五步法让你研究分子机制再也不愁!分子机制研究是大家最为头痛的主题,今天我们就来分享一下研究分子机制的经验和套路:(1)信号通路;(2)明星分子;(3)中心法则;(4)工具分子;(5)具体位点;(1)信号通路信号通路千千万,找到一条是关键,通路关系太复杂,讲不清楚就完蛋!确定信号通路的方法有很多,特别是当我们已经把一个基因的细胞和动物功能阐述清楚后:1)通过文献报道或者已知经验,比如分子A的功能是影响细胞自噬,那么像PI3K-Akt-mTOR通路等就是我们可以直接通过阅读综述获取的;2)通过RNA-seq或者芯片或者其它组学手段,筛选差异基因并对差异基因进行pathway或者GSEA富集分析,从而找到可能被基因A调控的信号通路;3)通过数据库预测,比如基于与基因A存在共表达关系来分析周围基因所参与的通路,从而得到A可能参与的通路,我们可以通过cbioportal/GEPIA对TCGA收录肿瘤中的信息进行分析,也可以分析GEO等非肿瘤的共表达结果,甚至有一些网站直接收录了这种共表达关系。
(2)明星分子明星分子选得好,文章分数才能高,中游节点最常选,上下连接有得搞!明星分子的概念大而且含糊,尽管通路是一个大的网络,但是总体上上下游关系还是存在的,如果简单来划分可以分为上游,中游和下游三段,三者之间没有严格的界限,一般的通路常常出现分子类型有:配体与受体,激酶/磷酸酶(去/泛素化酶)与底物,转录因子和靶基因等,以TGFβ-Smad通路为例,如果把细胞膜和核膜作为上中下分类的区分点,可以粗略的这么划分和标注:那么在这个通路里面什么分子是明星分子呢?一般来说,大家选的重点集中在中游这个范围内,下游的分子(比如图中的p15)一般用来作为细胞表型(细胞周期)的证据,可能考虑到膜蛋白研究的复杂和困难性,大家也很少选择上游的分子,所以中游的分子就成了明星分子选择的重点了,特别是通路的名字叫做TGFβ-Smad,所以很多研究就是围绕Smad这个蛋白展开,比如Smad这个家族的蛋白即是转录因子,可以通过结合靶基因的DNA调控分子表达,其本身又可以被磷酸化发挥功能,所以又是激酶-底物这一关系中的底物这一角色,因此激酶-Smad-磷酸化的Smad(转录因子)-靶基因就成了一个信号轴。
KEGG数据库的使用说明

KEGG数据库的使用方法与介绍http://www.genome.jp/KEGG的数据KEGG中的pathway是根据相关知识手绘的,这里的手绘的意思可能是指人工以特定的语言格式来确定通路各组件的联系;基因组信息主要是从NCBI等数据库中得到的,除了有完整的基因序列外,还有没完成的草图;另外KEGG中有一个“专有名词”KO(KEGG Orthology),它是蛋白质(酶)的一个分类体系,序列高度相似,并且在同一条通路上有相似功能的蛋白质被归为一组,然后打上KO(或K)标签。
下面就首先来讲一下KEGG orthology。
任找一个代谢通路图,在上方有pathway meue | payhway entry | Show(Hide) description | 这3个选项,点击pathway entry, 出现了一个页面,这个随时被连接出来的页面相信大家一定再熟悉不过了。
在这个页面中的pathway map项中点击按钮状的链接Ortholog table 。
就进入了Ortholog table如下的页面:在这个表中,行与物种对应,3个字母都是相应物中的英文单词缩写,比如has表示Homo sapiens,mcc表示Macaca mulatta;列就表示相应的Ortholog分类,比如K00844就表示生物体内的己糖激酶hexokinase这一类序列和功能相似的蛋白质类(酶类)。
如上图has后有3101,3098,3099这3个条目,它表示在人类细胞中中存在3中不同的己糖激酶,它们分别由以上这3组数字代表的基因所编码,这3组数字应该是这3个基因的登录号。
空白则表示在该物种中不存在这种酶。
点击K00844则这一KO分类信息及成员列表都可显示出来;点击has则链接到物种(人类)基因组去了;点击P,则显示相应的代谢通路。
下面我们点击3101,如下:如上图,就是我们常见的一个页面,3101是KEGG中的基因ID(登录号), H.sapiens表示物种,然后是基因的名称,表达的酶,属于哪个KO分类以及参与哪些代谢途径;下面还有结构、序列信息等等。
信号通路合辑

信号通路合辑纵观现如今的科研发展趋势,⽆论哪⽅⾯的研究都脱离不了分⼦机制,其实归根结底就是搞明⽩信号通路中上下游的基因是如何调控的,受到了哪些因素的影响。
华美⽣物特别整理了各研究领域信号通路⽰意图,以便于我们获取最直接的科研思路。
AMPK signaling pathway腺苷酸激活蛋⽩激酶 (AMPK) 在细胞能量稳态调节中起到关键作⽤。
在低⾎糖、低氧、缺⾎和热休克等情况下,可激活AMPK。
AMPK可作为异源三聚体复合体出现,内含⼀个催化性α亚单位和调节性β和γ亚单位。
AMP结合到γ亚单位后,可变构激活复合体,使其苏氨酸172位点更易磷酸化的底物,在α亚单位的激活环中更易被主要的上游AMPK激酶LKB1 磷酸化。
AMPK还能被CAMKK2在苏氨酸172位点直接磷酸化,这是由代谢激素(如脂联素和瘦素)刺激后胞内钙离⼦⽔平变化引起的反应。
作为细胞能量感受器,AMPK 可对ATP低⽔平做出反应,被激活后,可对补充细胞 ATP 供应的信号转导通路做出正向调控,这些通路包括脂肪酸氧化和⾃噬。
Apoptosis细胞凋亡,为⼀种细胞程序性死亡。
相对于细胞坏死(necrosis),细胞凋亡是细胞主动实施的。
细胞凋亡⼀般由⽣理或病理性因素引起。
⽽细胞坏死则主要为缺氧造成,两者可以很容易通过观察区分开来。
Caspase家族属于半胱氨酸蛋⽩酶。
起始组Caspase包括caspase-2,-8,-9,-10,-11和-12,与促凋亡信号紧密相连,⼀旦激活,这些酶会切割并激活下游的效应组Caspase,包括Caspase-3,-6,-7。
效应 Caspase通过对细胞内蛋⽩特定的天冬氨酸残基位置处进⾏切割实现细胞的凋亡。
FasL和 TNF对Fas和 TNFR的结合能够激活caspase-8和-10。
DNA损伤诱导PIDD的表达,PIDD与RAIDD 和caspase-2结合并激活caspase-2。
受损线粒体中释放的细胞⾊素C与caspase-9的活化相关。
Ras_Raf_MEK_ERK信号通路与细胞命运的联系

310 中国医药生物技术 2008年8月第3卷第4期Chin Med Biotechnol, August 2008, V ol. 3, No. 4·综述·Ras/Raf/MEK/ERK 信号通路与细胞命运的联系常超细胞在接受特定的细胞外信号刺激后会产生相应的特异性生理应答。
Ras/Raf/MEK/ERK 信号级联通路是一条可被广泛激活的有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,它能将细胞外信号传递入细胞核内,引起细胞内特异蛋白的表达谱变化,从而影响细胞命运。
在不同情况下激活该通路可引发细胞发生特异的甚至截然相反的应答反应[1]。
最初,关于该通路的研究大多集中在转录层面,认为在不同条件下激活的该通路可调节不同的即刻早期基因(immediate early genes,IEG)的转录表达,从而引发相应的细胞特异性应答。
但近年来随着研究的逐渐深入,人们发现几乎所有的生长因子和细胞因子都能激活同样的 IEG[2],并逐渐将研究关注点转移至激活该通路后所导致的蛋白翻译后调节层面。
现本文就 Ras/Raf/MEK/ERK 信号级联通路对细胞生理过程影响因素的最新研究进展做一综述。
1 生物学功能Ras/Raf/MEK/ERK 信号级联通路又称 ERK 通路,本文中 MEK 仅指 MEK1/2,ERK 仅指 ERK1/2。
该通路主要由一个三级酶联功能单位构成,即 Raf、MEK、ERK 激酶依次被磷酸化激活。
在生理状态下,ERK 是 MEK 的唯一下游底物,表明 MEK 及 ERK 在该通路中具有重要地位,激活后的 ERK 通过磷酸化激活一系列细胞膜表面以及细胞质、细胞核内的类似核糖体 S6 蛋白激酶(ribosomal protein S6 kinase,RSK)的蛋白激酶底物,并与之共同入核的方式促进环腺苷酸应答元件结合蛋白(cAMP responsive element binding protein,CREB)等重要转录因子的磷酸化,从而调节 IEG 如c-Fos、c-Myc、c-Jun、Egr1 等基因的转录表达[3]。
细胞信号通路大全

信号通路与免疫系统疾病
自身免疫疾病
自身免疫疾病患者体内免疫细胞信号通路异 常激活,如T细胞、B细胞等信号通路,导致 自身免疫反应过度。
炎症性疾病
炎症性疾病患者体内炎症细胞信号通路异常激活, 如NF-κB、MAPK等信号通路,导致炎症反应过度 或持续。
感染性疾病
感染性疾病患者体内病原微生物通过干扰免 疫细胞信号通路,如细菌、病毒等,逃避免 疫细胞的攻击。
PI3K-Akt信号通路
PI3K-Akt信号通路是细胞生存和增殖的关键信号转导途径。
PI3K-Akt信号通路在细胞生长、代谢、存活和凋亡等过程中发挥重要作用。当细胞受到生长因子、激素等刺激时,PI3K被激 活,进而催化生成PIP3,后者与Akt结合并使其磷酸化,从而激活Akt。Akt可以进一步调控下游的靶蛋白,参与细胞增殖、 迁移、代谢等过程。
JAK-STAT信号通路
JAK-STAT信号通路是细胞因子信号转导的重要途径之一。
JAK-STAT信号通路在细胞因子信号转导中发挥关键作用。当细胞因子与受体结合后,JAK被激活并催 化受体酪氨酸磷酸化,进而招募并磷酸化STAT蛋白。STAT蛋白形成二聚体并进入细胞核,调控靶基 因的表达,参与细胞生长、分化、免疫调节等过程。
信号通路的自调节
信号通路的正反馈调节
自调节的一种形式是正反馈调节,它通过增 加某个关键信号分子的数量或活性,进一步 增强自身的信号传递。例如,某些生长因子 可以诱导自身受体的表达,形成一个正反馈 环路,不断放大信号传递。
信号通路的负反馈调节
另一种自调节形式是负反馈调节,它通过降 低某个关键信号分子的数量或活性,来抑制 自身的信号传递。例如,某些激素可以通过 诱导产生拮抗性激素或受体,从而抑制自身 的信号传递。
干货:科研必备细胞信号通路查询数据库

干货:科研必备细胞信号通路查询数据库细胞的生命活动起源于信号传导。
信号通路是指当细胞内发生某种反应时,信号从细胞外到细胞内传递了一种信息,细胞要根据这种信息来做出相应的反应现象。
细胞外信号分子一般不能直接进入细胞,必须通过与胞膜表面(或胞内)特异性受体结合,引发胞膜变化,产生胞内信号分子并传至胞核内,从而引起基因及蛋白质变化,最终调节细胞功能,此过程称为信号转导通路,简称为信号通路。
从各种信号最终所导致的行为和功能来看,信号通路几乎渗透于所有的细胞生命活动:代谢、分裂、分化、功能、凋亡。
目前有好多专业的数据库提供了信号转导机制等的最新进展和已有知识的搜集整理,对于我们全面了解信号转导通路提供有益的帮助。
以下是比较常见与信号通路密切相关的数据库。
目前最常用的信号通路数据库是KEGG pathway数据库。
KEGG(京都基因与基因组百科全书)是基因组破译方面的数据库, 是国际最常用的生物信息数据库之一,以“理解生物系统的高级功能和实用程序资源库”著称。
后基因时代重大挑战是如何使细胞和有机体在计算机上完整的表达和演绎,让计算机利用基因信息对更高层次和更复杂细胞活动和生物体行为作出计算推测。
为达到此目的,人们建立了一个在相关知识基础上的网络推测计算工具。
在给出染色体中一套完整的基因的情况下,它可以对蛋白质交互(互动)网络在各种细胞活动起的作用作出预测。
各个数据库中包含了大量的有用信息。
基因组信息存储在GENES 数据库里,包括完整和部分测序的基因组序列;更高级的功能信息存储在PATHWAY数据库里,包括图解的细胞生化过程如代谢、膜转运、信号传递、细胞周期,还包括同系保守的子通路等信息;KEGG的另一个数据库LIGAND,包含关于化学物质、酶分子、酶反应等信息。
那除了KEGG以外还有那些信号通路数据库呢?下面小编给大家介绍几个比较常用的信号通路数据库。
1. UCSD Signaling GatewayUCSD Signaling Gateway 分子信号数据库是由加州大学圣地亚哥分校的圣地亚哥超级计算机中心主办的数据库,该数据库提供有关细胞信号的数千种蛋白质的基本信息。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
个性化信号通路图不愁,这个网站上就有信号通路(Signal pathway)的知识你都了解吗?申请基金时想扯点信号通路上去,抱抱信号通路的大腿有没有感觉困难呢?每种信号通路对应什么细胞现象?调控细胞的什么分子机制呢?人家文章的信号通路好美,而你的好low?来看看这篇文章,从此让你想扯就扯,个性化信号通路免费下。
花式抱大腿(一)信号通路的概念•定义:当细胞里要发生某种反应时,信号从细胞外到细胞内传递了一种信息,细胞要根据这种信息来做出反应的现象,叫做信号通路。
记得之前发过一篇微信文章:如果一个细胞是一座城(点击阅读),X师兄在这篇文章中把细胞的各个功能和一座城市的不同职能进行了类比,其中把信号通路(Signal pathway)比作是通信系统,例如微信、移动电话、email、QQ,顾名思义,信号通路主要起到信号传递作用,传递示意图:刺激因子→细胞膜受体→细胞内一、二级信使→特定分子机制被激活1.刺激因子(ligand):激素、生长因子、细胞因子、神经递质以及其它小分子化合物古代驿站,信号从一个驿站传递下一个驿站信号通路级联信号可以说是细胞活动最生动的写真了,从细胞生存必需的p53到代谢途径中的mTOR信号,从发育过程中Wnt信号到细胞间沟通的受体酪氨酸激酶信号,我们正在一步步解析这一信号调控的关键过程。
(二)信号通路各有各的职能信号通路已经发现有很多种,每种信号通路分别负责执行不同的细胞功能,就像风雨雷电四位神仙一样,各司其职,或者像四位龙王一样,各自负责各自的海域。
我们一起来看下都有哪些知名的信号通路。
(1)NF-κB信号通路由来:NF-κB(nuclearfactor-kappa B)是1986年从B淋巴细胞的细胞核抽提物中找到的转录因子[1],它能与免疫球蛋白kappa轻链基因的增强子B序列GGGACTTTCC特异性结合,促进κ轻链基因表达。
它是真核细胞转录因子Rel家族成员之一,广泛存在于各种哺乳动物细胞中。
家族成员:共发现5种NF-kB/Rel家族成员,分别是RelA(即p65)、RelB、C-Rel、p50/NF-kB1(即p50/RelA)和p52/NF-kB2 胞外刺激因子:TNF-a信号、炎症因子以及LPS、紫外线等外界刺激功能、疾病:凋亡、病毒复制、肿瘤发生、炎症反应、自体免疫疾病等。
NF-κB信号通路(2) JAK-STAT信号通路由来:由酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT 信息链组成[2]。
家族成员:JAK蛋白家族共包括4个成员:JAK1、JAK2、JAK3以及Tyk2;STAT六个成员,即STAT1-STAT6胞外刺激因子:细胞因子IL-2~7、GM-CSF、GH、EGF、PDGF 以及IFN等功能、疾病:细胞的增殖、分化、凋亡以及免疫调节等,与白血病相关。
Trends Biochem Sci.(3) MAPK/ERK信号通路由来:MAPK,丝裂原活化蛋白激酶(mitogen-activatedproteinkinases,MAPKs)是细胞内的一类丝氨酸/苏氨酸蛋白激酶,MAPK信号通路由一组以级联方式依次活化的丝苏氨酸蛋白激酶组成,包括MAPK激酶激酶(MAP kinase kinase kinase,MKKK)、MAPK激酶(MAP kinasekinase,MKK)和MAPK,这三种激酶能依次激活,共同调节着细胞的生长、分化、对环境的应激适应、炎症反应等[3]。
家族成员:研究最广泛的是ERK家族,有5个亚族,包括ERK1~ERK5胞外刺激因子:生长因子、细胞因子、病毒、癌基因等功能、疾病:肿瘤、糖尿病肾病、艾滋病、阿尔兹海默。
(4) Wnt信号通路由来:Wnt得名于Wg(wingless),与小鼠中的Ints类似,wingless基因最早在果蝇中被发现并作用于胚胎发育,以及成年动物的肢体形成INT 基因最早在脊椎动物中发现,位于小鼠乳腺肿瘤病毒(MMTV)整合位点附近。
Int-1 基因与wingless 基因具有同源性,合二为一,成为Wnt[4]。
家族成员:Wnt蛋白(Wnt配体);Wnt受体(Frizzled家族蛋白及低密度脂蛋白受体相关蛋白(LDL receptor related protein,LRP));Dishevelled(Dsh/Dvl)蛋白;β-连环蛋白(β-catenin)、糖原合成酶激酶3β(GSK-3β)、Axin/Conductin、APC(adenomatouspolyposis coli)蛋白等。
胞外刺激因子:Wnt2b、Wnt3a、Wnt8c、SOX2 、FGF等。
功能、疾病:发挥生长、发育、代谢和干细胞维持等过程中发挥作用,与胚胎发育、癌症癌症、肥胖、糖尿病、类风湿性关节炎等有关,也和内耳的形成有关。
(5)TGF beta信号通路由来:根据配体分子激活的不同的下游特异性通路可以分为TGF-β/Activin/Nodal和BMP/GDF/MIS两个亚家族通路。
该信号通路的激活首先是TGF-βs配体分子与受体结合,从而使受体TβRs磷酸化,磷酸化的TβR-I直接作用于底物Smads蛋白,活化的Smads就将配体与受体作用的信号从细胞膜、胞浆传递到细胞核内,再与其他核内因子协同激活或者抑制靶基因的转录[5]。
家族成员:TGF-β/Activin/Nodal和BMP/GDF/MIS两个亚家族胞外刺激因子:Bone morphogenetic proteins(BMPs), Growth and differentiation factors (GDFs), Anti-müllerian hormone(AMH), Activin, Nodal 和TGFβ等。
功能、疾病:调节细胞的生长、增殖、分化、迁移和凋亡等过程,与胚胎发育、骨骼等器官形成、机体的免疫反应相关。
(6)PI3K-AKT-mTOR信号通路由来:磷脂酰肌醇3-激酶(PI3Ks)信号通路。
PI3K可分为3类,其中研究最广泛的为I类PI3K, PI3K激活的结果是在质膜上产生第二信使PIP3, PIP3与细胞内含有PH结构域的信号蛋白AKT和PDK1(phosphoinositide dependent kinase-1)结合, 促使PDK1磷酸化AKT蛋白的Ser308导致AKT活化。
活化的AKT通过磷酸化多种酶、激酶和转录因子等下游因子,进而调节细胞的功能。
而mTOR是哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),是PI3K/Akt 下游的一种重要的丝氨酸-苏氨酸蛋白激酶。
它可通过激活核糖体激酶,来调节肿瘤细胞的增殖、存活和侵袭转移[6]。
家族成员:PI3K、AKT、mTOR、PTEN、。
胞外刺激因子:FGF、VEGF、HGF、血管位蛋白I(Ang1)、胰岛素等。
功能、疾病:细胞的黏附、生长和存活,与包括癌症、神经病变、自身免疫性疾病和血液淋巴系统疾病、乳腺癌有关。
(7)其他比较重要的通路有,限于篇幅,请大家自行检索:Hedgehog通路:Nusslein-Volhard等人在筛选影响果蝇幼虫发育基因时,发现hedgehog基因突变会导致幼虫长满刚毛,因此称为hedgehog。
其与基底细胞瘤,脑癌、肺癌、前列腺癌、胰腺癌和其它消化道器官癌。
其他:T-Cell receptor信号通路、Hippo信号通路、Notch信号通路。
(三)信号通路必读综述介绍--《Cell》•Wnt/β-Catenin Signaling and Disease:斯坦福大学Roeland Nusse教授,与另外一位荷兰乌德勒支大学医学中心分子遗传学教授Hans Clevers(荷兰皇家科学院院士,欧洲分子生物学组织EMBO会士)合作。
•mTOR Signaling in GrowthControl and Disease:清华大学施一公教授的综述文章,在这篇特邀文章中,他以结果为基础,详细分析比较了六类蛋白磷酸酶的功能机理。
•Mechanisms of TGF-β Sig nalingfrom Cell Membrane to the Nucleus•Signal Transduction by the JNKGroup of MAP Kinases•The Canonical Notch SignalingPathway: Unfolding the Activation Mechanism•Eph-Ephrin Bidirectional Signalingin Physiology and Disease•Shared Principles in NF-κBSignal ing•Calcium Signaling•AKT/PKB Signaling: NavigatingDownstrea•TOR Signaling in Growth andMetabolism•Protein Tyrosine Phosphatasesin the Human Genome•Cell Signaling by ReceptorTyrosine Kinases(四)信号通路绘图软件、网站除了Pathway Biuder(小张介绍过,绘制机制图和假说图,常用的软件有哪些?)你还知道其他的信号通路绘图软件或者网站吗?PathVisio是一个生物信息学工具,可以让你做各种各样的生物途径图。
我们可以创建和借鉴的途径,并将其输出到很多图像格式,批注在线联系在一起,如Ensembl,Entrez或HMDB生物数据库,并添加意见和医学文献引用。
PathVisio还可以通过高通量的实验数据通路中排序,我们可以导入基因芯片,蛋白质和代谢数据。
另外PathVisio 兼容WikiPathways。
有的童鞋想问,WikiPathways是啥?它是一个网站:,信号通路之家,成千上万的信号通路供你免费下载、编辑、更正(注册后方可编辑)每个人都可以在这个网站上上传绘画自己的信号通路图,会有专人进行验证,然后公布给全球科学家,可自由下载,下载的方法和格式如下:【参考文献】1.Karin M. Nuclear factor-KBin cancer development and progression. Nature. 2006 May 25; 441(7092):431-4362.Aaronson DS, Horvath CM (May2002). 'A roadmap for those who don't know JAK-STAT'. Science. 296 (5573): 1653–5.3.Qi M, Elion E A. MAP kinasepathways[J]. Journal of Cell Science, 2005, 118(16): 3569-3572.4.Nusse R, Varmus HE (Jun 1992).'Wnt genes'. Cell. 69 (7): 1073–87. doi:10.1016/0092-8674(92)90630-U.PMID 1617723.5.Munir S, Xu G, Wu Y, Yang B,Lala PK, Peng C (July 2004). 'Nodal and6.ALK7 inhibit proliferation andinduce apoptosis in human trophoblast cells'. J. Biol. Chem. 279 (30):31277–86.。
