课题2酸和碱的中和反应
最新人教版九年级化学下册课题二《酸和碱的中和反应》精品课件
中性
(2)实验结论:
酸性
酸性
碱性
碱性
1、pH值与溶液 酸、碱性的关系:
pH值> 7,溶液呈碱性;
pH值= 7,溶液呈中性 ;
pH值< 7,溶液呈酸性;
1.下列实验记录合理的是 ( ) A.用PH试纸测得某碱溶液的PH为12 B.用PH试纸测得某碱溶液的PH为8.1 C.用100ml烧杯量取7.5ml蒸馏水 D.用托盘天平称取10.15g NaCl
制作面条时,需加入碱性的 Na2CO3 ,用来防止面粉因发酵 而产生酸味。
松花蛋加工的主要原料: 食盐、生石灰、纯碱、水等。
上述两种食品食用时,可添加什么佐料,使食品的味道更为可口?
思考: 为什么被蚊虫叮咬过之后会觉得痛痒?有什么办法会消除肿痛?
用酸碱指示剂
石蕊试液 酸红碱蓝
酚酞 酸无碱红
常用pH来表示
测pH法:
pH试纸
pH计
实 验 方 案
1、用pH试纸测定pH的方法:
在点滴板或玻璃片上放一小片 试纸,用玻璃棒将被测液滴到试纸上, 把试纸显示的颜色与标准比色卡比较, 即可得出被测液的pH。
PH值——溶液酸、碱度的表示法 ,用数值表示,数值的取值范围为[0……14]
了解溶液的酸碱度的意义
(1)化工生产中许多反应必须在 一定的____ _____里才能进行; (2)农业生产中家作物一般适宜在 pH为_______或者_______的土壤中生长; (3)测定雨水的pH(酸雨的PH小于5.6), 可以了解空气的__________情况; (4)测定人体内或排出的液体的pH, 可以了解人体的________状况.
√
物质
混合物
纯净物
酸和碱的中和反应(一等奖说课稿)

酸和碱的中和反应(一等奖说课稿)尊敬的领导、老师们,大家好!今天我将为大家介绍人教版九年级下册化学第十单元课题2《酸和碱的中和反应》的第一课时——中和反应及应用。
我将从教材分析、学情分析、教学模式、教学设计、板书设计、课堂评价、课程资源开发、设计愿景八个方面简要谈谈我的教学设计。
一、教材分析一)教材的地位及其作用中和反应是酸和碱的重要性质,是贯穿酸、碱、盐知识体系的一个重要纽带。
同时,中和反应在日常生活和工农业生产中有着广泛应用。
因此,在课程标准中,中和反应体现在两个一级主题里,既是《生活中常见的化合物》酸和碱的主要性质,又是《物质的化学变化》中复分解反应的典型反应。
本节课的安排在常见的酸和碱之后,为学生打下一定的基础,有助于学生对新旧知识的重新构建。
二)教学目标根据以上分析,结合《初中化学新课程标准》,同时依据本班学生的认知结构及其心理特征,我制定了以下的教学目标:知识与技能目标1、通过实验探究初步领会中和反应、盐的概念。
2、了解中和反应在实际生活中的应用。
过程与方法目标1、通过学生自主的实验探究,初步学会利用指示剂判断中和反应是否发生的方法。
2、通过合作探究、讨论交流,培养学生发现问题,解决问题以及动手实践的能力和团结协作的能力。
情感态度与价值观目标1、进一步增强研究化学的兴趣。
2、培养学生实事求是的科学精神。
二、学情分析学生通过课题一“常见的酸和碱”的研究,已经了解了酸碱的一些化学性质,具备一定的实验操作能力和问题探究能力,对于小组合作研究也有了一些经验。
在此之前学生接触的化学变化一般都伴随有明显的现象,因此学生对中和反应能否发生会抱有疑惑,这是本节课需要解决的难点,也正是探究活动的切入点。
三、教学模式本节课采用探究式教学模式,通过实验探究和小组合作研究,培养学生的问题解决能力和团结协作能力,激发学生的研究兴趣。
四、教学设计本节课分为三个部分:引入、探究、总结。
引入部分通过实例引导学生了解中和反应的概念和应用;探究部分通过实验探究和小组合作研究,让学生深入了解中和反应的发生条件和判断方法;总结部分通过板书和讨论,让学生对本节课所学内容进行总结和回顾。
酸和碱的中和反应(一等奖教学设计)

酸和碱的中和反应(一等奖教学设计)课题2:酸和碱的中和反应(第一课时)教学设计一、教材分析一)教材的地位及其作用本课题从实验入手,介绍了中和反应的概念和应用。
中和反应是酸和碱的重要性质,也是盐与复分解反应的基础。
同时,在日常生活和工农业生产中也有广泛应用。
教材安排了活动和探究,旨在通过学生的亲身体验,增强对这部分知识的认识。
二)教学目的知识与技能目标:1.通过实验探究初步领会中和反应的概念。
2.了解中和反应在实际生活中的应用。
过程与方法目标:1.通过学生自主的实验探究,初步学会判断化学反应是否发生的某些方法。
2.通过合作探究、讨论交流,培养学生发现问题,解决问题以及动手实践的能力和团结协作的能力。
情感态度与价值观目标:1.增强研究化学的兴趣。
2.培养学生实事求是的科学精神。
3.通过中和反应在生活中的应用,体会化学与社会的密切关系,增强学生对社会的责任感。
三)教学的重、难点重点:中和反应的定义、实质及其应用。
难点:中和反应的探究过程和原理的理解。
二、学生学情分析学生已经了解了酸碱中和的概念,但对中和反应的实质尚不清楚。
通过前面的研究,学生已经掌握了酸碱的一些化学性质和正确操作实验的能力,也具备了一定的问题探究和小组合作研究的经验,为本节课的探究奠定了基础。
颜色由粉红色变成了无色,表明酸碱中和反应发生了。
方案二:滴甲基橙溶液滴加稀盐酸,颜色由橙色变成了红色,表明酸碱中和反应发生了。
方案三:滴酚酞溶液滴加NaOH溶液,颜色由无色变成了粉红色,表明酸碱中和反应发生了。
方案四:滴甲基橙溶液滴加NaOH溶液,颜色由红色变成了橙色,表明酸碱中和反应发生了。
通过实验,学生可以感受到中和反应的实质和特点,并且通过自主设计实验,培养了学生的实验能力和创新能力。
3、学生分享实验结果,讨论结论。
(5分钟)学生分享自己的实验结果和结论,讨论中和反应的原理和特点,加深对中和反应的理解。
四〉归纳总结,知识梳理。
(6分钟)教师引导学生总结中和反应的定义、特点、常见指示剂,帮助学生梳理知识框架,为后续研究打下基础。
课题2 酸和碱的中和反应(教案、教学设计)

课题2 酸和碱的中和反应第1课时中和反应1.理解酸碱中和反应的实质;2.了解中和反应在日常生活和工农业生产中的作用。
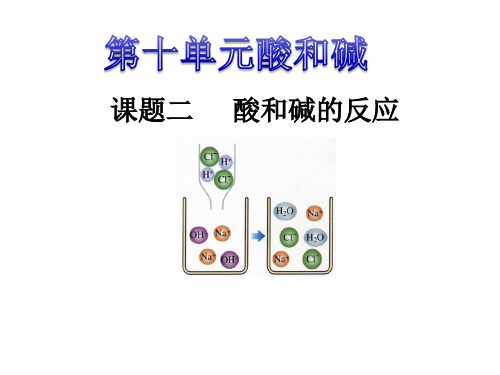
中和反应阅读书本60-61页的有关内容,完成下列问题:1.认真观察图10-14氢氧化钠与盐酸反应的微观粒子示意图,HCl在溶液中离解出H+和Cl-,NaOH在溶液中离解出Na+和OH-(用粒子符号表示),而在反应后的溶液中,H+和OH-消失了,变成了水分子,而Na+和Cl-仍然以离子的形式存在。
所以酸碱中和反应的实质是H+和OH-反应生成了H2O。
2.由金属离子和酸根离子构成的化合物叫做盐。
盐在水溶液中能解离出金属离子和酸根离子。
写出氯化钠、氯化钙和硫酸钠在水中解离的离子化学方程式。
3.酸与碱作用生成盐和水的反应,叫做中和反应。
仔细回忆酸和碱的化学性质,举例说明有盐和水生成的化学反应,不一定是中和反应。
酸与碱之间会发生化学反应吗?能否反应,请同学们进行下面的活动与探究。
如书本60页图10-13所示,在烧杯中加入5 mL氢氧化钠溶液,滴入几滴酚酞溶液。
再用滴管慢慢滴入稀盐酸,并不断搅拌溶液。
至溶液颜色恰好变成无色为止。
(1)氢氧化钠溶液呈碱性,滴加酚酞溶液变红色。
(2)当滴入盐酸溶液的量较少时,氢氧化钠有剩余,溶液显碱性,溶液呈红色,此时溶液中的溶质是氢氧化钠和氯化钠;当滴入的盐酸与氢氧化钠溶液恰好完全反应时,溶液显中性,溶液变为无色,此时溶液中的溶质是氯化钠。
实验中加入酚酞的作用是判断氢氧化钠是否完全反应。
(3)在实验中某同学不小心多加了几滴盐酸,这时溶液呈酸性。
若要除去实验中过量的盐酸可选用的试剂是氢氧化钠。
(4)取2滴上述反应后的无色溶液滴在玻璃片上,使液体蒸发,观察玻璃片上的现象。
玻璃片上的白色物质是氢氧化钠吗?请说明理由。
(5)写出该反应的化学方程式:NaOH+HCl NaCl+H2O。
1.现有二氧化碳、铁丝、氧化铁、稀盐酸、稀硫酸、石灰水、烧碱,写出它们之间能发生中和反应的化学方程式。
第十单元 课题2 酸和碱的中和反应)

第十单元
酸和碱
课题2 酸和碱的中和反应
思考: 为什么被蚊 虫叮咬过之后, 它们分泌的蚁 酸会使皮肤觉 得痛痒?有什 么办法会消除 肿痛?
为什么宝宝金水能够治疗蚊虫叮咬?
酸和碱之间会发生什么反应呢?
实验10-8 步骤:
在烧杯中加入10 mL氢氧化钠溶液,滴 入几滴酚酞溶液。再用滴管慢慢滴入 稀盐酸,并不断搅拌溶液,至溶液恰 好变成无色为止。
Al(OH)3 + 3HCl === AlCl3 + 3H2O (2)被蚊虫叮咬后,涂一些含有碱性的物质的药水。
讨论:举出生活中利用中和反应的实例。
反馈练习
1.近年来随着工业的发展污染越来越严重,甚至 造成酸雨,导致土壤酸化,不利于植物生长,为 改良酸性土壤可加入( B ) A.火碱 B.熟石灰 C.碳酸钠 D.稀硫酸
• 思考: 酸溶液一定是酸性溶液吗? 酸性溶液一定是酸溶液吗? • 结论:
酸溶液不等同于酸性溶液, 即:酸性溶液包括酸溶液和一些盐溶液。 (NaHSO4溶液、 CuSO4溶液) 碱溶液不等同于碱性溶液, 即:碱性溶液包括碱溶液和一些盐溶液。 (Na2CO3 溶液、 NaHCO3溶液)
酸溶液 酸性溶液
练习 • 1. 取1滴稀硫酸于试管中,加入适量的水,判断酸 性变强还是变弱? • 酸性变弱。
• 2. 用pH试纸测定白醋的酸碱度时,如果先将试纸 用蒸馏水湿润,再把白醋滴到试纸上,则测得的 结果与白醋实际的pH比较 A. 偏低 B. 偏高 C. 相等 D. 无法比较
√
• 3. 将一定溶质质量分数的氢氧化钠溶液加水稀释 ,下图中能正确表示pH变化的是(横坐标表示加 水的量,纵坐标表示pH)
反应前后溶液中离子发生了怎样的变化? NaOH → Na+ + OHHCl → H+ + ClNaOH + HCl = NaCl +H2O 一、中和反应 1.定义: 酸和碱作用生成盐和水的反应 2.判断: 反应物必须为酸和碱 如:Ca(OH)2 + 2HCl = CaCl2 + 2H2O
课题2 酸和碱的中和反应

6、某工厂原来用氢氧化钠溶液中和所排废水 中的硫酸,现改用氢氧化钾溶液中和以得到 钾肥。若氢氧化钾溶液的溶质质量分数与原 来所用氢氧化钠溶液的溶质质量分数相同, 则此时碱流量阀应如何调节( C ) A.无需变动 B.减小流量 C.加大流量 D.无法确定
HCl→H+ + ClNaOH→Na+ + OH-
氢氧化钠与盐酸反应 NaOH+HCl= NaCl+H2O
HCl和NaOH在水中 解离出离子
HCl + NaOH = NaCl + H2O
酸 + 碱 → 盐 + 水
中和反应:酸和碱作用生成盐和水的反应
酸溶液与碱溶液的反应实质是酸溶液中的氢 离子与碱中的氢氧根离子结合生成了水。 + 中和反应实质:H +OH
1、有一瓶溶液pH值是9.5,取少量注入试管中, 再滴入几滴酚酞试液,溶液呈 红 色,如果要使 试管里的溶液pH值降至5,可以的采取加酸 的方 法
2、把10g质量分数为10%的盐酸和10g质量分数 为10%的烧碱溶液混合均匀后,再滴入石蕊试 液,则溶液呈 红 色。
3、向稀盐酸中滴加氢氧化钠溶液至完全中和为 止(如图所示),溶液pH变化的图像正确的是 ( B)
6~7 11
12~13
了解溶液酸碱度有何重要意义?
1、化工生产中许多反应必须在一定的pH溶液中 才能进行. 2、在农业生产中,农作物一般适宜在pH为7或 接近7的土壤中生长. 3、测定雨水的pH可以了解空气的污染情况. 正常雨水的pH约为5.6,酸雨的pH小于5.6 胃酸的pH小于7 4、测定人体内或排出的液体的pH可以了解人 体的健康状况。
阅读教材61-62,知道:
酸和碱的中和反应教案定稿

课题2 酸和碱的中和反应第一课时一、教学目标(1)知道酸和碱之间发生的是中和反应。
(2)了解中和反应在实际中的应用。
教学重难点重点:酸碱之间的中和反应。
难点:中和反应的探究过程二、教学过程(一)复习旧知,引入新课通过前面的学习,我们知道酸、碱各自具有一些相似的化学性质,请问:为什么?请看大屏幕思考酸与碱之间会发生化学反应吗?让我们一起走进今天的探究之旅吧!(二)出示目标,学生自学课本(P60--61)通过预习,我们对本节课有个初步的了解,酸碱能否发生反应呢?请同学们进行下面的活动与探究。
(三)师生互研,探究新知探究1、操作取5mlNaOH溶液于烧杯中,逐滴加入稀盐酸,观察现象现象讨论:用什么方法可以证明酸和碱之间可以发生反应?探究2、取5mlNaOH溶液于烧杯中,滴入几滴酚酞溶液,再逐滴加入稀盐酸,边滴加边振荡,观察现象。
现象:化学方程式:借助微观示意图和动画图片进行分析反应的实质:过渡:结合酸碱反应实质,试写出下列反应的方程式例:Ca(OH)2+2HCl ===2NaOH+H2SO4 ===讨论:试总结上述三个反应的特点,归纳中和反应的定义1、上述反应有什么共同之处?(从反应物和生成物的角度分析)学生展示:过渡:理解了中和反应的概念,那中和反应在生产、生活中有哪些作用?探究3、中和反应的应用学生展示:1.改变土壤的酸碱性2.处理工厂的废水3.用于医药试写出工厂处理废水的化学方程式。
学生板演:Ca(OH)2+H2SO4 ==== CaSO4+2H2O试写出胃舒平主要成分是Al(OH)3,试写出用这种胃药治疗胃酸的化学方程式。
学生板演:Al(OH)3+3HCl ==== A1C13+3H2O讨论:你还能再举出一些利用中和反应的实例吗?学生展示:蚊虫叮咬涂抹牙膏、氨水;使用皮蛋加醋课堂知识回顾三、课堂练习:1、做酸和碱中和反应的实验时,有时需借助指示剂颜色的变化判断反应是否发生。
向盛有含有酚酞的NaOH溶液的烧杯中,不断滴入稀盐酸。
初中化学九年级下册-课题2 酸和碱和中和反应(第1课时 中和反应)教案

课题2酸和碱的中和反应第1课时中和反应一、教学目标1.根据酸和碱的性质,能设计出有明显现象的中和反应实验方案,并通过实验验证酸和碱能发生化学反应;2.从微观粒子的角度初步了解中和反应发生的原理,并能书写常见中和反应的化学方程式;3.了解中和反应在实际生活和生产中的广泛应用。
二、教学重难点重点:通过实验证明中和反应的发生。
难点:从离子的角度初步了解中和反应发生的原理。
三、教学过程【新课导入】还记得上节课我们表演的小魔术吗?(教师往黑板上贴一张白纸(预先用酚酞溶液写好NaOH),然后请一名学生用小喷壶往上喷氢氧化钠溶液,瞬间鲜艳的大红字“NaOH”跃然纸上。
)现在我们继续这个魔术。
用小喷壶往红色字迹“NaOH”上喷盐酸溶液,一会儿,红色的字迹消失了,再次喷氢氧化钠溶液,红色的字迹又出现了。
【过渡】我们知道在常见的酸溶液中都存在有H+,而在碱溶液中都存在有OH-,那么你能结合上面的魔术现象推测,酸和碱之间会发生反应吗?今天让我们一起来探讨这个问题。
【探究实验】用两支试管分别取少量的稀盐酸和氢氧化钠溶液,一起倒入小烧杯中,搅拌,并观察现象。
(学生分组合作,教师巡回指导,注意操作要点和安全。
)【问题】1.观察到什么现象。
(没有明显现象。
)2.据此现象能否判断盐酸和氢氧化钠溶液发生了化学反应?(不能。
)为什么?(没有明显现象能证明有新物质生成或原有的物质减少消失。
)【交流讨论】如何能证明盐酸和氢氧化钠这两种物质确实发生了反应?【总结与交流】证明无现象反应的发生实验设计思路:1.证明反应物被消耗(HCl或NaOH被消耗)2.证明有新物质生成【讲解】猜写盐酸和氢氧化钠反应的化学方程式:NaOH + HCl= NaCl +H2O。
基于我们对氯化钠化学性质了解的有限性,如果从证明有新物质生成的角度(即证明有氯化钠的生成)的角度,证明此反应发生,需要找与氯化钠反应有明显现象的物质,暂还没有学到。
如果想证明此反应产物水的生成,也比较困难,因为整个反应都是在水溶液中进行的,无法证明水的生成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2.在水、氢氧化钾和硫酸溶液中。它们PH值由大
到小的排列顺序是:氢氧化钾 水 硫酸。它们 之中能使紫色石蕊试液显紫色的是 水变红色的 是 硫酸,使无色酚酞试液变红的是 氢氧化钾 。
3、pH=0的溶液是 ( B )
A.不存在 B.酸性溶液 C.碱性溶液 D.中性溶液
4.下列物质溶于水,所得溶液的PH大于7的是( B )
②稀盐酸 2HCl+Mg(OH)2=MgCl2+2H2O
③加入熟石灰中和废液 酸 碱 中和
A.干冰 B.生石灰 C.食醋
D.食盐
5.下列是KOH溶液在不同浓度中测定的PH值,其中
浓度最大的是 ( D )
A.pH=9
整理ppt
B.pH=11 C.pH=12
24
D.pH=13
课后练习 1、 (1)酸 红
(2)PH试纸
碱红 玻璃棒
PH试纸
标准比色卡
(3)①Al(OH)3+3HCl=AlCl3+3H2O
整理ppt
15
精
确
测
定
溶
液
pH
的
仪
器
是
整理ppt
pH 计16
实验10-10 测定生活中一些物质的pH
pH 橘汁 糖水 牛奶 番茄汁 肥皂水 苹果汁
酸碱性
pH
汽水
自来水
唾液
草木灰水 洗洁精
白醋
整理ppt
酸碱性
17
整理ppt
18
思考:用PH试纸来测定某液体的pH时,如果先
用蒸馏水把试纸湿润 ,对实验结果会
6
二、中和反应在实际中的应用
问题(一)
你能用方程式 表达出它的原理么?
(说明:此酸雨为
硫酸型酸雨)
1.改变土壤酸碱性
H2SO4 + Ca(OH整理)p2pt= CaSO4 +2H2O7
问题(二)
硫酸厂的污水怎么处理?
2.处理工厂的废水
H2SO4+Ca(O整H理p)pt2=
CaSO4
+2H2O 8
(不是中和反应)
整理ppt
12
三、溶液酸碱度的表示法——pH 1、酸碱度:溶液酸碱性的强弱程度 2、溶液酸碱度的表示法:pH
(1) pH范围: 0~14
0
7
14
中性
(酸性增强)
(碱性增强)
整理ppt
13
(2)溶液的酸碱性与pH的关系 酸性溶液:pH<7 (pH值越小表示酸性越强) 碱性溶液:pH>7 (pH值越大表示碱性越强) 中性溶液: pH=7 (如水、食盐溶液)
产生的影响是 :( D )
A、偏大
B、偏小
C、没有影响 D、三种可能都有
整理ppt
19
用pH试纸来测定某液体的pH时,如果先用 蒸馏水把试纸湿润 ,对实验结果会产生 的影响是 :
①酸性溶液:实验结果pH偏大
②碱性溶液:实验结果pH偏小
③中性溶液:实验结果pH不变
整理ppt
20
3、了解溶液酸碱度有重要的意义
化工生产中许多反应必须在一定pH
溶液里才能进行;
在农业生产中,农作物一般适宜在
pH为7或接近7的土壤中生长;
测定雨水的pH(因溶解有二氧化碳,
正常雨水的pH约为5.6),可以了解
空气的污染;
测定人体内或排出的液体的pH,可
以了解人体的健康状况。
整理ppt
21
探究:洗发剂和护发剂的酸碱性
溶液的酸碱度对头发有什么影响?对
这四个反应有什么共同点?
整理ppt5Fra bibliotek一、中和反应: 酸+碱=盐+水
1、什么是盐?
由金属离子(或NH4+)和酸根离子构成的化合物
例如: CaCO3 NaCl NaHCO3 NH4Cl
Na2CO3
2、什么是中和反应?
酸与碱作用生成盐和水的反应,叫做中和反应
中和反应的实质:整H理p+pt+OH-=H2O
课题2
整理ppt
1
观察下列实验
NaOH和HCl
Na2CO3和HCl
现象 结论
NaOH和HCl
无现象
Na2CO3和HCl
产生气泡 发生反应
整理ppt
2
一、中和反应
在氢氧化钠溶液中滴加稀盐酸
通过无色酚酞溶液的颜整理色ppt 变化指示反应的发生3
HCl→H++Cl-
NaCl
NaOH → Na++OH-
你选择洗发水有什么启示?
整理ppt
22
练习:
1.(1)向盛有氢氧化钠溶液的锥形瓶里滴入 几滴酚酞溶液,溶液变成_红_ 色,pH_>_ 7, 溶液显_碱_ 性;逐渐向锥形瓶中滴入盐酸并 震荡,至溶液刚刚褪成无色时,pH_=_7,溶 液显_中_性;继续滴盐酸,pH_<__7,溶液显酸 性。
(2)某一自来水厂的水pH是4.5,取少量该 自来水加入试管中,再滴酚酞溶液,溶液呈 无__色,如果要使试管里溶液的pH升高,可以 采用加__碱__性__溶__液__或__加__整水_理_pp冲t__稀__的方法。 23
3.用于医药 问题(三) 此药中含有氢氧化铝
试写出胃康—U治胃酸过多的原理。
3HCl+Al(OH)3=整理ApptlCl3+3H2O
9
3.用于医药
问题(四)
蚊虫叮咬处肿成大包,这是蚊虫在人的皮肤
内分泌出蚁酸,从而使皮肤肿痛,可涂一些
碱性物质(如NH3·H2O)的药水,可减轻
痛痒,你知道其中的原因整理吗ppt ?
H2O
思考:反应前后不变的是什么离子? 反应后减少的是什么离子?
氢氧化钠与盐酸反应
中和反应的实质:整H理pp+t +OH-=H2O
4
NaOH+HCl= NaCl+H2O Ca(OH)2+2HCl= CaCl2+2H2O 2NaOH+H2SO4= Na2SO4+2H2O Cu(OH)2+H2SO4== Cu SO4+2H2O
思考:pH=0时,溶液呈__酸___性; pH=14时,溶液呈__碱___性; pH= 7时,溶液呈__中___性;
整理ppt
14
(3)测定pH最简便的方法: pH试纸
测定方法:在白瓷板或玻璃片上放一小片pH 试纸, 用玻璃棒蘸取溶液滴到pH试纸上,把试纸显示的 颜色与标准比色卡比较,读出该溶液的pH。
2HCl+Mg (OH)2=MgCl2+2H2O (除水垢)
整理ppt
11
思考:
胃舒平[主要成分是Al(OH)3]和小苏打[主 要成分是(NaHCO3)],它们可以治疗胃酸过 多的疾病,请用化学方程式表示反应原 理。 Al(OH)3+3HCl=AlCl3+3H2O(中和反应)
NaHCO3+HCl=NaCl+H2O+CO2
10
二.中和反应在实际中的应用
1.改变土壤酸碱性
H2SO4 + Ca(OH)2= CaSO4 +2H2O
2.处理工厂的废水
(改变酸性土壤)
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O
3.用于医药
(处理硫酸厂的污水)
3HCl+Al(OH)3=AlCl3+3H2O (中和胃酸)
4.用于生活
