配位化学基础
合集下载
配位化学基础及解题
Fe(H2O)62+,绿色;Fe(H2O)63+,棕色;
Co(H2O)62+,粉红色;Co(H2O)63+,红色
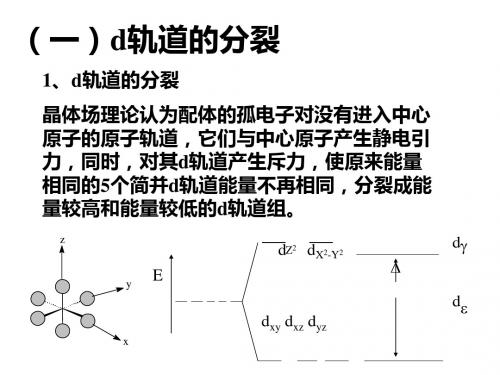
4、中心原子d电子组态
八面体配合物的中心原子d电子组态
弱场
强场
t2g
Eg
t2g
Eg
d1
1
1
d2
2
2
d3
3
3
d4
3
1
4
d5
3
2
5
d6
4
2
6
d7
5
2
6
1
d8
6
2
6
2
d9
6
3
6
3
d10
6
4
6
4
x
平面正方形场
z
37.5O
y
x
7.5O
22.5O
三角双锥场
表1 在各对称场中d轨道的能级(Dq)
结构
d(Z2)
四面体 -2.67 八面体 6.00 平面正方 -4.28 四方锥 0.86 五角双锥 4.93
d(x2-y2) d(xy) d(xz)
-2.67 6.00 12.28 9.14 2.82
成对能P<分裂能时,电子尽可能配对而不进入能 量较高的d轨道。此时,配合物未成对电子数少, 这种配合物称为内轨型配合物或低自旋配合物。
成对能P>分裂能时,电子不配对而是优先进入能 量较高的d轨道。此时,配合物未成对电子数多, 这种配合物称为外轨型配合物或高自旋配合物。
低自旋与高自旋由磁矩来判断
= U n(n+2) UB
该公式适用于第一过渡系金属离子
7、高、低自旋的经验判据
Co(H2O)62+,粉红色;Co(H2O)63+,红色
4、中心原子d电子组态
八面体配合物的中心原子d电子组态
弱场
强场
t2g
Eg
t2g
Eg
d1
1
1
d2
2
2
d3
3
3
d4
3
1
4
d5
3
2
5
d6
4
2
6
d7
5
2
6
1
d8
6
2
6
2
d9
6
3
6
3
d10
6
4
6
4
x
平面正方形场
z
37.5O
y
x
7.5O
22.5O
三角双锥场
表1 在各对称场中d轨道的能级(Dq)
结构
d(Z2)
四面体 -2.67 八面体 6.00 平面正方 -4.28 四方锥 0.86 五角双锥 4.93
d(x2-y2) d(xy) d(xz)
-2.67 6.00 12.28 9.14 2.82
成对能P<分裂能时,电子尽可能配对而不进入能 量较高的d轨道。此时,配合物未成对电子数少, 这种配合物称为内轨型配合物或低自旋配合物。
成对能P>分裂能时,电子不配对而是优先进入能 量较高的d轨道。此时,配合物未成对电子数多, 这种配合物称为外轨型配合物或高自旋配合物。
低自旋与高自旋由磁矩来判断
= U n(n+2) UB
该公式适用于第一过渡系金属离子
7、高、低自旋的经验判据
配位化学基础

若一个分子与其镜像不能通过平移和转动操作使彼此叠合, 如同左、右手一样, 这种异构现象称为旋光异构/对映异构。分 子的这种性质叫做“手性”, 相应的异构体就叫旋光异构体/对 映异构体。
1.配位数为6的配合物的几何异构体结构式的书写
(1) [MA4B2 ]型: 以[CoCl2(NH3)4]+ 为例
Cl Cl
n( n 2) B . M
(6-1)
n 表示分子中未成对的电子数。 n μ / B.M 0 0 1 1.73 2 2.83 3 4 5 5.92
3.87 4.90
3、 配合物的空间构型与杂化轨道类型
4、配合物的形成
(1) 配位数为4的配位单元
配位数为4的配位单元的空间构型有两种: 四面体 sp3 ; 平面四方形 dsp2,取决于形成体的价电子结构和配体的性质。
中心原子 (形成体) 配位体
[Ni(CO)4 ]
中心原子 (形成体) 配位体
内界 (配离子)
外界
外界
内界 (配离子)
内界
配合物
配合物
配合物
由配离子形成的配合物是由内界和 外界构成的。配合物的内界称配离子 用[ ]括起来。内界是配合物的特征部分。
配合物的外界是与内界保持电荷平衡的简单离子或离子团。内界与外界 之间以离子键结合。
如写出[M a2 b c d e]的几何异构体, 处在相对位置的配体可列出如下
组合, 再删除相同的组合, 剩余的部分画出结构式。
再如写出[M a3 b c d]的几何异构体, 处在相对位置的配体可列出如
下组合, 再删除相同的组合, 剩余的部分画出结构式。
A B D A A C
B C
A A D A
B C
1.配位数为6的配合物的几何异构体结构式的书写
(1) [MA4B2 ]型: 以[CoCl2(NH3)4]+ 为例
Cl Cl
n( n 2) B . M
(6-1)
n 表示分子中未成对的电子数。 n μ / B.M 0 0 1 1.73 2 2.83 3 4 5 5.92
3.87 4.90
3、 配合物的空间构型与杂化轨道类型
4、配合物的形成
(1) 配位数为4的配位单元
配位数为4的配位单元的空间构型有两种: 四面体 sp3 ; 平面四方形 dsp2,取决于形成体的价电子结构和配体的性质。
中心原子 (形成体) 配位体
[Ni(CO)4 ]
中心原子 (形成体) 配位体
内界 (配离子)
外界
外界
内界 (配离子)
内界
配合物
配合物
配合物
由配离子形成的配合物是由内界和 外界构成的。配合物的内界称配离子 用[ ]括起来。内界是配合物的特征部分。
配合物的外界是与内界保持电荷平衡的简单离子或离子团。内界与外界 之间以离子键结合。
如写出[M a2 b c d e]的几何异构体, 处在相对位置的配体可列出如下
组合, 再删除相同的组合, 剩余的部分画出结构式。
再如写出[M a3 b c d]的几何异构体, 处在相对位置的配体可列出如
下组合, 再删除相同的组合, 剩余的部分画出结构式。
A B D A A C
B C
A A D A
B C
2-1配合物的立体化学

[Co(en)3]3+
2、旋光异构
四配位 Td点群: MABCD
乳酸
OH
COOH C H CH3
六配位Oh点群: M(L-L)3, cis-M(L-L)2A2, MA2B2C2, MABCDEF eg. [Co(en)3]3+
N N Co N N N N
N N Co N N N N
D (+) Co(en)33+
配合物的异构类型
1、几何异构(geometric isomerism) 2、旋光异构(chiral isomerism)
异构类型
3、键合异构(linkage isomerism) 4、电离异构(ionization isomerism) 5、溶剂合异构(solvate isomerism)
6、配位异构(coordination isomerism)
空间斥力:配体间静电排斥, 与配体大小有关。
立方体场
Oh
四面体场
Td
球形场
八面体场 四方畸变
Oh D4h
平面四方场
D4h
中心离子的电子组态为:d0
d5
d10 d1
d6
通常与弱场配体形成 Td构型配合物。 例如: TiBr4 (d0),
FeCl4- (d5),
ZnCl42- (d10),
VCl4 (d1),
③ 同类配体(同为阴离子或同为中性分子)以配 位原子元素符号英文字母的先后排序。
配位化合物的命名原则:
① 阴离子名称在前,阳离子名称在后,阴、阳离子名称 之间用“化”字或“酸”字相连。此时,配阴离子一 律当含氧酸根看待; ② 配位个体中:配体名称在前,中心原子名称在后;
不同配体名称的顺序同书写顺序,相互之间以中圆点 “”分开,最后一种配体名称之后缀以“合”字;
第11章 配位化学基础

Al Fe Ru Os Hs Co Rh Ir Mt Si
N P
O S
F Cl
Ne Ar Kr Xe Rn
Sr Y 配位原子 Ba Lu
Tc Re Bh
Fr Ra Lr Rf Db Sg 配体中与中心金属直接 结合的原子。
Cu Zn Ga Ge As Se Br •Ni 排列在中心金属周围 Ag Cd In Sn Sb Te I •Pd分子或者阴离子 Pt Au Hg Tl Pb Bi Po At • 分为单齿配体与多齿配体
2018/5/31
21
配合物的分类
特殊配合物
1)夹心配合物:
金属原子 M 被夹在两个平行的碳环之间,形成夹心配合物。
2)羰基配合物
以 CO 为配体的配合物称为羰基配合物。
3)原子簇状化合物
有两个或两个以上金属原子以金属 –金属键( M–M)直接结合而 形成的化合物。
4)多核配合物
含两个或两个以上中心金属离子的配合物。
单齿 配体
特点 多齿 配体 举例
有两个或两个以上的配位原子同时与中心金属
结合。可分为二齿、三齿、多齿配体等。
O :O
N N
O H 2C :N CH2 CH 2 N: CH2 C O O: H 2C CH2 C O:
C C O
:O
邻二氮菲 (phen)
乙二胺四乙酸根 (EDTA4-)
配位数
配合物的组成
2018/5/31
11
[Fe(SCN)(H2O)5]2+, [Co(SCN)4(H2O)2]2-, [Cu(NH3)4(H2O)2]2+, [CuBr4]22018/5/31
12
2018/5/31
N P
O S
F Cl
Ne Ar Kr Xe Rn
Sr Y 配位原子 Ba Lu
Tc Re Bh
Fr Ra Lr Rf Db Sg 配体中与中心金属直接 结合的原子。
Cu Zn Ga Ge As Se Br •Ni 排列在中心金属周围 Ag Cd In Sn Sb Te I •Pd分子或者阴离子 Pt Au Hg Tl Pb Bi Po At • 分为单齿配体与多齿配体
2018/5/31
21
配合物的分类
特殊配合物
1)夹心配合物:
金属原子 M 被夹在两个平行的碳环之间,形成夹心配合物。
2)羰基配合物
以 CO 为配体的配合物称为羰基配合物。
3)原子簇状化合物
有两个或两个以上金属原子以金属 –金属键( M–M)直接结合而 形成的化合物。
4)多核配合物
含两个或两个以上中心金属离子的配合物。
单齿 配体
特点 多齿 配体 举例
有两个或两个以上的配位原子同时与中心金属
结合。可分为二齿、三齿、多齿配体等。
O :O
N N
O H 2C :N CH2 CH 2 N: CH2 C O O: H 2C CH2 C O:
C C O
:O
邻二氮菲 (phen)
乙二胺四乙酸根 (EDTA4-)
配位数
配合物的组成
2018/5/31
11
[Fe(SCN)(H2O)5]2+, [Co(SCN)4(H2O)2]2-, [Cu(NH3)4(H2O)2]2+, [CuBr4]22018/5/31
12
2018/5/31
配位化学-配位化学总结

如:F-,CN-, O2-, NCS-, NO3-
3. 通常情况下,2、4配位配合物中中心 离子的构型。
2配位----d10-------直线型
4配位----d0, d10, d7-----四面体 4配位----d8-----平面正方形
4. 四、六配位配合物的几何异构现象
4配位----四面体, 平面正方形(cis-, trans-)
(1)[CoCl(H2O)(en)2]2+ (2)[CoClBr(NH3)3(H2O)]+
第三章 配合物的化学键理论
1.用价键理论判断中心原子的杂化类型,空 间构型,磁性和稳定性。 2.配体场对d轨道能级的分裂作用
八面体、四面体、四方变形八面体、 平面正方形、四方锥
4.影响分裂能()的因素
配合物的构型 金属离子的电荷 d轨道的量子数 配体的本性(光谱化学序)
答: (1)和(2), (2)和(8),聚合异构 (1)和(8),配位异构
(3)和(5),键合异构 (5)和(7),电离异构 (4)和(6),溶剂合异构
3. 已知[M(AA)2X2]型配合物是旋光活性的。 根据这种事实,指出该配合物的结构特点。
4. 利用VSEPR模型判断IF3的分子构型。
5. 画出下列配合物的所有可能的几何异构体。
2. 指出下列配合物哪些互为异构体,并写出各类异构体的 名称及其特点。
(1)[Co(NH3)6][Co(NO2)6] (2)[Co(NO2)3(NH3)3] (3)[Pt(ONO)(NH3)3]Cl (4)[PtCl4(en)]·2py (5)[Pt(NO2)(NH3)3]Cl (6)[PtCl2(en)(py)2]Cl2 (7)[PtCl(NH3)3]NO2 (8)[Co(NO2)2(NH3)4][Co(NO2)4(NH3)2]
3. 通常情况下,2、4配位配合物中中心 离子的构型。
2配位----d10-------直线型
4配位----d0, d10, d7-----四面体 4配位----d8-----平面正方形
4. 四、六配位配合物的几何异构现象
4配位----四面体, 平面正方形(cis-, trans-)
(1)[CoCl(H2O)(en)2]2+ (2)[CoClBr(NH3)3(H2O)]+
第三章 配合物的化学键理论
1.用价键理论判断中心原子的杂化类型,空 间构型,磁性和稳定性。 2.配体场对d轨道能级的分裂作用
八面体、四面体、四方变形八面体、 平面正方形、四方锥
4.影响分裂能()的因素
配合物的构型 金属离子的电荷 d轨道的量子数 配体的本性(光谱化学序)
答: (1)和(2), (2)和(8),聚合异构 (1)和(8),配位异构
(3)和(5),键合异构 (5)和(7),电离异构 (4)和(6),溶剂合异构
3. 已知[M(AA)2X2]型配合物是旋光活性的。 根据这种事实,指出该配合物的结构特点。
4. 利用VSEPR模型判断IF3的分子构型。
5. 画出下列配合物的所有可能的几何异构体。
2. 指出下列配合物哪些互为异构体,并写出各类异构体的 名称及其特点。
(1)[Co(NH3)6][Co(NO2)6] (2)[Co(NO2)3(NH3)3] (3)[Pt(ONO)(NH3)3]Cl (4)[PtCl4(en)]·2py (5)[Pt(NO2)(NH3)3]Cl (6)[PtCl2(en)(py)2]Cl2 (7)[PtCl(NH3)3]NO2 (8)[Co(NO2)2(NH3)4][Co(NO2)4(NH3)2]
宋天佑版无机化学 第11章配位化学基础

F
-
F
-
F
-
F
-
F
-
3.内轨型与外轨型配合物
内轨型配合物
中心离子或原子以部分次外层轨道(n-1)d 参与组成杂化轨道,接受配体的孤电子对形成 内轨型配合物。如: d2sp3、dsp2、dsp3等。 特点:由于配体影响,形成体的电子重新 分布,未成对电子数减少。
成对能P:在形成内轨型配合物时,要违反 洪特规则,使原来的成单电子强行在同一d轨道 中配对,在同一轨道中电子配对时所需要的能 量叫做成对能(用P表示)。
11.1.3 配合物的命名
基本遵循一般无机化合物的命名原 则 1.整体命名:先阴离子,后阳离子 配离子为阳离子 外界是简单阴离子(OH-、Cl-), “某化某” [Ag(NH3)2]OH [Pt(NH3)6]Cl4 外界是复杂阴离子,“某酸某”
配离子为阴离子 外界为氢离子 “某酸” H2[PtCl6]
F HCI Br I
配体类型 单齿配体:一个配体中只含一个配位原子 NH3、OH-、X-、CN-、CO、SCN-等 多齿配体:一个配体中含2个或2个以上配位原子 草酸根(C2O42-) -OOC-COO- 双齿 乙二胺(en) NH2-CH2-CH2-NH2 双齿 乙二胺四乙酸根(EDTA或Y) 六齿 P862-863 部分配体名称: 硝基:NO2;亚硝酸根:ONO-;硫氰酸根:SCN-;异 硫氰酸根:NCS-;羰基:CO;羟基:-OH
MA2B2C2—正八面体的异构体。
平面偏振光
当平面偏振光通过某种介质时,有的介质对偏 振光没有作用,即透过介质的偏振光的偏振面 保持不变。而有的介质却能使偏振光的偏振面 发生旋转。这种能旋转偏振光的偏振面的性质 叫做旋光性。具有旋光性的物质叫做旋光性物 质或光活性物质。
-
F
-
F
-
F
-
F
-
3.内轨型与外轨型配合物
内轨型配合物
中心离子或原子以部分次外层轨道(n-1)d 参与组成杂化轨道,接受配体的孤电子对形成 内轨型配合物。如: d2sp3、dsp2、dsp3等。 特点:由于配体影响,形成体的电子重新 分布,未成对电子数减少。
成对能P:在形成内轨型配合物时,要违反 洪特规则,使原来的成单电子强行在同一d轨道 中配对,在同一轨道中电子配对时所需要的能 量叫做成对能(用P表示)。
11.1.3 配合物的命名
基本遵循一般无机化合物的命名原 则 1.整体命名:先阴离子,后阳离子 配离子为阳离子 外界是简单阴离子(OH-、Cl-), “某化某” [Ag(NH3)2]OH [Pt(NH3)6]Cl4 外界是复杂阴离子,“某酸某”
配离子为阴离子 外界为氢离子 “某酸” H2[PtCl6]
F HCI Br I
配体类型 单齿配体:一个配体中只含一个配位原子 NH3、OH-、X-、CN-、CO、SCN-等 多齿配体:一个配体中含2个或2个以上配位原子 草酸根(C2O42-) -OOC-COO- 双齿 乙二胺(en) NH2-CH2-CH2-NH2 双齿 乙二胺四乙酸根(EDTA或Y) 六齿 P862-863 部分配体名称: 硝基:NO2;亚硝酸根:ONO-;硫氰酸根:SCN-;异 硫氰酸根:NCS-;羰基:CO;羟基:-OH
MA2B2C2—正八面体的异构体。
平面偏振光
当平面偏振光通过某种介质时,有的介质对偏 振光没有作用,即透过介质的偏振光的偏振面 保持不变。而有的介质却能使偏振光的偏振面 发生旋转。这种能旋转偏振光的偏振面的性质 叫做旋光性。具有旋光性的物质叫做旋光性物 质或光活性物质。
配位化学的基础知识

H 2P4O HH 3P4O K 3H[H [H 2P 3P 4O ]4O H ][]K 1 a1
配体的加质子常数的关系
如同配合物稳定常数的关系一样 KH 所表示的称为逐级加质子常数, 相应的有积累加质子常数, 积累加质子常数与逐级加质子常数的关系有:
n H [[ H H ]n n [ L L ]] K 1 H K 2 H K 3 H .K .n H . i n 1K iH
第三节 配位数与配合物的立体结构
所说的配位数系指最高配位数。
金属离子和种类,氧化数
配位数取决于
决定性的
配体的种类
其它因素有:
1 空间因素
1)中心离子一定时,配体的体积增大,则配 位数下降
如Al(III)与F-可形成AlF63-, 而与Cl- , Br-, I-, 等只能形成AlX4-.
2) 配体一定时,中心离子体积增大,配位数 增大
2 电荷的影响
1)中心离子电荷大,利于形成配位数高 的配合物
2)配体为阴离子时,其电荷越低,越容 易形成高配位数的配合物
中心离子的配位数
有2,3,4,5,6,7,8,9,10,11,12, 最高有为14的报道, 在水溶液中常见的是2,4,6
Cu(NH3 )42+,Ni(NH3 )62+ 等形式存在
交换的两种途径
交换阴离子,选用阴离子交换树脂 交换阳离子,选用阳离子交换树脂
色层分离,利用淋洗时各配合物的稳定性差别进 行分离
用EDTA来淋洗负载稀土的树脂,其反应如下: (R)RE + (NH4)3HY =(R)(NH4)3
+REY- + H+
2 溶剂萃取
溶剂萃取的发展先从核工业开始
然后是稀有金属、贵金属
配体的加质子常数的关系
如同配合物稳定常数的关系一样 KH 所表示的称为逐级加质子常数, 相应的有积累加质子常数, 积累加质子常数与逐级加质子常数的关系有:
n H [[ H H ]n n [ L L ]] K 1 H K 2 H K 3 H .K .n H . i n 1K iH
第三节 配位数与配合物的立体结构
所说的配位数系指最高配位数。
金属离子和种类,氧化数
配位数取决于
决定性的
配体的种类
其它因素有:
1 空间因素
1)中心离子一定时,配体的体积增大,则配 位数下降
如Al(III)与F-可形成AlF63-, 而与Cl- , Br-, I-, 等只能形成AlX4-.
2) 配体一定时,中心离子体积增大,配位数 增大
2 电荷的影响
1)中心离子电荷大,利于形成配位数高 的配合物
2)配体为阴离子时,其电荷越低,越容 易形成高配位数的配合物
中心离子的配位数
有2,3,4,5,6,7,8,9,10,11,12, 最高有为14的报道, 在水溶液中常见的是2,4,6
Cu(NH3 )42+,Ni(NH3 )62+ 等形式存在
交换的两种途径
交换阴离子,选用阴离子交换树脂 交换阳离子,选用阳离子交换树脂
色层分离,利用淋洗时各配合物的稳定性差别进 行分离
用EDTA来淋洗负载稀土的树脂,其反应如下: (R)RE + (NH4)3HY =(R)(NH4)3
+REY- + H+
2 溶剂萃取
溶剂萃取的发展先从核工业开始
然后是稀有金属、贵金属
配位化学第2章-基础

硫酸铜和水都是独立存在的稳定化合物, 它们仍然可以相互作 用, 形成更复杂的化合物五水硫酸铜. 由于人们在相当长的一段 时间内并不能了解式3−1中两个反应物的作用机理, 尽管得到的 产物组成易于确定, 但其结构并不清楚, 因此, 早期将这类化合 物统称为复杂化合物, 汉语译为络合物. 1798年, 法国化学家塔舍特(Tassert)将蓝色的二氯化钴与氨 作用, 得到了玫瑰红色的化合物, 其组成为CoCl2∙6NH3, 该物质 在有氨和氯化铵存在下, 于水溶液中慢慢转变为桔黄色, 分析产 物的组成为CoCl3∙6NH3, 很明显, 它是由CoCl2∙6NH3氧化而产 生的, 见式3−2.
早在上世纪五十年代就已成立的国际性配位化学 学会, 至今已举办数十次国际配位化学会议(ICCC), 其中第25届就是于1987年7月在中国南京举行, 由 南京大学配位化学研究所承办, 我国化学界前辈戴 安邦院士担任大会主席, 著名无机化学家游效曾院 士担任大会秘书长.
据统计目前有关配位化学研究的原始论文占无 机化学专业论文总数的75%以上。 随着现代物质结构理论以及现代物理技术的推 动, 配位化学的研究成果已远远超出了无机化学 的范畴, 已经渗透到化学的所有分支领域, 包括 分析化学、有机化学、物理化学、高分子化学、 结构化学、环境化学、催化机理、生物化学、 以及能源、原子能、激光、半导体、空间科学 等众多科技领域.
CoCl2 (蓝色) + 6NH3 → CoCl2∙6NH3 (玫瑰红色) → CoCl3∙6NH3 (桔黄色) 3−2
上述研究可认为是配位化学的起点, 这是因为塔舍特的报道 在当时便引起轰动, 很多无机化学家对这类奇异的化学反应 性产生了浓厚兴趣. 从那时起, 经过一百五十年的发展, 到上 世纪中叶, 配位化学已发展成为化学学科中一门及其重要的 分支学科.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氢氧化二氨合银(Ⅰ) 氢氧化二氨合银 (Ⅰ) 四氯合铂(Ⅱ)酸 四吡啶合铂( 四氯合铂(Ⅱ)酸 四吡啶合铂(Ⅱ) (Ⅱ) 四羰基合镍(0) 四羰基合镍(0) 三氯化二氨 乙二胺)合钴(Ⅲ) 三氯化二氨 ·二(乙二胺)合钴(Ⅲ) 六氯合铂(Ⅳ)酸 六氯合铂 (Ⅳ)酸 (Ⅳ)
[Co(ONO)(NH3)5]SO4 硫酸 一亚硝酸根 · 五氨合钴(Ⅲ) 合钴(Ⅲ) [Pt(NO2)(NH3)(NH2OH)(Py)]Cl Ⅱ 氯化 一硝基 · 一氨 · 一羟氨基 · 一吡啶合铂 (Ⅱ)
n(n + 2)
- 2 + 4 + 4µ 2 n= 2
- 2 + 4 + 4 × 4.52 n = 3.61≈ 4 [CoF6]3-(4.5): = : 2
Co3+ :3d6 sp3d2 正八面体 [CoF6]3-: 外轨型
- 2 + 4 + 4 × 3.2 2 = 2.35≈ 2 n [Ni(NH3)4]2+(3.2): = : 2
配合物的组成: 二. 配合物的组成: [Cu ( NH3 ) 4 ]2+ SO4
内界 中 心 离 子
配 位 键 离子键
K 2 [Hg I4 ]
外 界 配 位 数 内 界
外界
配 位 体
配 位 体 数
配 离 子 的 电 荷
内界
配离子
[Cu ( NH3 ) 4 ] SO4
是体现配合物性质的核心部分 用方括号标明 1. 中心离子 ( 形成体 ) 位于配离子的中心 是配离子的核心部分 金属离子 某些金属原子 高氧化值的非金属元素 过渡金属离子
NH4[Cr(NCS)4(NH3)2] 四异硫氰酸根 ·二氨合铬(Ⅲ)酸铵 合铬(Ⅲ) (Ⅲ)酸铵 NH4[Cr(SCN)4(NH3)2] 四硫氰酸根 ·二氨合铬(Ⅲ)酸铵 合铬(Ⅲ) (Ⅲ)酸铵
[Ag(NH3)2]OH [Pt(Py)4][PtCl4] [Ni(CO)4] [Co(NH3)2(en)2]Cl3 H2[PtCl6]
[Ag(NH3)2]+ Ag+:4d105s0
sp杂化 杂化 4d 5s 5p sp 4d 5p
实验测定: 实验测定: 直线形构型
H3N—Ag+ —NH3 直线形, 键角180° 直线形, 键角 °
4d
2NH3
sp 5p
2. 配位数为4的配离子构型 配位数为4
(1) 四面体构型 四面体构型[Zn(NH3)4]2+ Zn2+:3d104s0
3d 4s 4p 重排 4d
3d
4s d2sp3
4p d2sp3杂化
4d
3d d2sp3 3d
6CN-
4d
4d
配离子的空间构型: 配离子的空间构型: 用(n-1)d、ns、np轨道杂化 、 、 轨道杂化
CN CN Fe CN CN CN CN
配位键 配合物
内轨型配位键 内轨型配合物
CN-、NO2- :内轨型配合物 X-、H2O : 外轨型配合物 稳定性: 稳定性: 内轨型配合物 > 外轨型配合物
重排, 重排,Co3+: d2sp3杂化 ( 内轨型 )
影响配位键类型的因素:
电荷增多, 电荷增多,易形成内轨型配合物 中心离子的电荷: 中心离子的电荷: [Co(NH3)6]2+ 外轨型配合物 [Co(NH3)6]3+ 内轨型配合物 配位原子电负性: 配位原子电负性: 外轨型 F、Cl、O 、 、 离子性成分较大 (电价配键 电价配键) 电价配键 大 小 C(CN-、CO) 内轨型
x
离子性成分较小, 离子性成分较小,共价键成分较大 (共价配键 共价配键) 共价配键
杂化轨道与配合物空间构型的关系
配位数 2 3 杂化轨道类型 sp sp2 dsp2 4 sp3 正四面体 直线形 平面三角形 平面正方形 空间构型 配合物举例
[Ag(NH3)2]+ [Ag(CN)2][CuCl3]2[Cu(CN)3]2[ Cu(NH3)4]2+ Pt(Ⅱ)、Pd(Ⅱ) Ⅱ、 Ⅱ [Co(SCN)4]2Zn(Ⅱ)、Cd(Ⅱ) Ⅱ、 Ⅱ [Ni(CN)5]3Fe(CO)5 [CoF6]3Fe(CN)6]3-
5
dsp3 sp3d2 d2sp3
三角双锥体
6
正八面体
各种单纯轨道和杂化轨道的成键能力: 各种单纯轨道和杂化轨道的成键能力: s<p<sp<sp2<sp3<d<dsp2<d2sp3 =sp3d2 < < < < 判断内、外轨配合物的方法: 判断内、外轨配合物的方法: µ——变小, 内轨型 变小, 变小 磁矩的变化 µ——不变, 外轨型 不变, 不变
4. 配离子的电荷 =中心离子的电荷+配位体的电荷 中心离子的电荷+ [Cu(NH3)4]2+ [HgI4]2[Ni(CO)4] [Fe(CN)4(NH3)(H2O)]+2 + 0×4 = +2 × +2 + (-1)×4 = -2 × 0 + 0×4 = 0 × +3 + (-1)×4 + 0 + 0 = -1 ×
≈1 Mn2+ : 3d5 [Mn(CN)6]4 -: d2sp3 正八面体 内轨型
例2:下列配离子中哪个磁矩最大? :下列配离子中哪个磁矩最大? [Fe(CN)6]3- [Fe(CN)6]4- [FeF6]3解: ∵ µ = n(n + 2) 配离子 [Fe(CN)6]3[Fe(CN)6]4[FeF6]3M的d电子数 的 电子数 ∴[FeF6]3-磁矩最大 [MLx]的未 的未 成对电子数 µ(理) 理 1.73 0 5.92
正八面体 键角90° 键角 °
对中心离子影响大的配体: 对中心离子影响大的配体: CN-、NO2- ( 重排 ) 对中心离子影响小的配体: 对中心离子影响小的配体: X-、H2O ( 不重排 ) NH3视情况而定: 视情况而定: [Co(NH3)6]2+ : Co2+ ( 3d74s0 ) 不重排, 不重排,Co2+:sp3d2杂化 ( 外轨型 ) [Co(NH3)6]3+ : Co3+ ( 3d64s0 )
配
2. 命名配合物: 命名配合物:
与一般无机盐和氢氧化物的命名原则相同 [CoCl2(NH3)3(H2O)]Cl 氯化 二氯 ·三氨 ·一水合钴(Ⅲ) 合钴(Ⅲ) [Co(NH3)6]Br3 三溴化六氨合钴 (Ⅲ) 三溴化六氨合钴(Ⅲ) 六氨合钴 [PtCl(NO2)(NH3)4]CO3 碳酸 一氯 ·一硝基 · 四氨合铂(Ⅳ) 四氨合铂(Ⅳ) 合铂 K2[PtCl6] K4[Fe(CN)6] 六氯合铂(Ⅳ) 酸钾 六氯合铂 (Ⅳ) 六氰合铁(Ⅱ) 六氰合铁 (Ⅱ) 酸钾
4. 磁矩与键型的关系
µ = n(n + 2)
强 弱 的 物 理 量 表 示 物 质 磁 性
n :
d 的 µ> 0, > , 磁
n与µ的关系 与 的关系
1 2 3 4 5 µ( /B.M.) 1.73 2.83 3.87 4.90 5.92
磁
(B.M.)
例1:实验测得下列配合物的磁矩数据如下 :实验测得下列配合物的磁矩数据如下: [CoF6]3-(4.5) [Ni(NH3)4]2+(3.2) [Ni(CN)4]2-(0) [Mn(CN)6]4-(1.8) 试判断其几何构型,并指出哪 试判断其几何构型, 些属于内轨型,哪些属于外轨型。 些属于内轨型, 解: µ =
:SCN- :NCS-
.. .. 乙二胺(en) : H2N—CH2—CH2—NH2 乙二胺 .. O 氨基乙酸: 氨基乙酸:NH2—CH2—C .. OH
N N
N
N
邻菲罗啉(o-phen) 邻菲罗啉 O .. HO O .. HO C—CH2 .. .. N—CH2—CH2—N C—CH2 乙二胺四乙酸(EDTA) 乙二胺四乙酸
第二节 配合物的化学键理论
特点: 特点:
第一: 中心离子多为过渡元素, (n-1)d轨道未填满电子 第一: 中心离子多为过渡元素, 轨道未填满电子 (n-1)d、ns、np和nd轨道能量相近, 、 、 和 轨道能量相近 易激发、杂化, 轨道能量相近, 易激发、杂化, d轨道参与配位体成键。 轨道参与配位体成键。 轨道参与配位体成键 第二: 考虑d轨道的两种价态:基态、激发态 轨道的两种价态: 第二: 考虑 轨道的两种价态 基态、 对配离子的颜色、光的吸收有影响,受配体的影响。 对配离子的颜色、光的吸收有影响,受配体的影响。 第三: 多数配离子含有未成对电子, 表现出顺磁性, 第三: 多数配离子含有未成对电子, 表现出顺磁性, 受到配位体的影响。 受到配位体的影响。
2. 配位体
配 类 单 配 多 配 体 型 齿 体 齿 体
与中心离子以配位键结合的离子或分子 一 些 常 见 配 位 体 提 实 例 供 孤 H2O: :NH3 :CO :X:CN- :OH:ONO- :NO2:SCN- :NCS电 子 乙二胺(en) 只含有一个配位原子的配体 草酸根(OX) 联吡啶(bpy) 对 EDTA(Y2-) 氨基乙酸 邻菲罗啉(o-phen) 的 原 含有二个或二个以上配位原子的配体 子 两可配体 配 位 原 子
-CN
4s
4p 3d 4s dsp2杂化 dsp2 4p
CNNi2+
-CN
CN3d
平面正方形 键角90° 键角 °
4CNdsp2
4p
3d
4p
3. 配位数为 的配离子构型 配位数为6的配离子构型
(1) [FeF6]3-的空间构型 sp3d2 ) 的空间构型( Fe 磁性相同, 八面体构型 实验结果: 实验结果: 3+与[FeF6]3-磁性相同, Fe3+:3d54s0
