有机苯乙醚的制备
乙醚的制备有机实验原理

乙醚的制备有机实验原理
乙醚在实验室中可以通过醇的脱水反应制备。
一种常用的方法是通过硫酸催化下醇的缩水反应。
具体的实验步骤如下:
1. 在干净的干燥胶皿中,加入适量的醇(如乙醇)。
2. 将胶皿放入冷水中,使其保持低温。
可以加入冰块来降低温度,以防止醇的挥发。
3. 在醇中滴加少量的浓硫酸,并用玻璃棒搅拌均匀。
硫酸作为催化剂可以促使脱水反应进行。
4. 继续加热醇溶液,并不断搅拌。
加热的目的是在加速脱水反应的同时也有助于乙醚的挥发。
5. 当观察到反应产生大量气体冒泡并有乙醚气味散发时,即表示乙醚生成。
6. 控制反应温度和时间,避免乙醚过度分解或挥发损失。
需要注意的是,这个实验过程中要注意安全,因为乙醚具有易燃和挥发性的特点。
实验室中应该进行适当的防护,如在通风良好的实验室中操作,避免乙醚的蒸气接触明火或其他易燃物质。
有机化合物的制备实验

第三章&有机化合物的制备实验实验十环己烯的制备一、实验目的1.学习环己醇在酸催化作用下分子内脱水制备环己烯的原理和方法。
2.了解分馏原理及其基本操作。
二、实验原理醇在脱水剂作用下分子内脱去一分子水而形成烯烃。
主反应:OH85%+H O342副反应:OH34+H O22O三、仪器与试剂仪器:图1.8分馏装置和图1.6普通蒸馏装置。
试剂:环己醇 10g(10.4mL,0.1mol),85% 磷酸 5mL,氯化钠 1g,无水氯化钙 1~2g,5%碳酸钠溶液 4mL 。
四、实验步骤在50mL 干燥的圆底烧瓶中,分别加入 10g 环己醇(10.4mL)(1),5mL85% 磷酸(2),充分摇荡使两种液体混合均匀。
投入几粒沸石,按图1.8安装好分馏装置。
用小锥形瓶作接收器,置于冷水浴中。
用小火慢慢加热混合物至沸腾,以较慢速度进行蒸馏,控制分馏柱顶部温度不超过73℃(3)。
当无液体蒸出时,可适当加大火源,继续蒸馏。
当温度达到 85℃时,停止加热,馏出液为环己烯和水的浑浊液。
在馏出液中分批加入约 1g 食盐,使之饱和。
再加入 3~4mL5% 的碳酸钠溶液,以中和其中的微量酸。
然后,将上述液体倒入分液漏斗中,振荡后静止分层。
分出下面的水层,将有机层转入干燥的小锥形瓶中,加入适量无水氯化钙将其干燥(4)。
将干燥后澄清透明的粗环己烯滤入 30mL 蒸馏瓶中,加入几粒沸石,加热蒸馏收集80℃~85℃馏分。
所用的蒸馏装置必须是干燥的。
产量:4~5g 。
1.4465。
环己烯的红外光谱图见图3.1。
纯环己烯为无色透明液体,沸点 83℃,n20D有 机 化 学 实 验本实验约需 4h 。
图3.1 环己烯的红外光谱图五、注释(1)环己醇在常温下是粘稠液体,如果用量筒量取,约 12.4mL ,应注意转移过程中的损失。
也可用称量法称取。
(2)脱水剂用磷酸或硫酸均可。
磷酸的用量是硫酸用量的 2 倍。
但用磷酸的好处一是反应中不生成碳渣,二是反应中无刺激性气体生成。
苯乙醚
一、实验目的
1、掌握Williamson 合成法制备醚的原理和方法。
2、进一步熟悉机械搅拌、分液等基本操作。
二、实验原理
通过Williamson 合成法由溴乙烷和苯酚钠作用制备苯乙醚。
其基本反应式为:
OH
++H O 2
NaOH
Na
O NaBr
CH 3CH 2Br
+
Na
O CH 2CH 3
+
三、主要试剂及物理性质
表1 物性常数
四、试剂用量规格
实验试剂:苯酚7.89g ,氢氧化钠 4g (0.l mol ),溴乙烷8.5mL (0.12mol ),水24ml ,饱和氯化钠16ml ,无水氯化钙。
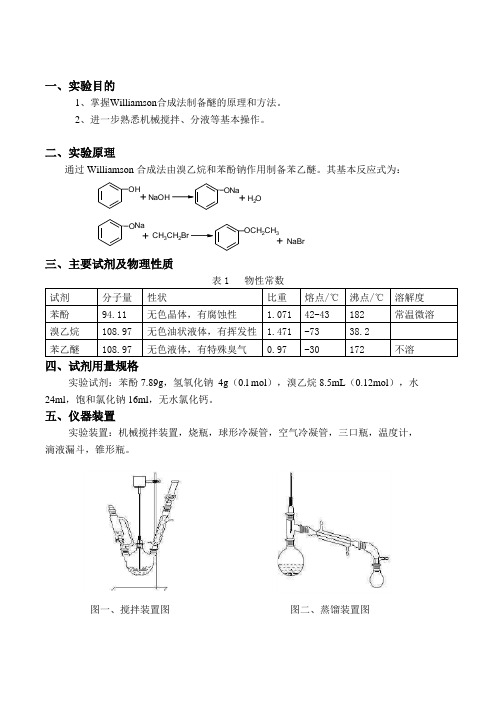
五、仪器装置
实验装置:机械搅拌装置,烧瓶,球形冷凝管,空气冷凝管,三口瓶,温度计,滴液漏斗,锥形瓶。
图一、搅拌装置图 图二、蒸馏装置图
七、实验结果
理论值=7.89÷94.11×108.97÷0.97=9.478ml
实际值=23×8÷46.7=3.940ml
产率=3.940/9.478×100%=41.57%
八、实验讨论
数据分析:产率偏低,但是产物比较清澈。
产率偏低的可能原因:
1、可能在刚开始时滴加溴乙烷速度控制不当,滴加过快,导致反应不完全,从
而使产率偏低;
2、在分液使油层有损失;
3、反应时,NaOH附在烧瓶壁上没有完全参与反应。
注意事项:
1、反应阶段控制溴乙烷的滴加速度,不能太快;
2、反应阶段的三口瓶和滴液漏斗、蒸馏阶段装置要事先干燥。
碘化钾作用下芳香醚的合成

碘化钾作用下芳香醚的合成巩海鹏,付国瑞,王幸宝【摘要】摘要:研究了以苯酚或萘酚为原料、溴代烷烃为烷基化试剂、KI催化作用下芳香醚的制备方法。
在相似的实验条件下合成了苯乙醚、正丁基苯基醚、β-萘乙醚、β-萘正丁基醚。
以正丁基苯基醚的合成为例,设计了正交实验考察反应温度、时间、催化剂用量对反应的影响,优选出较佳反应条件:反应温度80℃,反应时间2h,碘化钾1.0g。
表征产物的结构发现,其熔沸点数值及红外谱图与参考文献相符。
【期刊名称】甘肃科技【年(卷),期】2012(028)017【总页数】3【关键词】关键词:有机合成;碘化钾;芳香醚;正交实验芳香醚是一类重要的有机合成中间体,广泛应用于农药、染料等一系列精细化工产品的合成中[1-4]。
比如正丁基苯基醚是制造香料、杀虫剂和医药的原料[5];而β-萘乙醚又叫橙花素,是一种合成香料,与β-萘甲醚相比性质更稳定,能和其他香料化合物调和,效果良好,因此广泛用于肥皂和化妆品中作为香料,还可做玫瑰香、柠檬香等香料的定香剂[6]。
目前对芳香醚的合成方法研究逐渐受到人们的重视。
樊能廷[7]研究了用苯酚或萘酚与醇钠作用生成酚钠,后与溴丁烷反应制备芳香醚的方法,该法需要用金属钠与乙醇作用制备醇钠,成本高,危险性大。
近年来文献报道了利用季铵盐、聚乙二醇[8-9]或三乙醇胺[1,10]为相转移催化剂合成芳香醚的方法,虽然反应时间缩短了,但催化剂的来源受到限制。
研究表明,碘化钾在亲核取代反应中具有一定的催化作用,而且碘化钾价廉易得、毒性小、对环境污染小[11]。
因此探索了以苯酚、β-萘酚为原料,溴乙烷和正溴丁烷为烷基化试剂,KI催化作用下制备苯乙醚、正丁基苯基醚、β-萘乙醚、β-萘正丁基醚的方法。
1 实验部分1.1 芳香醚的合成1.2 仪器与试剂红外光谱用Digilab Merlin FT-IR光谱仪测定,KBr压片;熔点由XT-4显微熔点仪测定,温度计未校正。
丁醇、乙醇、氢氧化钾、碘化钾、浓硫酸、β-萘酚、溴化钠、苯酚(以上试剂均为分析纯);溴乙烷、正溴丁烷(自制)。
苯乙醚的制备

苯乙醚的制备一、危险性评估及相应防护措施苯酚危险性概述健康危害:苯酚对皮肤、粘膜有强烈的腐蚀作用,可抑制中枢神经或损害肝、肾功能。
急性中毒:吸入高浓度蒸气可致头痛、头晕、乏力、视物模糊、肺水肿等。
误服引起消化道灼伤,出现烧灼痛,呼出气带酚味,呕吐物或大便可带血液,有胃肠穿孔的可能,可出现休克、肺水肿、肝或肾损害,出现急性肾功能衰竭,可死于呼吸衰竭。
眼接触可致灼伤。
可经灼伤皮肤吸收经一定潜伏期后引起急性肾功能衰竭。
慢性中毒:可引起头痛、头晕、咳嗽、食欲减退、恶心、呕吐,严重者引起蛋白尿。
可致皮炎。
环境危害:对环境有严重危害,对水体和大气可造成污染。
燃爆危险:该品可燃,高毒,具强腐蚀性,可致人体灼伤。
防护及急救措施防护措施呼吸系统防护:可能接触其粉尘时,佩戴自吸过滤式防尘口罩。
紧急事态抢救或撤离时,应该佩戴自给式呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿透气型防毒服。
手防护:戴防化学品手套。
其它:工作现场禁止吸烟、进食和饮水。
工作毕,淋浴更衣。
单独存放被毒物污染的衣服,洗后备用。
保持良好的卫生习惯急救措施皮肤接触:立即脱去被污染的衣着,用甘油、聚乙烯乙二醇或聚乙烯乙二醇和酒精混合液(7:3)抹洗,然后用水彻底清洗。
或用大量流动清水冲洗,至少15分钟。
就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。
就医。
吸入:迅速脱离现场至空气新鲜处。
保持呼吸道通畅。
如呼吸困难,给输氧。
如呼吸停止,立即进行人工呼吸。
就医。
食入:立即给饮植物油15-30mL。
催吐。
就医。
溴乙烷危险性概述健康危害:会刺激肺部、眼睛和皮肤,可能引起头昏眼花、平衡失调,精神混乱,甚至昏迷和死亡,长期接触会损害肝、肾及心跳。
环境危害:醚味,蒸气比空气重会传播至远处,遇火源可能造成回火。
高温会分解生成刺激性的溴化氢及溴毒气。
主要症状:头昏眼花, 失去平衡, 胡言乱语, 意识不清。
防护措施吸入:立即把患者移到空气新鲜处。
苯乙醚的制备 2齐齐哈尔大学化学专业实验报告有机

齐齐哈尔大学实验报告题目:苯乙醚的制备学院:化学与化学工程学院专业班级:化学101 学生姓名:叶梦同组者姓名:何冰芯韩义军成绩:2013年 10 月 14 日苯乙醚的制备实验目的1、学习低沸点物质的取用,练习回流、蒸馏等基本操作2、通过制备苯乙醚,了解威廉门森醚合成法实验仪器三口瓶、回流冷凝管、漏斗、磁力搅拌实验药品苯酚、氢氧化钠、溴乙烷、饱和氯化钠水溶液、无水硫酸镁实验原理OH++H O 2NaOHNaO NaBrCH 3CH 2+NaO CH 2CH 3+主要试剂及物理性质试剂 分子量 性状 比重 熔点/℃ 沸点/℃ 溶解度苯酚 94.11 无色晶体,有腐蚀性 1.071 42-43 182 常温微溶 溴乙烷 108.97 无色油状液体,有挥发性 1.471 -73 38.2 苯乙醚 108.97 无色液体,有特殊臭气 0.97 -30 172 不溶表1 物性常数实验步骤取4.00g 氢氧化钠加入5mL 水溶解,将苯酚7.5g 和氢氧化钠溶液加入到装有搅拌器、回流冷凝管的100mL 三颈瓶中,加热并开搅拌装置,到温度上升至80~90℃时滴加溴乙烷6mL (滴加时一定要缓慢并调节好转子的速度),大约滴加1h ,,溴乙烷滴加完毕后再保温持续加热1.5 h ,停止加热,冷却,向三口瓶中加入10mL 的水,将其倒入100mL 分液漏斗中,分液,取上层液,加入5mL 的饱和氯化钠溶液洗涤两次,将洗涤好的上层液导入50mL 烧杯中,加入适量的无水硫酸镁进行干燥,将干燥好的液体倒入100mL 圆底烧瓶中进行蒸馏,收集160℃以上的馏分,产率为33.6%数据处理理论值=80mmol实际值=1.00ml==M m n M V ρ=16.12200.1967.0⨯=0.00791mmol 产率=%00989.0%1008000791.0=⨯mmolmmol注意事项1、滴加溴乙烷时要缓慢2、萃取分液时要注意基本要求,保留上层液体3、干燥时加入无水硫酸镁的量一定要适量,刚出现散落状时正合适4、蒸馏时蒸气温度稳定再开始收集,温度急剧下降后停止收集思考题1、反应过程中产生的白色固体是什么?答:有可能是氯化钠、也有可能把未反应的苯酚也蒸馏出来了,苯酚冷却后是无色晶体。
苯乙醚的制备
一、实验目的
1.通过苯乙醚的制备,了解Williamson合成法的原理及方法。
2.进一步熟悉蒸馏、分液等操作技术。
二、实验原理
C6H5OH+CH3CH2Br→C6H5OCH2CH3
三、主要试剂物理性质及用量规格
试剂用量
试剂物理性质
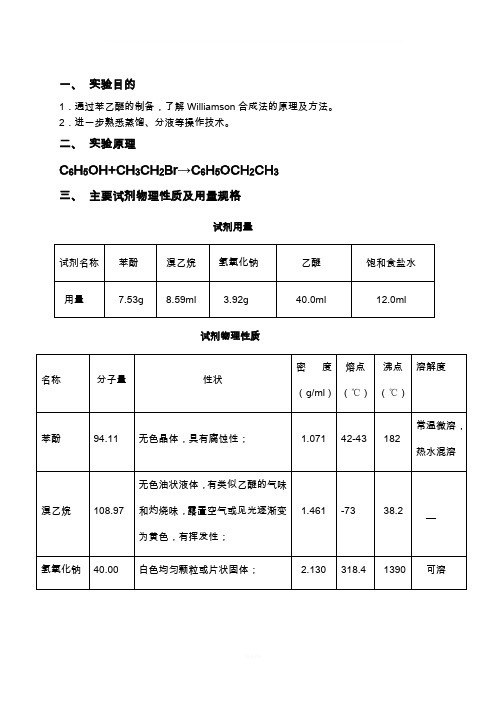
四、实验仪器及装置
仪器:三颈烧瓶(150mL)、球形冷凝管、搅拌器、空气冷凝管、温度计(200℃)、量筒、锥形瓶(100mL)、圆底烧瓶、玻璃棒、电炉
五、实验步骤及现象
六、实验结果
锥形瓶质量m=67.98g
产品和锥形瓶总质量M=71.67g
产品质量=M-m=71.67-67.98=3.69g
C6H5OH+CH3CH2Br→C6H5OCH2CH3
三组所取苯酚总质量=7.53+7.67+7.80=23.00 g
理论产量=23.00÷94×122=29.85g
实际产率=实际产量/理论产量×100%=3.69/29.85×100%=12.36%
七、结果与讨论
产率偏低原因分析
1、刚开始滴加溴乙烷时速度控制不当,溴乙烷的沸点为38.2℃,若控制不好滴速,在
80-90℃的水浴中很容易沸腾成气态,导致反应不完全。
2、分液时油层有损失,因为本组实验有机相在下层,水相在上层,且分液很困难,所以
损失较多。
蒸馏时温度最终稳定在148℃,不再上升的原因分析
1、苯乙醚的沸点为172℃,可能是混杂了苯酚,溴乙烷,水等杂志导致沸点降低。
Welcome To Download !!!
欢迎您的下载,资料仅供参考!。
10、苯乙醚的制备

有机化学实验报告实验名称:苯乙醚的制备学院:化学工程学院专业:化学工程与工艺班级:姓名:学号:指导教师:日期:1、掌握制备苯乙醚的原理和方法;2、进一步巩固搅拌、回流、分液、蒸馏等基本操作;二、实验原理 ̄1、制备苯乙醚的反应方程式:C6H5OH + CH3CH2Br → C6H5OCH2CH3三、主要试剂及物理性质1、主要试剂:苯酚、氢氧化钠、溴乙烷、无水氯化钙、饱和食盐水、试剂水等四、试剂用量规格仪器:150ml三口烧瓶、搅拌器、球形冷凝管、滴液漏斗、量筒(10ml)、量筒(50ml)、温度计(100℃)、分液漏斗、玻璃棒、电炉、烧杯等5-1制备苯乙醚的实验装置图5-2苯乙醚的蒸馏提纯装置图六、实验步骤及现象七、产率计算1、苯乙醚的理论值计算反应物:n苯酚=0.08mol m理论值=0.08*122g=9.76g 2、产率计算5组:m表面皿=64.58g,m总质量=74.38g,则m实际值=9.80g即产率=(实际值∕理论值)*100% ={9.80∕(9.76*5)}*100%=20.08%八、结果与讨论1、本次实验中苯乙醚的产率是20.08%,产率是偏低的。
造成产率偏低的原因:(1)操作不够严谨,回流、保温的时间不够充分;(2)溴乙烷滴加的速度过快,水浴时未参与反应而直接蒸发了;(3)反应过程中,氢氧化钠有部分吸附在烧瓶内壁上没有参与反应,导致整个反应不完全;(4)在3次的分液过程中,静置的时间不够长,有机层有部分损失;2、在反应过程中,回流的液体是溴乙烷,出现的固体是氢氧化钠和酚钠。
用饱和食盐水洗涤的目的是萃取出有机层。
3、蒸馏时,在140℃时开始收集产品,稳定温度为145℃,此后不再上升,苯乙醚的沸点高于这个温度,由于混杂了未反应的苯酚、溴乙烷等杂质使其沸点降低了。
4、蒸馏的玻璃仪器要干燥完全,否则蒸出的产物中含有水分,而非澄清透明。
在蒸馏中要收集高于150℃的馏分,故要选择使用空气冷凝管。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
齐齐哈尔大学
实验报告
题目:苯乙醚的制备
学院:____专业班级:___学生姓名:_________同组者姓名:_
成绩:_________
2013年10月28日
苯乙醚的制备
实验目的
1、学习低沸点物质的取用,练习回流、蒸馏等基本操作
2、通过制备苯乙醚,了解威廉门森醚合成法
实验仪器
三口瓶、回流冷凝管、漏斗、磁力搅拌
实验药品
苯酚、氢氧化钠、溴乙烷、饱和氯化钠水溶液、无水硫酸镁
实验原理
OH ++H O 2NaOH Na
O NaBr CH 3CH 2Br
+Na O CH 2CH 3+
主要试剂及物理性质
表1 物性常数
试剂 分子量 性状 比重 熔点/℃ 沸点/℃ 溶解度
苯酚 94.11 无色晶体,有腐蚀性 1.071 42-43 182 常温微溶 溴乙烷 108.97 无色油状液体,有挥发性 1.471 -73 38.2
苯乙醚 108.97 无色液体,有特殊臭气 0.97 -30 172 不溶
实验步骤
取4.00g 氢氧化钠加入5mL 水溶解,将苯酚7.5g 和氢氧化钠溶液加入到装有搅拌器、回流冷凝管的100mL 三颈瓶中,加热并开搅拌装置,到温度上升至80~90℃时滴加溴乙烷6mL (滴加时一定要缓慢并调节好转子的速度),大约滴加1h ,,溴乙烷滴加完毕后再保温持续加热1.5 h ,停止加热,冷却,向三口瓶中加入10mL 的水,将其倒入100mL 分液漏斗中,分液,取上层液,加入5mL 的饱和氯化钠溶液洗涤两次,将洗涤好的上层液导入50mL 烧杯中,加入适量的无水硫酸镁进行干燥,将干燥好的液体倒入100mL 圆底烧瓶中进行蒸馏,收集160℃以上的馏分,产率为33.6%
数据处理
理论值=80mmol
实际值=1.34ml
==M m n M V ρ=16
.12234.1967.0⨯=0.0106mmol 产率=%0132.0%100800106.0=⨯mmol
mmol
注意事项
1、滴加溴乙烷时要缓慢
2、萃取分液时要注意基本要求,保留上层液体
3、干燥时加入无水硫酸镁的量一定要适量,刚出现散落状时正合适
4、蒸馏时蒸气温度稳定再开始收集,温度急剧下降后停止收集
思考题
1、反应过程中产生的白色固体是什么?
答:有可能是氯化钠、也有可能把未反应的苯酚也蒸馏出来了,苯酚冷却后是无色晶体。
2、反应加入氢氧化钠的目的是什么?
答:
OH ++H O
2
NaOH Na
3、威廉门森法合成苯乙醚的反应机理
答:反应机理: 醇羟基在碱性条件下形成醇负离子,进攻卤代烃的碳正中心,卤代烃脱去卤素形成醚键。
反应条件为碱性,高浓度碱,高温对反应有利;水份对反应不利。
