差热分析
差热分析分析

差热分析分析差热分析是一种热分析技术,用于测定样品在温度变化过程中吸收或放出的热量。
差热分析主要应用于材料科学、化学、生物医学等领域,常用于确定材料的热稳定性、相变、降解等特性,以及化学反应、生物活性等反应过程的动力学参数。
本文将对差热分析技术的基本原理、数据分析、应用前景等进行详细介绍。
一、基本原理差热分析主要基于热量守恒原理,通过对比样品和参比样品在温度变化过程中的热量差异,得出样品在该温度范围内所吸收或放出的热量。
差热分析一般使用差动热量计,其基本结构由两个热电偶构成,一个接触样品,另一个接触参比样品。
当样品和参比样品接受相同的温度变化时,两侧热电偶所产生的电动势不同,这种电势差称为差动信号,与样品的热量吸收或释放有关。
差热分析实验中,通常以恒定的升温速率对样品和参比样品加热,同时测量两侧热电偶的电动势和温度。
通过对比两侧热电偶的信号,得出样品与参比样品的热量差异,进而确定样品的物理化学性质。
在差热分析过程中,常用的参比样品有空气、金属等。
二、数据分析差热分析实验中,得到的差动信号曲线通常呈现出峰形或谷形。
当样品发生物理化学变化时,其热量吸放会导致差动信号出现峰谷现象,峰表示样品吸收热量,谷表示释放热量。
通过对峰谷的面积、高度、位置等参数的分析,可以确定样品的热力学特性、相变、反应动力学参数等。
常用的数据分析方法包括:1. 峰温和半高宽分析:通过对峰温和半高宽的测量,可以确定样品的相变温度、热稳定性等。
2. 反应级数分析:差热分析可用于研究化学反应中的反应级数、反应机理等。
通过对峰形状的分析,可以确定反应级数以及反应动力学参数。
3. 动力学分析:差热分析可以用于测定反应的激活能、反应速率常数等动力学参数。
三、应用前景总之,随着科学技术的不断进步,差热分析技术将在材料科学、化学、生物医学等多个领域得到广泛应用,为相关研究提供有力的支持。
差热分析
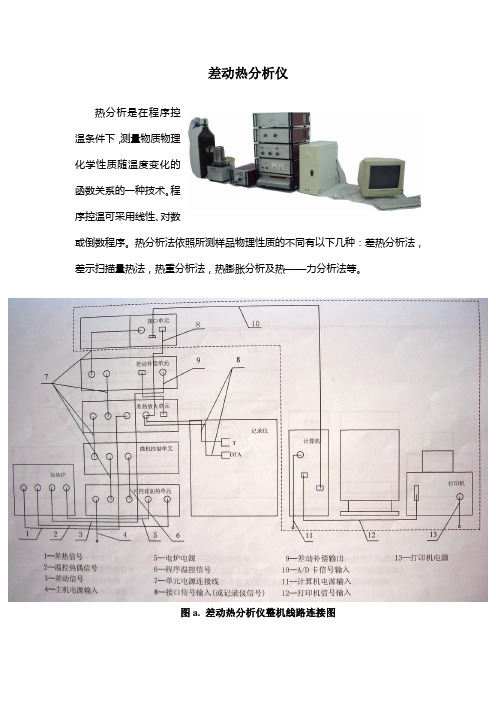
差动热分析仪热分析是在程序控温条件下,测量物质物理化学性质随温度变化的函数关系的一种技术。
程序控温可采用线性、对数或倒数程序。
热分析法依照所测样品物理性质的不同有以下几种:差热分析法,差示扫描量热法,热重分析法,热膨胀分析及热——力分析法等。
图a. 差动热分析仪整机线路连接图1.电炉2.气氛控制单元3.数据站接口单元4.差动热补偿单元5.差热放大单元6.可控硅加热单元7.微机温控单元图b. 仪器各主要部件2图c. 加热炉组件图d. 电炉(一)差热分析差热分析(differential thermal analysis, DTA)法是在程序控温下,测量物质与参比物之间温度差随温度或时间变化的一种技术。
根据国际热分析协会(international confederation for thermal analysis, ICTA) 规定,DTA曲线放热峰向上,吸热峰向下,灵敏度单位为微伏(μV)。
如图1-1为苦味酸(三硝基苯酚)的DTA曲线。
图1-1 苦味酸在动态空气中的DTA曲线可见,体系在程序控温下,不断加热或冷却降温,物质将按照它固有的运动规律而发生量变或质变,从而产生吸热或放热,根据吸热或放热便可判定物质内在性质的变化。
如:晶型转变、熔化、升华、挥发、还原、分解、脱水或降解等。
差热分析测量原理如图1-2所示。
图1-2 差热分析原理示意图图1-3 仪器工作原理差热分析仪主要由温度控制系统和差热信号测量系统组成,辅之以气氛和冷却水通道,测量结果由记录仪或计算机数据处理系统处理。
1.温度控制系统该系统由程序温度控制单元、控温热电耦及加热炉组成。
程序温度控制单元可编程序模拟复杂的温度曲线,给出毫伏信号。
当控温热电耦的热电势与该毫伏值有偏差时,说明炉温偏离给定值,由偏差信号调整加热炉功率,使炉温很好地跟踪设定值,产生理想的温度曲线。
2.差热信号测量系统该系统由差热传感器、差热放大单元等组成。
差热传感器即样品支架,由一对差接的点状热电耦和四孔氧化铝杆等装配而成,测定时将试样与参比物(常用α-Al2O3)分别放在两只坩埚中,置于样品杆的托盘上,然后使加热炉按一定速度升温(如10℃〃min-1)。
实验一差热分析一、目的意义差热分析(dta,differentialthermal

实验一 差热分析一、目的意义差热分析(DTA ,differentialthermal analysis)是研究相平衡与相变的动态方法中的一种,利用差热曲线的数据,工艺上可以确定材料的烧成制度及玻璃的转变与受控结晶等工艺参数,还可以对矿物进行定性、定量分析。
本实验的目的:1.了解差热分析的基本原理及仪器装置;2.学习使用差热分析方祛鉴定未知矿物。
二、基本原理差热分析的基本原理是:在程序控制温度下;将试样与参比物质在相同条件下加热或冷却,测量试样与参比物之间的温差与温度的关系,从而给出材料结构变化的相关信息。
物质在加热过程中,由于脱水,分解或相变等物理化学变化,经常会产生吸热或放热效应。
差热分析就是通过精确测定物质加热(或冷却)过程中伴随物理化学变化的同时产生热效应的大小以及产生热效应时所对应的温度,来达到对物质进行定性和/或定量分析的目的。
差热分析是把试样与参比物质(参比物质在整个实验温度范围内不应该有任何热效应,其导热系数,比热等物理参数尽可能与试样相同,亦称惰性物质或标准物质或中性物质)置于差热电偶的热端所对应的两个样品座内,在同一温度场中加热。
当试样加热过程中产生吸热或放热效应时,试样的温度就会低于或高于参比物质的温度,差热电偶的冷端就会输出相应的差热电势。
如果试样加热过程这中无热效应产生,则差热电势为零。
通过检流计偏转与否来检测差热电势的正负,就可推知是吸热或放热效应。
在与参比物质对应的热电偶的冷端连接上温度指示装置,就可检测出物质发生物理化学变化时所对应的温度.不同的物质,产生热效应的温度范围不同,差热曲线的形状亦不相同(如图16-2所示)。
把试样的差热曲线与相同实验条件下的已知物质的差热曲线作比较,就可以定性地确定试洋的矿物组成。
差热曲线的峰(谷)面积的大小与热效应的大小相对应,根据热效应的大小,可对试样作定量估计。
三.仪器设备与装置差热分析所用的设备主要由加热炉,差热电偶,样品座及差热信号和温度的显示仪表等所组成。
差热和热重分析

差热分析可以用来研究土壤中污染物 的热分解和转化过程,例如研究土壤 中农药的分解和转化过程。
热重分析可以用来研究土壤中污染物 的迁移和分布特性,例如研究土壤中 重金属的分布和迁移特性。
06 差热和热重分析的未来发 展与挑战
新技术发展
新型传感器技术
利用新型传感器技术,如纳米传感器和柔性传感器,提高差热和 热重分析的灵敏度和精度。
差热分析的应用
01 确定物质的熔点、玻璃化转变温度等物理 性质。
02 研究物质的热稳定性、热分解和氧化等化 学性质。
03
用于药物、食品、聚合物、陶瓷等领域的 研发和质量控制。
04
热重分析(TGA)
02 热重分析(TGA)
热重分析的定义
热重分析(TGA)是一种在程序控温下测量物质质量与温度关系的分析方法。通过 测量物质质量随温度变化的情况,可以研究物质在加热或冷却过程中的物理和化学 变化。
在热重分析中,样品被放置在热天平上,并加热或冷却以模拟不同的温度条件。随着温度的变化,样 品的质量会发生变化,这些变化被记录并转化为温度与质量之间的关系曲线。通过对曲线的分析,可 以了解物质在加热或冷却过程中的质量变化情况。
热重分析的应用
热重分析在多个领域都有广泛的应用,包括材料科学 、化学、制药、食品科学等。它可以用于研究材料的 热稳定性、分解行为、反应动力学以及物质在温度变 化过程中的相变等。
陶瓷材料的抗热震性能
差热分析可以研究陶瓷材料在不同温度下的热震稳定性,对于陶瓷 材料的应用具有重要意义。
金属材料
金属材料的熔点和凝固点
01
通过差热分析,可以精确测定金属材料的熔点和凝固点,有助
于了解金属材料的热物性。
金属材料的氧化和腐蚀行为
差热分析法(DTA)简介 (Differential Thermal Analysis)

差热分析法(DTA)简介(Differential Thermal Analysis)1.DTA的基本原理差热分析是在程序控制温度下,测量物质与参比物之间的温度差与温度关系的一种技术。
差热分析曲线是描述样品与参比物之间的温差(ΔT)随温度或时间的变化关系。
在DAT试验中,样品温度的变化是由于相转变或反应的吸热或放热效应引起的。
如:相转变,熔化,结晶结构的转变,沸腾,升华,蒸发,脱氢反应,断裂或分解反应,氧化或还原反应,晶格结构的破坏和其它化学反应。
一般说来,相转变、脱氢还原和一些分解反应产生吸热效应;而结晶、氧化和一些分解反应产生放热效应。
差热分析的原理如图Ⅱ-3-1所示。
将试样和参比物分别放入坩埚,置于炉中以一定速率进行程序升温,以表示各自的温度,设试样和参比物(包括容器、温差电偶等)的热容量Cs、Cr不随温度而变。
则它们的升温曲线如图Ⅱ-3-2所示。
若以对t作图,所得DTA曲线如图Ⅱ-3-3所示,在0-a区间,ΔT大体上是一致的,形成DTA曲线的基线。
随着温度的增加,试样产生了热效应(例如相转变),则与参比物间的温差变大,在DTA曲线中表现为峰。
显然,温差越大,峰也越大,试样发生变化的次数多,峰的数目也多,所以各种吸热和放热峰的个数、形状和位置与相应的温度可用来定性地鉴定所研究的物质,而峰面积与热量的变化有关。
图Ⅱ-3-1差热分析的原理图 II-3-1 差热分析的原理图图II-3-2试样和参比物的升温曲线1.参比物;2.试样;3.炉体;4.热电偶(包括吸热转变)图Ⅱ-3-3 DTA吸热转变曲线TA曲线所包围的面积S可用下式表示式中m是反应物的质量,ΔH是反应热,g是仪器的几何形态常数,C是样品的热传导率ΔT是温差,t1是DTA曲线的积分限。
这是一种最简单的表达式,它是通过运用比例或近似常数g和C来说明样品反应热与峰面积的关系。
这里忽略了微分项和样品的温度梯度,并假设峰面积与样品的比热无关,所以它是一个近似关系式。
差热分析

• 将试样和参考物(在一定 温度范围内不发生热效应 的一些热惰性物质)放在 炉子的恒温区内,以完全 相同的条件升温或降温, 在试样和参考物的底部安 装两支热电偶,并把这两 支热电偶反向串联—差示 热电偶起来。如右图所示:
•
当试样加热过程中产生吸热或放热效应时,试 样的温度就会低于或高于参比物质的温度,差热 电偶的冷端就会输出相应的差热电势。通过检流 计偏转与否来检测差热电势的正负,就可推知是 吸热或放热效应。在与参比物质对应的热电偶的 端连接上温度指示装置,就可检测出物质发生物 理化学变化时所对应的温度。
DTA与DSC区别
• DSC多了个补偿加热器 • 用差式扫描量热仪可以直接测量热量 ,差式分析却不可以。DTA在试样发 生热效应时,试样的实际温度已发生 改变。而DSC的试样热量变化随时可 以被补充。试样与参比物温度始终相 等,避免了热传。
典型的DSC曲线
典型的差示扫描量热(DSC) 曲线以热流率(dH/dt)为纵 坐标、以时间(t)或温度(T) 为横坐标,即dH/dt-t(或T) 曲线。 曲线离开基线的位移即代表样 品吸热或放热的速率(mJ· s1),而曲线中峰或谷包围的 面积即代表热量的变化。 因而差示扫描量热法可以直接 测量样品在发生物理或化学变 化时的热效应。
图7 典型的DSC曲线
第三节 热重法
• 热重法(TG或TGA):在程序控制 温度条件下,测量物质的质量与温度 关系的一种热分析方法。 • 其数学表达式为: ΔW=f(T)或(τ) • ΔW为重量变化,T是绝对温度,τ是时 间。 • 热重法试验得到的曲线称为热重曲线 (即TG)。 • TG曲线以质量(或百分率%)为纵坐 标,从上到下表示减少,以温度或时 间作横坐标,从左自右增加,试验所 得的TG曲线,对温度或时间的微分可 得到一阶微商曲线DTG和二阶微商曲 线DDTG
差热分析

S.L.Boersma (J.Amer.Ceram.
= mq
(3)
Soc.38.281.1955
G
W.W.Wendl endt 认为实 用于常规
m 试样中活性物质的质量
DTA 装置
q 单位活性物质量的转变或反应热 G 镍制品坩埚和周围镍套(带有盖)间的
导热系数
5
△T 温度差 t1 转变开始时间 t2 △T 回到零的时间 镍均温块 放置样品的空穴型状
础上经某种简化、例如样品物理性质不随温度变化、线性升温等推得峰面积与热
效应关系的数学表达式。表 1 列出了几种主要理论及其表达式。表 1 继 speil 之
后 出的峰面积和过程热效应关系的理论
理论 出者及 表达式
主要假设条件
备注
原始文献
M.J.Vold (Anal.Chem. 21.688.1949)
若将在实验温区内呈热稳定的已知物质(即参比物)和试样一起放人一个加 热系统中(见图 1),并以线性程序温度对它们加热。在试样没有发生吸热或放热 变化且与程序温度间不存在温度滞后时,试样和参比物的温度与线性程序温度是 一致的。若试样发生放热变化,由于热量不可能从试样瞬间导出,于是试样温度 偏离线性升温线,且向高温方向移动。反之、在试样发生吸热变化时,由于试样 不可能从环境瞬间吸取足够的热量,从而使试样温度低于程序温度。只有经历一 个传热过程试样才能回复到与程序温度相同的温度。
物质在加热或冷却过程中会发生物理变化或化学变化,与此同时,往往还伴 随吸热或放热现象。伴随热效应的变化,有晶型转变、沸腾、升华、蒸发、熔融 等物理变化,以及氧化还原。分解、脱水和离解等化学变化。另有—些物理变化, 虽无热效应发生但比热容等某些物理性质也会发生改变、这类变化如玻璃化转变 等。物质发生焓变时质量不一定改变,但温度是必定会变化的。差热分析正是在 物质这类性质基础上建立的一种技术。
差热分析法
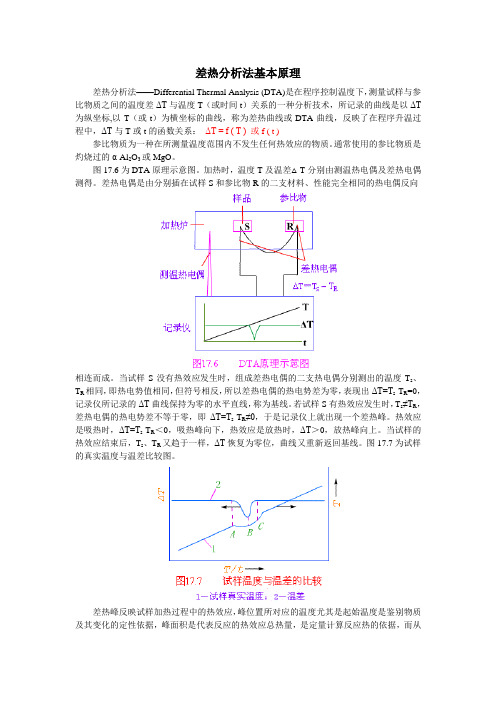
差热分析法基本原理差热分析法——Differential Thermal Analysis (DTA)是在程序控制温度下,测量试样与参比物质之间的温度差ΔT与温度T(或时间t)关系的一种分析技术,所记录的曲线是以ΔT 为纵坐标,以T(或t)为横坐标的曲线,称为差热曲线或DTA曲线,反映了在程序升温过程中,ΔT与T或t的函数关系:ΔT = f ( T ) 或f ( t )参比物质为一种在所测量温度范围内不发生任何热效应的物质。
通常使用的参比物质是灼烧过的α-Al2O3或MgO。
图17.6为DTA原理示意图。
加热时,温度T及温差△T分别由测温热电偶及差热电偶测得。
差热电偶是由分别插在试样S和参比物R的二支材料、性能完全相同的热电偶反向相连而成。
当试样S没有热效应发生时,组成差热电偶的二支热电偶分别测出的温度T s、T R相同,即热电势值相同,但符号相反,所以差热电偶的热电势差为零,表现出ΔT=T s-T R=0,记录仪所记录的ΔT曲线保持为零的水平直线,称为基线。
若试样S有热效应发生时,T s≠T R,差热电偶的热电势差不等于零,即ΔT=T s-T R≠0,于是记录仪上就出现一个差热峰。
热效应是吸热时,ΔT=T s-T R<0,吸热峰向下,热效应是放热时,ΔT>0,放热峰向上。
当试样的热效应结束后,T s、T R又趋于一样,ΔT恢复为零位,曲线又重新返回基线。
图17.7为试样的真实温度与温差比较图。
差热峰反映试样加热过程中的热效应,峰位置所对应的温度尤其是起始温度是鉴别物质及其变化的定性依据,峰面积是代表反应的热效应总热量,是定量计算反应热的依据,而从峰的形状(峰高、峰宽、对称性等)则可求得热反应的动力学参数。
表17.2列出了各种吸热和放热体系的类型,供判断差热峰产生机理时参考。
表17.2 差热分析中吸热和放热体系的主要类型现象(物理的原因)吸热放热现象(化学的原因)吸热放热结晶转变○○化学吸附○熔融○析出○气化○脱水○升华○分解○○吸附○氧化度降低○脱附○氧化(气体中)○吸收○还原(气体中)○氧化还原反应○○固相反应○○影响DTA的因素影响DTA的因素很多,下面讨论几种主要的因素:★升温速度的影响保持均匀的升温速度(ψ)是DTA的重要条件之一,即应:ψ = dT R / dt = 常数若升温速度不均匀(即ψ有波动),则DTA曲线的基线会漂移,影响多种参数测量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验10差热分析
【实验目的】
(1)掌握差热分析的基本原理和方法。
(2)用差热分析仪测定硫酸铜的差热图,并掌握定性解释图谱的基本方法
(3)了解ZCR II -差热分析仪的组成及结构,并掌握其使用方法。
【实验原理】
差热分析是在程序控制温度条件下通过温差测量来确定物质的物理化学性质的一种热分析方法,简称DTA 。
它可以对物质进行定性和定量分析,广泛应用于科研及生产部门。
物质在加热或冷却的过程中,如有熔化、升华、汽化、凝固、晶型转变、化合、分解、氧化、脱水、吸附、脱附等物理或化学的变化就会伴有热效应发生。
差热分析是测定在同一受热条件下,试样与参比物之间所产生的温差(T ∆)对温度(T )或时间(t)关系的一种方法(参比物是在测定的温度范围内不会发生任何物理化学变化的对热稳定的物质,如23Al O 、MgO 等),由于参比物在测量的温度范围内不会发生任何物理化学变化,因此,温差(T ∆)曲线无疑是试样的温度变化曲线。
将试样与参比物一起置于一个按规定速率逐步升温或降温的电炉中,然后分别记录参比物的温度以及试样与参比物之间的温差。
随着测定时间的延续,就可以得到一张差热图(或称热谱图)。
图2.31为一理想的差热图。
差热分析装置的结构原理如图2.32所示,它由差热分析炉、差热分析仪、计算机、打印机组成。
差热分析炉包括放试样和参比物的坩埚、加热炉、温度程序控制单元以及差热热电偶组,向外提供反应炉温、参比物温度和温差的电压信号,由差热分析仪进行处理。
差热分析仪由信号放大单元、A/D 转换器、中央处理单元(CPU )以及显示、面板控制单元组成,并提供标准计算机接口和记录仪接口,由外部计算机进行数据分析和曲线打印,如图 2.33所示。
试样与参比物放入坩埚后,按一定的速率升温,如果参比物和试样热容大致相同,就能得到理想的差热分析图。
图2.31中曲线T 是参比物的温度曲线,它表明参比物(或其他参考点)的温度随时间变化的情况。
AH 线为差热线,它反应试样与参比物间温差与时间的关系。
如试样无热效应产生时,试样与参比物间无温差T ∆=0,AH 线将是一条平滑的直线(基线)。
当试样发生变化而产生热效时,由于传热速率的不同,就会使样品与参比物的温度不一样,0T ∆≠。
则出现如曲线BCD 部分所示的峰顶向下的吸热峰。
反之,则出现如曲线EFG 部分所示的峰顶向上的放热峰。
差热图中峰的数目多少、位置、峰面积、方向、高度、宽度、对称性反应了试样在所测温度范围内所发生的物理变化和化学变化次数、发生转化的温度范围、热效应大小及正负。
峰的高度、宽度、对称性除与测试条件有关外,还与样品变化过程的动力学因素有关。
所测得的差热图比理想的差热图复杂得多。
差热峰的位置可参照如图2.33所示的方法来确定。
通过峰的起点b 、顶点c 和终点d ,分别作三条垂线与温度线交于'b 、'c 、'd 三点。
若温度线与差热线的记录完全同步,即两条曲线完全是用一个横坐标,则'b 、'c 、'
d 三点所对应的温度b c d T T T 、、就分别为峰的起点、峰点及终点温度,由于b T 大体上代表了开始温度,因此常用b T 表征峰的位置,对于很
尖锐的峰,其位置也可以用峰点温度c T 表示。
在实际测定中,由于试样与参比物间往往存在着比热容、导热系数、粒度、装填疏密程度等方面的差异,再加上样品在测定过程中会发生收缩或膨胀,差热线就会发生漂移,其基线不再平行于时间轴,峰的前后基线也不在一条直线上,差热峰可能比较平坦,b 、c 、d 三个转折点不明显。
可以通过做切线的方法来确定转折点及面积,图2.34中的阴影部分为校正后的峰面积。
差热图也可以用温差T ∆作纵坐标,参比物温度T 作横坐标表示。
差热峰的位置表示发生反应的温度;峰的面积表示反应热的大小;峰的形状则与反应的动力学有关。
【仪器与试剂】
ZCR 差热实验装置1套;分析天平1台;425()CuSO H O AR ;23l O α-A (AR)。
【实验步骤】
(1)将少许425CuSO H O 试样放入干净的研钵中研磨,
使其粒度和参比物23l O α-A 基本相同,约为200目。
(2)称取6~7mg 425CuSO H O 试样放入坩埚中,在另一只坩埚中放入相同质量的参比物23l O α-A 。
(3)打开炉罩:逆时针拧松两只炉体固定螺丝,双手握住炉体底板小心地向上垂直托起至最高点后,将炉体逆时针方向推移090,放稳后再松手。
此时看到一根白色的热电偶,热电偶顶端是坩埚托盘。
将盛有425CuSO H O 试样的坩埚放在左侧托盘上,盛有参比物23l O α-A 的坩埚放在右侧托盘上(用镊子取、放坩埚,取、放要轻拿轻放,不能向托盘施压,避免热电偶弯曲。
这一步操作一定要特别小心)。
然后双手握住炉体底板顺时针推移,推不动时,将定位杆插入定位孔后,在缓慢地放下炉体底板,拧紧两个炉体固定螺丝。
(4)用橡皮管将电炉冷却水接嘴与自来水管连接。
实验开始前,必须先打开水龙头通入冷却水(水流不能大)。
(5)打开差热分析仪的电源开关。
(6)参数设置:按下【功能】键,G T 指示灯亮时,设置参数才起作用。
用【移位】键和【加、减】键分别选中【定时】、【升温速度】、【G T 设置温度】。
依次设置为【15s 】、【010min C 】、【0
400C 】。
(7)按一下【采零】键,清除T ∆的初始偏差(随时清除差热分析仪元件等因素产生的初始偏差)。
待采零数显框中数值基本不变时,再进行以下操作。
(8)计算机操作:打开计算机,双击【差热分析2.00】,出现一个画面,10s 后出现一个坐标,在坐标的上方找到【设置】窗口,单击【设置】再单击串行口再单击【com2】(灰色行不能单击)。
(9)按下【T 0/T S /T G 】键,【T 0】、【T S 】、【T G 】、灯全亮,实验开始,程序进入升温阶段。
(10)在坐标的上方找到【操作】窗口,单击【操作】再单击【开始绘图】,计算机开始绘图。
(11)40min 后单击【操作】窗口再单击【停止绘图】,计算机停止绘图。
单击【拾点】在绘图区拾取所需要的点,并自动显示该点坐标值。
在差热图上处理数据,并计算峰面积。
(12)实验完毕,关闭计算机,关闭差热分析仪电源,待差热分析电炉的炉温降至室温时关闭冷却水,将坩埚清洁干净放入指定试剂瓶中。
【数据记录与处理】
(1)由所测样品的差热图,求出各峰的起始温度和峰温,将数据列表记录。
(2)求出所测样品的热效应值。
(3)样品425CuSO H O 的三个峰各代表什么变化,写出反应方程式。
根据实验结果,结合无机化学知识,推测425CuSO H O 中5个H 2O 的结构状态。
【思考题】
(1)在差热分析试验中如何选择参比物?常用的参比物有哪些?
(2)差热分析中参比物起什么作用?对参比物应有什么要求?试样中加参比物的作用是什么?
(3)在实验中为什么要选择适当的样品量和适当的升温速率?
(4)影响差热分析结果的主要因素有哪些?
【注意事项】
(1)425CuSO H O 试样需研磨成与参比物粒度相仿(约200目)
,两者装填在坩埚中的紧密程度应尽量相同。
试样与参比物坩埚的放置位置必须是做左托盘上放试样坩埚,右托盘上放参比物坩埚,否则实验将无法进行。
(2)操作前必须先通水,再接通电源,以免加热电炉损坏。
(3)用镊子取放时要轻拿轻放,特别小心。
不能将试样撒在托盘上,否则会造成仪器无法使用。
(4)托放炉体底盘时不得挤压、碰撞放坩埚的托架(该托架实际是测温探头,价格昂贵,损坏无法修复)。
(5)实验完毕,坩埚不要丢弃,可反复使用。
