大肠菌群平板计数法
食品安全国家标准 大肠菌群计数

食品安全国家标准食品微生物学检验大肠菌群计数1范围本标准规定了食品中大肠菌群(Coliforms)计数的方法。
本标准适用于食品中大肠菌群的计数。
2术语和定义2.1 大肠菌群coliforms在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌。
2.2 最可能数most probable number,MPN基于泊松分布的一种间接计数方法。
3检验原理3.1 MPN法MPN法是统计学和微生物学结合的一种定量检测法。
待测样品经系列稀释并培养后,根据其未生长的最低稀释度与生长的最高稀释度,应用统计学概率论推算出待测样品中大肠菌群的最大可能数。
3.2 平板计数法大肠菌群在固体培养基中发酵乳糖产酸,在指示剂的作用下形成可计数的红色或紫色,带有或不带有沉淀环的菌落。
4 设备和材料除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:4.1 恒温培养箱:36 ℃±1 ℃。
4.2 冰箱:2 ℃~5 ℃。
4.3 恒温水浴箱:46℃±1℃。
4.4 天平:感量0.1 g。
4.5 均质器。
4.6 振荡器。
4.7 无菌吸管:1 mL(具0.01 mL 刻度)、10 mL(具0.1 mL 刻度)或微量移液器及吸头。
4.8 无菌锥形瓶:容量500 mL。
4.9 无菌培养皿:直径90 mm。
4.10 pH 计或pH 比色管或精密pH 试纸。
4.11 菌落计数器。
5 培养基和试剂5.1 月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤:见附录A 中A.1。
5.2 煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤:见附录A 中A.2。
5.3 结晶紫中性红胆盐琼脂(Violet Red Bile Agar,VRBA):见附录A 中A.3。
5.4 磷酸盐缓冲液:见附录A 中A.4。
5.5 无菌生理盐水:见附录A 中A.5。
5.6 无菌1 mol/L NaOH:见附录A 中A.6。
大肠菌群平板计数法的注意事项

大肠菌群是经常用来衡量食品卫生情况的重要指标,绝大部分食品都会要求检测的项目。
在食品微生物实验室里,大肠菌群和菌落总数的检测频次应该是最高的,但检测过程中总会有一些小问题困扰着大家,以下来讲解一下大肠菌群平板计数法的注意事项。
方法选择相比于MPN计数法,平板计数法更适用于大肠菌群含量较高的食品。
但大肠菌群多少算是含量较高呢国标里没有明确规定,但通常认为,产品大肠菌群以100CFU/g(mL)为界,超过这个含量一般认为是含量较高。
但具体什么时候选用平板计数法进行大肠菌群的检测,大部分情况还是要看你的产品执行的标准。
假如产品标准要求大肠菌群含量的单位为CFU/g(mL),那必须选用平板计数法。
若是/g(mL)或者MPN/100g(mL),就应选择MPN计数法,MPN法具体选用哪版国标此处不再赘述。
因此,根据自己产品的情况选择适当的检测方法。
培养基的要求平板计数法使用的培养基为结晶紫中性胆盐琼脂培养基,简称VRBA。
无论是国标,还是培养基的使用说明中都明确表示,VRBA是不需要进行灭菌的,煮沸2min即可使用。
特地点出这一点是因为很多朋友都在问VRBA的灭菌条件,对不灭菌的培养基不信任,害怕出现检测异常,那是因为这些小伙伴们对其中的原理不清楚。
大肠菌群的定义是在一定培养条件下能够在发酵乳糖、产酸产气的需氧和兼性厌氧的革兰氏阴性无芽孢杆菌,因此大肠菌群是不能形成芽孢的,在VRBA培养基煮沸的过程中,即使有大肠菌群存在也会被杀灭,所以从培养基带入污染的可能性是没有的。
当然盛装培养基的容器是需要进行灭菌的,以免容器引入污染。
另外,VRBA是一种选择性的培养基,含有的结晶紫对革兰氏阳性菌有比较强的抑制作用而对革兰氏阴性菌几乎没有作用,而且平板培养产生的菌落还需要进行复发酵的验证,因此VRBA培养基就不需要进行灭菌了。
但值得注意的是,VRBA需要现配现用,配制出的培养基应当在3h之内使用完毕。
稀释度的确定国标中要求选择2-3个适宜的连续稀释度。
大肠菌群平板计数法方法学验证报告
GB 4789.3-2016大肠菌群平板计数法方法学验证报告一、验证目的验证GB4789.3-2016《食品微生物学检验大肠菌群计数(大肠菌群平板计数法)》在本实验室的适用性。
二、验证方法本实验样品取不同不同类型产品进行实验,严格按照GB4789.3-2016进行,除上述实验程序外,为保证本次验证的科学性和准确性,本次实验添加阳性对照组,对照组由标准菌株大肠埃希氏菌(CICC10389)接种培养而成,与样品实验程序同时进行。
三、验证设备和试剂1.冰箱:BCD-212DG/A 海信(北京)电器2.生化培养箱:LRH-70 上海一恒科学仪器3.电位pH计:PHS-3C+(精确度0.01)成都世纪方舟科技有限公司4.无菌均质器:SCIENTZ-04 宁波新芝生物科技有限公司5.恒温振荡器:SHA-A 江苏金坛环宇科学仪器厂6.菌落计数仪:Scan-500 北京五洲东方科技发展有限公司7.天平:JE-502 上海浦春计量仪器有限公司8.超净工作台:SW-CJ-2FD 上海博迅实业9.显微镜:B203LED 重庆奥特光学仪器有限公司培养基和试剂:1.结晶紫中性红胆盐琼脂(VRBA)北京陆桥技术股份有限公司2.煌绿乳糖胆盐(BGLB)肉汤北京陆桥技术股份有限公司3.无菌生理盐水:同GB 4789.3项下制法。
四、验证环境1.依据《消毒与灭菌效果的评价方法与标准GB15981-1995》定期对高压蒸汽灭菌锅的灭菌效果进行检测评价并记录;2.依据《无菌室消毒灭菌操作规程》定期对对无菌室、超净台进行清洁消毒灭菌并记录;3.依据《实验室质量控制规范食品微生物检测GB/T27405-2008》定期对对无菌室及超净台进行沉降菌检测并记录;4.无菌室检验:详见《xxxx》;五、验证步骤1.样品的稀释1.1 固体和半固体样品:称取25 g 样品放入盛有225 mL生理盐水的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成1:10 的样品匀液。
大肠菌群检测中平板计数法主要操作要领

大肠菌裙检测是一项非常重要的微生物检测工作,它可以帮助我们了解环境和食品中是否存在大肠菌裙,从而保证人们的健康安全。
在大肠菌裙检测中,平板计数法是一种常用的检测方法。
下面将介绍大肠菌裙检测中平板计数法的主要操作要领。
1.准备工作在进行大肠菌裙检测之前,需要准备相应的实验器材和培养基。
实验器材包括平板计数仪、移液器、无菌培养皿等。
培养基一般选择大肠埃希氏菌(EC)培养基。
2.样品处理将待测样品取适量放入无菌容器中,进行适当的稀释。
这一步要确保样品的稀释倍数适中,以保证后续的计数结果准确。
3.接种和培养取一定量的处理过的样品,在无菌工作台上均匀涂抹于含有适量培养基的培养皿上,然后进行培养。
培养条件一般为37摄氏度,培养时间为24小时。
培养后会形成菌落,这些菌落代表了原始样品中的细菌数量。
4.计数和记录在培养后,利用平板计数仪对菌落进行计数。
计数的时候需要注意避免重复计数同一菌落,保证计数准确。
需要记录计数结果,包括菌落数量和相应的单位。
5.结果分析根据计数结果,可以对原始样品中的大肠菌裙数量进行估算。
可以通过对对照组和样品组的比较来判断样品中大肠菌裙的数量是否合格。
大肠菌裙检测中平板计数法的主要操作要领就是以上几点。
通过严格按照这些要领进行操作,可以确保检测结果的准确性和可靠性。
在进行操作过程中,还需要遵守无菌操作规范,确保实验过程中不受外界污染。
希望大家在进行大肠菌裙检测时能够严格按照操作要领进行,保证测试结果的准确性,从而更好地保障人们的健康安全。
大肠菌裙检测中的平板计数法是一种经典的微生物计数方法,它主要用于测定食品、饮用水、环境等样品中大肠菌裙的数量。
在这个过程中,我们需要注意几个关键的环节,来保证实验的准确性和结果的可靠性。
在准备工作环节,我们需要保证实验器材和培养基的质量。
实验器材一定要经过严格的消毒和清洁,以免外来细菌的污染影响实验结果。
培养基的选用也尤为重要,要选择与待测细菌的生长要求相适应的培养基,以保证细菌在培养基上的正常生长。
计量大肠菌群数量的计数方法

计量大肠菌群数量的计数方法大肠菌群是指在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌。
直接或间接来自人与温血动物的肠道:包括肠杆菌科的大肠埃希氏菌属、柠檬酸杆菌属、肠杆菌属和克雷伯菌属,其中大肠埃希氏菌属为最典型大肠埃希氏菌。
一、卫生学意义人与温血动物粪便污染的指示菌:•大肠埃希氏菌——粪便近期污染;•其他菌属——粪便陈旧污染。
肠道致病菌污染食品的指示菌:•与肠道致病菌(如沙门氏菌、志贺氏菌)来源相同;在外界生存的时间与主要肠道致病菌一致。
二、修订的主要内容本标准与GB4789.2-2010相比,主要修改如下:1、删除了标准的英文名称2、修改了发布单位名称2010版本“中华人民共和国卫生部”2016版本“中华人民共和国国家卫生盒计划生育委员会”和“国家食品药品监督管理总局”3、前言:本标准代替GB4789.3—2010《食品安全国家标准食品微生物学检验大肠菌群计数》、GB/T4789.32—2002《食品卫生微生物学检验大肠菌群的快速检测》和SN/T0169—2010《进出口食品中大肠菌群、粪大肠菌群和大肠杆菌检测方法》大肠菌群计数部分。
本标准与GB4789.3—2010相比,主要变化如下:———增加了检验原理;———修改了适用范围;———修改了典型菌落的形态描述;———修改了第二法平板菌落数的选择;———修改了第二法证实试验;———修改了第二法平板计数的报告。
三、大肠菌群计数的两种方法第一法MPN法适用于大肠菌群含量较低的食品中大肠菌群的计数。
检验原理:MPN法是统计学和微生物学结合的一种定量检测法。
待测样品经系列稀释并培养后,根据其未生长的最低稀释度与生长的最高稀释度,应用统计学概率论推算出待测样品中大肠菌群的最大可能数。
第二法平板计数法适用于大肠菌群含量较高的食品中大肠菌群的计数。
检验原理:大肠菌群在固体培养基中发酵乳糖产酸,在指示剂的作用下形成可计数的红色或紫色,带有或不带有沉淀环的菌落。
饮料—大肠菌群的测定—平板计数法

3.3 乳糖发酵管 3.3.1 成分
蛋白胨
20g
乳糖
10g
0.04%溴甲酚紫水溶液
25mL
蒸馏水 3.3.2 制法
1000mL
将蛋白胨及乳糖溶于水中,校正 pH7.4,加入指示剂,分装 3mL,并放入一个小倒管,115℃高
压灭菌 15min。
3.4 EC 肉汤
3.4.1 成分
1
胰蛋白胨
20g
3 号胆盐(或混合胆盐)
匀稀释液。
5.2.2 用 1 mL 灭菌吸管吸取 1:10 稀释液 1 mL,注入含有 9 mL 灭菌生理盐水或其他稀释
液的试管内,振摇试管混匀,做成 1:100 的稀释液。
5.1.3 另取 1 mL 灭菌吸管,按上条操作依次做 10 倍递增稀释液,每递增稀释一次,换用 1
支 1 mL 灭菌吸管。
5.1.4 根据饮料卫生标准要求或对检样污染情况的估计,选择三个稀释度,每个稀释度接种 3 管。
FSPYL026 饮料 大肠菌群的测定 平板计数法
F_SP_ YL_026
饮料—大肠菌群的测定—平板计数法
1 范围 本方法采用平板计数法测定饮料中的大肠菌群。
本方法适用于饮料中大肠菌群的测定,饮料中大肠菌群数系以 100 mL(g)检样内大肠
菌群最可能数(MPN)表示。
2 原理
饮料检样经处理,在需氧及兼性厌氧、37℃条件下培养,通过计数报告检样中大肠菌群 最可能数。大肠菌群系指一群能发酵乳糖,产酸产气的革兰氏阴性无芽孢杆菌。
3.2.1 成分
蛋白胨
10g
乳糖
10g
磷酸氢二钾
2g
琼脂
17g
2%伊红 Y 溶液
20mL
大肠菌群计数

4. 用1mL无菌吸管或微量移液器吸取1:10样 品匀液1mL,沿管壁缓缓注入装有9mL磷酸 盐缓冲液或生理盐水的无菌试管中(注意吸 管或吸头尖端不要触及稀释液面),振摇试 管或换用1支1mL无菌吸管反复吹打,使其 混合均匀,制成1:100的样品匀液。
5. 根据对样品污染情况的估计,按上述操作, 依次制成系列十倍递增系列稀释样品匀液。 每递增稀释1次,换用1支1mL无菌吸管或 吸头。从制备样品匀液至样品接种完毕,全 过程不得超过15min。
1.本表采用三个稀释度【0.1g(ml),0.01g(ml),0.001g(ml),】每个稀释度接种三管。
2.表内所列检样量如改用 1g (ml),0. 10 1 3 0 16 4.5 1g(ml),0.01g(ml), 42 3 2 表内数字相应降低 1 150 37 倍;420
2 0 1 14 3.6 42 3 2 3 290 90 1,000
2 0.01g(ml),0.001g(ml),0.0001g(ml) 0 0 9.2 1.4 38 时,则表内数字应相应增高 3 2 2 210 10倍,其余类推。 40 430 如改用
稀释度的选择
将待检样品选取适宜的2~3个连续稀释度, 每个稀释度接种两 对照。及时将15mL~ 20mL冷至46℃的结晶紫中性红胆盐琼脂
0.001 0 1 0
1 0 0 0 1 2 0 1 0 1
高 9.5 9.6 11
18 18 38 18 18 38 20 38 42 42
0.01 2 2 2
3 3 0 0 0 1 1 1 1 2
0.001 0 1 2
0 1 0 1 2 0 1 2 3 0
MPN
95%置信区间 低 4.5 8.7 8.7
卫生指示菌——大肠菌群
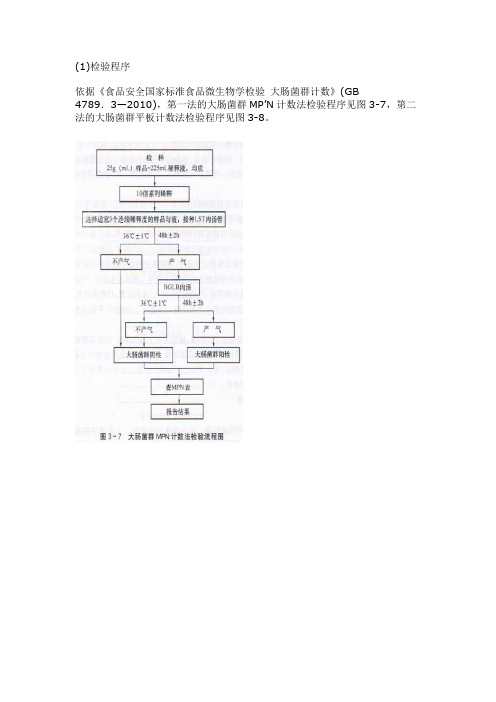
(1)检验程序依据《食品安全国家标准食品微生物学检验大肠菌群计数》(GB 4789.3—2010),第一法的大肠菌群MP’N计数法检验程序见图3-7,第二法的大肠菌群平板计数法检验程序见图3-8。
(2)原理1)大肠菌群MPN计数法检验月桂基硫酸盐胰蛋白胨(lauryl tryptose broth,LST)中的胰蛋白胨或胰酪胨提供碳源、氮源、硫和小量的生长因子,磷酸氢二钾(K2HPO4)和磷酸二氢钾(KH2PO4)提供缓冲能力,氯化钠维持渗透压。
乳糖是最主要的碳源,几乎所有的大肠菌群计数方法都是基于乳糖发酵实验,乳糖发酵产气是一个主要的筛选条件。
所以在大肠菌群的检测培养基中,乳糖就是一个鉴别性成分。
月桂基硫酸钠具有选择性,能抑制除了大肠菌群以外的其他微生物。
煌绿乳糖胆盐肉汤(brllliant green lactose bile broth,BGLB)含有两种抑制剂,牛胆盐和煌绿染料,它们能抑制革兰氏阳性细菌和产芽孢细菌。
同时选择出革兰氏阴性细菌。
大肠菌群细菌不受这两种抑制剂的影响,能发酵乳糖并生长繁殖。
从产气可以确定发酵反应的进行。
使用MPN法的假设前提是细菌随机分布、细菌细胞单个分布(不成串)、有生长繁殖能力和细菌生长有合适环境。
相对于平板计数的优势,MPN法接种量大;能检测较少数量的污染;预制的液体培养基是凉的,比直接倒的热的液体培养基危险性小,对检测目标菌的伤害小;可以提前准备培养基。
MPN表中阳性管的设定不是连续的,因为有些组合在统计学上的概率非常小,几乎是不可能发生的。
如果结果出现了表中没有的组合.应该重新检测,因为很可能结果是错误的。
2)大肠菌群平板计数法检验结晶紫中性红胆盐琼脂(violet red bile agar,VRBA)含有蛋白胨提供碳源、氮源.酵母提取物提供B族维生素刺激细菌的生长。
胆盐和结晶紫抑制大多数革兰氏阳性细菌。
乳糖是碳源,中性红是pH指示剂。
(3)应注意的问题1)发酵管灭菌后,最好能在高压灭菌锅内,等待温度降至摩温,若发酵管还是热的就从高压灭菌锅内取出.在室温下降温.倒管顶部会出现小气泡.给检验时观察气体的产生造成困难。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
大肠菌群平板计数法
一、操作步骤
1.样品的稀释
2.选取2个~3个适宜的连续稀释度, 每个稀释度接种2个无菌平皿,每皿1 mL。
同时取1mL 生理盐水加入无菌平皿作空白对照。
3.及时将15 mL~20 mL冷至46 ℃的结晶紫中性红胆盐琼脂(VRBA)约倾注于每个平皿中。
小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3 mL~4 mLVRBA覆盖平板表层。
翻转平板,置于36 ℃±1 ℃培养18 h~24 h。
4.平板菌落数的选择
选取菌落数在15 CFU~150 CFU 之间的平板,分别计数平板上出现的典型和可疑大肠菌群菌落。
典型菌落为紫红色,菌落周围有红色的胆盐沉淀环,菌落直径为0.5 mm 或更大。
5.证实试验
从VRBA 平板上挑取10 个不同类型的典型和可疑菌落,分别移种于BGLB 肉汤管内,36 ℃±1 ℃培养24 h~48 h,观察产气情况。
凡BGLB 肉汤管产气,即可报告为大肠菌群阳性。
6.大肠菌群平板计数的报告
经最后证实为大肠菌群阳性的试管比例乘以8.3中计数的平板菌落数,再乘以稀释倍数,即为每g(mL)样品中大肠菌群数。
例:10-4样品稀释液1mL,在VRBA平板上有100个典型和可疑菌落,挑取其中10个接种BGLB肉汤管,证实有6个阳性管,则该样品的大肠菌群数为:
100×6/10×104/g(mL)=6.0×105CFU/g(mL)。
