热力学方程简单介绍补充
合集下载
物理化学 0304热力学基本方程

1G= 5G 0
Vdp
G
H2O(s) T=263.15K p=101.325kPa
1G
H2O(l) T=263.15K p(l)=611Pa
等温可逆
5G
H2O(s) T=263.15K p(s)=552Pa
1G V l p
Pa V l 611 101326
p2 G=nRT ln p1
4
例:已知263.15K时H2O(s)和H2O(l)的饱和蒸气压分别为
H2O(l) 不可逆相变 解: T2=263.15K sl H m ( 263K ) (1)G 0 P=101.325kPa sl S m ( 263K ) G (2)有两种解法: H 1 可逆 S 1
A G S T V T p
dA SdT pdV dG SdT Vdp dU TdS pdV dA SdT pdV dH TdS Vdp dG SdT Vdp
U A p V S V T
解一:
G H TS
H2O(l) T2=273.15K P=101.325kPa S ( 273 K ) l m
263 S ( 263K )=S ( 273K ) m[C p ,m ( s ) C p ,m ( l )]ln 273
H (263K ) H (273K ) nC p,m T
各状态函数之间的关系
pV pV G
H U A
TS TS
H=PV+U A=U-TS G=H-TS =U+PV-TS =A+PV
9
dS Q r / T dU Q W dU TdS pdV
写出四个热力学基本方程

写出四个热力学基本方程
1.热力学的四个基本公式:dU=TdS-PdV;dH=TdS+VdP;
dF=-SdT-PdV;dG=-SdT+VdP。
热力学是从宏观角度研究物质的热运动性质及其规律的学科。
属于物理学的分支,它与统计物理学分别构成了热学理论的宏观和微观两个方面。
热力学定律,是描述物理学中热学规律的定律,包括热力学第零定律、热力学第一定律、热力学第二定律和热力学第三定律。
其中热力学第零定律又称为热平衡定律,这是因为热力学第一、第二定律发现后才认识到这一规律的重要性;热力学第一定律是能量守恒与转换定律在热现象中的应用;热力学第二定律有多种表述,也叫熵增加原理。
热力学第一定律也就是能量守恒定律。
自从焦耳以无以辩驳的精确实验结果证明机械能、电能、内能之间的转化满足守恒关系之后,人们就认为能量守恒定律是自然界的一个普遍的基本规律。
热力学第二定律的每一种表述,都揭示了大量分子参与的宏观过程的方向性,使人们认识到自然界中进行的涉及热现象的宏观过程都具有方向性。
2.热力学第二定律的英文解释是熵是趋向于总体增大,比如
1L90度水(A)和1L10度水(B)融合,不会是A的温度增加而 B的温度减小,因为如此的话,总体的熵减小。
如果A 温度降但B温度升高一点,其总体的熵增加。
热力学第三
定律通常表述为绝对零度时,所有纯物质的完美晶体的熵值为零。
或者绝对零度(T=0K即-273.15℃)不可达到。
R.H.否勒和 E.A.古根海姆还提出热力学第三定律的另一种表述形式:任何系统都不能通过有限的步骤使自身温度降低到0K,称为0K不能达到原理。
物理化学热力学基本方程

利用全微分条件 ,将其作用于(5.1)、(5.2)、(5.4)和(5.6)式,得到(5.8)~(5.11)式所 给八个热力学偏导数的关系:
如果有全微分 df adx ( T , p ) bdy / 则 S (a / y ) x (b / x ) y 必有
( T / V ) S ( p / S )V (V / S ) p ( p / T )V ( S / V ) T (V / T ) p ( S / p )T
p S T V V T
S V p T T p
G H TS
dG SdT V dp
V (G / p )T
当系统处于平衡态时,不仅描述该系统整体性质的宏观量不再随时 间改变,而且这些宏观量之间还存在着函数关系。只有少数几个是 独立态参量,其余宏观量则是态参量的函数。对于给定的系统,其 态参量的数目是确定的,但选哪几个宏观量作为态参量则是任意的。
我们可以将(5.1)式看成以S和V为独立变量表示的全微分dU ,U=U(S,V), 于是写为
dU ( U / S ) V dS ( U / V ) S dV
可以与(5.1)式比较,得到两个偏导数:
T ( U / S )V
p (U / V ) S
(5.8)
H U p V U (U / V ) S V F U T S U ( U / S )V S G U pV TS
U ( U / V ) S V ( U / S )V S
这说明,只要已知以S,V为独立态参量时内能U的表达式U=U(S,V), 就可以求得T,状态方程,p,H,F,G乃至系统的全部热力学量。所 以内能U是以S、V为独立态参量的特性函数。同样可以证明焓H,自由 能F和自由焓G分别是以(S,p),(T,V)和(T,p) 为独立态参量的特性函数。
热力学方程

;或根据已知的蒸 气压方程对比1/T项的系数
§3.10 吉布斯-亥姆霍兹方程和麦 克斯韦关系式
• 10.1 吉布斯-亥姆霍兹方程
从热力学基本方程可以导出下面关系式:
( A / T )
T
V
U T2
§3.9 克拉佩龙方程
• 9.2 固-液平衡、固-固平衡积分式
★凝聚相之间的两相平衡的定性讨论
Vm很小
熔化平衡:fusHm很大,dT/dp很小,外压对熔点的影响很小 晶型转变平衡:trsHm较小,因而dT/dp比熔化平衡大
★定量计算的相关近似处理
以熔化平衡为例
dT dp
T Vm Hm
ⅰ凝聚相与蒸气相之间的两相平衡 ⅱ凝聚相的体积忽略不计 ⅲ蒸气看成理想气体 ⅳ积分时将摩尔相变焓看成常数
★微分形式
d ln p vap Hm
dT
RT 2
★定积分形式
计算题型:
ln
p2 p1
vap Hm R
1
T1
1 T2
五个物理量 已知任意四 个求第五个
★不定积分形式
ln p vap Hm 1 C RT
fusVm , fusHm不变 ln T2 T1
V fus m fus H m
( p2
p1 )
ln(1T /T1)T /T1 T
T1
V fus m fus Hm
p
问:滑冰运动员冰鞋下冰的熔点怎样变化?
§3.9 克拉佩龙方程
• 9.3 克劳修斯-克拉佩龙方程
x
z y
x
9热力学基本方程

推导热力学函数间关系时,也常用到麦克斯韦关系式
麦克斯韦关系式中不含:
S T
p
和
S
T
V
问题 S ?
T p
S ? T V
解:dH= TdS+Vdp
定压下,除以dT
H T S T p T p
得 S Cp
T p T
而
Cp
H T
p
同理可得:
G
G3
nRTln
p2 p1
28.314 373 .15 ln 50
101 .325
J 4.38
kJ 0
GT,p 4.38 kJ 0
由吉布斯函数判据可知,过程自发进行。
A G ( pV ) G nRT 4.38 kJ 28.314373103 kJ 10.58 kJ
1.15 热力学函数的基本关系式
定量,定组成的单相系统; 纯物质是定组成的一种特例 保持相平衡及化学平衡的系统
热力学基本方程的应用:
计算纯物质 p、V、T 变化过程的ΔA、ΔG
dA=-SdT- pdV dG=-SdT+Vdp
AT
V2 V1
pdV
GT
p2 Vdp
p1
2. 麦克斯韦关系式
表明S、T、p、V 间的关系式
S p V T T V
p T S V V S
V S
p
T p
S
S p V T T V
S p
T
V T
p
几点结论:
麦克斯韦关系式表示:系统在同一状态的两种变 化率数值相等
S p V T T V
S p
T
V T
p
该式提供了可由实验直接测定的量,替代不能直接 测定的量
3.7 热力学基本方程及Maxwell关系式

恒T、p、W= 0: G 0
自发 平衡
dGm α dGm β Sm α dT Vm α dp Sm β dT
Vm β dp
[Sm β Sm α ]dT [Vm β Vm α ]dp
dp Sm β Sm α
βαSm
dT Vm β Vm α
βαVm
又因 βαSm
βαHm T
dp dT
βαH m T βαVm
U
SV
H
A
pT
G
说明: 1. 等式右边只有四个物理量T,S, p,V
2. 十字交叉法:
对U来说,S,V分别表示dS和dV; dS对角线 对应T,dV对角线对应p;箭头方向表示正负,指向 为负,则为TdS和 –pdV
2. U、H、A、G的一阶偏导数关系式
U f (S,V ) H f (S, p) A f (T ,V ) G f (T , p)
p
S V
T
p T
V
V T
p
S p
T
T V
S
p S
V
T p
S
V S
p
S V
T
p T
V
V T
p
S p
T
说明:
1. 关系式中只有四个物理量T, S, p,V
2. 对角线乘积为 TS 与 pV
3. 等式两边的分母与下标互换
4. S和V为广度量,而T和p为强 度量。同种性质的状态函数 的分式,不取负号。
分析:利用克拉佩龙方程 dT T βαVm
dp 解:由克拉佩龙方程有 dT
T
βαH m
lsVm lsH m
dp
积分,得 lnT2
T1
热力学方程

T2
dQm C m dT
Q C m dT C ( m T2 T1 )
T1
二、理想气体的摩尔热容量
1、理想气体的定体摩尔热容量
dQ dE pdV
CV,m
(dQm) dE i V R dT dT 2 i R 2
CV,m
i 理想气体 dE RdT 2 3 单原子理想气体 CV ,m R 2 双原子理想气体 CV ,m 5 R 2 多原子理想气体 CV ,m 3 R
4)系统内能改变的两种方式 10、做功可以改变系统的状态 摩擦升温(机械功)、电加热(电功) 功是过程量 20、热量传递可以改变系统的内能
热量是过程量
内能是状态量。
使系统的状态改变,传热和作功是等效的。 作功是系统内能与外界其它形式能量转换的量度。
热量是系统与外界能量转换的量度。
准静态过程
当热力学系统在外界影响下,从一个状态到另一 个状态的变化过程,称为热力学过程,简称过程。 热力学过程 准静态过程
QV M
等体过程中
摩尔气体吸热为:
CV , m T
理想气体的内能另一种表述:E
M
CV , mT
2、理想气体的定压摩尔热容量
dQ dE pdV
M
M i2 mol: Qp C p ,m T RT 2 M
Q E W
Q E W 热力学第一定律的普遍形式
dQ dE dW 无限小过程
规定 Q>0,系统吸收热量;Q<0,系统放出热量; W>0, 系统对外作功;W<0,外界对系统作功;
E>0,系统内能增加,E<0,系统内能减少。
Q E W
dQm C m dT
Q C m dT C ( m T2 T1 )
T1
二、理想气体的摩尔热容量
1、理想气体的定体摩尔热容量
dQ dE pdV
CV,m
(dQm) dE i V R dT dT 2 i R 2
CV,m
i 理想气体 dE RdT 2 3 单原子理想气体 CV ,m R 2 双原子理想气体 CV ,m 5 R 2 多原子理想气体 CV ,m 3 R
4)系统内能改变的两种方式 10、做功可以改变系统的状态 摩擦升温(机械功)、电加热(电功) 功是过程量 20、热量传递可以改变系统的内能
热量是过程量
内能是状态量。
使系统的状态改变,传热和作功是等效的。 作功是系统内能与外界其它形式能量转换的量度。
热量是系统与外界能量转换的量度。
准静态过程
当热力学系统在外界影响下,从一个状态到另一 个状态的变化过程,称为热力学过程,简称过程。 热力学过程 准静态过程
QV M
等体过程中
摩尔气体吸热为:
CV , m T
理想气体的内能另一种表述:E
M
CV , mT
2、理想气体的定压摩尔热容量
dQ dE pdV
M
M i2 mol: Qp C p ,m T RT 2 M
Q E W
Q E W 热力学第一定律的普遍形式
dQ dE dW 无限小过程
规定 Q>0,系统吸收热量;Q<0,系统放出热量; W>0, 系统对外作功;W<0,外界对系统作功;
E>0,系统内能增加,E<0,系统内能减少。
Q E W
热力学方程
克斯韦关系式
❖10.2 麦克斯韦关系式
将上述导出结果用于热力学基本方程:
dU
TdS
pdV
T V
S
p S
V
dH
TdS
Vdp
T p
S
V S
p
dA
SdT
pdV
S V
T
பைடு நூலகம்
p T
V
dG
SdT
Vdp
S p
T
V T
p
这四个关系式统称 麦克斯韦关系式, 它们的重要意义在 于把不可直接测定 的量转化为可直接
测定量
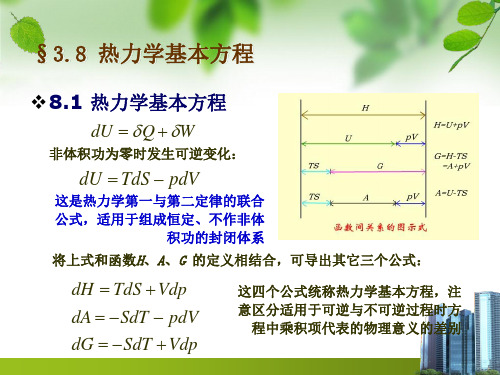
§3.8 热力学基本方程
❖8.1 热力学基本方程
dU Q W
非体积功为零时发生可逆变化:
dU TdS pdV
这是热力学第一与第二定律的联合 公式,适用于组成恒定、不作非体
积功的封闭体系
将上式和函数H、A、G 的定义相结合,可导出其它三个公式:
dH TdS Vdp dA SdT pdV dG SdT Vdp
这四个公式统称热力学基本方程,注 意区分适用于可逆与不可逆过程时方
程中乘积项代表的物理意义的差别
§3.8 热力学基本方程
❖8.2 热力学基本方程的应用
计算纯物质pVT变化过程的ΔA及ΔG
dA SdT pdV
dG SdT Vdp
★理想气体:
AT
nRT
ln V2 V1
GT
nRT
ln
p2 p1
dAT pdV dGT Vdp
★凝聚系统:
AT
V2 V1
pdV
0
GT
p2 Vdp V p
p1
§3.9 克拉佩龙方程
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(四)混合物逸度的计算
1. 计算方法 混合物逸度由于将混合物看作是一个整体,因而它的
逸度计算方法同纯物质逸度计算,原则上是相同的。
主要就是由PVT数据图解积分
数模:
ln
1
p
(
RT
-
V)dp
RT 0 p
p
ln
0
Z -1 dp
p
(恒T,x) (恒T,x)
三、非理想溶液
不符合理想溶液其中任一个热力学性质的溶液,就称 为非理想溶液。 (一)活度和活度系数
在决定活度系数与组成关联式时,必须要满足以下条 件:
如果选纯组分在体系的温度、压力下的状态作为标准 态,则当xi→1时,γi→1。
几个具有代表性的常用方程
1. wohl 型方程简化为以下方程(适用正规溶液): (1) Margules 方程
lnγ1=x22[A+2x1(B -A)] lnγ2=x12[B+2x2(A -B)]
普维法 当对比体积Vr≥2时,用这种方法。普维法 的基本方程就是两项维里方程。
Zi
1
Bi p RT
Zi
-1
Bi p RT
将此式代入式逸度系数计算式中,得:
lni
p 0
Bi p RT
dp p
p 0
Bi dp RT
(恒T)
∵ Bi对特定物质,仅是温度的函数
∴
ln i
Bi p RT
(恒T)
关键是求出维里系数Bi
上式写成: 亦即:
ln
f
L i
V均
p - pS
f
S i
RT
fiL
iS
piSexp
V均 RT
p - pSi
(三)混合物中组分i的逸度的计算
由前知:
ln i
1 RT
p
(
RT
0p
_
- V)dp
p
ln i
0
—
Zi
-
1
dp
p
(恒T,x) ( 恒 T,x )
➢这两个式子是计算混合物中组分i的逸度和逸度系数的 基本关系式。可以通过维里方程推导计算。(略) ➢计算混合物中组分i的逸度主要是指气体混合物 ➢对于液体混合物,一般情况下是计算活度,活度的概念
以分子①为中心 出现分子①的几率x11 出现分子②的几率x21
x11+x21=1
以分子②为中心 出现分子①的几率x12 出现分子②的几率x22
x12+x22=1
局部摩尔分数和总的摩尔分数不同是由于分子之间的作用力不同 所引起的。
g12=g21 而 g11≠g22 Wilson常数
① 将xij与xi和gij相关联
由四大微分式之一知 dGi=Vidp
(恒T)
由逸度定义
dGi=RTdlnfi (恒T)
∴RTdlnfi=Vidp (恒T)
或
lnf i
p
T
Vi RT
基础式
2.逸度系数计算式:
i
fi p
两边取对数,然后带入上面的式子中积分得:
p
lni
0
Zi
-1
dp p
Zi-------压缩因子
同理
组分i
混合物
p
ln i
0
—
Zi
-
1
dp
p
ln i
1 RT
p
(
RT
0p
_
- V)dp
(恒T,x) (恒T,x)
p
ln
0
Z -1 dp
p
ln
1
p
(
RT
-
V)dp
RT 0 p
3. 普遍化关系式法
两种:即普维法和普压法。一般普维法用 于低压体系,且采用公式计算;普压法一 般用于高压体系,通过查图获取。
x 21 x 2 x11 x1
x12 x1 x 22 x 2
校正后
x21 x2 exp( g21 / RT ) x11 x1 exp( g11 / RT )
x12 x1 exp( g12 / RT ) x22 x2 exp( g22 / RT )
令
12
V2L V1L
exp[(g21
g11) /
(5)
Lim p0
f p
1
(6)
2. 逸度系数定义式 对应于逸度,逸度系数也有三种:
纯组分i
i
fi p
fi ip
^
组分i
i
fi xip
^
^
fi xii p
混合物
f f p
p
3.逸度的物理意义
逸度的物理意义主要表现在: (1) 逸度是有效的压力;
(2)逸度是自由焓与可测的物理量之间的辅助函
基本式:dGi=RTdlnfi
(恒T)
从饱和蒸汽状态积分到饱和液体状态
G
L i
fiL
dGi RT dlnfi
G
V i
f
V i
G
L i
-
G
V i
RTln
f
L i
f
V i
在恒T、P下,汽液平衡时,GIV=GIL ∴GIV-GIL=0
RTln
f
L i
0
f
L i
1
f
V i
f
V i
亦即
fiL= fiV= fiS
i 1
i 1
正偏差 负偏差
(二) 活度系数与组成的关系
活度,需要知道活度系数γi;
➢活度系数γi一般是要据关系式求得;
➢γi与xi之间的关系,严格说来,是服从吉布斯—杜核
姆方程的;但吉布斯—杜核姆方程单独使用不能解决目
前的问题,一般用经验、半经验方程。
(三)活度系数的近似关联式
适用于分子结构相似的体系
(2) Van laar 方程
ln
1
1
A
Ax 1 Bx 2
2
ln 2
1
B
Bx 2 Ax 1
2
适用于分子结构差异较大的体系
方程中常数A、B的求法:必须借助于实验数据进行求取.
由无限稀释活度系数求A、B值
当x1→0 (x2→1.0)时
lim
1
ln
1
A
x10
lim
推算,且准确度高(比Van lear和Margules Eq相比) ②Wilson参数能够反映与T的关系,且具有半理论的
物理意义。 ③仅有二元参数可推算VLE中的ri。这个特点尤其显
著。 缺点:当lnri~xi曲线有极值时,不能用;
对部分互溶体系不能用。
若分子1—1和2—2间的吸引力大于1—2间的吸引 力,那么在分子1的周围应该有更多的分子1所包 围,在分子2的周围也应该有较多的分子2所包围
若分子1—2间的吸引力大于分子1—1和2—2间的 吸引力,那么在分子1的周围就就会有较多的分子 2所包围,在分子2周围有较多的分子1所包围。
对于二元体系,应具有四个局部摩尔分率
] 21
x2 x121
注意点: ①Wilson常数 对于二元溶液 g12—g22 ,g21—g11 可近似地视为常数,Wilson常数可为正也可为负值。
②Wilson参数λij,受温度的影响且为正值,负值无意 义。
Wilson Eq的特点:
优点:Wilson Eq的特点: ①Wilson Eq仅含有两个参数,故最少有一组数据可以
数。
4.注意事项
▪① 逸度和逸度系数都是强度性质的热力学函数
纯组分
fi=f(T,p)
混合物中组分i 混合物
^
f i f(T,p, xi )
f=f(T,p,x)
② 逸度的单位与压力相同,逸度系数无因次;
③ 理想气体的逸度等于p,逸度系数等于1.
二. 逸度系数的计算
(一)计算逸度的关系式
1. 基础式
Wilson Eq主要三点: ➢由于分子间作用力不同提出了局部组成的概念; ➢利用Boltzmann因子引入描述不同分子间的作用能, 将微观与宏观联系起来;
➢把局部组成概念引入Flory—Huggins提出的无热溶液, 用微观组成代替宏观组成.
局部组成的概念
局部组成的中心意思是: 当以微观观察时,液体混合物不是均匀的。也就是在 混合物中,某一点的组成与另一点的组成未必相同。
RT]
Wilson参数是T的函数
21
V1l V2l
exp[(g12
g22 ) /
RT]
∵ g12=g21
∴
ij
V
l j
Vil
exp[(gij
gii) /
RT ]
ln
r1
ln(
x1
x212
)
x2[
12 x1 x212
x2
21 x121
]
ln r2
ln( x2
x121)
x [ 12 1 x1x212
Bipc B0 B1
RTc
Bi
RTc pc
B0 B1
lni
Bi p RTc (B0 B1 ) p pr
RT Pc
RT Tr
B0 B1
普维法计算物质逸度的计算式
B0 0.083 0.422 Tr1.6
B1 0.139 0.172 T r 4.2
ω为偏心因子,偏心因子是反映物质分子形状、极性
的偏差,而这种偏差程度常用活度系数来衡量,即:
i
ai xi
fi
x
i
f
o i
fi
id
fi
