热力学基本方程与t-s
化工热力学马沛生第一版第三章习题答案

习题3-1. 单组元流体的热力学基本关系式有哪些? 答:单组元流体的热力学关系包括以下几种:(1)热力学基本方程:它们适用于封闭系统,它们可以用于单相或多相系统。
V p S T U d d d -= p V S T H d d d += T S V p A d d d --= T S p V G d d d -=(2)Helmholtz 方程,即能量的导数式pV S H S U T ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂= T S V A V U p ⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂=- TS p G p H V ⎪⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂= p V T G T A S ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂=- (3)麦克斯韦(Maxwell )关系式 V S S p V T ⎪⎭⎫⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂ p S S V p T ⎪⎭⎫ ⎝⎛∂∂=⎪⎪⎭⎫ ⎝⎛∂∂ TV V S T p ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂ Tp p S T V ⎪⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂ 3-2. 本章讨论了温度、压力对H 、S 的影响,为什么没有讨论对U 的影响?答:本章详细讨论了温度、压力对H 、S 的影响,由于pV H U -=,在上一章已经讨论了流体的pVT 关系,根据这两部分的内容,温度、压力对U 的影响便可以方便地解决。
3-3. 如何理解剩余性质?为什么要提出这个概念?答:所谓剩余性质,是气体在真实状态下的热力学性质与在同一温度、压力下当气体处于理想气体状态下热力学性质之间的差额,即:),(),(p T M p T M M ig R -=M 与M i g 分别表示同温同压下真实流体与理想气体的广度热力学性质的摩尔量,如V 、U 、H 、S 和G 等。
需要注意的是剩余性质是一个假想的概念,用这个概念可以表示出真实状态与假想的理想气体状态之间热力学性质的差额,从而可以方便地算出真实状态下气体的热力学性质。
物理化学热力学基本方程

利用全微分条件 ,将其作用于(5.1)、(5.2)、(5.4)和(5.6)式,得到(5.8)~(5.11)式所 给八个热力学偏导数的关系:
如果有全微分 df adx ( T , p ) bdy / 则 S (a / y ) x (b / x ) y 必有
( T / V ) S ( p / S )V (V / S ) p ( p / T )V ( S / V ) T (V / T ) p ( S / p )T
p S T V V T
S V p T T p
G H TS
dG SdT V dp
V (G / p )T
当系统处于平衡态时,不仅描述该系统整体性质的宏观量不再随时 间改变,而且这些宏观量之间还存在着函数关系。只有少数几个是 独立态参量,其余宏观量则是态参量的函数。对于给定的系统,其 态参量的数目是确定的,但选哪几个宏观量作为态参量则是任意的。
我们可以将(5.1)式看成以S和V为独立变量表示的全微分dU ,U=U(S,V), 于是写为
dU ( U / S ) V dS ( U / V ) S dV
可以与(5.1)式比较,得到两个偏导数:
T ( U / S )V
p (U / V ) S
(5.8)
H U p V U (U / V ) S V F U T S U ( U / S )V S G U pV TS
U ( U / V ) S V ( U / S )V S
这说明,只要已知以S,V为独立态参量时内能U的表达式U=U(S,V), 就可以求得T,状态方程,p,H,F,G乃至系统的全部热力学量。所 以内能U是以S、V为独立态参量的特性函数。同样可以证明焓H,自由 能F和自由焓G分别是以(S,p),(T,V)和(T,p) 为独立态参量的特性函数。
热力学第二定律(4)
dH TdS Vdp
(3) dA SdT pdV (4)
A(T ,V )
G(T , p)
dG SdT Vdp
适用条件:(1)无相变化和化学变化(恒定组成)的均 相封闭系统发生单纯pVT变化的可逆或不可逆过程(2) 对于化学反应和相变化只适用于非体积功为零的可逆过程 即非体积功为零的恒定组成的封闭系统
解:对理想气体,
pV nRT
p nRT /V
p nR ( )V T V
p nR U ( )T T ( )V p T p 0 V T V
所以,理想气体的热力学能只是温度的函数。
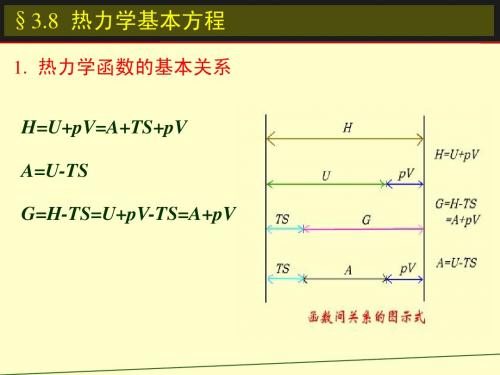
§3.8 热力学基本方程
8、偏微分运算规则: z f ( x, y ) 循环关系式:
=
2U U V S SV V S T V S
S一定时对V 微分 U T ; S V
§3.8 热力学基本方程 (1) dU TdS pdV
§3.8 热力学基本方程 3、热力学方程的简单应用
例:试证明理想气体恒温过程ΔA=ΔG
dT 0 dA pdV A
V2 V1
dT 0 dG Vdp G Vdp nRT ln
p1 p2
V1 pdV nRT ln V2
p2 V nRT ln 1 p1 V2
H G / T 2 T T p
积分:
G2
G1
T2 G H d( ) 2 dT T1 T T
T2 H G2 G1 dT 2 T1 T T2 T1
§3.8 热力学基本方程
热力学第二定律 概念及公式总结

热力学第二定律一、 自发反应-不可逆性(自发反应乃是热力学的不可逆过程)一个自发反应发生之后,不可能使系统和环境都恢复到原来的状态而不留下任何影响,也就是说自发反应是有方向性的,是不可逆的。
二、 热力学第二定律1. 热力学的两种说法:Clausius:不可能把热从低温物体传到高温物体,而不引起其它变化Kelvin :不可能从单一热源取出热使之完全变为功,而不发生其他的变化2. 文字表述: 第二类永动机是不可能造成的(单一热源吸热,并将所吸收的热完全转化为功)功 热 【功完全转化为热,热不完全转化为功】(无条件,无痕迹,不引起环境的改变) 可逆性:系统和环境同时复原3. 自发过程:(无需依靠消耗环境的作用就能自动进行的过程)特征:(1)自发过程单方面趋于平衡;(2)均不可逆性;(3)对环境做功,可从自发过程获得可用功三、 卡诺定理(在相同高温热源和低温热源之间工作的热机)ηη≤ηη (不可逆热机的效率小于可逆热机)所有工作于同温热源与同温冷源之间的可逆机,其热机效率都相同,且与工作物质无关四、 熵的概念1. 在卡诺循环中,得到热效应与温度的商值加和等于零:ηηηη+ηηηη=η 任意可逆过程的热温商的值决定于始终状态,而与可逆途径无关热温商具有状态函数的性质 :周而复始 数值还原从物理学概念,对任意一个循环过程,若一个物理量的改变值的总和为0,则该物理量为状态函数2. 热温商:热量与温度的商3. 熵:热力学状态函数 熵的变化值可用可逆过程的热温商值来衡量ηη :起始的商 ηη :终态的熵 ηη=(ηηη)η(数值上相等) 4. 熵的性质:(1)熵是状态函数,是体系自身的性质 是系统的状态函数,是容量性质(2)熵是一个广度性质的函数,总的熵的变化量等于各部分熵的变化量之和(3)只有可逆过程的热温商之和等于熵变(4)可逆过程热温商不是熵,只是过程中熵函数变化值的度量(5)可用克劳修斯不等式来判别过程的可逆性(6)在绝热过程中,若过程是可逆的,则系统的熵不变(7)在任何一个隔离系统中,若进行了不可逆过程,系统的熵就要增大,所以在隔离系统中,一切能自动进行的过程都引起熵的增大。
热力学方程

;或根据已知的蒸 气压方程对比1/T项的系数
§3.10 吉布斯-亥姆霍兹方程和麦 克斯韦关系式
• 10.1 吉布斯-亥姆霍兹方程
从热力学基本方程可以导出下面关系式:
( A / T )
T
V
U T2
§3.9 克拉佩龙方程
• 9.2 固-液平衡、固-固平衡积分式
★凝聚相之间的两相平衡的定性讨论
Vm很小
熔化平衡:fusHm很大,dT/dp很小,外压对熔点的影响很小 晶型转变平衡:trsHm较小,因而dT/dp比熔化平衡大
★定量计算的相关近似处理
以熔化平衡为例
dT dp
T Vm Hm
ⅰ凝聚相与蒸气相之间的两相平衡 ⅱ凝聚相的体积忽略不计 ⅲ蒸气看成理想气体 ⅳ积分时将摩尔相变焓看成常数
★微分形式
d ln p vap Hm
dT
RT 2
★定积分形式
计算题型:
ln
p2 p1
vap Hm R
1
T1
1 T2
五个物理量 已知任意四 个求第五个
★不定积分形式
ln p vap Hm 1 C RT
fusVm , fusHm不变 ln T2 T1
V fus m fus H m
( p2
p1 )
ln(1T /T1)T /T1 T
T1
V fus m fus Hm
p
问:滑冰运动员冰鞋下冰的熔点怎样变化?
§3.9 克拉佩龙方程
• 9.3 克劳修斯-克拉佩龙方程
x
z y
x
9热力学基本方程

推导热力学函数间关系时,也常用到麦克斯韦关系式
麦克斯韦关系式中不含:
S T
p
和
S
T
V
问题 S ?
T p
S ? T V
解:dH= TdS+Vdp
定压下,除以dT
H T S T p T p
得 S Cp
T p T
而
Cp
H T
p
同理可得:
G
G3
nRTln
p2 p1
28.314 373 .15 ln 50
101 .325
J 4.38
kJ 0
GT,p 4.38 kJ 0
由吉布斯函数判据可知,过程自发进行。
A G ( pV ) G nRT 4.38 kJ 28.314373103 kJ 10.58 kJ
1.15 热力学函数的基本关系式
定量,定组成的单相系统; 纯物质是定组成的一种特例 保持相平衡及化学平衡的系统
热力学基本方程的应用:
计算纯物质 p、V、T 变化过程的ΔA、ΔG
dA=-SdT- pdV dG=-SdT+Vdp
AT
V2 V1
pdV
GT
p2 Vdp
p1
2. 麦克斯韦关系式
表明S、T、p、V 间的关系式
S p V T T V
p T S V V S
V S
p
T p
S
S p V T T V
S p
T
V T
p
几点结论:
麦克斯韦关系式表示:系统在同一状态的两种变 化率数值相等
S p V T T V
S p
T
V T
p
该式提供了可由实验直接测定的量,替代不能直接 测定的量
3.7 热力学基本方程及Maxwell关系式

恒T、p、W= 0: G 0
自发 平衡
dGm α dGm β Sm α dT Vm α dp Sm β dT
Vm β dp
[Sm β Sm α ]dT [Vm β Vm α ]dp
dp Sm β Sm α
βαSm
dT Vm β Vm α
βαVm
又因 βαSm
βαHm T
dp dT
βαH m T βαVm
U
SV
H
A
pT
G
说明: 1. 等式右边只有四个物理量T,S, p,V
2. 十字交叉法:
对U来说,S,V分别表示dS和dV; dS对角线 对应T,dV对角线对应p;箭头方向表示正负,指向 为负,则为TdS和 –pdV
2. U、H、A、G的一阶偏导数关系式
U f (S,V ) H f (S, p) A f (T ,V ) G f (T , p)
p
S V
T
p T
V
V T
p
S p
T
T V
S
p S
V
T p
S
V S
p
S V
T
p T
V
V T
p
S p
T
说明:
1. 关系式中只有四个物理量T, S, p,V
2. 对角线乘积为 TS 与 pV
3. 等式两边的分母与下标互换
4. S和V为广度量,而T和p为强 度量。同种性质的状态函数 的分式,不取负号。
分析:利用克拉佩龙方程 dT T βαVm
dp 解:由克拉佩龙方程有 dT
T
βαH m
lsVm lsH m
dp
积分,得 lnT2
T1
化工热力学课后部分习题答案

2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,c s s r p p p =对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的s r p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。
由纯物质的p –V 图上的饱和蒸气和饱和液体曲线可知。
2-5.同一温度下,纯物质的饱和液体与饱和蒸气的热力学性质均不同吗?答:同一温度下,纯物质的饱和液体与饱和蒸气的Gibbs 自由能是相同的,这是纯物质气液平衡准则。
气他的热力学性质均不同。
3-1 思考下列说法是否正确① 当系统压力趋于零时,()()0,,≡-p T Mp T M ig(M 为广延热力学性质)。
(F ) ② 理想气体的H 、S 、G 仅是温度的函数。
(F ) ③ 若()⎪⎪⎭⎫⎝⎛+-=00ln p p R S S A ig,则A 的值与参考态压力0p 无关。
(T ) ④ 对于任何均相物质,焓与热力学能的关系都符合H >U 。
(T ) ⑤ 对于一定量的水,压力越高,蒸发所吸收的热量就越少。
(T ) 3-2 推导下列关系式:V T T p V S ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂ p T p T V U VT -⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂()2RT H T RT G p ∆∆-=⎥⎦⎤⎢⎣⎡∂∂ ()RTV p RT G T ∆∆=⎥⎦⎤⎢⎣⎡∂∂ 证明:(1)根据热力学基本方程 V p T S A d d d --= (a)因为A 是状态函数,所以有全微分:V V A T T A A TV d d d ⎪⎭⎫⎝⎛∂∂+⎪⎭⎫⎝⎛∂∂= (b) 比较(a)和(b)得: p V A S T A TV -=⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫⎝⎛∂∂, 由全微分性质得:V V T T p T T p p A T T A p V S ⎪⎭⎫ ⎝⎛∂∂-=⎥⎦⎤⎢⎣⎡⎪⎪⎭⎫ ⎝⎛∂∂∂∂=⎥⎦⎤⎢⎣⎡⎪⎭⎫ ⎝⎛∂∂∂∂=⎪⎭⎫ ⎝⎛∂∂-即 VT T p V S ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂(2)由热力学基本方程 V p S T U d d d -= 将上式两边在恒定的温度T 下同除以的d V 得:p V S T V U TT -⎪⎭⎫⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∂由(1)已经证明VT T p V S ⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂ 则 p T p T V U VT -⎪⎭⎫⎝⎛∂∂=⎪⎭⎫⎝⎛∂∂(3)由热力学基本方程 p V T S G d d d +-= 当压力恒定时 SdT dG -=由Gibbs 自由能定义式得 S T H G ∆∆∆-=()()()222T H T S T H S T T GT GTT T G p∆∆∆∆∆∆∆-=---⋅=-∂∂=⎥⎦⎤⎢⎣⎡∂∂等式两边同乘以R 得()2RT H T RT G p∆∆-=⎥⎦⎤⎢⎣⎡∂∂(4)当温度恒定时Vdp dG =()T V p T G T ∆∆=⎥⎦⎤⎢⎣⎡∂∂ 所以 ()RTVp RT G T ∆∆=⎥⎦⎤⎢⎣⎡∂∂ 3-4 计算氯气从状态1(300K 、1.013×105Pa )到状态2( 500K 、1.013×107Pa )变化过程的摩尔焓变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
的热量。p-V 图只能显示所作的功。
(2)既可用于等温过程,也可用于变温过程来计算 系统可逆过程的热效应;而根据热容计算热效应
不适用于等温过程。
QR TdS Q C dT (可用于任何可逆过程) (不能用于等温过程)
§3.7 熵变的计算
等温过程中熵的变化值 非等温过程中熵的变化值
T-S图 及其应用
图中ABCDA表示任一 可逆循环。 ABC是吸热过程,所吸 之热等于ABC曲线下的面积 CDA是放热过程,所放之 热等于CDA曲线下的面积 热机所作的功W为闭合 曲线ABCDA所围的面积。
ABCDA的面积 循环热机的效率 ABC曲线下的面积
T-S图 及其应用
图中ABCD表示任一 循环过程。 ABCD的面积表示循环 所吸的热和所做的功 EG线是高温(T1)等温线 LH是低温( T2)等温线
p S = V U T
或
T-S图 及其应用
什么是T-S图? 以T为纵坐标、S为横坐标所作的表示热力学过 程的图称为T-S图,或称为温-熵图。 根据热力学第二定律
QR dS T
QR TdS
系统从状态A到状态B, 在T-S图上曲线AB下的面积 就等于系统在该过程中的热 效应。
等温过程中熵的变化值
(1)理想气体等温可逆变化 QR Wmax U 0
V2 p1 Wmax nRT ln nRT ln V1 p2 Wmax QR S T T p1 V2 nR ln nR ln p2 V1
对于不可逆过程,应设计始终态相同的可逆 过程来计算熵的变化值。
T
T1
E
B
D
G C H
A
L
T2
0
M
N
S
(c)
EGHL代表Carnot 循环
GN和EM是绝热可逆过程的等熵线 ABCD代表任意循环 任意循环的热机效率不可能大于EGHL所代 表的Carnot热机的效率
T-S图 及其应用
T
T1
E
B
D
G C H
A
L
T2
0
M
N
S
(c)
T-S 图的优点:
(1)既显示系统所作的功,又显示系统所吸取或释放
热力学基本方程与T-S图
熵是热力学能和体积的函数,即
S S (U ,V )
S S dS dU dV U V V U 热力学基本方程可表示为
1 p dS dU dV T T
所以有
1 V S p T V U
