细胞成像分析系统
细胞分析系统技术参数

细胞分析系统技术参数细胞分析系统(Cell analysis system)是一种高级的实验室仪器,用于研究和分析细胞的生物学特性和功能。
这些系统通常结合了自动化、图像分析和荧光检测等功能,可以提供高通量的细胞分析和高分辨率的细胞成像。
以下是一些常见的细胞分析系统的技术参数。
1.自动化功能:细胞分析系统通常具有自动化的样本处理功能,可以自动加载和处理多个样本,大大提高了实验的通量和效率。
自动化功能还可以包括点样、染色和洗涤等操作。
2.分辨率:细胞分析系统通常具有高分辨率的成像功能,能够捕捉到细胞中微小的结构和细节。
分辨率的大小通常以像素为单位来表示,较高的分辨率意味着更清晰的图像。
3.荧光检测:细胞分析系统通常配备了多通道的荧光检测模块,可以同时检测多个荧光标记的细胞成分或分子。
荧光检测模块还应具有较宽的波长选择范围,以适应各种不同的荧光染料。
4.成像速度:细胞分析系统的成像速度是一个重要的参数,尤其对于需要处理大量样本的高通量实验来说。
较快的成像速度可以显著提高实验的效率。
5.数据分析软件:细胞分析系统通常配备了专业的数据分析软件,用于从成像和荧光检测结果中提取和分析细胞相关的信息。
数据分析软件通常具有图像处理、细胞计数、细胞分类和细胞追踪等功能。
6.样本容量:细胞分析系统可以处理的样本容量也是一个重要的参数。
一些系统可以同时处理多个样本,而另一些系统可能需要逐个处理样本。
7.显微镜模块:细胞分析系统通常配备了显微镜模块,用于观察和成像细胞。
显微镜模块应具有高质量的镜头和调焦系统,以获得清晰的图像。
8.细胞培养环境:细胞分析系统通常需要提供适合细胞生长和实验的培养环境,如恒温、湿度控制和二氧化碳供应等。
9.多模式分析:一些高级的细胞分析系统还具有多种不同的分析模式,如活细胞成像、细胞迁移分析、细胞周期分析等。
这些不同的分析模式可以帮助科研人员更全面地了解和研究细胞的功能和行为。
10.操作简便性:细胞分析系统应具有简单易用的界面和操作方式,以方便科研人员进行实验和数据分析。
全自动活细胞影像分析测定系统 (IN Cell Analyzer)

全自動活細胞影像分析測定系統 (IN Cell Analyzer)細胞水平功能測定及高內涵藥物篩選1. 緣由基於基因組學及蛋白質組學的發展及藥物篩選的需要,近一年來高內涵細胞及亞細胞水平的分析技術(High Content Screen, or HCS)發展神速。
大量的未知功能的基因及蛋白質的出現急需能有快速,定量定性的功能測定的技術,並且從DNA及蛋白質分子的研究轉入細胞中基因及蛋白質的功能研究。
藥物開發中也急需細胞水平的篩選來得到更多信息從而加快及降低藥物開發的成本。
全自動活細胞影像分析系統就是這一技術的代表。
從基因組及蛋白質組的研究將得到一系列與疾病有關的特定基因或蛋白,利用全自動活細胞影像分析測定系統,可快速定量的觀察到它們在細胞內的功能及作用機制,從而為疾病的產生,預防及治療提供依據,完成從基因,蛋白到細胞生物體內的完整資訊。
全自動活細胞影像分析測定系統結合高內涵細胞水平分析技術是近年來在藥物篩選中應用最廣的技術。
例如:治療SARS 中藥篩選,可透過全自動活細胞影像分析測定系統結合高內涵細胞水平分析技術篩選出對非典型肺炎不同病理環節和改善其臨床症狀有效的中成藥。
藥物篩選急需有新的方法來降低成本,提高效率,讓無效的候選藥物儘快在臨床測定前就被剔除,而在細胞水平層面的篩選完全符合這些要求。
觀察候選藥物在單個細胞中的活動情景能清晰的告訴我們藥物能否進入細胞,在細胞內如何分佈,候選藥物對細胞的作用如何,對細胞的毒性如何等多重資訊。
2. IN Cell Analyzer 活細胞圖像分析系統技術包括儀器,試劑及分析軟體三部分。
(1) 儀器儀器包括一個自動升降平台,高解析度CCD 相機,鐳射自動聚焦系統以滿足多螢光成像。
對於一個常規雙色成像,可在5 分鐘內或15 分鐘內完成96 孔板或384 孔板樣品分析。
IN Cell Analyzer 1000 提供多種圖像軟體後處理應用功能。
該系統也是一個開放平台,可容納多種實驗室自動系統,同時也可升級,增加如溫度控制或線上加樣等功能。
Celigo细胞成像分析仪的特点和应用详解

Celigo细胞成像分析仪的特点和应用Celigo细胞成像分析仪的特点和应用上海典奥生物科技有限公司(tekon biotech (Shanghai) Itd)Celigo细胞成像分析仪可分析生长在微孔板和T-flask中的贴壁和非贴壁(悬浮)细胞,具有超越传统方法的更好的优势。
Celigo具有特别一致的,高质量,全孔的明亮视野(brightfield)成像功能,结合强大的分割软件可在5分钟内获得整个微孔板的所有孔中的所有细胞的高质量数据。
Celigo具有非破坏性和非侵入性明亮视野分析功能,并有多色荧光功能作补充,使系统适合任何实验室中的基于细胞的广泛的实验。
图1 Celigo细胞成像分析仪Celigo细胞成像分析仪具有下列特征和优势:1)可接受T-flask(T-25和T-75)和多数微孔板(1536孔板到6孔板);2)可在整个孔的范围内进行准确的明亮视野细胞成像和识别;3)具有三通道荧光(除了明亮视野功能):红色荧光、绿色荧光和蓝色荧光;4)极快速的扫描(扫描整块微孔板大约耗时5-15min);5)有直观并易于使用的,功能强大的,软件分割和分类界面;6)可选择的API软件,可进行机械臂装载整合。
Celigo细胞成像分析仪的杰出的性能主要取决于它的独特的光学通路,此光学通路应用了一个大型的F-theta透镜和检流计镜片来进行大面积快速扫描。
与传统的基于显微镜的仪器不同,此系统可扫描整个孔,而无需移动微孔板,并保持一致的亮度对孔边缘的细胞进行准确的细胞识别。
Celigo可检测的细胞分析参数:1)总细胞数目(Total Cell Number);2)分类细胞数目(Gated Cell Number);3)分类细胞百分比(Percentage of Gated Cells);4)细胞密度(Cell Density);5)细胞面积(Cell Area);6)细胞平均强度(Cell Mean Intensity);7)细胞整体强度(Cell Integrated Intensity);8)细胞长宽比(Cell Aspect Ratio);9)细胞形状因子(Cell Form Factor);10)细胞光滑度(Cell Smoothness);11)克隆直径(Colony Diameter);12)克隆周长(Colony Perimeter)。
MetaMorph显微成像分析
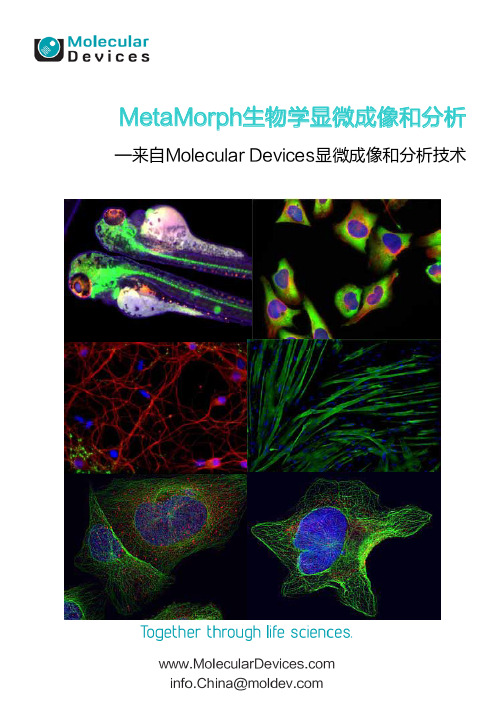
■ 从宏观到细节
同 时 获 得 相同细 胞的微观 和宏观图 像
■ 从 平 面 到立体 4D浏 览 , 获 知细胞的 所有结构 随时间发 生 的 位 移 变化和 转移过程 ,获得前 所未 有 的 深 层 细胞信 息
活细胞成像工作站
细胞离子成像
细胞离子成像/FRET简介
钙离子是生命活动最重要的离子之一,通过测 定细胞内游离钙离子浓度,科研工作者可以得知肌 肉收缩、神经信号传导、细胞间通讯、激素反应等 生命活动的重要信息。
另外,许多非金属阴离子,如H+,NO等及细胞 膜电位的检测和线粒体膜电位的快速检测对于观察 细胞的生物学特性有着重要的价值。
长 寿 命 光 源系统 多 种 类 型 的CCD
系 统 与 膜 片钳联 用
实 时 获 得 离子图 像和 离 子 绝 对 浓度值
应用实例
同时展示多波长图像和自定义的测量曲线。当对之前的图像进行二次分 析时,通过鼠标点击曲线任意位置能够快速展示出与之相对应的图像。
CHO细胞标记Fura-2 图像来源: the Biomedical Sciences short course , Marine Biological Laboratory, Woods Hole, MA. Courtesy of Lynda Pierini, PhD, Cornell Medical Center, Ken Dunn, PhD, Indiana University-Purdue University,and Professor ColinIzzard, SUNY University of Albany.
MetaMorph生物学显微成像和分析
cytation 1 细胞成像使用手册

Cytation 1细胞成像使用手册1.前言细胞成像技术是现代生物学和医学研究中不可或缺的重要手段之一。
Cytation 1 细胞成像系统是一款集成了数字显微镜和微孔板阅读器功能的高端设备,能够为用户提供高质量的细胞成像和定量分析。
本手册旨在帮助用户快速熟悉Cytation 1系统的使用方法,以便顺利进行细胞成像实验。
2.系统概述Cytation 1 细胞成像系统采用了先进的全自动成像技术,具有高分辨率、高灵敏度和高通量的特点。
系统配备了先进的数码相机和多种滤光片,可以对荧光、相差干涉、亮场和暗场成像等多种成像模式进行快速切换,满足不同细胞成像需求。
Cytation 1系统还具有高度智能化的图像分析和数据处理功能,可以轻松实现细胞计数、纯度分析、荧光定量分析等多项实验任务。
3.系统操作3.1 系统启动和关闭1)打开Cytation 1系统电源开关,等待系统自检完成;2)在计算机上启动Cytation 1图像处理软件,等待系统初始化;3)在实验准备就绪后,使用软件关闭系统电源。
3.2 样品加载1)将准备好的生物样品(例如细胞培养物或荧光标记的标本)装入标准微孔板中;2)注意微孔板的安装方向和位置,确保样品与成像区域对齐。
3.3 成像操作1)在软件界面设置所需的成像模式和参数;2)将装有样品的微孔板放入成像台中,调整焦距和曝光时间;3)点击软件界面上的“开始成像”按钮,等待成像完成。
3.4 数据处理1)成像完成后,系统会自动保存图像和数据;2)用户可以在软件中进行图像处理、分析和保存;3)根据实验要求生成成像报告或进行数据导出。
4.实验技巧4.1 样品处理1)在实验前,应仔细处理和准备样品,确保样品的纯度和活性;2)对于荧光标记的样品,应避免光照和暴露于强光下,以防标记物受到损伤。
4.2 成像参数设置1)在选择成像模式和参数时,应根据样品的特性和实验需求进行合理调整;2)根据成像目的,选择合适的滤光片和镜头,确保获得清晰和准确的成像结果。
FRET暨活细胞显微成像系统

荧光共振能量转移(FRET)影像系统Olympus(北京)销售服务有限公司上海分公司PDF created with pdfFactory Pro trial version 荧光共振能量转移(FRET)影像系统一、研究目的随着生命科学研究的不断深入, 光学显微镜使我们理解了细胞结构和有关功能。
但是分子 生物学研究已经显示了分子事件,例如信号传导和基因翻译,需要蛋白质的装配成特殊的大 分子复合体等。
对各种生命现象发生的机制,特别是对细胞内蛋白质间相互作用的研究变得尤 为重要。
传统的生物物理或生物化学方法例如亲和色谱法或免疫沉淀反应法和近来的酵母双杂 交、磷酸化抗体、免疫荧光、放射性标记等方法等,都需要破碎细胞或对细胞造成损伤,无 法做到在活细胞生理条件下实时地对细胞内蛋白质-蛋白质间相互作用进行动态研究。
而基于强度的影像技术FRET方法,使得研究活细胞内的这些相互作用变得容易了,荧光 共振能量转移( FRET)是用于对生物大分子之间相互作用定性、定量检测的一种有效方法。
根 据所基于的荧光显微镜配置不同而有不同的应用侧重,可在多细胞,单细胞,细胞膜,细胞 器等不同层次对生物大分子间的相互作用距离,动力学特性等进行研究。
二、FRET的原理和实现方法FRET的原理和发生的基本条件:1. 2. 3. 4. 发色团之间的距离在10A到100A 。
供体D的荧光光谱和受体A的吸收光谱足够多的重叠。
供体D的量子产率和受体A的吸收系数足够大。
D和A的跃迁偶极矩有最佳的相对取向,或者两者之一有一定的快速旋转的自由度。
FRET的实现方法:1) 稳态方法(基于供体、受体的三通道计算校准) 供体荧光的减弱-主要的方法 受体荧光的增强 激发光谱和吸收光谱的比较 2) 3) 光漂白方法 (Pb-FRET) 时间分辨方法(TR-FRET) 供体荧光的衰减 受体荧光的增长PDF created with pdfFactory Pro trial version FRET 特点:1) 动态实验,采集速度快 / 高速Shutter、高速CCD 2) 3) 4) 维持活细胞活性-CO2培养箱、恒温培养箱、恒温板 尽量减少光毒性,减少光照时间 保证长时间观察奥林巴斯 FRET 系统组成:1、显微镜 2、光源、高速荧光激发光切换控制和电动光闸 3、电动 XY 载物台 4、环境控制 5、高灵敏度冷 CCD 6、多种部件同时工作的控制软件 7、图像分屏器——DualView三、Olympus FRET系统详细技术参数一)显微镜:Optics 光学性能Ø 光学系统(Optical System): 奥林巴斯 2005 年最新推出的 UIS2 无限 远光学系统(UIS2 Infinity optical system) (UIS2 光学系统具有的高光 透过率和全光谱范围的色差校正,及高信噪比的特点,非常适合荧光 方面的研究,可以说是目前最先进的光学系统之一) 光路设计: V型光路把反射时的光线损失减少到最小程度,保证最大光 通过量System Flexibility系统适应性Ø Ø Ø 光口: 双层多光口设计(奥林巴斯首创)保证了输入/输出灵活性,提 供 6 条射入/射出光路,最多可同时接 4 路采集原像的图像获取系统。
FRET暨活细胞显微成像系统

荧光共振能量转移(FRET)影像系统Olympus(北京)销售服务有限公司上海分公司PDF created with pdfFactory Pro trial version 荧光共振能量转移(FRET)影像系统一、研究目的随着生命科学研究的不断深入, 光学显微镜使我们理解了细胞结构和有关功能。
但是分子 生物学研究已经显示了分子事件,例如信号传导和基因翻译,需要蛋白质的装配成特殊的大 分子复合体等。
对各种生命现象发生的机制,特别是对细胞内蛋白质间相互作用的研究变得尤 为重要。
传统的生物物理或生物化学方法例如亲和色谱法或免疫沉淀反应法和近来的酵母双杂 交、磷酸化抗体、免疫荧光、放射性标记等方法等,都需要破碎细胞或对细胞造成损伤,无 法做到在活细胞生理条件下实时地对细胞内蛋白质-蛋白质间相互作用进行动态研究。
而基于强度的影像技术FRET方法,使得研究活细胞内的这些相互作用变得容易了,荧光 共振能量转移( FRET)是用于对生物大分子之间相互作用定性、定量检测的一种有效方法。
根 据所基于的荧光显微镜配置不同而有不同的应用侧重,可在多细胞,单细胞,细胞膜,细胞 器等不同层次对生物大分子间的相互作用距离,动力学特性等进行研究。
二、FRET的原理和实现方法FRET的原理和发生的基本条件:1. 2. 3. 4. 发色团之间的距离在10A到100A 。
供体D的荧光光谱和受体A的吸收光谱足够多的重叠。
供体D的量子产率和受体A的吸收系数足够大。
D和A的跃迁偶极矩有最佳的相对取向,或者两者之一有一定的快速旋转的自由度。
FRET的实现方法:1) 稳态方法(基于供体、受体的三通道计算校准) 供体荧光的减弱-主要的方法 受体荧光的增强 激发光谱和吸收光谱的比较 2) 3) 光漂白方法 (Pb-FRET) 时间分辨方法(TR-FRET) 供体荧光的衰减 受体荧光的增长PDF created with pdfFactory Pro trial version FRET 特点:1) 动态实验,采集速度快 / 高速Shutter、高速CCD 2) 3) 4) 维持活细胞活性-CO2培养箱、恒温培养箱、恒温板 尽量减少光毒性,减少光照时间 保证长时间观察奥林巴斯 FRET 系统组成:1、显微镜 2、光源、高速荧光激发光切换控制和电动光闸 3、电动 XY 载物台 4、环境控制 5、高灵敏度冷 CCD 6、多种部件同时工作的控制软件 7、图像分屏器——DualView三、Olympus FRET系统详细技术参数一)显微镜:Optics 光学性能Ø 光学系统(Optical System): 奥林巴斯 2005 年最新推出的 UIS2 无限 远光学系统(UIS2 Infinity optical system) (UIS2 光学系统具有的高光 透过率和全光谱范围的色差校正,及高信噪比的特点,非常适合荧光 方面的研究,可以说是目前最先进的光学系统之一) 光路设计: V型光路把反射时的光线损失减少到最小程度,保证最大光 通过量System Flexibility系统适应性Ø Ø Ø 光口: 双层多光口设计(奥林巴斯首创)保证了输入/输出灵活性,提 供 6 条射入/射出光路,最多可同时接 4 路采集原像的图像获取系统。
细胞迁移or侵袭实验分析——LumaScope活细胞成像系统

细胞迁移/侵袭实验分析——LumaScope活细胞成像系统细胞迁移实验是普遍应用于评价损伤修复、贴壁肿瘤细胞转移或血管再生等的典型实验。
传统方法是应用无菌枪头(Tip)在细胞培养容器上划痕来实现。
但是此种方法无法实现在不同孔中划出同样大小的划痕。
Oris TM迁移/侵袭试剂盒能够提供更加精确的方法,在培养容器中生成一个圆形区域。
这种方法同样适用于观察不同方向的细胞迁移。
LumaScope活细胞成像系统具备传统显微镜的功能,可应用于细胞或组织培养实验室的日常细胞观察。
如细胞状态实时检测、远程传送和监控、细胞计数、形态观察、染色观察等。
LumaScope可放置于培养箱中实现细胞的长时间的连续成像和定点监测。
这种应用大大提高了实验过程检测的便捷性和结果的准确性。
本文将描述如何结合LumaScope与Oris TM迁移/侵袭试剂盒来实现细胞迁移/侵袭实验。
实验结果可通过Image J软件来进行分析,最终得到细胞迁移的数量和速度数据。
细胞迁移分析:Day 1:am 9:00插入Stoppers,接种细胞;pm 4:00(根据细胞贴附状况),拔除stoppers,PBS洗一遍后加入新鲜培养液。
Day 2:根据要观察的时间点设置LumaScope成像参数进行成像,并进行量化分析。
细胞侵袭分析:Day 1:am 9:00包被薄层BME(用无血清培养液制备),插入stoppers,接种细胞;pm 4:00 (根据细胞状况),拔除stoppers,包被厚层BME(含血清生长因子),再在第二层gel上面加上一层无血清培养液Day 2:根据要观察的时间点设置LumaScope成像参数进行成像,并进行量化。
一、材料●Oris TM迁移/侵袭试剂盒●细胞、培养容器和培养液●CO2培养箱●LumaScope活细胞成像系统●Image J软件(含Mtracking插件)二、操作方法1、根据上述Oris TM迁移/侵袭试剂盒使用说明培养细胞;2、75%乙醇消毒LumaScope系统及相关部件;3、将LumaScope系统放入CO2培养箱中,并连接到控制电脑(建议使用10倍或20倍物镜)4、将培养容器置于LumaScope载物台上,聚焦并找到目标视野;5、设置Time Lapse程序(包括光源、成像参数和保存路径等),建议成像间隔时间为20-30min;6、启动程序,系统将自动运行,直至结束;7、实验结果可通过Image J软件进行分析。
