全国高中学生化学竞赛决赛理论试题
中国化学会第21届全国高中学生化学竞赛(决赛)理论试题答案
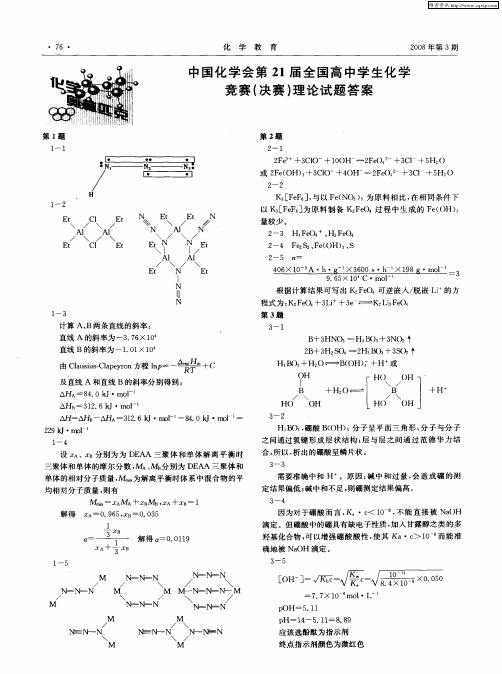
M M / NE N— N \ M
N
N 、
N \
M \
M M — N— N— — M / \ /
[一 √ c、 O] H 一 ^ 一 、 √ / ^ /
一 7 7 1 一 mo . × 0 l・I p H= 5 1 O . 1 p = 1 — 5 1 —8 8 H 4 . 1 。9
合, 所以 , 出的硼酸呈鳞片状 。 析
3— 3
需要 准确 中和 H 。原 因 : 中和 过量 , 造成 硼 的测 碱 会 定结 果偏低 ; 中和 不足 , 碱 则硼测定结果偏 高 。
3— 4
解 得 A O 9 5 B . 3 — . 6 , —O 0 5
1
B
因为对于硼酸 而 言 , K ・c 1 一 , < 0 不能 直 接被 Na OH
硼含量 =
( L 1 g・ - )
A CBr 3 N02
B H N0
第 4题
4— 1
。
分子 中的 N原子 的正 电荷 与冠醚环 上的氧 原子 的负 电 荷之 间的离子一偶极作用 。
C CH3 N0 D CH3 NH2
或者氮原子上 的氢与冠醚环 上的氧原子之间形成氢键 。
及直线 A和直线 B的斜率分别得到 :
△H^ 4 0 k to- =8 . J・ l o 1
△H B 3 2 6k 一 1 . J・to一 o l
0 l H
B
3— 2
+H O 2
1 (] 『 / … ) H\ … 1 ) H
J B
1HO O I H
或 2 e0H) +3 0一 4) = 2 e 。 F( 3 Cl + (H一 FOd一+3 1 5 ( C一+ H2)
第22届全国高中学生化学竞赛决赛理论试题参考答案

D×V×N
M
一3.730 g‘cm-3><(840.5 pro)3 X6.022X——1—0—2—3—m——o—1—-——'
(6.94十2X47.88十4×16.00)g・mol叫
≈8
晶胞中的原子数为:7×8=56E8个Li+,16个
(其他画法合理也得分) 4—2结构基元为1个a-Li。N 简单六方点阵 N3一的Li+离子配位数为8 4—3由LizN一平面层中原子分布和画出的结构可 作如下计算: 层中Li—N间距离为: (Ti3++Ti4+),32个02一] ②假定面对角线上的()2一离子处于接触状态 (正离子填隙町能使()2一处于撑开状态,实际不一定 接触),设02一离子半径为r,则存在8r=√2口的关 系:02一离子最大可能半径为: r=J2a/8----42×840.5 pm/8—148.6 pm ③由题意和晶胞中()2一离子数目(32个)可推
pm
1
dlA-N薪一三i矿一210・6
1
音dN—N音×364.8
知,该晶胞叮以看成是由8个ccp堆积的立方单位
pm
并置而成。 将Li+选为晶胞顶点,Li+在晶胞中的位置与金 刚石中的C相当。如下图:
(上述计算中可有多种方法) 4—4①快离子导体必须具备2个条件,其一是存 在未填充的空隙,其二是离子可以在空隙间迁移。 已知N3一半径为146 pm,N—N间距离为
V
=--0.438 V
(4)△后。一一刀FE
=--4×96.485×Eo.616一(一o.438)]
一--407(kJ・mol一1)
lg[H+]4・户(02)/矿
一1.229 V+(O.0591/4)V×
1—3由图可见,生成[Au(CN)z]一的电极电势比
全国高中学生化学竞赛试题及答案

评分通则1.凡要求计算或推导的,必须示出计算或推导过程。
没有计算或推导过程,即使结果正确也不得分。
2.有效数字错误,扣0.5分,但每一大题只扣1次。
3.单位不写或表达错误,扣0.5分,但每一大题只扣1次。
4.只要求1个答案、而给出多个答案,其中有错误的,不得分。
5.方程式(不是反应式!)不配平不得分。
6.用铅笔解答(包括作图)无效。
7.使用涂改液涂改的解答无效。
8.不包括在标准答案的0.5分的题,可由省、市、自治区评分组讨论决定是否给分。
9.答案中红色字为标准答案,而蓝字体(加下划线)为注释语不属于答案。
气体常数R =8.31447 J K -1 mol -1 法拉第常数F =96485 C mol -1 阿佛加德罗常数N A =6.022142×1023 mol -1第1题 (15分)1-1 2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。
117号元素是用249Bk 轰击48Ca 靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db 后发生裂变;5个原子则经q 次α衰变得到281Rg 后发生裂变。
用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角每式1分,画箭头也得 1分。
两式合并为 23n +Uns 5+Uns =Bk 6+Ca 629397294117249974820也得满分。
(2分)(3分)1-3 一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如第2题(5 分)最近我国有人报道,将0.1 mol L-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1 mol L-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。
2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2-)分别为0.345 V和-0.476 V,nFEӨ=RT ln K,EӨ表示反应的标准电动势,n为该反应得失电子数。
第23届全国高中学生化学竞赛理论试题(全)

第23届全国高中学生化学竞赛理论试题第1题用传统的工艺方法从矿物中提取锰和锌存在能耗高、三废排放量大和工艺流程长等缺点。
2009年报道,采用1:1硫酸溶液同槽浸出锰结核矿[质量分数20.0)(2=MnO ϖ]和锌精矿[质量分数70.0)(=ZnS ϖ]的工艺方法提取锰和锌获得成功,对资源综合利用、节能减排和清洁生产生有重要的实际意义。
已知44.0)/(,77.0)/(223-==+++Fe Fe E V Fe Fe E θθV ZnS S E V Mn MnO E V 265.0)/(,23.1)/(.22==+θθ。
1-1锰结核矿和锌精矿单独酸浸结果很不理想。
请通过热力学计算,说明锰结核矿和锌精矿同槽酸浸时发生化学反应的可行性。
1-2模拟实验发现,二氧化锰和硫化锌同槽酸浸时反应速率很慢,若在酸溶液中加入少量的铁屑则能明显使反应速率加快。
写出铁进入溶液后分别与二氧化锰和硫化锌发生化学反应的离子方程式,并简述反应速率加快的原因。
1-3研究发现,2种矿物同槽酸浸4小时后,锰和锌的浸出率只有~80%,为了提高浸出率,在实际工艺中,须将过滤后的滤渣用四氯乙烷处理后再做二次酸浸,请简要说明四氯乙烷的作用。
1-4锌精矿中常有部分铅共生,同槽酸浸工艺回收铅的方法之一是在浸渣中加入足量的食盐水使铅溶出,写出溶出铅的化学方程式。
第2题我国的稀土资源约占世界总量的80%,居世界第一位。
稀土元素的化学性质极其相似,分离十分困难,仅从1794年发现钇到1945年从铀裂变产物中得到钷就花了150年。
稀土萃取化学的研究为大规模分离和提纯稀土元素带来了新飞跃。
2008年国家最高科学技术奖授予化学家徐光宪,以表彰他在创立稀土串级萃取理论及其工艺方面的杰出贡献,该项成就使我国高纯稀土产品成本下降3/4,单一高纯稀土产品占世界产量的90%以上。
2-1 目前在稀土分离工业中广泛应用国产萃取剂P 507,它的化学名称为(2 乙基己基)膦酸(2乙基己基)酯,画出其化学结构简式,写出萃取三价稀土离子的化学反应方程式(萃取剂用HA 表示,稀土离子用RE 3+表示)。
全国高中学生化学竞赛决赛试题及答

全国高中学生化学竞赛决赛理论试题及答案第一题(6分)选取表1中的合适物质的字母代号(A~H)填人相应标题(①一⑧)后的括号中(单选),并按要求填空。
A B C D E F G HNO2+ NO N2O3N2H4NH3 N2O4H2N2O2NH2OH)不是平面分子,其衍生物用作高能燃料。
②()存在两种异构体,其中一种异构体的结构为。
③()具有线型结构,Lewis结构式中每个键的键级为2.0。
④()是无色的,平面分子,它的一种等电子体是。
⑤()既有酸性,又有碱性,可作制冷剂。
⑥()既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。
⑦()是顺磁性分子。
⑧()水溶液会分解生成N20,反应式为。
第二题(6分)图1是元素的△f G m/F一Z图,它是以元素的不同氧化态Z与对应物种的△f G m/F 在热力学标准态pH =0或pH == 14的对画图。
图中任何两种物种联线的斜率在数值上等于相应电对的标准电极电势ψA或ψB,A、B分别表示pH=0(实线)和pH=14(虚线)。
上图中各物种的△f G m/F的数值如表2所示。
表2 各物质的△f G m/FA X- X2HXO HXO2 XO3- XO4-F -3.06 0 / / / /Cl -1.36 0 1.61 4.91 7.32 9.79Br -1.06 0 1.60 / 7.60 11.12I -0.54 0 1.45 / 5.97 9.27B X-X2XO- XO2- XO3-XO4-F -3.06 0 / / / /Cl -1.36 0 0.40 1.72 2.38 3.18Br -1.06 0 0.45 / 2.61 4.47I -0.54 0 0.45 / 1.01 2.41⒈用上表提供的数据计算:ψA(IO3-/I-) ψB(IO3-/I-) ψA(ClO4-/HClO2)⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于还是小于其含氧酸盐的氧化性。
2021年全国高中化学竞赛决赛冬令营理论试题及答案

中华人民共和国化学会第20届全国高中学生化学竞赛(决赛)理论试题1月17日● 本竞赛试题共8题,总分120分,竞赛时间4小时。
迟到超过30分钟者不得进入考场,考试开始后1小时内不得离开考场。
解答完毕,将试卷和答卷及草稿纸折好,背面朝上放于桌面,撤离考场。
● 试卷和答卷已分别装订成册,不得拆散,所有解答必要写在答卷指定位置,写于其她位置无效.● 选手营号写在答卷每页左边指定位置,不得写所属地区,学校名称和姓名,否则按废卷论。
● 使用黑色墨水钢笔或圆珠笔答题,不得使用铅笔(涉及作图)。
使用提供草稿纸.不得携带任何其她纸张进入考场。
● 容许使用非编程计算器及直尺,橡皮、涂改液等文具,不得将文具盒以及手机、小灵通、BP机等通讯工具带入考场,一经发现将严肃解决。
原予量:H 1.008 B 10.81 C 2.01 N 14.01 O 16.00第1题(14分)钛及其合金具备密度小、强度高、耐腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。
国内四川省有大型钒钛磁铁矿。
从由钒钛磁铁矿经“选矿”得到钛铁矿提取金属钛(海绵钛)重要工艺过程如下:钛铁铁海面钛l-1 钛铁矿重要成分为FeTiO 3。
控制电炉熔炼温度(<1500K),用碳还原出铁,而钛则进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。
已知:FeTiO 3C TiO 2TiC Fe CO FeTiO 3FeTiO 3+=++++++CC 43==Fe CO 3Ti ++Fe 3CO①②③G m r J .mol -1===G m r J .mol-1G mr J .mol-1190900-161T 750000--500T 913800519T通过计算判断在电炉熔炼中重要发生以上哪个反映? (3分) 1-2 写出在1073—1273K 下氯化反映化学方程式。
(1分) 1-3 氯化得到TiCl 4中具有VOCl 3必要用高效精馏办法除去,为什么?实际生产中常在409 K 下用Cu 还原VOCl 3,反映物摩尔比为1:l ,生成氯化亚铜和难溶于TiCl 4还原物,写出还原反映方程式。
最新整理第届全国高中学生化学竞赛决赛理论试题只是分享
第29届中国化学奥林匹克(决赛)试题2015年11月28日 合肥注意事项1. 考试时间4小时。
迟到超过30分钟者不能进考场。
开始考试后30分钟内不得离场。
2. 考试“开始铃声”响起后方可拆开资料袋答题。
考试“结束铃声”响起后,立即停止答题,把试卷和答题纸放于桌面,由监考人员检查并将答题纸装订后一并放入资料袋。
听到可以离开指令后方可离开考场。
3. 发出停止答题指令后仍继续答题者,正在解答的试题(大题)以零分计。
4. 本试卷含9道大题,共5页。
试卷已装订成册,不得拆散。
所有解答必须写在答卷上指定的框格内,写于其他地方无效。
若有改动,需将新内容写于答卷的附页,并标明题号。
5. 凡要求计算的问题,只有计算结果而无计算过程,即使结果正确也不得分。
6. 用黑色墨水笔或黑色圆珠笔答题,不得携带任何其他纸张进入考场。
若需要草稿纸,可举手向监考人员索取。
7. 将营员号写在试卷首页和每页答卷指定位置,否则无效。
8. 允许使用非编程计算器以及直尺等文具,。
不得携带铅笔盒、书籍、通讯工具入场。
不得将草稿纸带出考场。
9. 欲上卫生间,举手示意,经监考人员允许方可离开座位出考场,考场外由志愿者全程引领。
第1题 (7分)1-1 CH 3SiCl 3和金属钠在液氨中反应,得到组成为Si 6C 6N 9H 27的分子,此分子有一条三重旋转轴,所有Si 原子不可区分,画出该分子结构图(必须标明原子各类,H 原子可不标),并写出化学反应方程式。
1-2 金属钠和(C 6H 5)3CNH 2在液氨中反应,生成物中有一种红色钠盐,写出化学反应方程式,解释红色产生的原因。
1-3 最新研究发现,高压下金属Cs 可以形成单中心的CsF 5分子,试根据价层电子对互斥理论画出CsF 5的中心原子价电子对分布,并说明分子形状。
第2题(11分)将银电极插入298 K 的1.000×10-1 mol/L NH 4NO 3和1.000×10-3 mol/L AgNO 3混合溶液中,测得其电极电势Ag Ag /+ϕ随溶液pH 的变化如下图所示,已知氨水的解离常数(K b )为1.780×10-5,理想气体常数R = 8.314 J •mol -1•K -1,法拉第常数F = 96500 C •mol -1。
全国高中学生化学竞赛(决赛)理论试题答案与评分标准
全国高中学生化学竞赛(决赛)理论试题答案与评分标准第一题 (评判分: 共11分)(1) (3分)3NAlCH 第一步反应: [Al (CH ) ] + 2 NH 2332[NH Al(CH )322]+2CH 4]223 Al(CH )NH [第二步反应: 3170C3]+6 CH 42[(2) (3分) 环铝氮烷的衍生物D 的结构式如下:CH 3Al NN AlAl N3CH 3H C(3) (5分)设: 混合物中2,6-二异丙基苯胺和化合物C 的质量分数分别为X 1和X 2;C j 、H j 、N j 、Al j 分别表示化合物j 中含C 、H 、N 、Al 的原子数;M j 表示化合物j 的分子量;则:编号 j 化合物分子式 C j H j N j Al j 相对分子质量M j1 2,6-二异丙基苯胺C 12H 17NH 21219 1 0 177.32 2 CC 28H 48N 2Al 2 284822466.74根据题意可列出下列二元一次方程组:12+28=0.7371177.32466.7412.011+2=0.0634177.32466.7414.01 X X X X 1212....解上述联立方程组可求得: X 1= 0.175 , X 2= 0.825答:混合物中2,6-二异丙基苯胺、化合物C 的质量分数分别为0.175、0.825。
评分标准:全题评判分: 共11分.(1) 评判分: 共3分,其中第一步反应为1分, 第二步反应为2分, 没用结构简式表示的不给分, 未配平、但方程中各化合物结构简式写对的, 第一步扣0.5分, 第二步扣1分;(2) 评判分: 3分(3) 评判分: 共5分, 写对求解联立方程组得3分, 方程结果X1、X2各占1分,全对得2分, 错一个扣1分;用百分数表示者, 只要正确不扣分, 结果数字有效位数不正确者, 每个结果扣0.25分。
第二题(评判分: 共18分)1. (评判分: 6分)第一步反应为CaC2O4·H2O脱水反应, N2和O2对反应无影响, 所以热重曲线相同(2分);第二步反应为CaC2O4的分解,由于CO在O2中氧化放热,使温度升高,加快了反应速率,所以在较低的炉温下CaC2O4即开始分解(2分);第三步反应为CaCO3 的分解,N2和O2对反应无影响,但由于第二步反应分解速率不同,使所生成的CaCO3有所不同,所以曲线有差异(2分)。
全国高中学生化学竞赛(省级赛区)试题与答案(Word版)1
全国奥林匹克化学竞赛(浙江赛区)试题第1题(6分)配平方程式(1)CrCl3+KMnO4+H2O=K2Cr2O7+MnCl2+HCl+MnCr2O7(2)As2S2+HNO3+H2O=H3AsO4+NO↑+H2SO4第2题(12分)(1)实验证明,硫化铜与硫酸铁在细菌作用下,在潮湿多雨的夏季,成为硫酸和硫酸盐而溶解于水,这就是废石堆渗沥水,矿坑水成为重金属酸性废水的主要原因,试写出配平的化学方程式。
(2)从金矿中提取金,传统的也是效率极高的方法是氰化法。
氰化法提金是在氧存在下氰化物盐类可以溶解金。
试写出配平的化学方程式。
(3)对二乙苯在酸性高锰酸钾溶液中被氧化并有气体产生,试写出配平的反应式。
第3题(12分)(1)用石灰乳跟硫熬煮而成的石硫合剂含多硫化钙(CaS n)。
多硫化钙在空气中与二氧化碳等酸性物质接触易析出多硫化氢,多硫化氢是一种极不稳定的黄色液体,试用化学方程式说明多硫化钙具有杀虫作用的原因。
(2)在强碱B-:(如NH4+NH2-),的存在下CH3CH2CH2CH2Cl可按下列两种历程发生消除反应,分别称之为Eα消除和E2消除:Eα:E2:试构思一个实验证实上述历程。
第4题(12分)(1)实验室中所用的氧化钢(CuO)是黑色粉末。
在使用电烙铁时,其头部是一铜制的烙铁头,长期使用,表面被氧化,但脱落下来的氧化膜却是红色的,试说明原因。
(2)法医鉴定砷中毒(通常为砒霜)的方法是用锌、盐酸和试样混在一起,将生成的气体导入热玻璃管,如果试样中有砷化物存在,则在玻璃管的壁上出现亮黑色的“砷镜”。
试写出有关的反应式。
(3)把CO2气体通入澄清的石灰水,立即会产生浑浊,但把SO2气体通入澄清的石灰水,却不容易看那浑浊,而CaCO3和CaSO3都是难溶的电解质,试说明原因。
第5题(6分)分子式为C7H10的开经烃A,可发生下列反应:(1)A经催化加氢可生成3一乙基戊烷。
(2)A与硝酸银氨溶液反应可产生白色沉淀。
历年化学竞赛国家决赛题目-第26届全国高中学生理论试题
两种水笼(图4.2)构成,每个水笼中心均包含一个A分子(视为球形),X射线衍射表明该
晶体属立方晶系,晶胞中心为对称中心,体对角线为3次旋转轴。已知其中两个A的分数
坐标分别为0,0,0和0,1/2,1/4。写出该晶胞所有A的分数坐标及相应水笼的类型;不考虑氢
原子,写
出该晶体的点阵类型(须写出简要的分析过程)。
XI属正交晶系,晶胞参数a = 450.19 pm,b = 779.78 pm,c = 732.80
pm,计算该晶胞中水分子的个数。
4-3 冰-Ic是一种亚稳态,在-
80℃由水蒸汽凝结而成,属立方晶系,晶体内所有氢键键长均相等,晶胞参数a = 635.80
pm。计算氢键键长并给出该晶体的点阵类型(不考虑氢原子,须写出简要的分析过程)。
),它们的键角从大到小顺序为:_________________________________。
1-2 铋的高价化合物具有很强的氧化性,酸性介质中可用NaBiO3氧化Mn(II) 得到 Mn(VII)以鉴定锰。写出该反应的离子反应方程式.
1-3 卤氧化铋作为一类新型光化学催化剂,具有较高的催化活性和稳定性,近几年备
第4页,共8页
3-6 用表3-2中所给数据和3-5的计算结果分別解释温度对反应(1)的影响。 3-7 己知在一定温度下反应方向会发生变化,请计算反应的转向温度。
第4题(15分)冰有十六种晶型。冰中每个水分子与周围4个水分子形成氢键,氢键键长
可表示为通过氢键相连接的两个氧原子的核间距。
4-1 自然界中最常见的冰是冰-Ih,属六方晶系(图4.1),晶胞参数a = b = 449.75 pm,c =
第5页,共8页
五角十二面体 十四面体 图4.1( 为O原子)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2006年全国高中学生化学竞赛决赛理论试题2006年1月7日 上海● 竞赛时间4.5小时。
迟到超过30分钟者不能进考场。
开始考试后1小时内不得离场。
时间到,把试题和答卷纸装入信封,放在桌面上,听到指令后方可撤离考场。
● 试卷和答卷装订成册,不得拆散。
所有解答必须写在答卷纸的指定位置的方框内,答在试题纸上一律无效。
● 用黑色墨水笔或黑色圆珠笔答题。
不得携带任何其他纸张进入考场。
需要额外的答卷纸或草稿纸时可举手向监考老师索取。
在答卷纸页眉自填总页数和页码。
● 必须在试题首页左边和每页答卷纸左边指定位置填写营号及姓名,否则按废卷论。
● 允许使用非编程计算器以及直尺等文具。
不得携带铅笔盒、通讯工具入场。
第1题 (9分)钨是我国丰产元素,是熔点最高的金属,广泛用于拉制灯泡的灯丝,有“光明使者”的美誉。
钨在自然界主要以钨(VI)酸盐的形式存在。
有开采价值的钨矿石是白钨矿和黑钨矿。
白钨矿的主要成分是钨酸钙(CaWO 4);黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe,Mn)WO 4。
黑钨矿传统冶炼工艺的第一阶段是碱熔法:黑钨矿NaOH, 空气熔融(1)水浸A )浓盐酸(2)滤液沉淀B焙烧产品C其中A 、B 、C 都是钨的化合物。
1-1. 写出上述流程中A 、B 、C 的化学式,以及步骤⑴、⑵、⑶中发生反应的化学方程式。
1-2. 钨冶炼工艺的第二阶段则是用碳、氢等还原剂把氧化钨还原为金属钨。
对钨的纯度要求不高时,可用碳作还原剂。
[1] 写出用碳还原氧化钨制取金属钨的化学方程式。
[2] 用下表所给的298.15K 的数据计算上述反应的标准自由能变化,推出该反应在什么温度条件下能自发进行。
(假设表中数据不随温度变化)营号 姓名物质 f m −1m W(s)WO 3(s) C(石墨) CO(g) CO 2(g) H 2(g) H 2O(g) H 2O(l)-842.87 0 -110.52 -393.51 0 -241.82 -285.31 32.64 75.90 5.74 197.56 213.64 130.57 188.7269.901-3. 为了获得可以拉制灯丝的高纯度金属钨,不宜用碳而必须用氢气作还原剂,为什么?写出用氢气还原氧化钨的化学方程式。
1-4. 在酸化钨酸盐的过程中,钨酸根WO 42-可能在不同程度上缩合形成多钨酸根。
多钨酸根的组成常因溶液的酸度不同而不同,它们的结构都由含一个中心W原子和六个配位O 原子的钨氧八面体WO6通过共顶或共边的方式形成。
在为数众多的多钨酸根中,性质和结构了解得比较清楚的是仲钨酸根[H 2W 12O 42]10-和偏钨酸根[H 2W 12O 40]6-。
在下面三张结构图中,哪一张是仲钨酸根的结构?简述判断理由。
(a)(b)(c)1-5. 仲钨酸的肼盐在热分解时会发生内在氧化还原反应,我国钨化学研究的奠基人顾翼东先生采用这一反应制得了蓝色的、非整比的钨氧化物WO 3-x 。
这种蓝色氧化钨具有比表面大、易还原的优点,在制钨粉时温度容易控制,目前冶炼拉制钨丝的金属钨都用蓝色氧化钨为原料。
经分析,得知蓝色氧化钨中钨的质量分数为0.7985。
[1] 计算WO 3-x 中的x 值。
[2] 一般认为,蓝色氧化钨的颜色和非整比暗示了在化合物中存在五价和六价两种价态的钨。
试计算蓝色氧化钨中这两种价态的钨原子数比。
(相对原子质量:W: 183.84 O: 16.00)营号 姓名磷的含氧酸及其盐是一类重要的化工产品,广泛用于食品、营养、肥料、阻燃、去油去污、防腐蚀、防锈、锅炉水处理等。
连二磷酸H 4P 2O 6是一种四元酸,它的结构式为 ⑴ 。
在0 ︒C 时,H 4P 2O 6在空气中是稳定的,温度升高,部分转变成它的异构体,结构式为 ⑵ ;也有部分会发生歧化反应,生成另外两种各含2个磷原子的含氧酸,它们的结构式为 ⑶ 和 ⑷ 。
H 4P 2O 6在酸性介质中加热会分解成两种磷的含氧酸,化学方程式为 ⑸ 。
制备连二磷酸可从制备其钠盐出发。
在5︒C 把红磷加入到剧烈搅拌的NaOH (0.2 mol·L -1)和NaClO (1.5 mol·L -1)混合溶液中,反应得Na 2H 2P 2O 6,化学方程式为 ⑹ 。
将纯化后的二钠盐溶于水,再通过 ⑺ ,即可获得纯的连二磷酸的水溶液,然后减压蒸发可得连二磷酸晶体。
第3题 (5分)四氧化三锰主要用于电子工业,是生产软磁铁氧体的原料之一。
3-1. 四氧化三锰的制法有焙烧法和还原法两类。
在还原法中,先将水锰矿(主要成分MnOOH )焙烧成三氧化二锰,再于250~500℃用甲烷还原生成四氧化三锰。
请写出上述二步反应的化学方程式。
3-2. 通常所说的四氧化三锰中,锰的价态实际上既有二价,也有三价和四价。
在某研究工作中,要求得知四氧化三锰中不同价态锰的比值,采用的测定方法步骤如下:i 称取三份质量相同的试样。
第一份以硫酸铵-硫酸溶液选择性溶解试样中的二价锰,过滤洗涤后,滤液用氨水中和并用氨-氯化铵缓冲溶液调至pH 10,加入必要的试剂和指示剂,用EDTA 标准溶液(a 1 mol·L -1)滴定至终点,耗去b 1 mL 。
ii 第二份试样中,准确加入过量的草酸钠标准溶液(a 2 mol·L -1,b 2 mL )和适量硫酸,加热使试样全部溶解,立即用高锰酸钾标准溶液(a 3 mol·L -1)滴定剩余的还原剂至终点,耗去b 3 mL 。
iii 第三份试样中,同样加入过量的草酸钠标准溶液和适量硫酸,加热使全部溶解。
冷却后用氨水中和并用氨-氯化铵缓冲溶液调至pH 10,加入必要的试剂和指示剂,用EDTA 标准溶液滴定至终点,耗去b 4 mL 。
[1] 写出步骤ii 溶解试样时,不同价态锰的氧化物同草酸之间反应的化学方程式;写出用高锰酸钾滴定剩余还原剂的化学方程式。
[2] 用a 1、a 2、a 3、b 1、b 2、b 3和b 4写出试样中二价、三价和四价锰含量(分别用X 、Y 、Z 表示)的计算式,单位用mmol 表示。
营号 姓名轻质碳酸镁是广泛应用于橡胶、塑料、食品和医药工业的化工产品,它的生产以白云石(主要成分是碳酸镁钙)为原料。
4-1. 石灰石和卤水长期作用形成白云石,写出该反应的离子方程式。
4-2. 右图是省略了部分原子或离子的白云石晶胞。
[1] 写出图中标有1、2、3、4、5、6、7的原子或离子的元素符号。
[2] 在答题纸的图中补上与3、5原子或离子相邻的其他原子或离子,再用连线表示它们与Mg 的配位关系。
4-3. 白云石分解所得CaO 和MgO ,加水制成Mg(OH)2和Ca(OH)2的悬浮液,通入适量CO 2(g),实现Ca 2+、Mg 2+的分离。
已知:Mg(OH)2 K sp =5.61×10-12 Ca(OH)2 K sp =5.50×10-6 MgCO 3 K sp =6.82×10-6 CaCO 3 K sp =4.96×10-9H 2CO 3K a 1=4.30×10-7, K a 2=5.61×10-11计算下列反应的平衡常数KMg (OH)2 + Ca(OH)2 + 3CO 2 = Mg 2+ + 2HCO 3- + CaCO 3 + H 2O4-4. 25o C ,100 kPa CO 2在水中溶解度为0.0343 mol·L -1。
将100 mol MgO 和100 mol CaO 加水制成1000 L 悬浮液,通入CO 2,使Mg 2+浓度达到0.100 mol·L -1,Ca 2+浓度不超过10-4 mol·L -1,且不生成MgCO 3沉淀。
通过计算说明如何控制CO 2的压力(假设CO 2在水中溶解符合亨利定律)。
4-5. Mg(HCO 3)2溶液加热分解,得到产品轻质碳酸镁(实为碱式碳酸盐)。
18.26 g 轻质碳酸镁纯样品经高温分解完全后得8.06 g 固体,放出3.36升(折合成标准状况)二氧化碳,通过推算,写出轻质碳酸镁的化学式(提示:轻质碳酸镁化学式所含的离子或分子数目为简单整数)。
(相对原子质量:Mg: 24.3 C: 12.0 O: 16.0 H : 1.01)营号 姓名酒石酸在立体化学中有特殊的意义。
著名法国科学家Louis Pasteur 曾通过研究酒石酸盐的晶体,发现了对映异构现象。
在不对称合成中,手性酒石酸及其衍生物常被用作手性配体或用作制备手性配体的前体。
5-1.天然L -(+)-酒石酸的Fischer 投影式如右图所示。
请在答题纸所给出的结构图上用R 或S 标出L -(+)-酒石酸的手性碳构型,并用系统命名法命名。
5-2.在答题纸指定位置上画出L -(+)-酒石酸的非对映异构体的Fischer 投影式。
该化合物是否有旋光性?为什么?5-3.法国化学家H. B. Kagan 曾以天然酒石酸为起始原料合成了一种重要的手性双膦配体DIOP ,并用于烯烃的不对称均相催化氢化,获得很好的对映选择性。
DIOP 的合成路线如下:O ObcO OO OO O 22Ts = 对甲苯磺酰基dDIOPe请在答卷纸的指定位置写出上述反应过程中a , b , c , d 和e 所代表的每一步反应的试剂及必要的反应条件。
5-4.美国化学家K. B. Sharpless 发现了在手性酒石酸二乙酯(DET) 和Ti(OPr i )4的配合物催化下的烯丙醇类化合物的不对称环氧化反应,因而荣获2001年诺贝尔化学奖。
该反应产物的立体化学受配体构型的控制,不同构型的DET 使氧选择性地从双键平面上方或下方加成,如下图所示:[O]D -(-)-DET, Ti(OPr i )(CH 3)3COOH, CH 2Cl 2, -20Ci4R R R 氧从下方加成(CH 3)3COOH, CH 2Cl 2, -20CR 1, R 2, R 3 = H, 烷基≥ 90% e.e.COOHH OH COOH HOH L -(+)-酒石酸营号 姓名该不对称环氧化反应曾被成功用于(+)-Disparlure (一种林木食叶害虫舞毒蛾性引诱剂)的合成上,合成路线如下:OHACrO 3 2NBD -(-)-DET, Ti(OPr i )4(CH 3)3COOH, CH 2Cl 2-20o CC (+)-Disparlure(C 19H 38O)均相催化氢化反应D请在答卷纸的指定位置画出化合物A 、B 、C 、D 和 (+)-Disparlure 的立体结构。
第6题 (8分)杂环化合物2-甲基四氢呋喃-3-酮(即目标产物I )是咖啡香气的主要成份之一,有多种合成方法。
