溶液的蒸气压下降共46页文档
《溶液的蒸气压、凝固点、沸点和渗透压》

1. 溶液的蒸气压下降当一种不挥发的溶质溶解于溶剂后.溶液表面的溶剂分子数目由于溶质分子的存在而减少,因此蒸发出的溶剂分子数目比纯溶剂时少,即溶液的蒸气压比纯溶剂时的蒸气压的线低。
他们的查称为蒸气压下降。
△ p=R-p A=X3 P A某些固体物质,如氯化钙、五氧化二磷等,常用作十燥剂。
这是由于它们的强吸水性使其在空气中易潮解成饱和水溶液,其蒸气压比空气中水蒸气的压力小,从而使空气中的水蒸气不断凝结进入“溶液”。
浓硫酸也可用作液体十燥剂。
2. 溶液的凝固点下降从图可以看出.在零度时水和冰的蒸气压相等(0 . 61kPa),此时水、劝和水蒸气三相达到平衡,oC即为水的凝固点。
由于水溶液是溶剂水中加入了箔质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低了:助的蒸气压,冰与溶液不能共存。
如果在溶液中放人冰,冰就融化。
所以只有在更低的温皮下才能使溶液的蒸气压与冰的蒸气压相等。
这就是溶液的凝固点下降。
△ t凝=k凝m溶液凝固点下降应用很广。
在汽车、坦克的水箱(散热器)中常加人防冻剂乙二酵、洒精、甘油等,其中以乙二醇为优,因为它具有高沸点、高化学稳定性以及从木溶液中结出时形成淤泥状而不是块状冰特点;在水泥砂浆中加入食盐或氯化钙,能防止冬季产生冰冻现象。
在制冷过程中,用无机盐水溶液作裁冷剂或用冰一无机盐水溶液(共晶冰)作蓄冷剂.使其更适用于低温制冷装置。
3. 溶液的沸点上升图中aa' ,ac ' ,bb '线分别表示水、冰和溶液的蒸气压与温度的关系。
当液体的蒸气压等于外界压力时,液体就沸腾,这时的温度称为沸点。
纯水在100C时的蒸气压等于(等于外界压力),故水的沸点是100C。
水中加入难挥发的溶质后,由于溶液的蒸气压曲线下降,只有在更高的温度下才能使它的蒸气压达到101. 3kPa而汤踢。
这就是沸点上升的原因。
实验证明,难挥发物质溶液的拂点总是高于纯溶剂的沸点。
△ t沸=k沸m在钢铁发黑处理工艺中所用的氧化液,因含Na0Hffi NaN再,所以加热至140 一150C也不致沸腾。
溶液的蒸气压下降

• 该类溶液满足的条件:溶质是难挥发的、非电 解质,稀水溶液。
一、溶液的蒸气压
在一定温度下,封闭体系当溶液中液体与其蒸气 达到液、气两相平衡时,液面上方的蒸气称为饱和 蒸气,饱和蒸气所产生的压力称为该温度下液体的 饱和蒸气压,简称蒸气压。
水和冰的蒸气压曲线
△Tb=KbmB
四、稀溶液的凝固点降低
• 溶液的凝固点是指固态纯溶剂与液态溶液平衡共 存时的温度。
• 水中溶解难挥发非电解质后,溶液的蒸气压下降,, 也使溶液的凝固点降低。
O
• 难挥发非电解质稀溶液的凝固点降低与溶质B 的 质量摩尔浓度成正比。
△Tb=KbmB
• 测量出难挥发非电解质稀溶液的凝固点降低可计, 算出 B 的摩尔质量。
nB nA
=
nB mA /MA
=
bMBMAmA B
由以上两式,得
△p = pAMAmB = kmB
三、稀溶液的沸点升高
• 在相同温度下,难挥发非电解质稀溶液的蒸气 压总比纯溶剂的低。
• 这样必然导致溶液的沸点高于纯溶剂的沸点, 这种现象称为稀溶液的沸点升高。
O
难挥发非电解质稀溶液的沸点升高与溶质B的 质量摩尔浓度成正比。
例题
分散体系
• 一种物质以极小的颗粒(称为分散相)分散在 另一种物质(分散介质)中所组成的体系叫做 分散体系。
• 分散体系按照分散相颗粒的大小,大致可分为 三类。
液的浓度,R为气体常数,n为溶质的物质的量,T
为绝对温度。
➢ van’t Hoff公式表示,在一定温度下,溶液的渗透 压与单位体积溶液中所含溶质的粒子数(分子数 或离子数)成正比,而与溶质的本性无关。
溶剂蒸气压下降
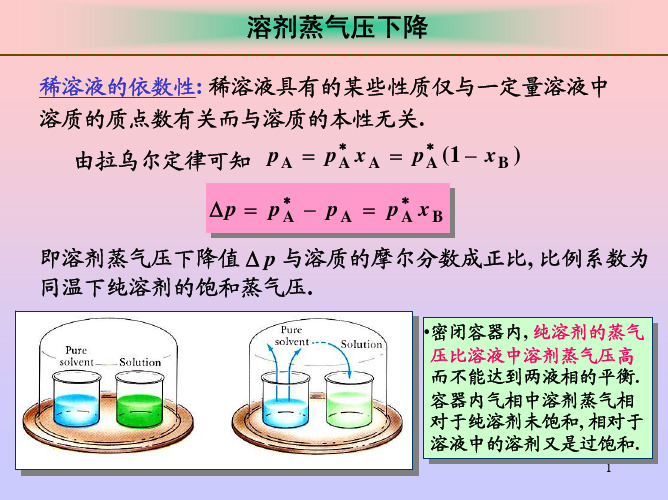
可见在液固平衡温度下, 挥发性组分在液 态和固态时的蒸气压相等.由此可定性解 释凝固点下降的原因(见图).
Tf Tf∗
T
•稀溶液的凝固点降低
6
凝固点下降公式的推导
A(l, Tf , x A , p)
∗ µ A(l) = µ A(s)
A * (s, Tf , p)
A(l, Tf + dT , x A + dx A , p)
继续
dlnx A =
∗ ( S A(l) − Sm, A(s) )
dln x A =
RT Θ ∆ fus H m, A
RT
2
dT =
∗ ( H A(l) − H m, A(s) )
RT
2
dT
dT
∗ Θ H A(l) − H m, A(s) ≈ ∆ fus H m, A 7
凝固点下降公式的推导
RT Θ 若视 ∆ fus H m, A 为与温度无关的常数 , 积分得
Tb∗ Tb T
•稀溶液的沸点上升 纯溶剂的饱和蒸气压 曲线遵守克-克方程
沸点上升系数
ln( p /[ p]) = −
* ∆ vap H m
RT
+C
3
渗透压
渗透压: 渗透平衡时, 溶剂液面和同一水平的溶液截面上所受的 压力之差, 用 Π 表示. ∗ ∗ µ A(l) = µ A(l) + RT ln x A < µ A(l) 渗透发生的原因: 渗透平衡时, 溶液一方压力的变化对溶剂化学势的影响抵 消了组成的影响, 从而有
xA
1
dlnx A
Π V = n B RT Π = c B RT
4
ΠV A = − RT ln x A
溶液的蒸气压凝固点沸点和渗透压
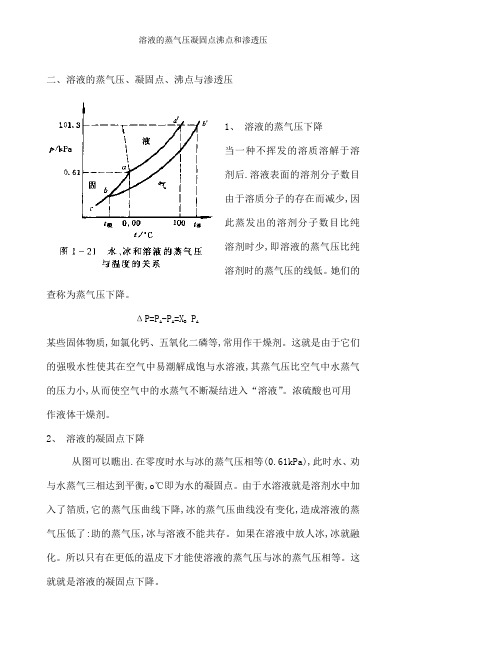
二、溶液的蒸气压、凝固点、沸点与渗透压1、溶液的蒸气压下降当一种不挥发的溶质溶解于溶剂后.溶液表面的溶剂分子数目由于溶质分子的存在而减少,因此蒸发出的溶剂分子数目比纯溶剂时少,即溶液的蒸气压比纯溶剂时的蒸气压的线低。
她们的查称为蒸气压下降。
ΔP=PA -PA=XBPA某些固体物质,如氯化钙、五氧化二磷等,常用作干燥剂。
这就是由于它们的强吸水性使其在空气中易潮解成饱与水溶液,其蒸气压比空气中水蒸气的压力小,从而使空气中的水蒸气不断凝结进入“溶液”。
浓硫酸也可用作液体干燥剂。
2、溶液的凝固点下降从图可以瞧出.在零度时水与冰的蒸气压相等(0.61kPa),此时水、劝与水蒸气三相达到平衡,o℃即为水的凝固点。
由于水溶液就是溶剂水中加入了箔质,它的蒸气压曲线下降,冰的蒸气压曲线没有变化,造成溶液的蒸气压低了:助的蒸气压,冰与溶液不能共存。
如果在溶液中放人冰,冰就融化。
所以只有在更低的温皮下才能使溶液的蒸气压与冰的蒸气压相等。
这就就是溶液的凝固点下降。
Δt凝=k凝m溶液凝固点下降应用很广。
在汽车、坦克的水箱(散热器)中常加人防冻剂乙二酵、酒精、甘油等,其中以乙二醇为优,因为它具有高沸点、高化学稳定性以及从木溶液中结出时形成淤泥状而不就是块状冰特点;在水泥砂浆中加入食盐或氯化钙,能防止冬季产生冰冻现象。
在制冷过程中,用无机盐水溶液作裁冷剂或用冰—无机盐水溶液(共晶冰)作蓄冷剂.使其更适用于低温制冷装置。
3、溶液的沸点上升图中aa’,ac’,bb’线分别表示水、冰与溶液的蒸气压与温度的关系。
当液体的蒸气压等于外界压力时,液体就沸腾,这时的温度称为沸点。
纯水在100℃时的蒸气压等于101、3kPa(等于外界压力),故水的沸点就是100℃。
水中加入难挥发的溶质后,由于溶液的蒸气压曲线下降,只有在更高的温度下才能使它的蒸气压达到101.3kPa而汤踢。
这就就是沸点上升的原因。
实验证明,难挥发物质溶液的拂点总就是高于纯溶剂的沸点。
稀溶液的依数性-视频版-1-溶液的蒸气压下降

由于稀溶液中,bB ≈ cB,所以,
Δp ≈ k ·cB
ppt编号2-1-17
p = po ·xA ∆p = po ·xB
∆p = k ·bB
以上三式均为拉乌尔定律的数学表达式, 均只适用于难挥发性溶质的稀溶液。
ppt编号2-1-7
T/K
273 278 283 293 303 313 323
不同温度下水的饱和蒸汽压
p / kPa
0.610 6 0.871 9 1.227 9 2.338 5 4.242 3 7.375 4 12.333 6
T/K
333 343 353 363 373 423
p / kPa
19.918 3 35.157 4 47.342 6 70.100 1 101.324 7 476.026 2
1、纯液体的蒸气压(p)
蒸发
H2O (l) 凝结 H2O (g)
液态水 T/℃ 一定温度下,当蒸发与凝结速率相等,气相和液 相达到动态平衡时 ,密闭空间蒸汽的含量和压力 保持一定。 在此温度下,与液相处于平衡时蒸汽 所具有 的压力 即此温度下水的蒸气压。
ppt编号2-1-6
液体的蒸气压 p ① p与液体的本性有关 ② 温度升高,p增大 ③ 易挥发性物质的 p大,难挥发性物质的 p 小。
∴ p0- p = p0 xB
令 Δp = p0- p
则有
Δp = p0 ·xB
式中,Δp - 溶液的蒸气压下降值,
po - 纯溶剂的蒸气压,
xB - 溶质的物质的量分数
ppt编号2-1-15
对于稀溶液,有 nA >> nB,
第一章 稀溶液的依数性

高原上煮鸡蛋,为什么煮不熟? 高原上煮鸡蛋,为什么煮不熟?
12
(二)溶液的沸点升高
实验表明, 实验表明,难挥发非电解质溶液的沸点总 是高于纯溶剂的沸点。这一现象称为溶液的沸 是高于纯溶剂的沸点。这一现象称为溶液的沸 点升高(boiling point elevation) 点升高 溶液的沸点升高值(△ 溶液的沸点升高值 △Tb) =溶液的沸点 b) -纯溶剂的沸点 b0) 溶液的沸点(T 纯溶剂的沸点(T 溶液的沸点 即: △Tb=Tb- Tb0 难挥发性非电解质稀溶液的沸点升高的原 因是溶液的蒸汽压低于纯溶剂的蒸汽压。 因是溶液的蒸汽压低于纯溶剂的蒸汽压。
22
例
某非电解质溶解于100g水中,所得溶液 水中, 将4.5g某非电解质溶解于 某非电解质溶解于 水中 时结冰, 在-0.465 0C时结冰,该非电解质的相对分子质量。 时结冰 该非电解质的相对分子质量。 水的K 解:水的 f=1.86 K·kg ·mol-1,因为 mB ∆Tf = Kf bB = Kf mA MB K f ⋅ mB MB = m A ∆Tf 式中m 分别为溶剂和溶质的质量, 式中 A 和mB 分别为溶剂和溶质的质量, MB为溶质的摩尔质量 为溶质的摩尔质量(kg ·mol-1)。代入数值得 。
20
计算0.100mol·kg-1的NaCl溶液的凝固点。 溶液的凝固点。 例 计算 溶液的凝固点 已知水的 水的K 已知水的 f=1.86 K·kg ·mol-1
型电解质, 解 NaCl为AB型电解质,i =2 为 型电解质 ∆Tf = 2×0.100 mol·kg-1×1.86 K·kg·mol –1 × =0.372 K Tf(NaCl) = - 0.372 ℃ 。
21
a.可以测定溶质的相对分子量。 可以测定溶质的相对分子量。 可以测定溶质的相对分子量 凝固点降低法具有灵敏度高、实验误差小、 凝固点降低法具有灵敏度高、实验误差小、 重复测定溶液浓度不变等优点。 重复测定溶液浓度不变等优点。 b.利用凝固点降低的性质,用盐和冰的混 利用凝固点降低的性质, 利用凝固点降低的性质 合物作冷却剂。 合物作冷却剂。 例如采用NaCl和冰,温度可以降到–22oC, 和冰,温度可以降到 例如采用 和冰 , 和冰, 用CaCl2·2H2O和冰,温度可以降到 和冰 温度可以降到–55oC。 。
溶液的蒸气压
分散质粒子直径:
d<1nm
分子、离子分散系 真溶液
单相
d=1~100nm 胶体分散系
高分子溶液 单相
胶体
多相
d>100nm
粗分散系
悬浊液、乳浊液 多相
1.2.2 溶液浓度的表示方法(溶质/溶剂、溶质/溶液)
1.2.2.1 物质的量浓度cB=
nB V
单位:mol·L-1
基Hale Waihona Puke 单元• 物质的量:系统中所含基本单元的量。单位:mol
1231溶液的蒸气压下降1溶液的蒸气压2溶液的蒸气压下降2降低原因3拉乌尔定律一定温度下难挥发非电解质稀溶液的蒸气压下降与溶液的质量摩尔浓度成正比而与溶质的本性无1232溶液的沸点升高为溶剂的沸点升高常数单位kkgmol1难挥发非电解质稀溶液的沸点升高与溶液的质量摩尔浓度成正比而与溶质的本性无关
1.1.2 液体
1.3.3.2 动力学性质——布朗运动
(1)胶体粒子不断受到分散剂粒子在各个方向上的不均匀的 碰撞;
(2)分子热运动。
1.3.3.3 电学性质
(1)电泳:在电场作用下,分散质粒子在分散剂中的定 向移动。
(2)电渗:分散质被固定,分散剂在电场中的定向移动。 用电泳、电渗的方向(正好相反)可判断胶粒带电的性质。 (3)原因:a、固体胶核的吸附作用
△Tb Tb Tbo Kb bB
• Kb为溶剂的沸点升高常数,单位K∙kg∙mol-1
• 难挥发、非电解质、稀溶液的沸点升高与溶液的质量摩尔 浓度成正比,而与溶质的本性无关。
• 例:
1.2.3.3 溶液的凝固点降低
• (1)凝固点(Tf) p冰 =p液体时,系统达固-液两
• 相平衡,此时系统对应的温度。
基础化学教学课件:4.3.1 溶液的蒸气压下降
拉乌尔
拉乌尔定律
• 难挥发性非电解质稀溶 液的蒸气压下降与溶液 浓度的关系。
Raoult定律
① 第一表达式:pA = pA* xA
pA*:纯溶剂蒸气压 pA :溶液的蒸气压 xA :溶剂的摩尔分数
xA < 1 ,故 pA< pA*
② 第二表达式:计算溶液蒸气压的下降值
设:xB为溶质的摩尔分数
∵ xA+ xB =1 pA = pA* xA ∴ pA*= pA*(1- xB)
溶液的蒸汽压下降
溶液的蒸汽压下降
生活中的现象:
一、为什么在高原上煮饭不容易熟? 二、为什么要在结冰的路面上撒盐? 三、为什么输液时通常将药物溶解在0.9% 的生理盐水或5%葡萄糖溶液中?
溶液性质的影响因素
溶液的性质
一、溶液性质与溶质本性有关
颜色、体积、氧化还原性、酸碱性、导电性及表面张力等
颜色
蒸气压下降
如果在上述的纯溶剂中加入溶质配成溶液,会发生怎么样的变化呢?
纯溶剂分子溢出
稀溶液中溶剂分子溢出
溶液的蒸气压 下降
蒸气压下降
蒸气下降
结论:在一定温度下达到平衡时,含 有难挥发性溶质的溶液,其蒸气压总 是低于同温度下纯溶剂的蒸气压。
溶液的蒸气压下降
溶液浓度越大,蒸气压下降越多。
溶剂及稀溶液的蒸汽压示意图
溶液的蒸气压下降
饱和蒸汽压
一定温度下,密闭容器中液相和它的气相 达到平衡状态时,蒸气所具有的分压,简 称蒸气压。
符号表示:P 单位:Pa或kPa
蒸气压的大小由什么决定?
影响蒸气压的因素——物质的本性
相同温度下,不同的液体具有不同的 饱和蒸气压。
沸点越高
• 分子间引力愈大 • 蒸气压越小
溶液蒸气压下降原理的应用
溶液蒸气压下降原理的应用1. 介绍溶液蒸气压下降原理是指当溶液中溶质浓度增加时,溶液的蒸汽压会相应地下降。
这个原理在很多实际应用中都有重要的作用。
2. 蒸气压与浓度的关系溶液的蒸汽压与溶质的浓度之间存在着直接的关系,即随着溶质浓度的增加,溶液的蒸汽压会降低。
这是因为溶质与溶剂之间的分子间相互作用力会影响溶液中溶质分子逸出到气相的能力。
3. 应用1:控制溶液的蒸发速率利用溶液蒸气压下降原理,可以控制溶液的蒸发速率。
通过调整溶液中溶质的浓度,可以选择性地降低溶液的蒸气压,从而减缓溶液的蒸发速率。
这对于需要长时间稳定溶液浓度的实验或者工业生产过程非常重要。
4. 应用2:调节溶液的沸点在溶液中,溶质会降低溶剂的蒸汽压,从而提高溶液的沸点。
这种原理被广泛应用于调节溶液的沸点的实验和工业过程中。
5. 应用3:浸泡液的使用在一些需要控制溶液浓度的情况下,溶液蒸气压下降原理也被应用于浸泡液的使用中。
通过调整溶浸液中溶质的浓度,可以控制溶液与待处理物体之间的物质交换速率。
6. 应用4:蒸馏技术蒸馏是利用液体的沸点差异来分离混合物的一种常用技术。
溶液蒸气压下降原理是这一技术的基础。
在蒸馏过程中,通过调节溶液中溶质的浓度,可以控制溶液的蒸汽压,从而实现混合物的分离。
7. 应用5:湿度控制在某些需要控制湿度的环境中,如实验室、工厂或储存场所等,溶液蒸气压下降原理也被应用于控制湿度。
通过调节溶液中溶质的浓度,可以控制空气中水分的含量,从而实现湿度的控制。
8. 应用6:晶体生长溶液蒸气压下降原理在晶体生长过程中也起着重要的作用。
通过调节溶液中溶质的浓度,可以控制晶体生长速率和晶体的形状。
这对于一些需要精确控制晶体质量的实验或者工业过程非常关键。
9. 结论溶液蒸气压下降原理是一种重要的物理原理,在实际应用中有着广泛的用途。
通过调节溶液中溶质的浓度,可以实现对溶液蒸发速率、沸点、物质交换速率、湿度以及晶体生长速率等的控制。
这些应用对于实验室研究、工业生产和日常生活中都具有重要意义。
4.2.1 稀溶液的蒸气压下降
加入 难挥发 溶质
相平衡
相平衡 被打破
重新建立 相平衡 蒸气压下降
稀溶液的蒸气压
拉乌尔定律
1887年,法国物理学家拉乌 尔根据大量实验结果提出:在 一定温度下,稀溶液的蒸气压 (p液)与溶剂的摩尔分数成正比 (xA),比例系数为纯溶剂的蒸气 压(pA*)
p液 = xA pA*
拉乌尔定律仅适用于难挥发非电解质的稀溶液
4.2.1 稀溶液的蒸气压下降
蒸气压
蒸气压
H2O (l)
汽化 凝结
H2O (g)
相平衡:物质处于两相之间的平衡 相平衡是物理平衡;
相平衡是一种动态平衡;
相平衡状态为饱和状态,此状态下的蒸气称为饱和蒸 气,饱Байду номын сангаас蒸气所具有的压力称为该液体的饱和蒸气压, 简称蒸气压。
蒸气压是液体的重要性质
蒸气压
稀溶液的蒸气压
拉乌尔定律 对于二组分溶液,溶质的摩尔分数xB = 1 − xA
xB pA* = pA* (1 − xA ) = pA* − xA pA* = pA* − p液 = Δp
拉乌尔定律的第二种表述:溶液的蒸气压 下降值(Δp)等于纯溶剂的饱和蒸气压(pA*)与 溶液中溶质的摩尔分数(xB)的乘积
水
温度 / K 水的蒸气压 / kPa
273 0.613
温度
313
373
7.333 101.325
蒸气压是液体的重要性质
蒸气压
乙醚
乙醇
水
化合物 蒸气压 / kPa
298 K 水
3.155
乙醇 7.233
温度 乙醚
73.483
稀溶液的蒸气压
纯溶剂
溶液
稀溶液的蒸气压
