影响化学平衡的条件图像
影响化学平衡的条件及vt图
Chem is try!
例3: 反应 2NO2(g)
N2O4(g)
达平衡后增大压强,平衡如何移动?
【分析】P变化-﹥体积变化-﹥浓度变化 (气体系数之和大的方向,浓度变化更大,即速率变化更大!)
v
V正
V正 ′ V逆′
V逆
t
Chem is try!
对于反应前后气体总体积相等的反应,改变
压强对平衡无影响;
滴加NaOH溶液
增加C(反应物) 向正方向移动 滴加NaOH溶液
现象
改变因素 移动方向
产生红褐色沉淀,溶液红色变浅
减小C(反应物) 向逆方向移动
图像分析: •增加反应物的浓度, V正 瞬间增大, 而V逆不变,V正 > V逆
平衡向正反应方向移动,直到
速率-时间关系图:V”正 = V ”逆,最后建立新的化学平衡。
例:对如下平衡
A(气) + B (气)
2C (气) + D (固)
V正
V正’= V逆’ V正
V逆 0
t1 t2 t3
加压对化学平衡的影响
V正’ = V逆’
V逆 0
t1 t2 t3
减压对化学平衡的影响
Chem is try!
[注意] ①对于反应前后气体总体积相等的反应,改
变压强对平衡无影响;
增大压强,体积 减小,浓度同等程 度增大,颜色变深, 但平衡不移动.
实验目的:探究浓度变化对化学平衡的影响
实验原理:Cr2O72-+H2O
橙色
实验结果及现象:
步骤
滴加3-10滴浓H2SO4
2CrO42-+2H+
黄色
滴加10-20滴 6mol/LNaOH
高中化化学平衡有关图像

B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
12.在一定条件下,可逆反应2X(g) 2y(g)+z(g)(正反应放热),在t1时达到平衡,然后在t2时开始加热至一定温度后停止加热并保温,到t3时又建立平衡,下图中能表示这一变化情况的是()
C.图Ⅱ研究的是温度对反应的影响,且甲的温度较高
D.图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
4.反应:L(固)+aG(气) bR(气)达到平衡时,温度和压强对该反应的影响图所示:图中:压强p1>p2,x轴表示温度,y轴表示平衡混合气中G的体积分数。据此可判断
A.上述反应是放热反应B.上述反应是吸热反应
3.(四川卷)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是()
A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C.反应开始到10 s时,Y的转化率为79.0%
勒沙特列原理适应于各种平衡体系,有着深刻的内涵,学习时要从原理入手,剖析潜在的规律,总结出操作性较强的判断标准.
专练2:可逆反应aA(g)+bB(g) pC(g),反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示压强不同的曲线,B图表示的是温度不同的曲线,试比较下列大小关系:P1______P2,T1______T2,ΔH_____0,a+b______p。
[方法技巧]化学平衡经常会以图像来考查,不仅要掌握影响化学平衡的因素及勒沙特列原理,同时还要掌握识图的方法和一些规律,如“先拐先平数值大”和“定一议二”等原则。
高中化学-化学平衡图像

A.图Ⅰ研究的是 t0 时升高温度对反应速率的影响 B.图Ⅱ研究的是 t0 时增大压强(缩小容积)或使用催化剂对反应
速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
第10min:升温、加入催化剂 第16min:升温
选修 4
第三节 化学平衡
第 6 课时 化学平衡图像
知识回顾
温故追本溯源·方可推陈知新
1. 对于 N2(g)+3H2(g) 2NH3(g) ΔH<0
知识归纳
外界因素对化学平衡的影响
(1)增大 c(N2),平衡向正反应方向移动,N2 的转化率 减小 ,(勒夏特列原理):
① 浓度:增大反应物(或
H2 的转化率 增大 ,N2 的百分含量增大,H2 的百分含量减小。减小生成物)的浓度,
自我检测
1. 一定温度下在密闭容器内进行着某一反应,X 气体、Y 气体的物
质的量随反应时间变化的曲线如图。下列叙述中正确的是 (
)
B
A.反应的化学方程式为 5Y
X
B.t1 时,Y 的浓度是 X 浓度的 1.5 倍
C.t2 时,正、逆反应速率相等
D.t3 时,逆反应速率大于正反应速率
目标定位 知识回顾
目标定位 知识回顾
主目录
学习探究
自我检测
解化学平衡图像题的技巧
(1). 看图象:
①.看面(如:纵坐标与横坐标的意义)
②.看线(如:线的走向和变化趋势、斜率) 1、研究斜率比较速率大小 2、根据正逆反应速率大小、线的变化趋势来判断平衡移动
课件3:2.3.5 化学平衡图像、等效平衡

练习3
右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应速度和 化学平衡的变化情况,ab过程中改变的条件可能
是 ;bc过程中改变的条件可能是
; 若增
大压强时,反应速度变化情况画在c—d处.
V正 V逆
升温 减小[SO3]
三、x% – t 图
x% (或用φ(C) 表示)可以表示反应物、生成 物在反应体系中的物质的量百分数(体积分数)、 或表示反应物的转化率等;
1、将2molSO2和2molSO3 气体混合于固定体积的密闭 容器中,在一定条件下发生反应:2SO2(气)+O2(气) 2SO3 (气),平衡时SO3为n mol。相同温度下,分 别按下列配比在相同体积的密闭容器中加入起始物 质,平衡时SO3的物质的量大于n mol的是( C D)
A. 2mol SO2+1 molO2
说明:转化率与百分含量的情况恰好相反。
例6:某逆反应为:A(g)+B(g)
3C(g),下图中的甲、
乙、丙分别表示在不同条件下,生成物C在反应混合物中
的体积分数 φ(C)与反应时间t的关系。
φ(C) a
φ(C) T1 ℃ φ(C)
a
T2 ℃
b
b
0甲 t
0 乙t
0 丙t
⑴若图甲中的a、b两条曲线分别表示有催化剂和无催化剂 的情况,则曲线 b 表示的是无催化剂时的情况(催化剂
(1) 时 间 t1 的 意 义
是
.
(2) 在 时 间 0 至 t1 的 间 隔 里 , v
(I2)=
.
(3)此平衡状态下,H2的转化
率为
.
(1)达到平衡所用的时间 (2)(0.2/t1 mol·L-1·min-1) (3)50%
影响化学平衡的条件图像
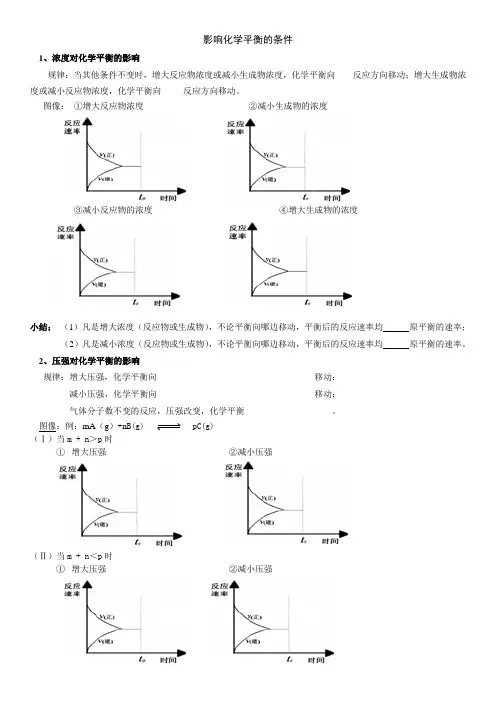
影响化学平衡的条件1、浓度对化学平衡的影响规律:当其他条件不变时,增大反应物浓度或减小生成物浓度,化学平衡向____反应方向移动;增大生成物浓度或减小反应物浓度,化学平衡向_____反应方向移动。
图像:①增大反应物浓度②减小生成物的浓度③减小反应物的浓度④增大生成物的浓度小结:(1)凡是增大浓度(反应物或生成物),不论平衡向哪边移动,平衡后的反应速率均原平衡的速率;(2)凡是减小浓度(反应物或生成物),不论平衡向哪边移动,平衡后的反应速率均原平衡的速率。
2、压强对化学平衡的影响规律:增大压强,化学平衡向____________________________________移动;减小压强,化学平衡向____________________________________移动;气体分子数不变的反应,压强改变,化学平衡____________________。
图像:例:mA(g)+n B(g) pC(g)(Ⅰ)当m + n>p时①增大压强②减小压强(Ⅱ)当m + n<p时①增大压强②减小压强(Ⅲ)当m + n=p时①增大压强②减小压强小结:压强变化直接导致变化。
(1)凡是增大压强,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率;(2)凡是减小压强,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率。
3、温度对化学平衡的影响规律:升高温度平衡向方向移动,降低温度平衡向方向移动。
A(g)+B(g) C(g)△H >0①升高温度②降低温度图像:A(g)+B(g) C(g)△H <0①升高温度②降低温度图像:小结:(1)凡是升高温度,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率;(2)凡是降低温度,不论平衡向哪边移动,平衡后的反应速率均原平衡的速率。
化学平衡和速率图像

3.“平台”类 v-t 图——催化剂(或压强)对化学反应 速率的影响
图像中 v′(正)、v′(逆)都是突然增大,且增大的程度 相同,t1 时刻,图像中出现了“平台”,化学平衡不发生移 动,改变的条件可能是使用了催化剂也可能是对反应前后气 体总体积不发生变化的反应增大了压强。
(2)解题原则——“先拐先平数值大”。 在化学平衡图像中,先出现拐点的反应则先达到平衡,先出 现拐点的曲线表示的温度较高(如图Ⅰ中 T2>T1)、压强较大(如图 Ⅱ中 p2>p1)或使用了催化剂(如图Ⅲ中 a 使用了催化剂)。
Ⅰ.表示 T2>T1,生成物的百分含量降低,说明正反应是放热 反应,温度升高,平衡逆向移动。
图像Ⅱ中,v′(正)渐变,v′(逆)突变,t1 时刻图像中有一条线是 连续的,且 v′(正)>v′(逆),说明 t1 时刻改变的条件是减小了生成 物的浓度,使 v′(逆)突变,平衡正向移动。
2.“断点”类 v-t 图——温度(或压强)对化学反应速率的影响
图像Ⅰ中,v′(正)、v′(逆)都 是突然增大的,t1 时刻,图像中出现 了“断点”,且 v′(正)>v′(逆), 平衡正向移动,说明该反应的正反 应可能是吸热反应(或气体总体积减 小的反应),改变的外界条件B(g) pC(s)+qD(g)反应过程中,
其他条件不变时,产物 D 的质量分数 D%与温度 T 或压强 p
的关系如图所示,请判断下列说法正确的是
A( )
A.降温,化学平衡向正反应方向移动
化学反应速率和化学平衡的图像
化学反应速率和化学平衡的图像
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。
化学课件《化学平衡——化学平衡图像》优秀ppt 人教课标版
v
V(正)
V(正)
V(逆)
V(逆)
时间 t
练习6:
已知反应: 3A( g ) + B( g )
C( s ) + 4D( g )
下图中a、b 表示一定条件下,D的体积分数随时间t的
0.4
(2)反应的化学方程式是:
0.3
______2_A_____2_B__+_C_______
0.2 0.1
(3)8min后,若将容器的体
积缩小一半,c(A)将___增_大____
c(B)将___增_大____c(C)将__增__大___ 0
(填增大、减小、不变);
B A
C 时间(min)
平衡将向___逆_____反应方向移动;达到新的平衡时混 合气体的相对平均分子质量是_____增__大____ , A的转化率 ____减_小____。
A. N2(g) + 3H2(g)
2NH3(g) △H < 0
B. H2(g) + I2(g)
2HI(g) △H < 0
C. 2SO3(g)
2SO2(g) + O2(g) △H > 0
D. 4NH3(g) + 5O2(g) 4NO(g) + 6H2O(g) △H < 0
练习5:
对于达到平衡的可逆反应: X + Y W + Z 增大压 强则反应速率的变化图象如图所示。据此分析 X、Y、 W、Z的聚集状态是
谢谢
85.每一年,我都更加相信生命的浪费是在于:我们没有献出爱,我们没有使用力量,我们表现出自私的谨慎,不去冒险,避开痛苦,也失去了快乐。――[约翰·B·塔布] 86.微笑,昂首阔步,作深呼吸,嘴里哼着歌儿。倘使你不会唱歌,吹吹口哨或用鼻子哼一哼也可。如此一来,你想让自己烦恼都不可能。――[戴尔·卡内基]
化学平衡图像分析
a+b>c 正反应为放热反应
a+b>c 正反应为吸热反应
a+b<c 正反应为吸热反应
a+b=c 正反应为放热反应
5.速率—温度(压强)图
化学平衡的图像分析
对于反应 2SO2 + O2
SO3 △H<0 ,升温或增压时,
v(正)、v(逆)的变化如下图所示:
v
v
v(逆)
v(正)
v(正)
v(逆)
T
T升高,v(逆)加快程度大于v(正)
p
p升高,v(正)加快程度大于v(逆)
下列各图是温度或压强对反应2A(s)+2B(g) 应
化学平衡的图像分析 2C(g)+D(g)(正反
为吸热反应)的正逆反应速率的影响,其中正确的图象是( )
V V正
V
V逆
V正
V逆
A
T
v
V正
V逆
C
P
T
B
V
V逆 V正
P
D
6.平衡线 与 非平衡点
化学平衡的图像分析
α a
3.作出判断: 依题意仔细分析作出正确判断。
这样的图像!
添加标题
情况1:加入催化剂
添加标题
情况2:当a+b=c时, 采用改变压强的方法
添加标题
B%
可逆反应m A(s)+n B(g) e C(g)+f D(g),反应过程中,当 其它条件不变时,C的百分含量(C%) 与温度(T)和压强(P)的关系如下图, 下列叙述正确的是( )
达平衡后,加入催化剂则C%增大
如图所示,反应:X (g) + 3Y (g) 2Z (g)(正反应为放热反应),在不
化学平衡图像
2.c/n-t图象
看起点和终点
浓度减小的是 反应物 ,浓度增大的是生成物 , 若反应物没有全部转化为生成物,即应该用可逆符号。
看图:写反应方程式
VA:VB:VD:VE = ΔCA: ΔCB: ΔCD: ΔCE
= ΔnA: ΔnB: ΔnD: ΔnE =a:b:d:e 2.0 1.5
n
1.0
0.5 0
首先要把握大方向,即升温使正、逆反应速率都变大,所以 B不会是答案;再看起点和终点,由于原反应是平衡的(V逆=V 正),因而起点相同,又由于再次达到平衡(V正=V逆),因而 终点相同,故A不是答案;由于正反应是放热反应,所以升温 使V正和V逆都增大,但逆反应增大得更多,故V逆更大,即V 逆的曲线斜率大,故答案为C。
C A B
t
2A+ B
3C
浓度——平衡——时间曲线
mA(g)+nB(g)
pC(g)+qD(s) △H
此图在t2时,如果是加热,那么△H值是大于0,还 是小于0?如果是减压,那么m+n与p的关系如何?
△H > 0 n
m+n < p
C
A或B
0
t1 t2 t3
t
速度-温度曲线
速度-压强曲线
百分含量
百分含量-温度曲线
pC(g)+qD(g) △H 300C m+n > p+q
200C 100C 分析图像: P1 P
△H < 0
0
物质百分含量——压强——温度曲线
3、对于2A(g)+B(g) C(g)+3D(g)(正反应吸热) 有如下图所示的变化,图中Y轴可能表示: AD
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
v
平衡I
v逆=v正
平衡II
V’逆=v’正
平衡I
v逆=v正
平衡II
V’逆=v’正
o
使用正催化剂
t
o
使用负催化剂
t
[总结] 勒夏特列原理:
如果改变平衡状态的一 个条件(温度、压强、浓度 等),平衡就向着能够减弱 这种改变的方向移动
条件的改变
平衡移动过程中 新平衡建立 时
具体 增大(或减小)向反应物(或生 生成物的浓 反应物(或生 成物)浓度减小 度较原平衡 成物)的浓度 (或增大)的方 时增大 向移动
D% P 1 T1 P 1 T2 P 2 T2 o t
2、讨论温度和压强对化学平衡影响的图 象。如右图:
转化率高说明平衡向正反 应方向移动;转化率低则 说明平衡向逆反应方向移 动。在图中:当讨论温度 对平衡影响时需假设压强 不变,温度升高,转化率 增大,则表示正反应是吸 热反应;当讨论压强对平 衡影响时,需假设温度不 变,压强增大,转化率增 大,则表示正反应是气体 体积缩小的反应。
C. 加催化剂
D. 减小压强
2、下列平衡体系中,改变某条件,平衡将如何 移动? (1)CO+NO2 CO2+NO(正反应放热反应),升 高温度 ,化学平衡向 逆反应方向移动 ,增大压 强化学平衡 不移动 。 (2) 3NO2(g)+ H2 O(l) 2HNO3(l)+NO(g) 通入氧气化学平衡向正反应方向移动 ,增大 压强 正反应方向移动 。
创新解读1:浓度对化学反应速率和化学平衡的影响关系如图所
示。
V V’(正) V V V’(逆)
V’逆=v’正
V’(逆)
V’(逆)
V’逆=v’正
V’(正) V’(正)
V’逆=v’正
O
T
O
A 增加反应物浓度
B降低反应物浓度
T
O
C增加生成物浓度
T
V V V’(逆) V’(正)
V’逆=v’正
V’(正)
V’逆=v’正
v
V’逆
V’逆=v’正 V’正
v
V’正 V’逆=v’正
V’逆
o
Q>0,
T升高
t
o
Q>0, T 降低
t
v
V’正 V’逆=v’正
v
V’逆
V’逆=v’正
V’逆
V’正
o
Q<0,
T升高
t
o
Q<0,T降低
t
4.催化剂对化学平衡的影响
催化剂能同等程度的改变υ正和 υ逆,对 化学平衡移动无影响,但能缩短达到平衡所用的 时间。 创新解读4:催化剂对化学反应速率和化学平衡的影 响关系可用图表示 v
v
V’逆
V’逆=v’正 V’正
v
V’正 V’逆=v’正
V’逆
o
“>”、增大Pt
o
“>”、
t 降低P
o
“<”、增大P
t
v
V’逆
V’逆=v’正 V’正
v
V’逆=v’正 V逆=v正
v V逆=v正
V’逆=v’正
o
“<”、降低 压强
t
o
“=”增大压强
t
o
“=”降低压强
t
3.温度对化学平衡的影响
在其他条件不变的情况下,温度升高,会使化学平衡向着吸热反 应的方向移动;温度降低、会使化学平衡向着放热反应的方向移动。 创新解读 3 :温度对化学反应速率和化学平衡的影响关系如图所示 (Q>0表示正反应放热,Q<0表示正反应吸热)
创新解读4:从结果上看,平衡移动前(υ),后 (υ`),速率间存在如下关系: (1) υ正`= υ逆`>υ正= υ逆 (2) υ正`= υ逆`=υ正= υ逆 (3) υ正`= υ逆`<υ正= υ逆
二、外界条件对化学平衡的影响
1.浓度对化学平衡的影响 在其他条件不变的情况下,增大反应物 的浓度或减小生成物的浓度,都可以使化学平 衡向正反应的方向移动;增大生成物的浓度或 减小反应物的浓度,都可以使化学平衡向逆反 应的方向移动。
V’(逆)
O
D降低反应物浓度
T
O
E同时降低反应物浓度 降低生成物浓度
T
2.压强对化学平衡的影响
在其他条件不变的情况下,增大压强,会使化学平衡向着气体体积缩小的 方向移动;减小压强,会使化学平衡向着气体体积增大的方向移动。 创新解读2:压强对化学反应速率和化学平衡的影响关系如图所示
v
V’正 V’逆=v’正 V’逆
v 转V
化 率
1. × 1 0 1.
10
6
Pa 10
5
Pa
× 1 0
o
T/℃
例题:
某 反 应 aA(g)+b(B)g = dD(g) 在一密闭的容器中进行,当温 度和压强变化时测得反应体系 中 D 的百分含量与时间 t 的关系 如图所示,则 B A.P2>P1;a+b>d;T2>T1,正反 应为放热反应 B.P2>P1;a+b<d;T2>T1,正反 应为放热反应 C.P2<P1; a+b>d;T2<T1,正反 应为放热反应 D.P2<P1;a+b<d;T2<T1,正反 应为吸热反应
增大(或减小)向反应体系压强 气体体积缩 有气体存在的 减小(或增大) 小(或增大) 反应的压强 的方向移动 升高(或降低)向吸热(或放热)反应体系温 温度 反应方向移动 度降低(或 升高) 抽象 改变一个条件 减弱这种变化
[巩固练习]
1、在一定条件下,下列可逆反应达到化 学平衡:H2(g)+I2(g) 2HI(g)(正反 应为放热反应),要是混合气体的紫色加 深,可以采取的方法是 ( B ) A. 降低温度 B. 升高温度
第三节 影响化学平衡的条件
主讲人
ห้องสมุดไป่ตู้
王素红
一、化学平衡移动
[定义] 可逆反应中,旧化学平衡的破坏, 新化学平衡的建立过程,叫做化学平衡移动。 创新解读 1 :从范围上看,化学平衡移动的 使用范围是可逆反应。 创新解读2:从本质上看,化学平衡移动的结 果是在某个方向上(正反应方向,或逆反应方向) 发生了化学反应。 创新解读3:从过程上看,化学平衡移动与化学反应 速率存在下列关系: ①υ(正)> υ(逆)时, 平衡向正反应方向移动 平衡不移动 ②υ(正)= υ(逆)时, ③υ(正)< υ(逆)时, 平衡向逆反应方向移动
(3)2SO2 +O2 2SO 3(正反应放热反应)加入 V2 O5化学平衡 不移动 ,降低温度化学平衡
向 正反应方向移动 。
2.某温度时反应A+B 2C达到平衡 状态,若升高温度,C的平衡浓度增大, 吸 则正反应为 热反应,如果 A为气 态,且增大压强,A的量增大,则B为 态或 液 态,C为 固 态。 气
