第五章相图(冶金物理化学)PPT课件
合集下载
第5章 相图

物质统称为水型物质.
2.可逆与不可逆多晶转变
z 多晶转变相图 4个单相区
晶型II熔融曲线
晶型转变线 晶型I的升华曲线
熔体的蒸气压曲线
3相平衡点: 晶型II的升华曲线 晶型II、熔体和气相
3相平衡点: 晶型I、II和气相
z 多晶转变相图(介稳平衡态)
过热晶型I熔融曲线 过热晶型I的介稳单相区
过冷熔体的介稳单相区
硅钙石:不一致熔 各种高炉矿渣中
水泥熟料生产重要
9%体积效应
C2S:一致熔融化合物 具有复杂的多晶转变 C3S:不一致熔融化合物
2150℃ ~ 1250℃
IV. 三元系统相图
对于三元凝聚态系统, C=3,n=1(T)
相律:F = C-P + n = 4-P
Fmin = 0,Pmax = 4 Pmin = 1,Fmax = 3
z 自由度(F)
在温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内任意改变而不会引起旧相消失或新相产生的 独立变量数目.
z 组分及独立组分(C)
组分 系统中每个能独立分离出来,并能独立存在的化学纯物质. 独立组分 足以表示系统中各个相的组成所需的组分的最小数目.
C = 组分数-独立的化学反应数-独立的限制条件数
M’熔体的结晶路程
液相点
L M’
1
F=2
L→S F=1
3
L→S F=1
5
固相点
L→S 2
4 L→S
6S
M
⑦ 形成有限固溶体的二元相图
B在A中 形成的 固溶体
SA(B)的 溶解度 曲线
B在A中 的最大 固溶度
A在B中 的最大 固溶度
A在B中 形成的 固溶体
2.可逆与不可逆多晶转变
z 多晶转变相图 4个单相区
晶型II熔融曲线
晶型转变线 晶型I的升华曲线
熔体的蒸气压曲线
3相平衡点: 晶型II的升华曲线 晶型II、熔体和气相
3相平衡点: 晶型I、II和气相
z 多晶转变相图(介稳平衡态)
过热晶型I熔融曲线 过热晶型I的介稳单相区
过冷熔体的介稳单相区
硅钙石:不一致熔 各种高炉矿渣中
水泥熟料生产重要
9%体积效应
C2S:一致熔融化合物 具有复杂的多晶转变 C3S:不一致熔融化合物
2150℃ ~ 1250℃
IV. 三元系统相图
对于三元凝聚态系统, C=3,n=1(T)
相律:F = C-P + n = 4-P
Fmin = 0,Pmax = 4 Pmin = 1,Fmax = 3
z 自由度(F)
在温度、压力、组分浓度等可能影响系统平衡状态的变量中, 可以在一定范围内任意改变而不会引起旧相消失或新相产生的 独立变量数目.
z 组分及独立组分(C)
组分 系统中每个能独立分离出来,并能独立存在的化学纯物质. 独立组分 足以表示系统中各个相的组成所需的组分的最小数目.
C = 组分数-独立的化学反应数-独立的限制条件数
M’熔体的结晶路程
液相点
L M’
1
F=2
L→S F=1
3
L→S F=1
5
固相点
L→S 2
4 L→S
6S
M
⑦ 形成有限固溶体的二元相图
B在A中 形成的 固溶体
SA(B)的 溶解度 曲线
B在A中 的最大 固溶度
A在B中 的最大 固溶度
A在B中 形成的 固溶体
冶金物理化学第5章熔渣-脱氧及选择性氧化

6
4.9 钢液脱氧反应 9
4. 注意
1. 2. 脱氧能力最强的元素,其ωmin不是钢液脱氧的实际要求。 对同一脱氧元素,可能有不同的脱氧产物生成。
例:Al脱氧
7
4.9.4 锰、硅、铝的脱氧反应
一、Mn脱氧
Mn是弱脱氧剂.其脱氧产物不能是纯MnO,而是MnO与FeO的熔体。相当于[Mn] 高时的脱氧产物。
4.9 钢液脱氧反应
吹氧 铁 钢
随C含量的降低,钢液中溶解氧的含量会不断提高, 影响: 影响: 后序的合金化; 在钢液冷却与凝固过程发生氧化反应,造成气孔和夹杂。 氧化冶炼终了必须脱氧。 脱氧的基本方法:结合成氧化物而分离去除。
0
4.9 钢液脱氧反应
1. 沉淀脱氧
1
4.9 钢液脱氧反应
1. 沉淀脱氧
再由FeO的熔化自由能数据:
(1)+(6)-(4)得
11
4.9.4 锰、硅、铝的脱氧反应
二、Si脱氧 1600 ℃时,FeO与SiO2能形成熔体。
图7-104.9.4 锰、硅、铝的脱氧反应
三、Al脱氧
铝是强脱氧剂。炼钢中常用它作终脱氧,并可控制晶粒。由FeO-A1203相图。
13
4.9.4 锰、硅、铝的脱氧反应
当W[Al]>(9x 10-6)%时,产物是A1203。所以,一般情况下铝脱氧反应写为:
1600℃ 时, W[Al]低于(9xI0-6)%,含氧超过0.06%时,脱氧产物是FeO-A1203反应为
1600℃
时,
14
4.9.4 锰、硅、铝的脱氧反应
将(a)、(b)两式取对数:
将以上两式作图,如图所示。
15
4.9.4 锰、硅、铝的脱氧反应
相图分析ppt课件
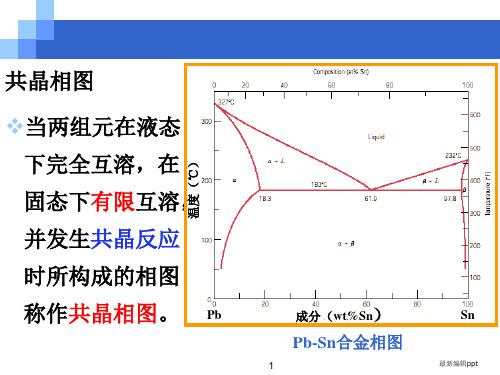
当碳在铁中的含量超过溶解度时,多余碳以Fe3C 形式存在于铁碳合金,称为渗碳体。
Fe3C硬度高、强度低(b35MPa), 脆性大, 塑 性几乎为零。
Fe3C是一个亚稳相,在一定条件下可发生分解: Fe3C→3Fe+C(石墨), 该反应对铸铁有重要意义。
42
最新编辑ppt
⒉ 碳在铁中的固溶度
形成稳定化合物的合金: 性能-成分曲线出现拐点。
❖共晶合金
两相机械混合物的合金: 性能与合金成分呈直线关
系,是两相性能的算术平
均值。
混= ∙Q + β∙Qβ
HB混=HB ∙Q +HBβ∙Qβ
(Q 、Qβ为两相相对重量)36
最新编辑ppt
相图铸造性能的关系
固溶体合金:
液固相线间距越大、偏
析倾向大, 树枝晶发达, 流动性降低, 补缩能力 下降, 分散缩孔增加.
三条水平线hjbpskfe55一工业纯铁002二钢002214c高温组织为单相亚共析钢002077c共析钢077c过共析钢077214c214二fefec合金的平衡结晶过程56三白口铸铁214669c铸造性能好亚共晶白口铸铁21443c共晶白口铸铁43c过共晶白口铸铁43669c21457工业纯铁的结晶过程12点间转变为34点间56点间7点开始从中析出fe585921460共析相图与共晶相图相似共析相图与共晶相图相似共析线共析线pskpsk线线共析点共析点s点点共析温度共析温度共析共析成分成分共析合共析合金金共析成共析成分合金分合金亚共析合金亚共析合金共共析线上共析点以左的合析线上共析点以左的合金金过共析合金过共析合金共析线共析线上共析点以右的合金上共析点以右的合金
61
铁碳合金相图
最新编辑ppt
铁碳相图课件

亚共晶白口铁相组成物与组织组成物相对量
1148
oC时初晶γ相析出完毕,剩余L发生共晶反应,形成Ld;
继续冷却时,初晶γ相和共晶γ相中均将析出Fe3CII,冷却到
727 oC时剩余初晶γ相转变为P,Ld转变为Ld′;
室温相组成:α+Fe3C; 室温组织组成:P+Ld′+Fe3CII 以3.0%C的亚共晶白口铁为例,1148 oC时:
6.69 0.4 w 100% 94% 6.69 0.0218 wFe3C 1 94% 6%
组织组成物相对量
0.77 0.4 100% 49% 0.77 0.0218 wP 1 49% 51% wF先
21/70 21/66 /63
14/70 14/66 /63
2、共析钢结晶过程
室温组织:P(F+Fe3C)
单相液体的冷却
15/70 15/66 /63
匀晶反应 L 相中析出 γ 相(奥氏体 A )
γ单相固溶体的冷却
γ相发生共析反应生成珠光体P
16/70 16/66 /63
共析转变:由一个固相在恒温下转变为另外
两个固相的转变。组织为F+FeC3两相交替排
亚共析钢组织组成物中Fe3CIII最大含量
含0.0218%C的过共析钢冷却到室温时析出的Fe3CIII 最多。 wFe3CIII 0.0218 0.0008 100% 0.3% 6.69 0.0008
4、过共析钢结晶过程
室温组织P+Fe3CⅡ
单相液体的冷却 L相→ γ相(A)
组成物是什么?如何计
算?
5%C钢在1148 oC时 的组织组成物是什 么?如何计算?
!第五章-课件Fe-C相图4

合金在1~2点转变为 , 到3点, 开始析出 Fe3C。奥氏体中析出的Fe3C称二次渗碳体, 用Fe3CⅡ表示, 沿晶界呈网状分布.
温度下降, Fe3CⅡ量增加。到4点, 成分沿
ES线变化到S点,余下的 转变为P。
室温组织为:P+ Fe3CⅡ
凝固过程:L→L+γ→γ→γ+Fe3CⅡ →P + Fe3CⅡ
珠光体金相组织
在同一珠光体中,铁素体和渗碳体具有一定的晶体学位向关系
亚共析钢(Wc=0.0218~0.77% )的平衡结晶过程及组织
冷却曲线如图:
室温组织为:α+ P 的白色为α。 过程如下:L→L+δ→ L+δ+γ→L+γ→ γ→α+γ → α+P+γ→α+ P (析出Fe3CⅢ)
需注意:①室温组织为α+ P, 由于α发生在共析转变之前, 称为先共析铁素体。 ②共析转变之前α和γ的相对量 (即共析转变后α和P的相对量) 可通过杠杆法则计算。
N
L+ H B
J
+
+
S
铁素体
转变过程:L→L+δ→δ→δ+γ→γ →α+γ→α→α+ Fe3CⅢ
共析钢(Wc=0.77%)的平衡结晶过程及组织
合金液体在1-2点间转 变为。到S点发生共析 转变:S⇄P+Fe3C, 全 部转变为珠光体。
L→L+γ→γ→P(α+ Fe3C)
共析钢的室温组织
亚共析钢的室温组织
亚共析钢室温下的组织为F+P . 在0.0218~0.77%C 范围内珠光体量随含碳 量增加而增加。
温度下降, Fe3CⅡ量增加。到4点, 成分沿
ES线变化到S点,余下的 转变为P。
室温组织为:P+ Fe3CⅡ
凝固过程:L→L+γ→γ→γ+Fe3CⅡ →P + Fe3CⅡ
珠光体金相组织
在同一珠光体中,铁素体和渗碳体具有一定的晶体学位向关系
亚共析钢(Wc=0.0218~0.77% )的平衡结晶过程及组织
冷却曲线如图:
室温组织为:α+ P 的白色为α。 过程如下:L→L+δ→ L+δ+γ→L+γ→ γ→α+γ → α+P+γ→α+ P (析出Fe3CⅢ)
需注意:①室温组织为α+ P, 由于α发生在共析转变之前, 称为先共析铁素体。 ②共析转变之前α和γ的相对量 (即共析转变后α和P的相对量) 可通过杠杆法则计算。
N
L+ H B
J
+
+
S
铁素体
转变过程:L→L+δ→δ→δ+γ→γ →α+γ→α→α+ Fe3CⅢ
共析钢(Wc=0.77%)的平衡结晶过程及组织
合金液体在1-2点间转 变为。到S点发生共析 转变:S⇄P+Fe3C, 全 部转变为珠光体。
L→L+γ→γ→P(α+ Fe3C)
共析钢的室温组织
亚共析钢的室温组织
亚共析钢室温下的组织为F+P . 在0.0218~0.77%C 范围内珠光体量随含碳 量增加而增加。
大学材料科学基础 第五章铁碳相图(2)

1.2% C过共析钢室温下平衡组织
计算1.2%C 过共析钢中Fe3CII和Fe3C的含量。
亚共析钢和过共析钢的固态相变区别:亚共析钢中先 共析相是F,过共析钢中先共析相是Fe3C。
The evolution of the microstructure of hypoeutectoid and hypereutectoid steels during cooling. In relationship to the Fe-Fe3C phase diagram.
(2)碳在铁中的固溶体 铁素体:碳在α铁中的间隙固溶体,用α 或F (ferrite) 表示。碳在δ铁中的间隙固溶体 也称高温铁素体,用δ表示。 奥氏体:碳在γ铁中 的间隙固溶体,用γ或A (austenite) 表示。
工业纯铁的显微组织
奥氏体的显微组织
(3)渗碳体(Fe3C,cementite) 渗碳体是铁和碳形成 的化合物,具有复杂的晶 体结构,熔点为1227℃。 渗碳体硬度极高,塑性几 乎等于0,是硬脆相。是 钢中的主要强化相。在一 定条件下,渗碳体可以分 解而形成石墨状的自由碳: Fe3C→3Fe + C(石墨)。这 一过程对于铸铁和具有重 要意义。
三、 铁碳合金相图
铁碳相图的历史很悠久了,早在1897年, 英国皇家矿业学院教授Roberts Austen 就绘制了 世界上第一张铁碳相图,1900年,荷兰阿姆斯特 丹大学的物理化学教授Roozeboom根据相律对其 做了修订,与我们目前使用的铁碳相图已基本相 同。 铁碳合金是现代工业使用最广泛的合金,即 碳钢。生产中使用的钢铁材料90%是碳钢,10% 是合金钢。铁碳相图是研究铁碳合金的重要工具, 对于钢铁材料的研究和使用, 特别是热加工工艺 的制订都有重要的指导意义。
相图在冶金中的应用全解PPT课件

第11页/共59页
第一讲:绪论
• 组元(指独立组元)
• 组元是构成平衡体系中各相所需要的最少的独立 成分。
• 组元数不一定等于构成该体系的物种数。 • 组元数与物种数的区别和联第12页/共59页
第一讲:绪论
• 组元(指独立组元)
• 体系的组元数为1,单元系 • 组元数为2、二元系 • 其余类推
Temperature (oC)
CaO - MgO
Data from FToxid - FACT oxide database 2010
ASlag-liq
0.236
0.410
2374o
AMonoxide + AMonoxide#2
2825o
0.944
0.2
0.4
0.6
0.8
1
mole MgO/(CaO+MgO)
)
G fus A(TB )
RT
ln
a(l) A(TB
)
T
* f,
A
G
fus A
0
fus
H
A
Tf*,
A
S
fus A
第36页/共59页
第二讲:二元系
• 简单共熔(共晶)型二元系相图计算的原理
• A的熔点 处 T f*, A
•
fus
S
A
设
fus
H
A
T* f ,A
随温度
变化fu不sSA大和, f则usH
A
TB
)
T* f ,A
G fus A(TB )
RT
ln
a(l) A(TB
)
R
T
ln
a
第一讲:绪论
• 组元(指独立组元)
• 组元是构成平衡体系中各相所需要的最少的独立 成分。
• 组元数不一定等于构成该体系的物种数。 • 组元数与物种数的区别和联第12页/共59页
第一讲:绪论
• 组元(指独立组元)
• 体系的组元数为1,单元系 • 组元数为2、二元系 • 其余类推
Temperature (oC)
CaO - MgO
Data from FToxid - FACT oxide database 2010
ASlag-liq
0.236
0.410
2374o
AMonoxide + AMonoxide#2
2825o
0.944
0.2
0.4
0.6
0.8
1
mole MgO/(CaO+MgO)
)
G fus A(TB )
RT
ln
a(l) A(TB
)
T
* f,
A
G
fus A
0
fus
H
A
Tf*,
A
S
fus A
第36页/共59页
第二讲:二元系
• 简单共熔(共晶)型二元系相图计算的原理
• A的熔点 处 T f*, A
•
fus
S
A
设
fus
H
A
T* f ,A
随温度
变化fu不sSA大和, f则usH
A
TB
)
T* f ,A
G fus A(TB )
RT
ln
a(l) A(TB
)
R
T
ln
a
金属材料与热处理第五章-铁-碳-合-金ppt课件

改变。
29
图5-21 铁碳合金组织、性能与成分的对应关系
30
五、铁碳相图的应用
铁碳相图从客观上反映了钢铁材料的组织随 化学成分和温度变化的规律, 因此,在工程上为选材 及制定铸造、锻造、焊接、热处理等热加工工 艺提供了重要的理论依据。
1.在选材方面的应用
31
铁碳相图揭示了合金的性能与成分之间的关系,为合理 选择材料提供了依据。 2.在制定热加工工艺方面的应用
AC线和DC线为液相线,铁碳合金在液相线温度以上处于 液态,用符号L表示。
11
表5- 1 Fe-Fe3C相图中的特性点
12
表5-2 Fe-Fe3C相图中的特性线
13
3.相图中各相区分析 Fe-Fe3C相图中各相区的相组分见表5-3。
14
表5-4 铁碳合金的分类
二、铁碳合金的分类 在Fe-Fe3C相图中,按碳的质量分数和室温平衡组织
碳溶于α-Fe中所形成的间隙固溶体称为铁素体,用符号 F表示。
5
6
图5-5 渗碳体的晶体结构示意图
7
二、奥氏体
碳溶于γ-Fe中所形成的间隙固溶体称为奥氏 体,用符号A表示。 三、渗碳体
渗碳体的分子式为Fe3C,它是一种具有复杂 晶体结构的金属化合物,其晶体结构如图5-5所示。
8
第二节 铁 碳 相 图 Fe-Fe3C相图是指在极其缓慢的冷却条件下,
44
5.叙述铁碳合金的平衡组织、性能随碳的质量分数变化的规
律。
6.为什么铸铁适于铸造成形,而钢适于压力加工成形?
45
42
8.铁碳相图有哪几个方面的应用?
练习题 1.现有三种铁碳合金,一种合金的显微组织中珠光体量占80 %,铁素体量占20%;第二种合金的显微组织中全部为珠光体; 第三种合金的显微组织中珠光体量占95%,二次渗碳体量占5 %。问这三种合金各属于哪一类合金?其碳的质量分数各是 多少?
29
图5-21 铁碳合金组织、性能与成分的对应关系
30
五、铁碳相图的应用
铁碳相图从客观上反映了钢铁材料的组织随 化学成分和温度变化的规律, 因此,在工程上为选材 及制定铸造、锻造、焊接、热处理等热加工工 艺提供了重要的理论依据。
1.在选材方面的应用
31
铁碳相图揭示了合金的性能与成分之间的关系,为合理 选择材料提供了依据。 2.在制定热加工工艺方面的应用
AC线和DC线为液相线,铁碳合金在液相线温度以上处于 液态,用符号L表示。
11
表5- 1 Fe-Fe3C相图中的特性点
12
表5-2 Fe-Fe3C相图中的特性线
13
3.相图中各相区分析 Fe-Fe3C相图中各相区的相组分见表5-3。
14
表5-4 铁碳合金的分类
二、铁碳合金的分类 在Fe-Fe3C相图中,按碳的质量分数和室温平衡组织
碳溶于α-Fe中所形成的间隙固溶体称为铁素体,用符号 F表示。
5
6
图5-5 渗碳体的晶体结构示意图
7
二、奥氏体
碳溶于γ-Fe中所形成的间隙固溶体称为奥氏 体,用符号A表示。 三、渗碳体
渗碳体的分子式为Fe3C,它是一种具有复杂 晶体结构的金属化合物,其晶体结构如图5-5所示。
8
第二节 铁 碳 相 图 Fe-Fe3C相图是指在极其缓慢的冷却条件下,
44
5.叙述铁碳合金的平衡组织、性能随碳的质量分数变化的规
律。
6.为什么铸铁适于铸造成形,而钢适于压力加工成形?
45
42
8.铁碳相图有哪几个方面的应用?
练习题 1.现有三种铁碳合金,一种合金的显微组织中珠光体量占80 %,铁素体量占20%;第二种合金的显微组织中全部为珠光体; 第三种合金的显微组织中珠光体量占95%,二次渗碳体量占5 %。问这三种合金各属于哪一类合金?其碳的质量分数各是 多少?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
T
τ→
A
xB→
B
纯物质:均匀降温→液态凝固(T不变) →均匀降温
合金:均匀降温→有固体析出(降温变缓)→两种固体
同时析出(T不变) →均匀降温
重庆科技学院
冶金与材料工程学院
第五章 相图
具有简单共晶体的二元系相图
T
T* f, A
T* f, B
重庆科技学院
G
E
H
A
B
xB→
冶金与材料工程学院
第五章 相图
TM →T1 M →a1 M→ a1 b1
T1 →T2 a1 →m a1 →a2 b1→ b2
T* f, B
T2 →TE m →n a2 →E b2→ H T < TE n → —— H →, G →
b1(T1) b2(T2) H
B
无论从何处开始, 体系点达到共晶线 液相组成达到E点
冶金与材料工程学院
冶金与材料工程学院
第五章 相图
5.3.4 常见的几种二元系相图
◆具有简单共晶体(前已讲) ◆生成化合物 ◆完全互熔的固熔体型 ◆固态部分互溶的固熔体型 ◆液态部分互溶型
重庆科技学院
冶金与材料工程学院
第五章 相图
(1)具有简单共晶体的二元系相图 基本要求:
体系最低熔点(共晶点 f=0);T
共晶线,共晶反应
5.3.2 简单共晶二元系相图分析
(1)点:
纯物质凝固点——
T
* f, A
和
T
* f, B
,f
= 0;
共晶点——E,三相点, T
f E = 2-3+1=0;
T* f, A
T* f, B
共晶反应:
l(E) 冷却 sA(G) + sB(H)
G
加热
E
H
重庆科技学院
A
B
xB→
冶金与材料工程学院
第五章 相图
冶金与材料工程学院
第五章 相图
5.2 相律
相律:研究相态变化的规律。 相数(Φ ),组元数(K),自由度数(f )之间的变化规律。
①相数:体系中所含相的数目,记为Φ。 相数的计算方法:
自然界中物质有三种存在形态(s,l,g) 气态:一般能无限混合 ——单相 液态:完全互溶 —— 单相
不完全互溶 —— 多相 固态:一般不能互溶 —— 多相
第五章 相图
分析相图:点、线、面(区)的意义
三条二元平衡线将平面图分
为三个区,交于一个点O
线:两相平衡 ,两相平衡线
pC
A
面: AOB(g) ,AOC(L) ,BOC(S)
水
(单相平衡)
p2
点O:p = 610Pa
p1 冰 F
O 水蒸气
T = 273.01K 三相平衡
(三相平衡点)
重庆科技学院
B T1 T2 T
第五章 相图
5.3.3 杠杆规则(计算平衡时各相的量)
以物系点M的冷却过程为例
T
M
T* f, A
T* f, B
G
a1 a2 m
n
E
b1(T1) b2(T2) H
A
xB→
B
重庆科技学院
T2 :
Wl(a2) b2m
WB(s,b2 )
a2m
刚到 TE :
Wl(E) Hn W En B(s,H)
刚完成:共W晶 A(G s,) Hn W Gn B(,sH)
(2) 线:
A物液相线——
T E * f, A
液相线上,f = 2-2+1=1;
; B物液相线—— Tf,*B E
共晶线——GEH线,三相线, f = 2-3+1=0;
T
(3)面:
单相区—— 液相线以上
T* f, A
f = 2-1+1=2;
两相区—— 和Tf,*BGEHHBA Tf*,A EG
l + sA
第五章 相图
第五章 相图
5.1 水的相图 5.2 相律 5.3 二元系相图及应用 5.4 三元系相图及应用
重庆科技学院
冶金与材料工程学院
第五章 相图
5.1 水的相图
相图:用几何的方法表示相平衡关系。 T、P、组成和相数相互关系的几何图形。
相:体系中物理、化学性质完全一致的所有部分的总和。
绘制:(1)实验 测 H2O(L)= H2O(g) 平衡的 T ,p H2O(S)= H2O(g)
G
f = 2-2+1=1;
l
E
sA + sB
T* f, B
l + sB
H
总结相区标注的规律,会标注相区 A
(相邻相区相数差1 )
重庆科技学院
B
xB→
冶金与材料工程学院
第五章 相图
(4)冷却过程分析
温度 体系点 液相点 固相点
T
T* f, A
G A
M
a1 a2 m
n E
xB→
重庆科技学院
TM
M
M ——
固溶体 —— 单相
重庆科技学院
冶金与材料工程学院
第五章 相图
②组元和组元数
组元(组分),也称独立组元 描述体系中各相组成所需最少的、能独立存在的物质
组元(分)数: 体系中组元的个数,简称组元,记为K。 无化学反应体系:组元数 = 物种数(S) 有化学反应(R)体系:组元数 ≠ 物种数 如 H2(g), O2(g), H2O(g) ★ 常温、常压下, K = 3 ★ 2000℃、常压下,2H2(g)+ O2(g) == 2H2O(g)
(L=S1+S2);分析物系点
T* f, A
T* f, B
的结晶过程。
应用:造渣材料、耐火材料 G 选择组成配比
独立反应式数R=1 , K = S-R=3-1=2
Kp
p2 H2O
p p 2 H2 O2
重庆科技学院
冶金与材料工程学院
第五章 相图
③自由度或独立变量
自由度:指体系可变因素(T、P 、C…)的数目,这些
因素在一定程度内变动时新相不产生,旧相不消失。
用符号 f 表示。
自由度数=独立变量数
f=K-φ+2 相律的数学式
冶金熔体,凝聚相 ,P影响小
f=K-φ+1
讨论温度——组成图
5.3.1 绘制二元系相图(热分析法)
方法: 称样 →熔化→ 缓慢冷却过程中记录τ、t℃ →作t℃——τ图 (步冷曲线图) → 绘t℃——组成图
重庆科技学院
冶金与材料工程学院
第五章 相图
T 纯A ① ② ③ ④ ⑤ 纯B
二元系相图
步冷曲线各 段 f=?
式中的2——考虑T、P两个与外界有关的因素 若对凝聚相,忽略P的影响:f=K-φ+1(如冶金炉渣) 若考虑外界T、P、磁场的影响:f=K-φ+3
通式可写成: f=K-φ+n
重庆科技学院
冶金与材料工程学院
第五章 相图
5.3 二元系相图
二元相图:f=K-φ+2 fmax=2-1+2=3 φmax= K-f+2=2-0+2=4
H2O(S)= H2O(L) (2)作p—T图
重庆科技学院
冶金与材料工程学院
第五章 相图
水的相图 p-T图 —— 根据实验数据绘制
OA:L—g平衡 OC:L—S平衡 OB:S—g平衡 O:p =610Pa
T = 273.01K
重庆科技学院
pC
p2 p1 冰
F
A 水O 水蒸气来自B T1 T2 T冶金与材料工程学院
τ→
A
xB→
B
纯物质:均匀降温→液态凝固(T不变) →均匀降温
合金:均匀降温→有固体析出(降温变缓)→两种固体
同时析出(T不变) →均匀降温
重庆科技学院
冶金与材料工程学院
第五章 相图
具有简单共晶体的二元系相图
T
T* f, A
T* f, B
重庆科技学院
G
E
H
A
B
xB→
冶金与材料工程学院
第五章 相图
TM →T1 M →a1 M→ a1 b1
T1 →T2 a1 →m a1 →a2 b1→ b2
T* f, B
T2 →TE m →n a2 →E b2→ H T < TE n → —— H →, G →
b1(T1) b2(T2) H
B
无论从何处开始, 体系点达到共晶线 液相组成达到E点
冶金与材料工程学院
冶金与材料工程学院
第五章 相图
5.3.4 常见的几种二元系相图
◆具有简单共晶体(前已讲) ◆生成化合物 ◆完全互熔的固熔体型 ◆固态部分互溶的固熔体型 ◆液态部分互溶型
重庆科技学院
冶金与材料工程学院
第五章 相图
(1)具有简单共晶体的二元系相图 基本要求:
体系最低熔点(共晶点 f=0);T
共晶线,共晶反应
5.3.2 简单共晶二元系相图分析
(1)点:
纯物质凝固点——
T
* f, A
和
T
* f, B
,f
= 0;
共晶点——E,三相点, T
f E = 2-3+1=0;
T* f, A
T* f, B
共晶反应:
l(E) 冷却 sA(G) + sB(H)
G
加热
E
H
重庆科技学院
A
B
xB→
冶金与材料工程学院
第五章 相图
冶金与材料工程学院
第五章 相图
5.2 相律
相律:研究相态变化的规律。 相数(Φ ),组元数(K),自由度数(f )之间的变化规律。
①相数:体系中所含相的数目,记为Φ。 相数的计算方法:
自然界中物质有三种存在形态(s,l,g) 气态:一般能无限混合 ——单相 液态:完全互溶 —— 单相
不完全互溶 —— 多相 固态:一般不能互溶 —— 多相
第五章 相图
分析相图:点、线、面(区)的意义
三条二元平衡线将平面图分
为三个区,交于一个点O
线:两相平衡 ,两相平衡线
pC
A
面: AOB(g) ,AOC(L) ,BOC(S)
水
(单相平衡)
p2
点O:p = 610Pa
p1 冰 F
O 水蒸气
T = 273.01K 三相平衡
(三相平衡点)
重庆科技学院
B T1 T2 T
第五章 相图
5.3.3 杠杆规则(计算平衡时各相的量)
以物系点M的冷却过程为例
T
M
T* f, A
T* f, B
G
a1 a2 m
n
E
b1(T1) b2(T2) H
A
xB→
B
重庆科技学院
T2 :
Wl(a2) b2m
WB(s,b2 )
a2m
刚到 TE :
Wl(E) Hn W En B(s,H)
刚完成:共W晶 A(G s,) Hn W Gn B(,sH)
(2) 线:
A物液相线——
T E * f, A
液相线上,f = 2-2+1=1;
; B物液相线—— Tf,*B E
共晶线——GEH线,三相线, f = 2-3+1=0;
T
(3)面:
单相区—— 液相线以上
T* f, A
f = 2-1+1=2;
两相区—— 和Tf,*BGEHHBA Tf*,A EG
l + sA
第五章 相图
第五章 相图
5.1 水的相图 5.2 相律 5.3 二元系相图及应用 5.4 三元系相图及应用
重庆科技学院
冶金与材料工程学院
第五章 相图
5.1 水的相图
相图:用几何的方法表示相平衡关系。 T、P、组成和相数相互关系的几何图形。
相:体系中物理、化学性质完全一致的所有部分的总和。
绘制:(1)实验 测 H2O(L)= H2O(g) 平衡的 T ,p H2O(S)= H2O(g)
G
f = 2-2+1=1;
l
E
sA + sB
T* f, B
l + sB
H
总结相区标注的规律,会标注相区 A
(相邻相区相数差1 )
重庆科技学院
B
xB→
冶金与材料工程学院
第五章 相图
(4)冷却过程分析
温度 体系点 液相点 固相点
T
T* f, A
G A
M
a1 a2 m
n E
xB→
重庆科技学院
TM
M
M ——
固溶体 —— 单相
重庆科技学院
冶金与材料工程学院
第五章 相图
②组元和组元数
组元(组分),也称独立组元 描述体系中各相组成所需最少的、能独立存在的物质
组元(分)数: 体系中组元的个数,简称组元,记为K。 无化学反应体系:组元数 = 物种数(S) 有化学反应(R)体系:组元数 ≠ 物种数 如 H2(g), O2(g), H2O(g) ★ 常温、常压下, K = 3 ★ 2000℃、常压下,2H2(g)+ O2(g) == 2H2O(g)
(L=S1+S2);分析物系点
T* f, A
T* f, B
的结晶过程。
应用:造渣材料、耐火材料 G 选择组成配比
独立反应式数R=1 , K = S-R=3-1=2
Kp
p2 H2O
p p 2 H2 O2
重庆科技学院
冶金与材料工程学院
第五章 相图
③自由度或独立变量
自由度:指体系可变因素(T、P 、C…)的数目,这些
因素在一定程度内变动时新相不产生,旧相不消失。
用符号 f 表示。
自由度数=独立变量数
f=K-φ+2 相律的数学式
冶金熔体,凝聚相 ,P影响小
f=K-φ+1
讨论温度——组成图
5.3.1 绘制二元系相图(热分析法)
方法: 称样 →熔化→ 缓慢冷却过程中记录τ、t℃ →作t℃——τ图 (步冷曲线图) → 绘t℃——组成图
重庆科技学院
冶金与材料工程学院
第五章 相图
T 纯A ① ② ③ ④ ⑤ 纯B
二元系相图
步冷曲线各 段 f=?
式中的2——考虑T、P两个与外界有关的因素 若对凝聚相,忽略P的影响:f=K-φ+1(如冶金炉渣) 若考虑外界T、P、磁场的影响:f=K-φ+3
通式可写成: f=K-φ+n
重庆科技学院
冶金与材料工程学院
第五章 相图
5.3 二元系相图
二元相图:f=K-φ+2 fmax=2-1+2=3 φmax= K-f+2=2-0+2=4
H2O(S)= H2O(L) (2)作p—T图
重庆科技学院
冶金与材料工程学院
第五章 相图
水的相图 p-T图 —— 根据实验数据绘制
OA:L—g平衡 OC:L—S平衡 OB:S—g平衡 O:p =610Pa
T = 273.01K
重庆科技学院
pC
p2 p1 冰
F
A 水O 水蒸气来自B T1 T2 T冶金与材料工程学院
