乙氧亚甲基乙酰乙酸乙酯及其类似物的合成与应用
乙酰乙酸乙酯的合成

⼄酰⼄酸⼄酯的合成⼄酰⼄酸⼄酯的合成学院:化⼯与材料学院班级:B1201姓名:康丽霞学号:15111201061 分⼦结构2 基本信息3物性数据1. 性状:⽆⾊液体,有芳⾹味。
2. 沸点(oC,101.3kPa):1813. 熔点(oC,酮式):-394. 熔点(oC,烯醇式):-445. 相对密度(g/mL,25/4oC):1.021266. 相对蒸汽密度(g/mL,空⽓=1):4.57. 折射率(20oC):1.41948. 黏度(mPa·s,25oC):1.50819. 闪点(oC,闭⼝):84.410. 燃点(oC):29511. 燃烧热(KJ/mol,25oC):3162.712. ⽐热容(KJ/(kg·K),24.5oC,定压):1.9213. 临界温度(oC):40014. 电导率(S/m,25oC):1×10-715. 蒸⽓压(kPa,40~41oC):0.2716. 热导率(W/(m·K),30oC):0.155817. 溶解性:微溶于⽔,溶于有机溶剂。
25℃时在⽔中溶解12%;⽔在⼄酰⼄酸⼄酯中溶解4.9%。
18. 相对密度(20℃,4℃):1.028219. 液相标准热熔(J·mol-1·K-1) :251.420. ⽓相标准燃烧热(焓)(kJ·mol-1):-3228.521. ⽓相标准声称热(焓)( kJ·mol-1) :-561.774 存储⽅法1.应远离⽕源置阴凉通风处贮存。
2.本品⽤铝桶包装,桶盖密封性要好,贮于阴凉通风处,防⽕。
按易燃有毒化学品规定贮运5 合成⽅法1. 双⼄烯酮与⼄醇酯化法双⼄烯酮和⽆⽔⼄醇在浓硫酸催化下进⾏酯化,得⼄酰⼄酸⼄酯粗品。
再经减压精馏得成品。
2.⼄酸⼄酯⾃缩合法由两分⼦⼄酸⼄酯在⾦属钠存在下⾃缩合⽽得。
2. 由⼄酸⼄酯在⼄醇钠存在下缩合后蒸馏⽽得。
由双⼄烯酮与⽆⽔⼄醇在浓硫酸催化下酯化后减压蒸馏⽽得。
合成亮菌甲素的新工艺路线

合成亮菌甲素的新工艺路线孙正萍马新民陶琳(南京制药厂有限公司,江苏南京210007)摘要:KBH4-ZnCL2-THF-C6H5CH3 还原体系在93~95 ℃时的还原活性较强,能使3,5二羟基苯甲酸直接还原成3,5二羟基苯甲醇。
关键词:硼氢化钾;硼氢化锌;还原体系;3,5二羟基苯甲酸;3,5二羟基苯甲醇Armillarisin A the New Technology of ProcessSun Zh e ngp i ng M a X inmin Tao li n(N a n ji ng ph a rm a c e ut i c a l C o.,L T D,N a n ji ng210007,Ch i n a)A bs tr ac t:KBH4-Z nC L2-TH F-C6H5C H3r educ t i on s ystem i s very ac t i v a t e i n93~95 ℃, 3,5 2-hydroxy benzoic ac i d c an be redacted to 3,5 2-hydroxy benz y l a l cohol dir ec t l y.K e y w ords:Pota ss i um borohydr i de;z i nc borohydr i de;r educ t i on system;3,5 2-hydroxy benzoic ac i d;3,5 2-hydroxy benz y l a l cohol亮菌甲素,学名假密环菌甲素(Ar m ill a r i s i num A),是一种新的香豆类化合物,是从亮菌中提取的有效成分之一,亦可人工合成。
为黄色或微带橙黄色长方形板状结晶或结晶性粉末,无臭。
在水中几乎不溶,在乙醇或甲醇中极微溶解。
亮菌甲素的分子式为C12H10O5,化学名为3-乙酰基-5-羟甲基-7-羟基香豆素。
分子量为234,熔点245℃。
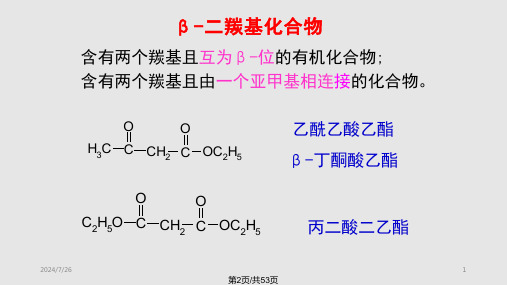
有机化学二羰基化合物
碳氧双键处于共轭体系,发生了电子的离域,使体
系能量降低而趋于稳定。
:OH
H3C C CH
O C OC2H5
2024/7/26
4
第5页/共53页
影响烯醇式含量的其它因素:
① 活泼亚甲基上连有吸电子基团,烯醇式含 量↑,连有供电子基团,烯醇式含量↓。
O
O
O
O
H3C
C
CH
C OC2H5 > H3C
C
CH2
2+
Hg
+
H
OH CH CH2
O CH3C H
β-二羰基化合物的烯醇式结构稳定性:乙酰乙酸乙酯
实验事实:
① 能与NaHSO3、HCN等发生加成反应; ② 能与羟胺、苯肼反应,生成肟、苯腙等; ③ 能被还原成β-羟基酸酯; ④ 经水解、酸化后,可以脱羧生成丙酮。
O
O
H3C C CH2 C OC2H5
有羰基
O CH3C CH
O COC2H5
Na+
Br(CH2)4Br
O CH3C
C2H5ONa
COCH3
成酮分解
COOC2H5
O CH COC2H5 CH2(CH2)3Br
O
CCH3
2024/7/26
28
第29页/共53页
② 制二酮
2024/7/26
制β-二酮(1,3-二酮)
O CH3C CH
O COC2H5
第11页/共53页
三、丙二酸二乙酯的合成及应用
1、丙二酸二乙酯的制法 2、丙二酸二乙酯在有机合成上的应用
① 制备烃基取代乙酸 ② 制备二元羧酸
2024/7/26
乙酰乙酸乙酯及在合成上的应用ppt课件

该反应可由酰胺制备有机腈类化合物。
N + H2O
•脱羰反应-霍夫曼(Hofmann)降级反应
RCONH2 + Br2 + 4NaOH H2O
RNH2 + 2NaBr + Na2CO3 + 2H2O
该反应可由酰胺制备少一个碳原子的伯胺,产率较高.
•与亚硝酸的反应
RCONH2 + HNO2
RCOOH + N2 + H2O
该反应可用于酰胺的鉴别和定性分析。
•酰胺的水解
HCl
加热
RCOOH + NH4Cl
RCONH2 + H2O
NaOH RCOONa + NH3
加热
在有机合成上,氨基的酰化在水解,多用于氨基的保护。
•酰胺的酸碱性
酰胺是近中性化合物,这是由于氮原子上的未共用电子对与碳基 上的π电子形成共轭体系,电子云向羰基方向移动,降低了氮原 子上的电子云密度,使其结合质子的能力减弱。
目标要求
1.掌握几种类型的羧酸衍生物结构及命名 2.了解羧酸衍生物的物理性质及光谱性质 3.掌握羧酸衍生物的化学性质 4.掌握羧酸衍生物的亲核取代反应机理及反应活性 5.了解羧酸衍生物的相互转换 6.掌握乙酰乙酸乙酯、丙二酸二乙酯的性质及在合成中的应用 7.学会设计有机合成路线
一、羧酸衍生物结构和命名
'
R
反应可逆
-羰基酯
= =
= =
=
=
=
反应机理:
C2H5O
αH O
+ CH2 C OC2H5
O
C2H5OH
CH2 C OC2H5
O
O
O
乙氧亚甲基丙二腈和乙氧亚甲基氰乙酸乙酯的合成与应用进展

基 氰 乙酸 乙酯 或 乙氧 甲烯 基 氰 乙 酸 乙酯 ,或 2 氰 一 基 一 一 氧基丙 烯 酸 乙酯 , 3 乙氧基 ~ 一 3乙 或 一 2 氰基 丙烯 酸 乙酯 ,英 文 名 eh l tov eh l ev na e t, ty e x m tve c a oct e h n a 分 子 式 CH O H= C C )C O t , 一 个 相 当 于 1 C (N ( O E ) 是
2 1 年第 l 0 1 8卷第 6期
化 工 生产 与技 术
C e c l rd cina dT c n l y h mi o u t n eh oo aP o g
・3 1・
乙氧亚 甲基丙 . - 乙氧亚 甲基氰 乙酸 乙酯的 合成 与 应 用 进 展
郑 土 才
( 州 学院化 学与材 料 工程 学院 , 江 衢 州 3 4 0 ) 衢 浙 2 0 0
乙酸 甲酯(c、 甲胺 基 亚 甲基 氰 乙酸 乙酯 fd和二 2 )二 2)
甲胺基 亚 甲基氰 乙酸 甲酯 (e, 这些 化合 物 同样极 2 )但
1 合成
11 乙氧亚 甲基丙 二腈 .
少 见诸 报道 。上 述化 合物 的结 构式 为 :
CN
/
CN
1一般 都 以丙 二腈 与原 甲酸 三 乙酯 在 醋酸 酐存
C N
厂
=
—
—
CN
—
f
:
CN
\
Me o
 ̄ OE , 2 O t
2 b
 ̄
Me
CO OM e, 2 c
CN M e N 2 COOEt M e N , 2 2 d
CN CO0 M e 。 2 e
乙酰乙酸乙酯的合成

2
2
补充3: (3)环状一元羧酸
n=2, 易开环
• 二卤化物( Br(CH 2)nBr, n=3~7)与丙二酸酯的成 环反应
CH2 (COOC2H5 )2
2 C2H5ONa
COOC2 H5 COOC2 H5
Br(CH2)5Br
注意物料比1:1
COOH
• 利用丙二酸酯为原料的合成方法,常称为丙二酸酯 合成法。
合成甲基酮(丙酮同系物)和一元羧酸(乙酸同系物)
两个卤代烃(不同) 分步取代,否则产物 复杂化。
补充5:
第1步 取代
第2步 取代
合成:甲基环烷基甲酮
物料比 1:1
若:物料比为 2:1,如书中习题9 (4)(考研题)
比 较 产 物
1,3-丁二烯与Br2的 1,4加成, 氢化.
与无-H的 醛缩合
•烯醇负离子的共振式:
• 由于有烯醇式的存在,所以叫烯醇负离子;又由于亚
甲基上也带有负电荷,反应往往发生在此碳原子上, 所以这种负离子也称为碳负离子。
14.2 -二羰基化合物碳负离子的反应
主 要
• 碳负离子的反应类型: (1)与卤烷反应:即羰基碳原子的烷基化或烷基化反应 (2)与羰基化合物反应:常称为羰基化合物和-二羰基化合 物的缩合反应;当与酰卤或酸酐作轭加成反应或 1,4-加成 反应.
与FeCl3作用 不显色
• 亚甲基对于两个羰基来说都是位置,所以-H特别活 泼。 -二羰基化合物也叫含有活泼亚甲基的化合物。
14.1 -二羰基化合物的酸性和烯醇负离子的稳定性 • 酸性:亚甲基同时受到两个羰基的影响,使-H有 较强的酸性(比醇和水强)。 • 互变异构生成烯醇式。在碱作用下,生成负离子:
有机化学 Organic Chemistry
乙酰乙酸乙酯合成及后处理方法的筛选

乙酰乙酸乙酯合成及后处理方法的筛选
乙酰乙酸乙酯是一种常见的有机化合物,具有广泛的应用领域。
本文旨在探讨乙酰乙酸乙酯的合成及后处理方法的筛选。
乙酰乙酸乙酯的合成方法有许多种,常见的包括酸催化法、碱催化法、酶催化法等。
在这些方法中,酸催化法是最常用的方法之一。
该方法通常使用硫酸或磷酸等强酸作为催化剂,将乙醇和乙酸酐反应,生成乙酰乙酸乙酯。
但是,酸催化法存在酸侵蚀、产物纯度低等问题,因此需要寻找更为优化的方法。
一种可能的优化方法是使用离子液体作为催化剂。
离子液体具有高催化活性、低毒性、易回收等优点,可用于代替传统的有机溶剂催化剂。
此外,离子液体还可通过改变其结构和配位离子等方式来调控反应的速率和选择性。
在乙酰乙酸乙酯的后处理过程中,通常需要进行蒸馏、结晶、过滤等步骤,以提高产物的纯度和收率。
其中,蒸馏是最常用的方法之一。
该方法通过调节温度和压力,将乙酰乙酸乙酯从反应混合物中分离出来。
但是,蒸馏过程中容易出现分解和副反应,影响产物的纯度和收率。
因此,需要进行适当的调节和优化。
另一种可能的优化方法是采用超声波辅助分离技术。
该技术利用超声波的物理效应,促进反应混合物的分离和提纯。
与传统的分离方法相比,超声波辅助分离技术具有反应速率快、产物纯度高等优点。
因此,针对乙酰乙酸乙酯的合成及后处理方法,可以通过筛选不同的催化剂和分离技术,以优化反应条件,提高产物的纯度和收率。
乙酰乙酸乙酯下游应用

乙酰乙酸乙酯下游应用
乙酰乙酸乙酯是一种重要的化学品,它的下游应用十分广泛。
下面将从以下几个方面介绍其应用。
一、药品方面
乙酰乙酸乙酯可用于生产解热镇痛药阿司匹林,以及镇咳药、消炎药等药品。
在医疗领域中,其应用十分重要。
二、塑料方面
除了医疗领域之外,乙酰乙酸乙酯的下游应用也十分广泛。
由于其优异的化学稳定性和物理性能,乙酰乙酸乙酯被广泛应用于塑料制品的生产。
具体地,它可以用来生产聚丙烯酸酯、聚丙烯等塑料制品。
三、表面活性剂
此外,乙酰乙酸乙酯还可以用作表面活性剂,例如洗涤剂、功能型润滑油和柔性聚氨酯泡沫塑料热塑性弹性体中的增塑剂等。
四、印染方面
最后,乙酰乙酸乙酯可用于印染领域。
乙酰乙酸乙酯作为稀释剂和增塑剂应用于刺绣绸、涤纶和尼龙等材料的印染。
在这里,我们只介绍了乙酰乙酸乙酯下游应用的四个方面,但它在化工、汽车、建筑、纺织、印染、间接食品添加剂、化妆品以及其他制
造行业中的应用,是我们所想象不到的。
毋庸置疑,乙酰乙酸乙酯是一种极具综合利用价值的化学品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
乙氧亚甲基乙酰乙酸乙酯及其类似物的合成与应用张彦;郑土才;许响生;陈慧玲【摘要】介绍了乙氧亚甲基乙酰乙酸乙酯及其类似物的特性,叙述了其合成方法,以及他们在有机合成特别是杂环化合物如异噁唑、吡唑、嘧啶、香豆素等合成中的应用,并对其应用前景进行了展望.建议加强反应活性研究,如环合时如何使用不同的反应条件,使乙酰基或酯基优先参与环合,或与不对称化合物环合时使用不同条件,以得到不同的环合产物.【期刊名称】《化工生产与技术》【年(卷),期】2011(018)002【总页数】4页(P26-28,32)【关键词】乙氧亚甲基乙酰乙酸乙酯;异噁唑;吡唑;嘧啶;杂环合成【作者】张彦;郑土才;许响生;陈慧玲【作者单位】浙江工业大学化学工程与材料学院,杭州,310014;衢州学院化学与制药工程系,浙江衢州,324000;衢州学院化学与制药工程系,浙江衢州,324000;浙江工业大学化学工程与材料学院,杭州,310014;衢州学院化学与制药工程系,浙江衢州,324000【正文语种】中文【中图分类】TQ225.24+1乙氧亚甲基乙酰乙酸乙酯(1),又名乙氧甲叉乙酰乙酸乙酯,英文名ethyl ethyoxymethyleneacetoacetate,分子式C2H5OCH=C(COCH3)(COOC2H5),是一种相当于1个酮基、1个酯基和1个醛基接在同一个碳原子上的多功能化合物,在有机合成转化中表现出醛、酮和酯的性质。
由于其酮基、酯基与醛基均相互在β位,因此使它们成为构筑杂环化合物特别有效的1,3-二羰基化合物,以其为原料可以合成吡唑、嘧啶、异噁唑、香豆素等多种杂环化合物,具有重要的应用价值。
但国内外目前对其合成和应用的报道很少。
1的类似物有乙氧亚甲基乙酰乙酸甲酯 (2)、甲氧亚甲基乙酰乙酸乙酯(3)、甲氧亚甲基乙酰乙酸甲酯(4)、二甲氨基亚甲基乙酰乙酸乙酯(5)及二甲氨基亚甲基乙酰乙酸甲酯(6)。
这些化合物一般均为顺反式异构体的混合物,结构分别为(Me和Et分别为甲基和乙基):本文叙述1及其类似物2~6的合成,以及它们在构建杂环化合物中的应用。
1的合成,文献报道均以乙酰乙酸乙酯与原甲酸三乙酯为原料在醋酐中缩合:经典文献采用醋酐一次性加入,一般收率仅65%左右[1-4]。
付炎等按照文献[1]制备,收率为55%[5];李强、黄惠琴等按乙酰乙酸乙酯、原甲酸三乙酯、醋酐摩尔比为1:1:2投料反应,1的收率分别为56.6%和65%[6-7];王绍杰、黄晓龙、陈娟、沈敬山和杨建坤等按类似方法,以摩尔比分别为1:1:2.1、1:0.96:1.96、1:1.2:2.5、1:1.5:3.0和1:1.5:3.0投料反应,1的收率分别为67.2%、71%、75%、85%和85%[8-12]。
王斌等以原料乙酰乙酸乙酯、原甲酸三乙酯、醋酐摩尔比为1:3:1投料反应,而且原甲酸三乙酯为滴加,并有少量氯化锌催化,1的收率也仅70%[13];Masaaki等报道将催化剂醋酐改为滴加,同时采取边反应边精馏除去低沸点产物如醋酸和醋酸乙酯的办法,原料摩尔比为 1:1.2~1.5:3.0~4.0[14]。
醋酐滴加可避免剧烈反应造成的反应失控和产物热分解,精馏去除低沸物则降低了醋酸引起的产物分解。
徐军等和陈梅筠等使用该方法,原料摩尔比为1:1.2:2.5,1的收率提高至82%[15-16];Ramakrishinan等以1:1.22:2投料反应,采取同时精馏的方法,1的收率提高至79.7%[17]。
从以上结果可以看出,提高原甲酸三乙酯和醋酐的配比,及采用边反应边精馏的方法均可以明显提高1的收率,但前法会显著增加原料成本,后法具有更大的工业化意义,同时醋酐滴加有利于生产安全性的提高。
1的类似物2~4可分别由乙酰乙酸甲酯与原甲酸三乙酯、乙酰乙酸乙酯与原甲酸三甲酯、乙酰乙酸甲酯与原甲酸三甲酯以类似方法缩合而得,但国内外对其报道很少。
陈卫民等、于锋臣、李家明等和张海峰等分别报道了以N,N-二甲基甲酰胺二甲基缩醛替代原甲酸三乙酯,制备了5[18-21]。
该产物不经分离直接与盐酸羟胺环合制得5-甲基异噁唑-4-羧酸乙酯,2步反应总收率为78%~79%,表明5的收率高于已知的相应1的收率,而且该缩合不需要醋酐作溶剂,N,N-二甲基甲酰胺二甲基缩醛的成本比原甲酸三乙酯低,因此5是一个值得重视的可以替代1的中间体。
以乙酰乙酸甲酯与N,N-二甲基甲酰胺二甲基缩醛缩合可得类似物6。
1及其类似物是一个同时含有乙氧亚甲基、酮和酯3种官能团的化合物,并且其相互在β位,特别适于制备五元和六元杂环化合物。
由于环合一般仅需2个官能团,因此在环合产物中还有1个酮羰基或酯基,可以用于进一步的转化,如酯基可以转化为羧酸并脱羧、酰胺并降解、酰氯等,从而合成应用广泛的多种中间体和产品。
2.1 合成异噁唑类化合物1与盐酸羟胺缩合可制备5-甲基-4-异噁唑羧酸乙酯:再经水解等可制得羧酸、酰氯和酰胺等,其中与对三氟甲基苯胺制得的酰胺即为免疫调节剂类抗风湿性关节炎药物来氟米特(leflunomide)。
缩合一般在甲醇或乙醇或乙醇与水混合溶剂中进行,可以添加或不加缚酸剂醋酸钠,收率为61%~85%[5,7-8,10,12-13,15-16]。
有些文献将5-甲基-4-异噁唑羧酸乙酯直接水解得到5-甲基-4-异噁唑羧酸,2步总收率为 50%~80%。
Ramakrishinan等将50%羟胺水溶液于冷却下滴入1的甲醇溶液中反应,后处理得5-甲基-4-异噁唑羧酸乙酯,收率79%,HPLC分析得1的质量分数98.7%,异构体少于0.5%[17]。
5与盐酸羟胺的缩合在甲醇中进行,不加醋酸钠,以乙酰乙酸乙酯计2步收率71%或79%,以醋酸钠作缚酸剂2步收率78%[18-20]。
2.2 合成吡唑类化合物1在酸催化下与水合肼缩合可制备5-甲基-4-吡唑羧酸乙酯(或3-甲基-4-吡唑羧酸乙酯),再经水解等可制得羧酸、酰氯和酰胺等:陈娟等报道将质量分数80%水合肼滴入1的乙醇(质量分数95%)溶液中反应,后处理得吡唑产物,收率77%,稀氢氧化钠水解后得相应的羧酸[10]。
2.3 合成嘧啶类化合物1在酸催化下与尿素缩合,再经碱催化环合等得到5-乙酰基嘧啶,环合优先发生在酯基上:李强等报道了该合成工艺,1与尿素在盐酸、甲醇中缩合得中间体氨甲酰氨基亚甲基乙酰乙酸乙酯,收率75%[6]。
该中间体在氢氧化钠溶液中环合得5-乙酰基尿嘧啶,收率30.5%。
它再经三氯氧磷氯化和氢氧化钾消除得到5-乙炔基尿嘧啶(eniluracil)。
Eniluracil是尿嘧啶还原酶抑制剂,与5-氟尿嘧啶(5-FU)合用可显著提高5-FU的生物利用度,且不受尿嘧啶还原酶个体差异的影响[22]。
2.4 合成香豆素类化合物1在乙醇钠催化下与苯酚类化合物缩合、环合可制得3-乙酰基香豆素类化合物,环合优先发生在酯基上。
黄晓龙等在研究香豆素类化合物抗癌和防癌活性时,为增加香豆素4位双键碳的正电性,设计合成了一系列3-乙酰基香豆素衍生物,均以相应的苯酚与1在乙醇钠存在下缩合而得[9]:所用酚类包括间苯二酚、均苯三酚、邻苯三酚、2-甲基间苯二酚、4-氯间苯二酚和2,4-二羟基二苯酮等,如2-甲基间苯二酚与1、钠、乙醇反应得3-乙酰基-7-羟基-8-甲基香豆素,收率94.1%。
生物活性测试表明,这些化合物对突变具有不同程度的抑制作用。
孙丽等也报道了类似3-乙酰基香豆素类化合物的合成[23]。
从以上介绍可以看出,1及其类似物是十分有用的杂环合成中间体,可以合成异噁唑、吡唑、嘧啶和香豆素等多种杂环,这些杂环化合物在医药、农药等领域有广阔的应用前景。
1及其类似物还可用于合成喹啉、喹诺酮和碳环类化合物等。
国内外尚缺乏对1及其类似物的系统研究,其作为一个有用的砌块(building block)没有得到充分发挥。
由于1~4的生产成本较高,因此建议加强对5的研究,使其得到更广泛的应用。
同时应加强对1和5的反应活性研究,如环合时如何使用不同的反应条件,使乙酰基或酯基优先参与环合,或与不对称化合物环合时,使用不同条件,以得到不同的环合产物。
如与尿素缩合时,可生成5-乙酰基尿嘧啶或2-羟基-4-甲基-5-嘧啶羧酸乙酯,与苯酚反应时,可生成3-乙酰基香豆素或3-乙酰基色酮等。
[1]Hiroyuki Y.Studies on the synthesis of 4,5-disubstituted isaoxazoles and their cleavage reaction with sodium ethoxide III.Structure of isoxazole compound derived from ethyl 2-formylacetoacetate[J].Yakugaku Zasshi,1959,79(6):836-838.[2]DoleshallG,SeresP.Isoxazole-oxazoleconversionbyBeckmann rearrangement[J].J Chem Soc,Perkin Trans I,1988(7):1875-1879.[3]Giulia M,Lusia M,Pitero S.Reaction of 2-dimethylaminomethylene-1,3-diones with dinucleophiles VI.Synthesis of ethyl or methyl 1,5-disubstituted 1H-pyrazole-4-carboxylates[J].J Heterocyclic Chem,1987,24:1669-1675. [4]Gallagher P T,Hicks T A,Mullier G W.N-Phenyl butenamides with pharmaceutical properties:EP,0257882[P].1988-03-02。
[5]付焱,张嫡群,姜少灏,等.来氟米特的合成[J].中国医药工业杂志,2000,31(12):533-534.[6]李强,王尊元,马臻,等.尿嘧啶还原酶抑制剂5-乙炔基尿嘧啶的合成工艺研究[J].中国药物化学杂志,2003,13(4):227-228.[7]黄惠琴,吴松.抗类风湿性关节炎新药来氟米特的合成[J].中国药物化学杂志,2000,10(2):132-133.[8]王绍杰,吴秀静,胡玉柱,等.来氟米特的合成工艺研究[J].中国药物化学杂志,2000,10(3):199-200.[9]黄晓龙,徐世平,付招娣,等.抗癌及癌化学预防药物的研究:3-乙酰香豆素衍生物的合成及其抗致突活性与结构间的关系[J].药学学报,1996,31(6):431-435. [10]陈娟,席海涛,张秀芹,等.3-甲基-4-吡唑甲酸和 3,5-二甲基-4-吡唑甲酸的合成[J].精细化工,2007,24(2):199-201,208.[11]沈敬山,王斌,李剑峰,等.来氟米特的合成[J].中国医药工业杂志,2001,32(2):49-50.[12]杨建坤,庄红林,李香梅.来氟米特的合成[J].河北职工医学院学报,2001,18(4):6-7.[13]王斌,李峰,凌俊,等.5-甲基-4-异噁唑甲酰氯的合成研究[J].化学试剂,2001,23(1):38-45.[14]Masaaki T,Noriyoshi H.Production of alkyl 2-ethoxymethyleneacetoacetate:JP,3106849[P].1991-05-07.[15]徐军,廖本仁.来氟米特中间体5-甲基-4-异噁唑甲酸的合成[J].中国医药工业杂志,2002,33(4):158-159.[16]陈梅筠,江立新,蔡奇峰.来氟米特的合成[J].四川化工与腐蚀控制,2003,21(4),334.[17]Ramakrishinan A,Gobind K,Neeraj K,et al.An improved process forpreparation of leflunomide:WO,2007086076[P].2007-08-02.[18]陈卫民,徐继红.新型免疫异制剂来氟米特合成的改进[J].第一军医大学学报,1999,19(3):256-257.[19]于锋臣,牛桂云,张贵民.5-甲基-4-异噁唑甲酸的合成[J].齐鲁药事,2004,23(6):40-41.[20]李家明,张宪美,查大俊.来氟米特的合成[J].中国医药工业杂志,2002,33(2):53-54.[21]张海峰,李媛,王昭煜.N,N-二甲基甲酰胺二甲基缩醛的制备[J].化学试剂,1990,12(2):125.[22]张喆.抗癌药物5-氟尿嘧啶的增效剂eniluracil[J].药学进展,1999,23(1):53-54.[23]孙丽,胡云楚,唐智勇,等.香豆素的合成、应用及其理论研究[J].应用化工,2010,39(2):264-269.【相关文献】[1]Hiroyuki Y.Studies on the synthesis of 4,5-disubstituted isaoxazoles and their cleavage reaction with sodium ethoxide III.Structure of isoxazole compound derived from ethyl 2-formylacetoacetate[J].Yakugaku Zasshi,1959,79(6):836-838.[2]DoleshallG,SeresP.Isoxazole-oxazoleconversionbyBeckmann rearrangement[J].J Chem Soc,Perkin Trans I,1988(7):1875-1879.[3]Giulia M,Lusia M,Pitero S.Reaction of 2-dimethylaminomethylene-1,3-diones with dinucleophiles VI.Synthesis of ethyl or methyl 1,5-disubstituted 1H-pyrazole-4-carboxylates[J].J Heterocyclic Chem,1987,24:1669-1675.[4]Gallagher P T,Hicks T A,Mullier G W.N-Phenyl butenamides with pharmaceutical properties:EP,0257882[P].1988-03-02。
