DEAE纤维素柱层析纯化酶蛋白实验
鸡卵类粘蛋白的分离纯化、活性及分子量测定

鸡卵类粘蛋白的分离纯化、活性及分子量测定摘要:鸡卵类粘蛋白(chicken ovomucoid,简称CHOM)是由鸡卵清中制成的一种糖蛋白,它具有强烈的抑制胰蛋白酶的作用。
采用有机溶剂沉淀法将鸡蛋清经三氯乙酸(TCA)—丙酮溶液处理,除去沉淀物,经丙酮分级沉淀活的粗品,再经过DEAE纤维素(二乙基氨基乙基纤维素)柱层析纯化而得合格产品,然后用Folin-酚法测定卵类粘蛋白的抑制活力测得纯蛋白的抑制活力大于粗蛋白的抑制活力,最后通过SDS-聚丙烯酰胺凝焦电泳测定蛋白质分子量测得粗蛋白的相对分子量为34311纯蛋白的相对分子量为32924与理论值有一定差距。
关键词:鸡卵类粘蛋白; 胰蛋白酶; 有机溶剂 ;层析; 电泳中图分类号:Q文献标识码:AIsolation and purification of CHOM and its activity 、 molecular weight determinationAbstract:Chicken ovomucoid (CHOM) is a glycoprotein made from chicken egg white, it has a strong role in inhibiting trypsin. Organic solvent precipitation method using egg white by trichloroacetic acid (TCA) - acetone solution was to remove sediment by acetone precipitation of live crude, through the DEAE cellulose (diethylaminoethyl cellulose) column layer Analysis of purified products derived from qualified, then Folin-phenol method ovomucoid inhibited activity, and finally by SDS-polyacrylamide gel electrophoresis determination of protein molecular weight of coke.Key words:CHOM ;Trypsin ; organic solvent ; chromatogram ; electrophoresis.鸡卵类粘蛋白(chicken ovomucoid 简称CHOM)是由鸡卵清中制成的一种糖蛋白,它具有强烈的抑制胰蛋白酶的作用[1],常用于胰蛋白酶的酶学性质的研究。
酶工程实验
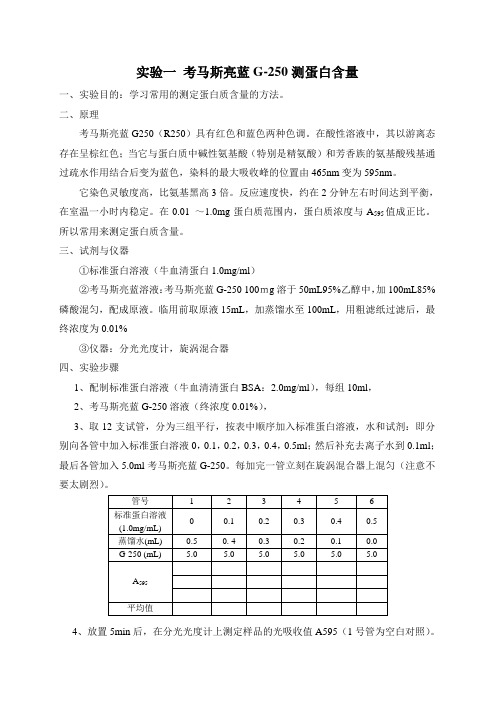
实验一考马斯亮蓝G-250测蛋白含量一、实验目的:学习常用的测定蛋白质含量的方法。
二、原理考马斯亮蓝G250(R250)具有红色和蓝色两种色调。
在酸性溶液中,其以游离态存在呈棕红色;当它与蛋白质中碱性氨基酸(特别是精氨酸)和芳香族的氨基酸残基通过疏水作用结合后变为蓝色,染料的最大吸收峰的位置由465nm变为595nm。
它染色灵敏度高,比氨基黑高3倍。
反应速度快,约在2分钟左右时间达到平衡,在室温一小时内稳定。
在0.01 ~1.0mg蛋白质范围内,蛋白质浓度与A595值成正比。
所以常用来测定蛋白质含量。
三、试剂与仪器①标准蛋白溶液(牛血清蛋白1.0mg/ml)②考马斯亮蓝溶液:考马斯亮蓝G-250 100mg溶于50mL95%乙醇中,加100mL85%磷酸混匀,配成原液。
临用前取原液15mL,加蒸馏水至100mL,用粗滤纸过滤后,最终浓度为0.01%③仪器:分光光度计,旋涡混合器四、实验步骤1、配制标准蛋白溶液(牛血清清蛋白BSA:2.0mg/ml),每组10ml,2、考马斯亮蓝G-250溶液(终浓度0.01%),3、取12支试管,分为三组平行,按表中顺序加入标准蛋白溶液,水和试剂:即分别向各管中加入标准蛋白溶液0,0.1,0.2,0.3,0.4,0.5ml;然后补充去离子水到0.1ml;最后各管加入5.0ml考马斯亮蓝G-250。
每加完一管立刻在旋涡混合器上混匀(注意不要太剧烈)。
4、放置5min后,在分光光度计上测定样品的光吸收值A595(1号管为空白对照)。
5、用标准蛋白的量为横坐标,用A595为纵坐标,作标准曲线图,由此曲线,根据后续试验测出的未知样品的A595值,可查出未知样品的蛋白质含量。
6、实验结果分析:误差分析,为什么出现这样的结果,什么原因导致的?实验二3,5-二硝基水杨酸(DNS)法测定酶活力一、实验目的:学习DNS测定还原糖的方法二、实验原理:还原糖的测定是糖定量测定的基本方法。
亲和层析法纯化胰蛋白酶第一部分实验内容简介

亲和层析法纯化胰蛋白酶第一部分实验内容简介
第1页
1 内容摘要 亲和层析包含了一整套复杂底物及其配体与生物大分
子之间相互作用时所形成独特生物学特征。在亲和结合过 程中包括到疏水力、静电力、范德华力及空间阻力等原因 影响。
亲和层析概念能够了解为配基以共价键形式与水不溶 性固体载体共价结合, 形成含有高度专一性亲和吸附剂。 以该介质为填料填充亲和层析柱,从复杂混合物中有针对 性分离某一个成份。
亲和层析法纯化胰蛋白酶第一部分实验内容简介
第4页
1. 3试验流程
鸡蛋清
Spharose 4B
猪胰脏
↓
↓
↓
提取
↓ 分离纯化
活化 ↓
提取 ↓
↓ 纯卵粘蛋白(CHOM) →←活化Spharose 4B 胰蛋白酶原粗提液
↓ 偶联
↓ 激活
↓
↓
CHOM-Spharose 4B →← 胰蛋白酶提取液
↓ 亲和层析
亲和层析法纯化胰蛋白酶第一部分实验内容简介
第2页
本试验以亲和层析方法分离纯化猪胰蛋白酶为目标,
从猪胰脏提取液中分离纯化胰蛋白酶,最终得到纯度较高
胰蛋白酶。围绕亲和层析试验所包括蛋白质和酶基础性质
及相关技术进行综合训练。其中主要包含亲和层析介质配
基制备,亲和介质合成,蛋白质和酶分离纯化,酶活性测
定等内容。
ቤተ መጻሕፍቲ ባይዱ
经过综合训练,能够系统掌握蛋白质制备基础原理和
操作,学习怎样进行试验设计,掌握试验过程中关键步骤,
对试验中出现问题进行科学分析。使学生在学习试验技术
同时,自觉培养分析问题和处理问题能力。
亲和层析法纯化胰蛋白酶第一部分实验内容简介
8DEAE纤维素离子交换层析纯化血清白蛋白

(3)平衡:装柱后接上恒压贮液瓶,用0.06mol/L
NH4Ac (pH 6.5)洗涤平衡,流速 1ml/min。
2、DEAE—纤维素层析纯化白蛋白
• 1)上样:将4ml 用缓冲液稀释后的血清样品加入上述已平衡 好的层析柱表面,使样品进入柱床内。小心用4ml 0.06mol/L NH4Ac缓冲液洗涤沾在管壁上的蛋白质样品,使其进入床内。
基质
电荷基团 反离子
纤维素-O — CH2— COO-— Na+ 阳离子交换剂
树脂 -O — N+(CH3)2 — OH- 阴离子交换剂
8DEAE纤维素离子交换层析纯 化血清白蛋白
CM- cellulose (Carboxymethyl cellulose)
DEAE- cellulose (diethylaminoethyl cellulose)
8DEAE纤维素离子交换层析纯化血 清白蛋白
• 根据待分离物质带电性质不同的分离纯化方法。 • 以离子交换剂为固定相,特定的离子溶液为流
动相,依据各种离子或离子化合物与离子交换 剂的结合力不同进行分离纯化的层析方式。
离子交换剂
离子交换剂由基质、电荷基团(或称功能基团) 和 反离子组成。基质一般是不溶性聚合物,如 纤维素,交联葡聚糖,交联琼脂糖等;
• DEAE-纤维素离子交换层析(Ion Exchange Chromatography, IEC)纯化 血清白蛋白
8DEAE纤维素离子交换层析纯 化血清白蛋白
1、分离血清得到高纯度的白蛋白
2、掌握DEAE-纤维素离子交换层析原理与 实验操作技术
3、了解紫外检测仪、自动部分收集器、记 录仪、恒压高位槽的原理与使用方法
1-DEAE—层析实验

实验三DEAE—纤维素梯度层析实验1、实验目的与要求:通过DEAE-纤维素阴离子交换剂,采用一条线型离子强度和恒定pH洗提曲线,对鸡蛋白蛋白(CEA)样品进行分级分离,以了解梯度洗提的层析方法。
2、实验原理:DEAE-纤维素是以纤维素为母体接有二乙基氨基乙基(DEAE)活性基团的弱碱性阴离C2H5∣子交换剂(纤维素-O-CH2-CH2-NH )。
它在离子交换层析中可用于蛋白质、核酸、激素、∣C2H5酶等大分子的分离与纯化。
对于某些组分比较复杂或性质比较相近的蛋白质样品。
在采用一般的恒溶剂系统进行离子交换柱层析时,往往不容易分离,这时可采用梯度洗提(装置见图1-2)。
即利用一定的样品离子在不同的离子强度(或pH)溶液中对一定的离子交换剂的平衡常数不同,在洗提过程中,通过不断改变洗提的离子强度(pH不变)[根据实验的具体情况,也可同时改变离子强度和pH],以逐步改变样品中各组分与离子交换剂的交换能力,最后得到分离,这种层析方式即称为梯度洗提层析。
洗提剂的梯度产生如图所示,当A1=A2时,产生线形梯度;当A1>A2时,产生凹型梯度;当A1<A2时,产生凸型梯度(见图1)。
不同的样品,应根据实验情形,选择合适的梯度洗提曲线。
3、实验器材与装置:3-1、实验仪器:(1)、电脑及装置(2)、紫外检测仪(3)、恒流泵(4)、磁力搅拌器(5)、混合器(5)、梯度混合仪(6)、离心机3-2、实验器材:(1)、层析柱(20×1.0cm)(2)、自动取液器(3)、烧杯100 ml(4)、量筒(5)、玻棒3-3、实验装置图(1)、 图1: 梯度洗脱示意图(2)、图2:DEAE —层析实验装置图4、试剂与配制:4-1.实验试剂:(1)、DEAE-52(2)、鸡蛋白蛋白(CEA )(3)、三羧甲基氨基甲烷(Tris)(4)、盐酸(5)、氯化钠4-2.试剂配制:(1)、Buffer A(20mM pH8.0 Tris-HCl )的配制:取Tris g,溶于ml蒸馏水中,用ml HCl调至pH8.0 (2)、Buffer B的配制:Buffer A加1.0M NaCl(3):CEA样液的配制:20.0mg CEA+1ml Buffer A5、方法与步骤:(1)、DEAE-纤维素处理:本实验采用20 mMol/L ,pH8.0 Tris-HCl平衡好的DEAE-纤维素。
血清清蛋白、γ-球蛋白的分离、提纯与鉴定-实验报告

生物化学实验报告姓名:学号:专业年级:组别:生物化学与分子生物学实验教学中心【实验报告第一部分(预习报告内容):①实验原理、②实验材料(包括实验样品、主要试剂、主要仪器与器材)、③实验步骤(包括实验流程、操作步骤和注意事项);评分(满分30分):XX】实验目的:1、掌握盐析法分离蛋白质的原理和基本方法2、掌握凝胶层析法分离蛋白质的原理和基本方法3、掌握离子交换层析法分离蛋白质的原理和基本方法4、掌握醋酸纤维素薄膜电泳法的原理和基本方法5、了解柱层析技术实验原理:1、蛋白质的分离和纯化是研究蛋白质化学及其生物学功能的重要手段。
2、不同蛋白质的分子量、溶解度及等电点等都有所不同。
利用这些性质的差别,可分离纯化各种蛋白质。
3、盐析法:盐析法是在蛋白质溶液中,加入无机盐至一定浓度或达饱和状态,可使蛋白质在水中溶解度降低,从而分离出来。
蛋白质溶液中加入中性盐后,由于中性盐与水分子的亲和力大于蛋白质,致使蛋白质分子周围的水化膜减弱乃至消失。
中性盐加入蛋白质溶液后由于离子强度发生改变,蛋白质表面的电荷大量被中和,更加导致蛋白质溶解度降低,蛋白质分子之间聚集而沉淀。
4、离子交换层析:离子交换层析是指流动相中的离子和固定相上的离子进行可逆的交换,利用化合物的电荷性质及电荷量不同进行分离。
5、醋酸纤维素薄膜电泳原理:血清中各种蛋白质的等电点不同,一般都低于pH7.4。
它们在pH8.6的缓冲液中均解离带负电荷,在电场中向正极移动。
由于血清中各种蛋白质分子大小、形状及所带的电荷量不同,因而在醋酸纤维素薄膜上电泳的速度也不同。
因此可以将它们分离为清蛋白(Albumin)、α1-球蛋白、α2-球蛋白、β-球蛋白、γ-球蛋白5条区带。
实验材料:人混合血清葡聚糖凝胶(G-25)层析柱DEAE纤维离子交换层析柱饱和硫酸铵溶液醋酸铵缓冲溶液 20%磺基水杨酸1%BaCl溶液氨基黑染色液2漂洗液 pH8.6巴比妥缓冲溶液电泳仪、电泳槽实验流程:盐析(粗分离)→葡聚糖凝胶层析(脱盐)→DEAE纤维素离子交换层析(纯化)→醋酸纤维素薄膜电泳(纯度鉴定)实验步骤:(一)盐析+凝胶柱层析除盐:(二)离子交换层析(纯化):(三)醋酸纤维素薄膜电泳:1、点样(如下图):-点样线尽量点得细窄而均匀,宁少勿多2、电泳:①薄膜粗面向下②点样端置阴极端③两端紧贴在滤纸盐桥上,膜应轻轻拉平电压:110V时间:50min3、染色和漂洗:电泳完毕后,关闭电源,将膜取出,直接浸于染色液中5min。
DEAE纤维素离子交换层析法分离血清蛋白

装柱注意事项
• 将处理好的纤维素悬液倾入层析柱内 (注 意不要带入气泡,如混悬液过浓,可增加 适量Na2HPO4液)
• 打开恒流泵,使液体流出,控制流速为3-6 秒1滴。直到全部纤维素都放入柱内(或柱 中纤维素沉积至一定高度)
• 注意:一定不要干柱
22
装柱后期
• 再次检查整套层析设备是否正确连接 • 调好检测零点及流速:以0.01mol/L
生物化学实验
DEAE纤维素离子交换层析法 分离血清蛋白
指导教师:曹文华
1
[实验目的]
1.掌握DEAE-纤维素离子交换层析法 分离血清蛋白质的实验原理及过程。
(参见教材P94-95实验十六)
2.熟悉层析技术的相关原理。 (参见教材P12-23:包括层析技术的概念、分
类及分离原理。离子交换层析法的基本原理、 介质种类、洗脱方式等。整套层析设备的组 成及使用等)
8
离子交换剂:是一类含有可解离基团的不溶性的高 分子化合物。
根据交换剂的结构不同,分为 离子交换树脂
分类 离子交换纤维素 离子交换葡聚糖和离子交换琼脂凝胶
根据交换剂的性能不同,分为 阳离子交换剂 阴离子交换剂
*
9
10
11
本实验分离原理
本实验是用离子交换层析的分离原理,将血 清蛋白质(白蛋白PI=4.88(4.7-4.9); α1球蛋 白PI=α1球蛋白PI = 5.06; β球蛋白PI=5.12; γ球蛋白PI=6.85-7.50 )在pH为8的条件下 交换到装在柱子中的DEAE纤维素离子交换 剂(阴离子交换剂)上后,应用梯度洗脱 法,逐渐改变pH与离子强度,将血清中各 种蛋白质组成成分逐步洗脱下来,从而达 到分离提纯的目的。
Na2HPO4为标准调基线(吸光度A为5%, 透光率T为95%);流速为5-10滴每分钟(612秒1滴)。 • 记录仪:摘下笔帽,笔落下,启动,测量 状态,走纸速度为6cm/h, 量程为100mV
deae纤维素离子交换层析原理

deae纤维素离子交换层析原理DEAE纤维素离子交换层析原理离子交换层析是一种利用离子保持在流动相中的静电相互作用分离混合物的技术。
这种层析技术通常用于对分子进行分离和纯化,是许多分子生物学和生物工艺学实验的关键步骤之一。
DEAE纤维素层析是一种离子交换层析技术,其原理是根据大分子带电荷的相互作用进行分离。
DEAE(二乙氨基乙基)代表了这种离子对相互作用,它们是氨基乙醇与二甲基氨基乙醇的混合物,呈弱碱性。
DEAE纤维素层析分离过程中,混合物被加入含有DEAE纤维素的纯化介质中,通常是由一个固相列和一个移动相组成的。
由于DEAE纤维素有静电吸附性,分子会被吸附到纤维素表面,并与它们的相反电荷互相吸引,形成了一个复杂的矩阵。
随着固相列的流动,分子会以不同的速度被吸附到DEAE纤维素表面,并对带电荷的分子进行分离。
DEAE纤维素层析技术通常用于分离电荷分布不均匀的大分子,例如蛋白质或DNA。
在这种情况下,蛋白质或DNA会在不同程度上与DEAE纤维素相互作用,其中带正电荷的分子会强烈地吸附到DEAE纤维素表面,而带负电荷的分子则会逐渐流过固相列。
DEAE纤维素层析可以用于分离具有不同电荷的蛋白质或DNA分子。
DEAE纤维素层析可用于从复杂混合物中纯化蛋白质甚至核酸。
根据DEAE纤维素层析的原理,我们可以预测分子的行为并更好地优化层析条件。
增加NaCl浓度或者pH值可以瞬间影响DEAE纤维素对分子的亲和力,不同的DEAE纤维素介质或动态增加离子浓度都会影响分子的结合和释放。
DEAE纤维素层析技术非常适合分离带电荷的大分子,因为它利用的是分子之间电荷间的相互作用进行分离。
该技术是分子生物学,生物化学和生物工艺学中广泛使用的分离技术之一,具有广泛的应用前景。
DEAE纤维素层析技术是生化分离技术中最常用的一种技术之一,可以高效地纯化目标大分子,如蛋白质和DNA。
DEAE纤维素层析技术具有操作简单、高分离效率、生物活性好、适用范围广等优点,被广泛应用于制药、食品、环保、农业等领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DEAE纤维素柱层析纯化酶蛋白实验
(文献来自于丁香通())
本实验目的是以柱层析的方法进一步纯化蔗糖酶蛋白,利用DEAE 纤维素树脂作为离子交换剂进行柱层析分级分离。
实验方法
离子交换层析法
实验方法原理利用DEAE纤维素树脂作为离子交换剂进行柱层析分级分离。
实验材料酶蛋白
试剂、试剂盒DEAE纤维素NaOH HCL Tris-HCl缓冲液NaCl
仪器、耗材层析柱收集器磁力搅拌器搅拌子烧杯玻璃砂漏斗水泵抽滤瓶pH试纸pH计三通管止水夹吸耳球紫外比色杯尿糖试纸点滴板电导率仪
实验步骤1. 离子交换剂的处理
称取1.5 克DEAE 纤维素( DE-23 ) 干粉, 加入0 . 5 mol/ LNaOH 溶液( 约50ml) , 轻轻搅拌, 浸泡至少0.5 小时( 不超过1 小时) , 用玻璃砂漏斗抽滤, 并用去离子水洗至近中性, 抽干后, 放入小烧杯中, 加50 ml 0.5 mol/ L HCl , 搅匀, 浸泡0.5 小时, 用去离子水洗至近中性, 再用0.5 mol/ L NaOH 重复处理一次, 用去离子水洗至近中性后, 抽干备用(因DEAE 纤维素昂贵, 用后务必回收)。
实际操作时, 通常纤维素是已浸泡过并回收的, 按“ 碱→酸” 的顺序洗即可, 因为酸洗后较容易用水洗至中性。
碱洗时因过滤困难, 可以先浮选除去细颗粒, 抽干后用0.5 mol/ L NaOH-0.5 mol/ L NaCl 溶液处理, 然后水洗至中性。
2. 装柱与平衡
先将层析柱垂直装好, 在烧杯内用0.02 mol/ L, pH7.3
Tris-HCl 缓冲液洗纤维素几次, 用滴管吸取烧杯底部大颗粒的纤维素装柱, 然后用此缓冲液洗柱至流出液的电导率与缓冲液相同或接近时即可上样。
3. 上样与洗脱
上样前先准备好梯度洗脱液, 本实验采用20 ml , 0.02 mol/ L,pH7.3 的Tris-HCl 缓冲液和20 ml 含0.2 mol/ L 浓度NaCl 的0.02 mol/ L, pH7.3 的Tris-HCl 缓冲液, 进行线性梯度洗脱。
取两个相同直径的50 ml 小烧杯, 一个装20
ml 含NaCl 的高离子强度溶液, 另一个装入20 ml 低离子强度溶液, 放在磁力搅拌器上,在低离子强度溶液的烧杯内放入一个小搅拌子( 在细塑料管内放入一小段铁丝, 两端用酒精灯加热封口) , 将此烧杯置于搅拌器旋转磁铁的上方。
将玻璃三通插入两个烧杯中, 上端接一段乳胶管, 夹上止水夹, 用吸耳球小心地将溶液吸入三通( 轻轻松一下止水夹) , 立即夹紧乳胶管, 使两烧杯溶液形成连通, 注意两个烧杯要放妥善, 切勿使一杯高、一杯低。
用5 ml 0.02 mol/ L, pH7.3 的Tris-HCl 缓冲液充分溶解醇级分Ⅱ (注意玻璃搅棒头必须烧圆, 搅拌溶解时不可将离心管划伤) , 若溶液混浊, 则用小试管, 4 000 r/ min 离心除去不溶物。
取1 . 5 ml 上清液( 即醇级分Ⅱ样品, 留待下一个实验测酶活力及蛋白含量) , 将剩余的3 . 5 ml 上清液小心地加到层析柱上, 不要扰动柱床, 注意要从上样开始使用部分收集器收集, 每管2.5~3.0 ml/ 10 min。
上样后用缓冲液洗两次, 然后再用约20 ml 缓冲液洗去柱中未吸附的蛋白质, 至A280 降到0.1 以下, 夹住层析柱出口, 将恒流泵入口的细塑料导管放入不含NaCl 的低离子强度溶液的小烧杯中, 用胶布固定塑料管, 接好层析柱, 打开磁力搅拌器, 放开层析柱出口, 开始梯度洗脱, 连续收集洗脱液, 两个小烧杯中的洗脱液用尽后, 为洗脱充分, 也可将所配制的剩余30 ml 高离子强度洗脱液倒入小烧杯继续洗脱, 控制流速2.5~3.0 ml/ 10 min。
测定每管洗脱液的A280 光吸收值。
4. 各管洗脱液酶活力的定性测定
在点滴板上每一孔内, 加一滴0.2 mol/ L, pH4.9 的乙酸缓冲液, 一滴0.5 mol/ L 蔗糖和一滴洗脱液, 反应5 min , 在每一孔内同时插入一小条尿糖试纸, 10~20 min 后观察试纸颜色的变化。
用“ + ” 号的数目, 表示颜色的深浅, 即各管酶活力的大小。
合并活性最高的2~3 管, 量出总体积, 并将其分成10 份,分别倒入10 个小试管, 用保鲜膜封口, 冰冻保存, 使用时取出一管, 此即“ 柱级分Ⅲ”。
注意: 从上样开始收集, 可能有两个活性峰, 梯度洗脱开始前的第一个峰是未吸附物, 本实验取用梯度洗脱开始后洗下来的活性峰。
在同一张图上画出所有管的酶活力、NaCl 浓度( 可用电导率代替) 和光吸收值A280 的曲线和洗脱梯度线。
