四川大学化工原理实验-精馏实验
四川大学化工原理实验数据处理——精馏实验(excel 2007)

档
精馏实验) 衡关系拟合与 对应的平衡气 者自行下载后
子中填写实验 的数据,并自 醇的比热容及 到更加适合实
具体要求参照 考。填写数据 数据与相同行 插值编写)或 线性插值编
在MS Office 版本是可能存
理实验数据处 工计算的数据理四川大学化工原理实验(实验4 精馏实验) 中全回流及部分回流的精馏实验数据。同时,平衡关系拟合与 浓度关系拟合页通过插值法分别计算某液相浓度对应的平衡气 相浓度与某折光率下对应的液相浓度值。请使用者自行下载后 依照说明使用。 2.全回流与部分回流数据处理时,请在浅蓝色格子中填写实验 数据,本文档将自动在浅橙色格子中计算出相应的数据,并自 动在图中绘制出数据曲线。(部分回流中水与乙醇的比热容及 汽化潜热为20℃数值,供参考使用,使用者查阅到更加适合实 验条件的数据时可以修改)。 3.平衡关系拟合及浓度关系拟合中数据填写位置具体要求参照 相应图表中灰色文本框的说明,计算数值仅供参考。填写数据 时,在某行的浅蓝色格子中填写数据,使得所填数据与相同行 中茶色单元格的数据接近(平衡关系,通过三次插值编写)或 介于本行与上行数值之间(浓度关系拟合,通过线性插值编 写)。 4.本文档在MS Office 2010中编辑完成,建议在MS Office 2007或更高版本中使用以保证视觉效果,使用低版本是可能存 在更大的偏差。 5.本文档由“白石子”制作,供四川大学化工原理实验数据处 理使用。由于计算方法与保留位数等问题,与手工计算的数据 可能存在一定的差距,请使用者自行验证。
化工原理实验—精馏

化工原理实验—精馏1. 概述精馏是一种常用的分离技术,广泛应用于化工工艺中。
它通过将混合液加热至蒸发,然后在冷凝器中冷却并凝结回液体,从而实现混合物中组分的分离。
本实验旨在通过精馏实验,掌握精馏原理、操作步骤和相关设备的使用方法。
2. 实验原理2.1 精馏原理精馏是基于液体混合物中各组分的不同沸点而进行的分离过程。
在加热的作用下,沸点较低的组分会先蒸发,经过冷凝器冷却后变为液体回流,而沸点较高的组分则会滞留在容器中。
通过收集冷凝后的液体,我们可以分离出混合物中的不同组分。
2.2 实验设备在精馏实验中,主要使用以下设备:•加热设备:电热板、油浴等;•冷凝器:通常采用水冷型冷凝器,通过循环冷却水实现液体冷凝;•分馏柱:用于增加接触面积,提高分离效果;•采样装置:用于采集样品,检测组分浓度等。
2.3 操作步骤精馏实验的基本步骤如下:1.准备实验设备:包括加热设备、冷凝器、分馏柱等;2.准备混合液:按照实验要求,将需要分离的混合液制备好;3.装配设备:将冷凝器安装在分馏柱上方,连接好相应的管道和热源;4.开始加热:逐渐加热混合液,将其中的沸点较低组分蒸发出来;5.冷却和回流:通过冷凝器使蒸发的组分冷却并凝结成液体,回流到容器中;6.收集液体:将回流液体收集,并记录途中温度和时间等相关数据;7.结束实验:实验完成后,及时关闭加热设备和冷凝器,整理实验装置。
3. 实验操作及数据记录3.1 实验设备准备首先,确保实验室环境安全,检查仪器设备是否齐全,并找到精馏实验所需的各种设备:•电热板:用来提供加热源;•分馏柱:用来增加接触面积,提高分离效果;•冷凝器:通常为水冷型冷凝器,确保冷却效果良好。
3.2 实验样品准备按照实验要求,取出需要分离的混合液样品。
注意记录样品的成分和浓度等信息。
3.3 装配设备将冷凝器安装在分馏柱上方,并连接好相应的管道和热源。
确保连接紧密,无泄漏。
3.4 开始实验1.打开电热板,设置适当的加热温度;2.将混合液置于分馏烧瓶中,放入加热设备中;3.监测温度变化:通过温度计等工具,记录样品温度的变化。
化工原理实验精馏实验报告

化工原理实验精馏实验报告一、实验目的1、熟悉精馏的工艺流程和设备结构。
2、掌握精馏塔的操作方法和调节原理。
3、学会分析精馏过程中各种因素对分离效果的影响。
4、测定全回流和部分回流时的精馏塔效率。
二、实验原理精馏是利用混合物中各组分挥发度的差异,通过多次部分汽化和多次部分冷凝,使混合物分离成较纯组分的单元操作。
在精馏塔中,汽液两相在塔板上进行逆流接触,液相中的易挥发组分向气相中转移,气相中的难挥发组分向液相中转移,从而实现混合物的分离。
精馏塔的分离能力通常用塔板效率来衡量。
全塔效率是指达到指定分离要求所需的理论塔板数与实际塔板数之比。
单板效率则是指某一块塔板上的实际增浓程度与理论增浓程度之比。
三、实验装置与流程1、实验装置本实验采用的精馏装置主要由精馏塔、冷凝器、再沸器、进料泵、回流比控制器等组成。
精馏塔为筛板塔,塔板数为_____块。
2、实验流程原料液由进料泵送入精馏塔顶部,在塔内与上升的蒸汽进行传热和传质。
塔顶蒸汽经冷凝器冷凝后,一部分作为回流返回塔顶,另一部分作为产品采出。
塔釜液体由再沸器加热产生蒸汽,返回塔内。
四、实验步骤1、全回流操作(1)检查实验装置,确保各设备正常运行,无泄漏现象。
(2)向塔釜加入一定量的原料液,开启再沸器加热,使塔釜液沸腾。
(3)调节塔顶冷凝器的冷却水量,控制塔顶温度在一定范围内。
(4)当塔顶和塔釜温度稳定后,记录塔顶、塔釜的温度和压力,以及回流液和采出液的流量。
(5)稳定运行一段时间后,取样分析塔顶和塔釜产品的组成。
2、部分回流操作(1)在全回流操作稳定的基础上,设定一定的回流比。
(2)调节进料泵的流量,控制进料速度。
(3)观察塔顶和塔釜温度的变化,及时调整加热量和冷却水量。
(4)稳定运行一段时间后,取样分析塔顶和塔釜产品的组成。
五、实验数据处理与分析1、全回流操作(1)根据实验记录的数据,计算塔顶和塔釜产品的组成。
(2)计算全塔效率。
2、部分回流操作(1)根据实验记录的数据,计算塔顶和塔釜产品的组成。
化工原理精馏实验

化工原理精馏实验化工原理精馏实验是化工工程中的一项重要实验内容,它主要用于分离和提纯混合物中的组分。
本文将介绍化工原理精馏实验的基本原理、实验步骤以及实验中需要注意的事项。
1. 实验目的化工原理精馏实验的主要目的是通过温度差异,利用液体蒸汽和凝结的原理,将混合物中的组分分离并得到纯净的产品。
通过这个实验,我们可以了解精馏作为一种分离技术的原理和应用。
2. 实验原理化工原理精馏实验的基本原理是利用混合物中各组分的不同沸点,通过升温使其中具有较低沸点的组分先蒸发,然后通过冷凝使其变为液体,从而实现分离。
在实验过程中,我们需要使用精馏塔,该塔内部设置有填料,用于增加混合物和蒸汽之间的交流面积,并实现更充分的分离。
3. 实验步骤(1) 准备实验所需设备和药品,包括精馏装置、混合物、填料等。
(2) 将混合物加入精馏瓶中,并将瓶塞密封。
(3) 将冷凝管和进料管连接到精馏瓶上,确保连接牢固。
(4) 将精馏瓶放入加热设备中,逐渐升温。
(5) 观察精馏瓶内的液体是否开始蒸发,当温度上升到某一点时,开始收集冷凝液。
(6) 根据实验需要,调整加热温度和收集冷凝液的时间,以实现所需组分的分离和提纯。
4. 实验注意事项(1) 在进行化工原理精馏实验前,需先对所需设备进行检查和清洁,确保实验过程的安全性。
(2) 在实验操作中,热量的传递速度会影响分馏过程的效果,因此需要掌握合适的加热速率。
(3) 为了避免精馏烧坏填料或其他设备,需要控制温度,确保温度在安全范围内。
(4) 实验结束后,应将设备进行清洗和消毒,防止残留物对下次实验的影响。
5. 实验结果分析通过化工原理精馏实验,可以得到分离出的纯净组分,并进行定量分析。
根据实验结果,可以进一步探讨精馏的分离效果、提纯效率等指标,并对所得纯净组分进行性质分析。
总结:化工原理精馏实验是一项重要的实验内容,通过实验可以了解精馏作为一种分离技术的原理和应用。
在实验过程中,需要注意设备的清洁和安全操作,合理控制加热温度和加热速率,以达到较好的分馏效果。
化工原理实验--精馏实验
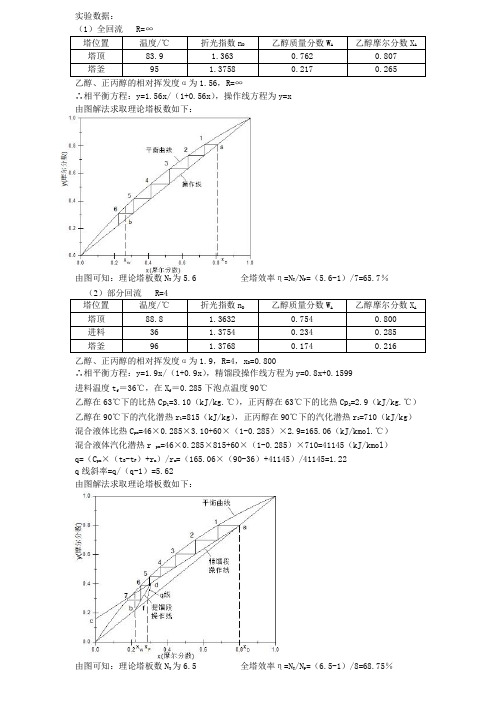
实验数据:
(1)全回流 R=∞
乙醇、正丙醇的相对挥发度α为1.56,R=∞
∴相平衡方程:y=1.56x/(1+0.56x),操作线方程为y=x
由图解法求取理论塔板数如下:
由图可知:理论塔板数N T为5.6 全塔效率η=N T/N P=(5.6-1)/7=65.7%
乙醇、正丙醇的相对挥发度α为1.9,R=4,x D=0.800
∴相平衡方程:y=1.9x/(1+0.9x),精馏段操作线方程为y=0.8x+0.1599
进料温度t f=36℃,在X f=0.285下泡点温度90℃
乙醇在63℃下的比热Cp1=3.10(kJ/kg.℃),正丙醇在63℃下的比热Cp2=2.9(kJ/kg.℃)乙醇在90℃下的汽化潜热r1=815(kJ/kg),正丙醇在90℃下的汽化潜热r2=710(kJ/kg)混合液体比热C pm=46×0.285×3.10+60×(1-0.285)×2.9=165.06(kJ/kmol.℃)
混合液体汽化潜热r pm=46×0.285×815+60×(1-0.285)×710=41145(kJ/kmol)
q=(C pm×(t B-t F)+r m)/r m=(165.06×(90-36)+41145)/41145=1.22
q线斜率=q/(q-1)=5.62
由图解法求取理论塔板数如下:
由图可知:理论塔板数N T为6.5 全塔效率η=N T/N P=(6.5-1)/8=68.75%。
化工原理精馏实验报告

化工原理精馏实验报告实验目的,通过精馏实验,掌握精馏原理和操作技能,了解精馏在化工生产中的应用。
一、实验原理。
精馏是利用液体混合物中各组分的沸点差异,通过加热、蒸馏和冷凝等过程,将混合物中的不同组分分离的方法。
在精馏过程中,液体混合物首先被加热至其中沸点最低的组分的沸点,然后将其蒸发成气体,再通过冷凝器冷却成液体,最终得到不同组分的纯净物质。
二、实验仪器与试剂。
1. 精馏设备,包括蒸馏烧瓶、冷凝器、接收烧瓶等。
2. 试剂,乙醇-水混合物。
三、实验步骤。
1. 将乙醇-水混合物倒入蒸馏烧瓶中。
2. 加热蒸馏烧瓶,待混合物沸腾后,蒸气通过冷凝器冷却成液体。
3. 收集不同温度下的液体,记录温度和收集时间。
四、实验结果与分析。
经过精馏实验,我们成功地将乙醇-水混合物分离成不同组分。
在实验过程中,我们观察到随着温度的升高,液体收集瓶中的液体组分逐渐发生变化,初馏液中含有较高乙醇含量,尾馏液中含有较高水含量。
这符合精馏原理,也验证了实验的准确性。
五、实验总结。
通过本次实验,我们深入了解了精馏原理和操作技能,掌握了精馏在化工生产中的应用。
精馏作为一种重要的分离方法,在化工领域有着广泛的应用,可以有效地提取纯净物质,满足不同生产需求。
六、实验注意事项。
1. 在实验过程中,要注意控制加热温度,避免混合物过热。
2. 实验结束后,要及时清洗和保养实验仪器,确保下次实验的顺利进行。
七、参考文献。
1. 《化工原理与实践》,XXX,XXX出版社,XXXX年。
2. 《化工实验指导》,XXX,XXX出版社,XXXX年。
以上就是本次化工原理精馏实验的实验报告,希望能对大家有所帮助。
四川大学化工原理实验报告
四川大学化工原理实验报告竭诚为您提供优质文档/双击可除四川大学化工原理实验报告篇一:xxxx学院化工原理实验报告贵州理工学院化工原理实验报告学院:化学工程学院专业:化工职教班级:化职131 篇二:化工原理实验报告张资源与环境工程学院精馏分离实训报告姓名:张x学号:xxxxxxxxx专业:应用化工班级:xxx指导教师:张xx20XX年12月日24目录1.精馏实验1.1精馏的原理1.1.1精馏的分类1.1.2精馏的计算方法1.1.2.1概述1.1.3理论塔板数的计算方法1.1.3.1图算法1.1.3.2捷算法1.1.3.3严格计算法1.2实验目的1.3实验原理1.4实验材料1.5实验过程1.6实验结果2.总结1.精馏实验精馏是一种利用回流使液体混合物得到高纯度分离的蒸馏方法,是工业上应用最广的液体混合物分离操作,广泛用于石油、化工、轻工、食品、冶金等部门。
1.1精馏的原理双组分混合液的分离是最简单的精馏操作。
典型的精馏设备是连续精馏装置,包括精馏塔、再沸器、冷凝器等。
精馏塔供汽液两相接触进行相际传质,位于塔顶的冷凝器使蒸气得到部分冷凝,部分凝液作为回流液返回塔底,其余馏出液是塔顶产品。
位于塔底的再沸器使液体部分汽化,蒸气沿塔上升,余下的液体作为塔底产品。
进料加在塔的中部,进料中的液体和上塔段来的液体一起沿塔下降,进料中的蒸气和下塔段来的蒸气一起沿塔上升。
在整个精馏塔中,汽液两相逆流接触,进行相际传质。
液相中的易挥发组分进入汽相,汽相中的难挥发组分转入液相。
对不形成恒沸物的物系,只要设计和操作得当,馏出液将是高纯度的易挥发组分,塔底产物将是高纯度的难挥发组分。
进料口以上的塔段,把上升蒸气中易挥发组分进一步提浓,称为精馏段;进料口以下的塔段,从下降液体中提取易挥发组分,称为提馏段。
两段操作的结合,使液体混合物中的两个组分较完全地分离,生产出所需纯度的两种产品。
当使n组分混合液较完全地分离而取得n个高纯度单组分产品时,须有n-1个塔。
化工原理精馏实验报告
化工原理精馏实验报告
实验目的:掌握化工原理中的精馏操作,并通过实验验证理论知识的正确性。
实验原理:
精馏是一种分离液体混合物组成的常用方法。
精馏通过不同组成的液体在加热的条件下产生蒸汽,然后再在冷凝管中冷凝成液体,最后通过收集液体可以得到不同组成的馏分。
实验仪器:
1. 精馏塔:用于分离混合物。
2. 加热器:提供加热源。
3. 冷凝器:用于冷凝产生的蒸汽。
4. 温度计:用于测量温度。
实验步骤:
1. 将需要进行精馏的混合物加入精馏塔中。
2. 打开加热器,通过加热产生蒸汽。
3. 在冷凝器中冷凝产生的蒸汽,并收集液体。
4. 使用温度计测量液体的沸点。
5. 根据液体的沸点,确定得到的馏分的组成。
实验结果:
在实验过程中,我们成功地通过精馏操作将待分离的混合物分解为不同组成的馏分。
通过温度计测量得到的沸点数据,我们可以精确地确定馏分的组成。
实验结论:
通过这次实验,我们掌握了化工原理中的精馏操作,并验证了理论知识的正确性。
精馏是一种常用的分离液体混合物的方法,在工业生产中有着广泛的应用。
掌握了精馏操作,有助于我们理解和解决化工过程中的实际问题。
化工原理精馏实验报告
化工原理精馏实验报告实验目的:本实验旨在通过对乙醇和水的精馏实验,掌握精馏过程的基本原理和操作技术,了解精馏过程中的温度变化规律,并对实验结果进行分析和总结。
实验原理:精馏是利用液体混合物中各组分的沸点差异,通过加热混合物使其中某一组分先汽化,再凝结成液体,从而实现对混合物的分离的一种物理方法。
在精馏过程中,液体混合物首先被加热至其中某一组分的沸点,该组分首先汽化,然后通过冷凝器冷却凝结成液体,最终得到纯净的组分。
实验步骤:1. 将乙醇和水混合成一定比例的混合物,倒入精馏瓶中。
2. 装上加热设备和冷凝器,调节加热设备温度至混合物中乙醇的沸点。
3. 观察冷凝器出口的液体,收集不同温度下的液体样品。
4. 对收集的液体样品进行密度测定和酒精度测定。
实验结果:通过实验,我们得到了乙醇和水在不同温度下的液体样品。
经过密度测定和酒精度测定,我们得到了不同温度下乙醇和水的纯度和组成。
实验分析:根据实验结果,我们发现在不同温度下,乙醇和水的纯度和组成存在明显差异。
通过对实验数据的分析,我们可以得出精馏过程中乙醇和水的分离效果较好,且随着温度的升高,乙醇的纯度逐渐提高。
实验总结:本次实验通过对乙醇和水的精馏实验,使我们更加深入地了解了精馏过程的基本原理和操作技术。
同时,实验结果也验证了精馏过程中液体混合物的分离效果,并为我们今后在化工生产中的实际应用提供了重要参考。
结语:通过本次实验,我们不仅掌握了精馏过程的基本原理和操作技术,也对乙醇和水的混合物分离效果有了更深入的了解。
希望通过今后的实践操作和学习,能够更好地运用精馏技术解决实际生产中的问题,为化工生产贡献自己的一份力量。
化工原理下实验精馏实验
密度 Kg/m3 971.4 969.2 967.0 964.6 962.2 959.7
四、实验操作
开机:启动四组加热丝,打开全凝器的冷却水进口阀,当 塔顶的温度快速上升时,及时关掉1、2组加热器,利用可 调加热丝将3,4组加热电流调节为12A(1#,2#板式塔) 或30A(3#,4#填料塔)
全回流:塔顶蒸汽温度达到70~80℃时,不进料也不出料 即F=0,D=0,逐渐开启回流阀,回流量的大小应注意控 制(1#、2#塔,L应小一些约为2~3l/h, 3#、4#塔回流量 可靠调节至7~8 L/h,在全回流下运行10分钟,期间当回 流流量有下降的趋势,则关小回流阀,全回流时间10分钟。
填料塔的等板高度:HETP
Z NT
等板高度(HETP)是指与一层理论塔板的传质作用相当的填料层
高度。它的大小取决于填料的类型、材质与尺寸,受系统物性、
操作条件及塔设备尺寸的影响。
Z-实际的填料层高度。
关键:如何求NT: 逐板计算法或梯级图解法
测出以下数据:
温度[℃]: tD、tf、tW 组成[mol/mol]:xD、xf、xW 流量: F、D、L
的全回流操作? (9)在本实验室的精馏实验过程,发生了液泛现象,试分析原因并提出解
决的方法。 (10)采用本实验室的流程分离乙醇和水的混合物,能否得到无水乙醇?为
什么?
精馏塔中塔板或填料是气液两相接触的场所由塔釜产生的上升蒸汽与从塔顶下降的下降液接触进行传热和传质下降液经过多次部分气化重组分含量逐渐增加上升蒸汽经多次部分冷凝轻组分含量逐渐增加从而使混合物达到一定程度的分离
精馏实验
二、实验原理简介
精馏塔中,塔板或填料是气液两相接触的场所,由塔釜产 生的上升蒸汽与从塔顶下降的下降液接触进行传热和传质, 下降液经过多次部分气化,重组分含量逐渐增加,上升蒸 汽经多次部分冷凝,轻组分含量逐渐增加,从而使混合物 达到一定程度的分离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2—过量液沫夹带线 (气相负荷上限线) 5—溢流 液泛线 4—液相负荷上限 线(气泡夹带线 ) 1—漏液线(气相 负荷下限线)
Vs(m3/h)
P
3
' OP
b
4
a b
O
OP "
c
c
Ls(m3/h)
1
0
塔板负荷性能图
2. 稳定后用5mL试管抽取回流液、釜液各1mL,在阿贝折射
仪上测出折 射率,查折射率与组成图得xD,xW,xn-1,
xn xw<xn<xn-1<xD
1.3600 n 1.3600 1.3300 0
1.3300
xn
1
部分回流实验: 1. 启动加料泵,拧开进料阀门,调节进料转子流量计控制进料 量F,关小回流转子流量计,打开产品转子流量计计产品量 D,进行部分回流操作。 a. 调节转子流量计指示的读数,即为不同的回流比R; b. 改变进料量F;
精馏实验
一、实验目的 1.了解精馏塔设备的结构,熟悉精馏操作方法; 2.测定精馏塔的全塔效率和个别板效率。 1. 再沸器的汽化量如何控制? 2. 气液分离器是如何工作的?
问 题
3. 在全回流时测定全塔效率需测量哪些变参? 部分回流时测定全塔效率需测量哪些变参? 4. 阿贝折射仪会用否?如何使产品合格?
c. 改变釜液加热量;e.随时调节控制釜液液位不变;
通过上述四种方式调节,观察塔内现象,塔内所示温度,压 力及各个流量稳定后,方可进行取样分析。 2. 用5mL试管抽取回流液、料液和釜液各1mL,在阿贝折射仪 上测出折射率,查图得xD、 xF 、xw 并记录回流量L和产品量D。 3. 测定原料的进口温度tFC,确定加料热状态参数q。
xn1 xn * yn xn
xn-1
xn yn+1Fra bibliotek馏塔的全塔效率ET是理论塔板数NT与实际塔板数N之比,即
NT ET 100 % N
100
N 16块
全回流下求ET:
80
* yn
60
3 4
2
1
测定变参: xD, xw
全回流下求Emv:
y
5
40
20
6
0 0
xn
20 40
xW
x
二、实验原理
精馏是同时并多次运用部分汽化和部分冷凝的方法以分离 混合溶液为较纯溶液的操作,而精馏塔则是实现此过程的一种
设备。
单板效率(默弗里板效率):
EmV
yn yn 1 * yn yn 1
n-1 y n n n+1
实际塔板 理论塔板
在全回流下测定,yn+1=xn
,
yn=xn
EmV
意电压、电流不要超过满量程,以免烧坏仪表。
5. 加热约20分钟,从观察罩观察有鼓泡发生,塔顶放空阀有乙醇
蒸汽溢出时,关闭该排空阀进行粗蒸馏。排空阀作用?
全回流实验: 1. 开启回流转子流量计,关闭产品转子流量计,让全部塔顶
品回流塔内。调节加热电压,使塔内操作处于正常工况 。
3—液相负 荷下限线
2
a
q线方程:
m C pm (tb t F ) q m
L R D
q zF yq xq q 1 q 1
R xD xn 精馏段方程: yn 1 R 1 R 1
求B(xd,yd)
在部分回流下测定全塔效率的变参:
xD, xF , xW , tF , L , D
三、实验流程
1
2 3
4
5 6
T
7 11 12
13 8 9 T
14 15
16 17
18 10 20 21
19
T
P
22 26
23
24
25 29
27
28
30
33 34 31 32
四、实验操作
1. 理清流程。
塔顶气体的流向? 冷却水调节阀在何处?
2. 开启排空阀,通冷却水。
3. 配15~20%乙醇-水溶液在料槽中,打开总电源,启动加料 泵加料到釜的液位刻度线。 是否加料看液位? 4. 打开恒定加热器和可调加热器电源,调节变压器预热釜液,注
4、 关机步骤:
A、变压器调零,关闭恒定和可调电加器;
B、关进料阀,进料流量计调零,停进料泵;
C、关产品流量计;
D、塔内无回流液时,关闭冷却水阀;
F、关闭总电源;
60
xD80
100
测定变参: xn, xn-1
部分回流下求全塔效率:(三点法)
100
A(xD, xD)
21 3 5 4
80
A
6 7
60
B(xd, yd) C(xw, xw)
8
y
40
B
9
20
10
0 0
xW
C
20
xF
40
x
60
xD80
100
C pm C pA x A C pB xB
m A x A B xB
