螯合物认识误区
螯合物

化学物质
01 简介
03 螯合反应 05 相关应用
目录
02 配合物 04 常见的螯合剂 06 螯合程度的检测
基本信息
螯合物是具有环状结构的配合物,是通过两个或多个配位体与同一金属离子形成螯合环的螯合作用而得到。
简介
简介
具有环状结构的配合物,由具有两个或多个配位体与同一金属离子形成螯合环的化学反应——螯合作用而得 到。配体和金属离子间的配位键通常有两种类型:
螯合物是(旧称内络盐)是由中心离子和多齿配体结合而成的具有环状结构的配合物。螯合物是配合物的一 种,在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。“螯”指螃蟹的大钳, 此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
螯合物通常比一般配合物要稳定。从配合物的研究可知,具有五元环或六元环的螯合物很稳定,而且所形成 的环越多,螯合物越稳定。
(1)配体上酸的基团离解去H+,然后与金属离子配位;
金属EDTA螯合物
(2)配体上含有孤电子对的中性基团与金属离子配位.
螯合物最显著的一种特性是其热力学稳定性和热稳定性。螯合环的稳定性与芳香环相似。螯合物可为不带电 荷的中性分子,也可为带电的络离子,前者易溶于有机溶液中,后者可溶于水中,此性质可用于分离和分析金属 离子。金属离子与配体形成螯合物的一般原则是软硬酸碱理论,就是:硬亲硬,软亲软。
分析化学
螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。 化学包覆:在无机粉体表面的吸附或化学反应对颗粒表面螯合有机分子中的官能团进行包覆使颗粒表面改性。
螯合程度的检测
螯合程度的检测
如果配体和银离子结合后,紫外可见区有变化,可以用紫外光谱测定反应进行的程度;如果没有光信号变化, 也可以使用电化学手段,用银-氯化银电极测定体系游离银离子浓度;如果是固体的话,只能用溶剂洗涤固体,将 游离银离子洗脱,然后用原子吸收或其他手段检测银
螯合物知识点

螯合物知识点螯合物是指含有一个或多个配位基与中心金属离子形成稳定配位键的化合物。
螯合物在化学、环境科学和生物学等领域中具有重要应用。
本文将从基础概念、螯合物的形成与性质、应用以及未来发展等方面介绍螯合物的知识点。
1. 基础概念螯合物的概念最早由法国化学家阿尔弗雷德·文伯(Werner)于19世纪末提出。
螯合物由一个或多个配位基(通常是有机物分子或离子)与中心金属离子形成稳定的配位键,形成一个整体稳定的结构。
2. 螯合物的形成与性质螯合物的形成是通过配位键的形成而实现的。
配位基通常通过提供自由电子对与金属离子形成配位键。
螯合物具有以下几个特点:•稳定性:螯合物能够通过配位键的形成增加化合物的稳定性,使其在不同条件下保持稳定结构。
•水溶性:由于螯合物通常具有较大的极性,因此在水溶液中具有良好的溶解性。
•选择性:螯合物的形成可以导致与金属离子的高度选择性结合,从而实现对特定金属离子的识别和分离。
3. 螯合物的应用螯合物在许多领域中具有广泛的应用。
以下是几个重要的应用领域:3.1 化学分析螯合物可以用于分析化学中的金属离子的检测与定量。
通过选择合适的螯合剂,可以实现对特定金属离子的高度选择性识别和分离,从而实现对复杂样品中金属离子的分析。
3.2 医药领域螯合物在医药领域中有广泛应用。
例如,铁离子螯合物可以用作治疗贫血的药物,钙离子螯合物可以用于治疗骨质疏松症等。
3.3 环境科学螯合物在环境科学领域中也具有重要应用。
例如,螯合物可以用于处理废水中的金属离子,使其形成不溶性沉淀物,从而实现对金属离子的去除和废水的净化。
4. 螯合物的未来发展螯合物的研究和应用仍在不断发展。
随着对环境污染和资源稀缺的关注加大,对绿色和可持续发展的需求增加,螯合物的设计和合成也向着更高效、可再生和环境友好的方向发展。
总之,螯合物作为一种特殊的化合物,在化学、环境科学和生物学等领域中具有广泛的应用。
通过了解螯合物的基础概念、形成与性质、应用和未来发展,我们可以更好地理解和应用螯合物,为解决相关问题提供有效的解决方案。
关于微量元素氨基酸螯合物的几个问题(滕冰)

O=C R CH NH2
O
+ · HSO4¯
M
微量元素氨基酸螯合物络阳离子
mol 比 AA: M = 1 : 1
1.关于螯合率 1.关于螯合率
在螯合物的实际应用中,人们经常把“螯合 在螯合物的实际应用中,人们经常把“ 看作一种反应得率。事实上, 螯合率” 率”看作一种反应得率。事实上,“螯合率” 概念的提出是不正确的,( ,(络合物化学中没 概念的提出是不正确的,(络合物化学中没 螯合率”概念) 有“螯合率”概念)因为在不考虑螯合物稳 定程度的情况下, 定程度的情况下,配位体螯合金属离子的反 应很容易发生,只要是混合配位体和金属离 应很容易发生, 子的溶液就可以实现螯合。但是, 子的溶液就可以实现螯合。但是,衡量螯合 是否很“彻底” 是否很“彻底”,则应以螯合物的稳定常数 来表示。 来表示。
Fe2++CH2(NH2)COOH [Fe(CH2(NH2)COOH)]2+ [Fe2+][ CH2(NH2)COOH] [Fe(CH2(NH2)COOH)]2+
K1
[Fe(CH2(NH2)COOH)]2+ + CH2(NH2)COOH
[Fe(CH2(NH2)COOH)2]2+
[Fe(CH2(NH2)COOH)2]2+ [CH2(NH2)COOH] [Fe(CH2(NH2)COOH)]2+
O C O H2O 0 NH2
H2C
Fe
CH 2
NH 2 H2O
O
C O
由于螯合反应是分步进行的, 由于螯合反应是分步进行的,故习惯上把未知具 体配位情况的铁-氨基酸螯合物的结构描述为 体配位情况的铁 氨基酸螯合物的结构描述为 即:
螯合物的定义

螯合物的定义螯合物是指那些在分子结构上能与金属离子形成稳定络合物的化合物。
这种络合物在溶液中可以作为一种特殊的离子载体而起到传递信息的作用,即“传递信息”。
螯合物主要有两大类型,即金属螯合物和非金属螯合物。
非金属螯合物如 EDTA、 CMA、 EDTMP 等。
金属螯合物包括氨基酸及蛋白质的衍生物,如谷氨酸、天冬酰胺、二肽、三肽、四肽等,均具有很好的络合性能,对钙、镁、锌、铜等金属离子都有良好的螯合作用。
另外还有某些含氮杂环化合物,如吡啶、喹啉、噻唑、嘧啶、吲哚等也具有较强的螯合性能。
螯合物通过螯合作用将金属离子连接在一起形成螯合物。
这样既保证了金属离子的生理功能,又增加了分子的稳定性。
从某种意义上讲,螯合物比一般配位剂更安全。
因此,利用螯合物来解决生产实际问题时,不仅考虑到所需螯合物的稳定性,同时也必须考虑螯合物本身的毒性。
当然,由于存在络合物的空间位阻效应,因此在进行螯合反应时,必须严格控制螯合条件,使得络合物尽量小,才能提高螯合物的选择性。
金属螯合物与其他无机或有机配位剂相比,具有以下优点:1.对人体健康危害少,且容易被生物降解。
2.具有明显的抗肿瘤活性。
3.具有生物活性,易被生物体内酶系统水解。
4.具有特异性,不会引入新的杂质。
5.对细胞膜通透性影响极小。
6.与蛋白质或多糖形成的螯合物,有助于药物吸收。
7.具有缓释性,不会出现快速排泄。
8.无毒,对环境友好。
9.价廉,容易获取。
10.具有独特的生物相容性。
11.适宜 pH 范围宽。
12.可通过重组 DNA 技术修饰,改变其结构,增强其功能。
13.易于获得。
螯合物的缺点:1.螯合物的稳定性差,不耐光、热和碱。
2.在低温下,螯合物容易失去活性。
3.对金属离子敏感,特别是铜离子。
4.螯合物的分子结构复杂,不便于进行纯化处理。
螯合物广泛应用于日常生活中的各个方面:工业上制造螯合铁、铬等金属和其它金属的氢氧化物;农业上制造多种微量元素肥料;医学上用于临床治疗肝炎、肾病综合征、癌症、心血管疾病、老年痴呆症、糖尿病等;食品添加剂、饲料添加剂等方面也有广阔前景。
(一)螯合物和螯合剂的概念PPT课件
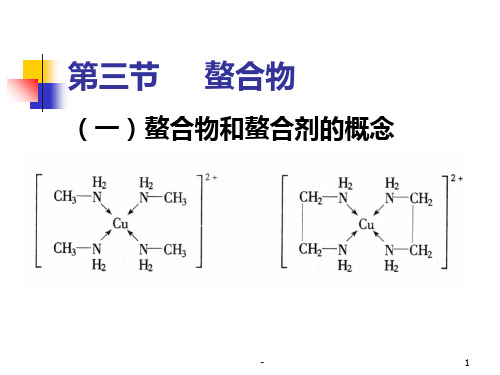
-
6
CaY2-的结构
-
7
EDTA与金属离子的配合有以下特点:
1.螯合能力强 除碱金属以外,能与 几乎所有的金属离子形成稳定的螯 合物。
2.与金属离子形成的螯合物大多带 有电荷,因此易溶于水。
-
8
3.简单的螯合比 不论几价的金属离子, 它们与EDTA总是1:1螯合。例如:
M2++H2Y2--MY2 - +2H + M3++H2Y2--MY - +2H + M4++H2Y2--MY +2H +
-
12
(二)EDTA螯合滴定的基本原理
EDTA螯合滴定就是基于EDTA与
金属离子螯合反应的一种重要的滴定分 析方法,常用于测定溶液中金属离子的 含量。
EDTA螯合滴定的原理和基本过程:
滴定时使用的指示剂叫做金属指示剂。 它们是一类能与金属离子形成有色配合 物的水溶性有机染料。
-
13
作为金属指示剂必须具备以下条件: 1.与金属离子形成的配合物的颜色 与其本身(即未配合时)的颜色有 明显不同;
Ca2++H2Y2- ⇌ CaY2- +2H+ Mg2+ + H2Y2- ⇌MgY2- +2H+
滴定终点时:
MgIn-+ H2Y2- ⇌MgY2- +HIn- +H+
紫红
蓝
-
21பைடு நூலகம்
水的总硬度按下式计算:
总硬度= 式中:
CEDTVAEDTA V水样 1000
CEDTA: EDTA 标准溶液的浓度( mol ·L-1 ) VEDTA : 消耗EDTA标准溶液的体积(L) V: 滴定时水样的体积(L)
螯合物-配合物-络合物

配位键,又称配位共价键,或简称配键,是一种特殊的共价键。
当共价键中共用的电子对是由其中一原子独自供应时,就称配位键。
配位键形成后,就与一般共价键无异。
形成条件配位键的形成需要两个条件:一是中心原子或离子,它必须有能接受电子对的空轨道;二是配位体,组成配位体的原子必须能提供配对的孤对电子。
当一路易斯碱供应电子对给路易斯酸而形成化合物时,配位键就形成了。
例如气态氨NH3和气体三氟化硼BF3形成固体NH3BF3化合价在配位化合物中,由电负性小的元素原子向电负性大的元素原子提供孤对电子形成配位键时,每个有一对孤对电子的前者(电负性小的原子)显示+2价,后者显示-2价。
反之,由电负性大的元素原子提供孤对电子与电负性小的元素原子之间形成配位键时,两种元素都无价态变化。
常见配位键化合物∙一氧化碳CO,其中碳氧间的三对共用电子对有一配位键,两个正常共价键。
∙铵根NH4+,其中N原子与左下右的H原子以极性键结合,与上边的H以配位键结合,由N原子提供孤对电子螯合物(英语:Chelation)是配合物的一种在螯合物的结构中,一定有一个或多个多齿配体提供多对电子与中心体形成配位键。
“螯”指螃蟹的大钳,此名称比喻多齿配体像螃蟹一样用两只大钳紧紧夹住中心体。
金属EDTA螯合物螯合物通常比一般配合物要稳定,其结构中经常具有的五或六元环结构更增强了稳定性。
正因为这样,螯合物的稳定常数都非常高,许多螯合反应都是定量进行的,可以用来滴定。
使用螯合物还可以掩蔽金属离子。
可形成螯合物的配体叫螯合剂。
常见的螯合剂如下:∙乙二胺(en),二齿∙2,2'-联吡啶(bipy),二齿∙1,10-邻二氮杂菲(phen),二齿∙草酸根(ox),二齿∙乙二胺四乙酸(EDTA),六齿值得一提的是EDTA。
它能提供2个氮原子和4个羧基氧原子与金属配合,可以用1个分子把需要6配位的钙离子紧紧包裹起来,生成极稳定的产物。
螯合物在工业中用来除去金属杂质,如水的软化、去除有毒的重金属离子等。
络合物和螯合物的区别

络合物和螯合物的区别络合物络合物之一络合物通常指含有络离子的化合物,例如络盐[Ag(NH3)2]Cl、络酸H2[PtCl6]、络碱[Cu(NH3)4](OH)2等;也指不带电荷的络合分子,例如[Fe(SCN)3]、[Co(NH3)3Cl3]等。
配合物又称络合物。
络合物的组成以[Cu(NH3)4]SO4为例说明如下:(1)络合物的形成体,常见的是过渡元素的阳离子,如Fe3+、Fe2+、Cu2+、Ag+、Pt2+等。
(2)配位体可以是分子,如NH3、H2O等,也可以是阴离子,如CN-、SCN-、F-、Cl-等。
(3)配位数是直接同中心离子(或原子)络合的配位体的数目,最常见的配位数是6和4。
络离子是由中心离子同配位体以配位键结合而成的,是具有一定稳定性的复杂离子。
在形成配位键时,中心离子提供空轨道,配位体提供孤对电子。
络离子比较稳定,但在水溶液中也存在着电离平衡,例如:[Cu(NH3)4]2+Cu2++4NH3因此在[Cu(NH3)4]SO4溶液中,通入H2S时,由于生成CuS(极难溶)络合物之二含有络离子的化合物属于络合物。
我们早已知道,白色的无水硫酸铜溶于水时形成蓝色溶液,这是因为生成了铜的水合离子。
铜的水合离子组成为[Cu(H2O)4]2+,它就是一种络离子。
胆矾CuSO4·5H2O就是一种络合物,其组成也可写为[Cu(H2O)4]SO4·H2O,它是由四水合铜(Ⅱ)离子跟一水硫酸根离子结合而成。
在硫酸铜溶液里加入过量的氨水,溶液由蓝色转变为深蓝。
这是因为四水合铜(Ⅱ)离子经过反应,最后生成一种更稳定的铜氨络离子[Cu(NH3)4]2+而使溶液呈深蓝色。
如果将此铜氨溶液浓缩结晶,可得到深蓝色晶体[Cu(NH3)4]SO4,它叫硫酸四氨合铜(Ⅱ)或硫酸铜氨,它也是一种络合物。
又如,铁的重要络合物有六氰合铁络合物:亚铁氰化钾K4[Fe(CN)6](俗名黄血盐)和铁氰化钾K3[Fe(CN)6](俗名赤血盐)。
螯合物ppt课件

在光谱分析中的作用
形成配合物
螯合物可以与金属离子形成配合物,改变金属离 子的光谱特征,使其更容易被检测和分析。
提高灵敏度
螯合物的形成可以降低光谱散射和背景干扰,提 高分析的灵敏度和准确性。
增加选择性
某些螯合物具有特殊的光谱特征,可以用于区分 不同的金属离子,增加分析的选择性。
通过离心、过滤、蒸馏等 方法将生成的螯合物与其 他反应物分离,并进行纯 化。
影响因素与优化
配体与金属离子的匹配程度
不同的配体与金属离子形成的螯合物稳定性不同,因此需要根据 目标螯合物的稳定性要求选择合适的配体和金属离子。
反应条件
反应温度、压力、时间等条件都会影响螯合物的合成与制备效率, 因此需要根据实际情况进行优化。
。
农业领域
一些螯合物可以作为农药和肥 料,提高农作物的产量和品质 。
环境领域
螯合物可用于水处理、土壤修 复等领域,如利用螯合物去除 重金属离子等污染物。
工业领域
螯合物可用于催化、电镀、印 染等领域,如利用螯合物作为
催化剂加速化学反应。
02
螯合物的合成与制备
合成方法
01
02
03
配体设计
根据目标螯合物的结构特 点,选择合适的配体进行 设计。
生物医药领域
研究螯合物在药物输送、诊断和治疗方面的应用,提高疗效和降低 副作用。
环境领域
开发用于水处理、土壤修复和环境保护的螯合物。
未来发展的挑战与机遇
挑战
随着科技的快速发展,对螯合物的性能和功能要求越来越高,需要不断研究和 创新。
机遇
随着绿色合成、高通量合成和组合合成等技术的发展,可以发现更多新的螯合 物,并应用于更多领域。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
螯合物认识误区
螯合物认识上的五大误区
(一) 混淆螯合物与复合物、有机物的概念
这些名词(或定义)之间是有区别的。
“有机物”的概念最广泛,包括最简单的有机物,如富马酸铁、乳酸亚铁等,这类产品是较低级的有机物,其效果与无机物在实质上并没有什么大的区别,只是刺激性较少而已;有机物更多的是指包括氨基酸复合物、氨基酸螯合物、肽螯合物、金属蛋白盐(全谱氨基酸螯合物)、多糖有机矿物质等在内的,由金属与有机配位体结合而形成的化合物。
“复合物”则泛指金属与氨基酸等形成的化合物(包括带电荷和不带电荷的分子);通常是指由金属与氨基酸按1∶1比例结合而形成的化合物。
“螯合物”通常专指金属与二个氨基酸或多个氨基酸通过较牢固的化学键(配位键和离子键)形成的杂环(五环或六环)结构,整个分子结构呈中性,也有人称其为肽螯合,能借助原有的小肽吸收机制被机体吸收,快速,高效,低耗能,不易饱和。
在众多的有机矿物质当中,二肽螯合物是最理想、最高效、效果也最好的有机物。
(二)螯合物的质量说不清,在金属含量一样的情况下,谁的产品便宜就用谁的
其实,螯合物产品的质量关键不是金属含量高低,最关键的是金属螯合程度,即到底有多少金属是与氨基酸结合的,有多少是呈金属离子状态(与无机物如硫酸盐一样)。
采用最新的原子吸收光谱法(Atomic Absorption Spectrometry,AAS)和特异性离子电极法(Ion selective electrode,ISE),两种检测法相结合就可以客观地检测螯合物的产品质量。
若产品中金属离子越多,产品质量就越差。
仅凭金属含量高低来判定产品质量优劣是完全错误的。
(三) 将螯合物的水溶性与螯合物的质量混为一谈
错误地认为只有金属螯合物溶于水,才能被吸收。
不能溶于水的螯合物是不能被吸收的,没用的,质量差的。
实际上由于消化液的组成非常复杂,绝对不是水溶液的复制品。
许多不溶于水的螯合物,在消化道中完全溶解或呈现很好的分散状,能被机体很好地吸收和利用。
如血红素螯合铁不溶于水,微溶于酸,但有很好的吸收和生物利用率。
有些氨基酸铁或有机铁虽然易溶于水,但吸收率和生物利用率却较低。
实验室标准品“螯合双赖氨酸铜”非常容易溶解;但是,双蛋氨酸铜,也是螯合的,其水溶解性就差。
有机物的可溶性主要是由配位体的功能来决定的,不是由金属结合程度来决定的。
(四) 认为有机矿物质分子量越小就越容易吸收
虽然大分子不易被吸收,如大于10000道尔顿(约80个氨基酸)的确难吸收,2500道尔顿的多肽(约20肽)吸收也较少,小肽或寡肽(2~6个氨基酸为主)较易吸收。
但值得一提的是:过去的研究认为,吸收主要是以游离氨基酸的形式为主,因为游离氨基酸分子量最小。
但近年来的科学研究发现,吸收主要是以小肽形式为主,分子量比游离氨基酸要大几倍。
因为科学家已经在动物的小肠刷状缘上发现了大量的小肽集聚。
小肽比游离氨基酸更易吸收,且效率要高,不易饱和,这可能与小肠吸收机制有关,特别是与小肠上皮细胞膜上的特异性转运载体(原来称为镶嵌蛋白)的数量和活性相关。
分子量越小就越容易吸收的观点是不严谨不科学的。
血红素螯合铁分子量为616,吸收率远高于甘氨酸铁(1∶1则分子量为130, 2∶1则分子量为204),生物利用度好。
如果越小越易吸收,则只需要生产甘氨酸系列产品即可,但实际上国外大公司的产品多数是全谱氨基酸螯合物产品。
(五) 单一氨基酸产品好于全谱氨基酸产品
部分用户认为:单一氨基酸产品,成分准确清楚,含量可靠;但是,全谱氨基酸产品有17种氨基酸,成分多而杂,不知道哪个有用,效果很难说。
这样的看法是不符合事实的。
例如,蛋氨酸或赖氨酸金属有机物即为一类单一氨基酸产品;同时,很多人都认为蛋氨酸和赖氨酸是必需氨基酸,本来就需要额外
补充,添加这类产品就可一举两得(既可补充金属螯合物,又可增加必需氨基酸的量)。
但是,在实际应用中,发现这类效果并不好;有些试验中,蛋氨酸锌的效果还不如草酸锌,更不如全谱氨基酸锌。
仔细研究发现,蛋氨酸锌,特别是1∶1复合产品,其稳定常数明显偏低,仅为4.3;二蛋氨酸锌稳定常数较好为8.3。
美国一家公司在1996年之前都是生产蛋氨酸锌,现在已改为生产全谱的氨基酸(17种氨基酸)金属系列产品。
另一方面,机体需要的是多样化的有机螯合物,对单一特定氨基酸螯合物的需要量很少;添加过多,既没必要,而且或许还会造成吸收通道的竞争,而机体所需的其它氨基酸螯合物却一点也没有,从而影响最终的使用效果。
在国外各种有机产品的激烈较量中,单一特定氨基酸螯合物渐渐退出市场,取而代之的是全谱氨基酸螯合物,并成为压倒性的优势产品。
