RealtimePCR(从原理到实验方法及数据分析)
RealtimePCR原理及其定量方法

定量PCR技术: 通过对PCR扩增反应中每一 个循环产物荧光信号的实 时检测从而实现对起始模 板定量及定性的分析
2、荧光定量PCR常用的三个概念
扩增曲线、阈值、CT值
plateau phase Liner phase
Exponential phase
Normalised reporter Fluorescence (Rn)
另一种思路
由于PCR反应体系中荧光物质的荧光强度与PCR产物的量成 正比,所以可以用荧光强度来代替PCR产物的量,同时考虑 荧光本底值,则:
Rn= RB+ X0(1+ Ex) Rs
总荧光信号强度=本底信号+分子数量×单位信号强度
Rn:第n个循环时的总信号 RB:本底 RS:单位信号强度 X0:起始DNA数目 Ex:PCR扩增效率
线性关系、扩增效率确认
相关系数(R2):大于0.98 标准曲线斜率: -3 到 -3.5 PCR扩增效率(Ex): 0.9到1.2
扩增效率
106 105 104 103 102 10
荧光强度---循环数曲线
初始模板量对数---C(T)循环数标准曲线
扩增效率理论值为1,即每增加一个循环PCR产物加倍。
实时荧光定量PCR原理和定量方法 一、荧光定量PCR的原理
在PCR反应体系中加入荧 光基团,利用荧光信号累积 实现了实时监测整个PCR进程, 对起始模板进行定量分析的 方法。
三个关键词: 实时,定量,荧光
1、定量与常规PCR的差别
常规PCR技术: 对 PCR 扩 增 反 应 的 终产物进行定量及 定性分析
非理想的PCR反应:
Xn=X0 ×(1+Ex)n
n:扩增循环数 X0:起始模板数量 Xn:第n次循环后扩增产物数量 Ex:PCR扩增效率
实时荧光定量PCR的数据分析方法

实时荧光定量PCR的数据分析方法
作者:易健明, 屈武斌, 张成岗, YI Jian-Ming, QU Wu-Bin, ZHANG Cheng-Gang
作者单位:易健明,张成岗,YI Jian-Ming,ZHANG Cheng-Gang(军事医学科学院放射与辐射医学研究所,蛋白质组学国家重点实验室,全军军事认知与心理卫生研究中心,北京100850;安徽医科大学研究生院,安徽合肥230032)
, 屈武斌,QU Wu-Bin(军事医学科学院放射与辐射医学研究所,蛋白质组学国家重点实验室,全军军事认知
与心理卫生研究中心,北京100850)
刊名:
生物技术通讯
英文刊名:Letters in Biotechnology
年,卷(期):2015,26(1)
引用本文格式:易健明.屈武斌.张成岗.YI Jian-Ming.QU Wu-Bin.ZHANG Cheng-Gang实时荧光定量PCR的数据分析方法[期刊论文]-生物技术通讯 2015(1)。
实时定量PCR技术(real-time PCR)

样品重复
重复次数请遵循统计学的要求 小样本统计,n>6(n>3) 未知样品和标准品都要重复 所有复管在同样条件下完成PCR
2.2 技术方法及数据
绝对定量与相对定量
绝对定量:绝对标准曲线法
标准品拷贝数的计算 待测样本浓度(ng/ul)=OD260×40×稀释 倍数 样本分子量=碱基数×324 待测样本拷贝数(copies/ul)=待测样本浓 度/样本分子量×6×1014
扩增效率 扩增效率与标准曲线的斜率相关,计算方程为: 扩增效率(E)=10-1/斜率。理论上,在每个指 数扩增循环中,PCR产物的量加倍,即PCR产 物2倍增加,反应效率为2,扩增效率就为2, 就可得2=10-1/斜率,标准曲线得斜率就为-3.32, 斜率得绝对值与荧光曲线间距相同。 如果将扩增效率用百分率来表示,即: E%=(E-1)×100%,对于理想的PCR反应, E=2,即:扩增效率E%=(2-1)×100%=100% 如果E=1.92,带入方程(1.92-1)×100%=92%, 表示每个循环的终点,扩增产物的拷贝数增加 1.92倍,或每次循环有92%的模板被扩增。
TaqMan探针
TaqMan定量原理
荧光共振能量转移(FRET)
当某个荧光基团的发射谱与另一个荧光基团的吸 收光谱重叠,且两个基团距离足够近时,能量可 以从短波长(高能量)的荧光基团传递到长波长 (低能量)的荧光基团,这个过程称为荧光共振 能量转移(FRET),实际相当于短波长荧光基团释放 的荧光被屏蔽。
PCR效率对定量结果的影响
Real time PCR操作步骤:从采样到数据处理

Real time PCR操作步骤:从采样到数据处理1.采样:1.1采样前的准备:DEPC水,灭菌手术刀剪,75% 酒精,2 mL无RNA酶离心管,2个盛有DEPC水的烧杯,一个用于冲洗样品,一个用于放置手术刀剪,以减少外界污染。
1.2采样过程中的注意事项:采样人员需带好口罩和手套,并且尽量少讲话。
当鸡放血致死后,立即解剖,并优先取RNA试验用样品。
取样量约100 mg左右(根据RNA提取方法不同可改变取样量),尽量保证每管取样大小和部位接近一致(可事先取些样品,有个大概的标准即可)。
RNA样品采集于离心管中,立即投入液氮(或者RNA保存液中)冻存,最后统一转入-70 ℃冰箱。
根据实验条件选择RNA样品的保存方式,优先选择液氮保存。
建议:如果直接投入液氮保存,离心管盖子要盖严,以免液氮渗入管中,导致离心管在转入-70 ℃冰箱时管盖崩开使样品损失。
2.总RNA提取提取组织和细胞总RNA推荐使用Trizol法。
2.1 Trizol提取总RNA的操作步骤以下操作需在超净台中进行,超净台使用前需用75% 酒精擦拭台面,紫外灯照射半小时后,打开风机排除臭氧,减少对实验人员的伤害。
此外,要提前制冰备用。
1)每50-100 mg样品加1 ml Trizol,使用高通量研磨仪研磨30 s。
2)研磨后样品放置5 min,4 ℃12 000 g离心10 min,上清液转移到另一个1.5 ml无RNA酶离心管中(已冰上预冷)。
3)加入200 µL氯仿,用力摇晃15 s,室温放置5 min。
4) 4 ℃ 12 000 g离心15 min,上清液转移至另一个1.5 ml无RNA酶离心管中(已冰上预冷)。
5)加入500 µL异丙醇,上下颠倒混匀,室温静置10 min,沉淀RNA。
6) 4 ℃ 12 000g离心10 min,弃上清。
7)加入1 ml 75% 乙醇(DEPC水配制),用移液器反复吸打乙醇,洗涤RNA沉淀。
Real-timePCR实验原理与技术

实时荧光定量PCR技术原理
01
在实时荧光定量PCR反应中, DNA模板被扩增时,与荧光探 针结合,产生荧光信号。
02
随着DNA的扩增,荧光信号逐 渐增强,通过对荧光信号的实 时监测和分析,可以计算出 DNA的起始浓度。
03
通过标准曲线或内参基因的校 准,可以将起始浓度转化为目 标基因的表达量或基因拷贝数 。
实时监测荧光信号
实时监测荧光信号,确保PCR产物在指数扩增阶段被检测到。
标准化实验流程
建立标准化实验流程,确保实验结果的可靠性和可重复性。
未来展望
新技术应用
01
随着新技术的不断发展,如数字PCR、微流控PCR等,Real-
time PCR技术将得到进一步优化。
高通量检测
02
通过多重PCR和高通量检测平台,实现大规模样本的快速检测。
03
Real-time PCR 实验数 据分析
数据收集与整理
数据收集
在实时PCR实验中,数据收集通常涉 及记录每个循环的荧光信号强度。这 些数据通常以图表形式表示,其中横 轴表示循环数,纵轴表示荧光信号强 度。
数据整理
收集到的原始数据需要经过整理,包 括去噪、去除异常值和标准化等步骤, 以确保数据分析的准确性。
自动化与智能化
03
实现Real-time PCR的自动化和智能化,提高实验效率,减少人
为误差。
THANKS FOR WATCHING
感谢您的观看
real-timepcr实验原 理与技术
contents
目录
• Real-time PCR 实验原理 • Real-time PCR 实验技术 • Real-time PCR 实验数据分析 • Real-time PCR 实验应用 • Real-time PCR 实验注意事项与优化建
Realtime PCR实验原理与技术 ppt课件

qRT-PCR技术实验操作(优化)
标准品的选择: 理论上可以以目的基因的PCR扩增产物为标准品, 但是存在降解、污染等因素影响定量结果。
论坛网友给出了几种解决方法: ① 另设计一对引物用于荧光PCR; ② 将扩增序列插入T载体后作为标准品; ③ 设计一对外围引物扩增PCR,将产物连入T载体(①+②)
Realtime PCR实验原理与技术
qRT-PCR技术荧光标记方法的 分类
1. 非特异性的DNA结合染料法:荧光染料能非特异结合DNA
双链结构的小沟中,而游离的荧光染料不发出荧光。
常用染料:Pico Green (灵敏度高,>=25pg/mL) SYBR I
缺点:易受到非特异性扩增和引物二聚体的影响。 措施:设计特异性引物,优化PCR反应条件。
定量分析?
Realtime PCR实验原理与技术
qRT-PCR技术原理
a) Ct值(Cycle Threshold;每个反应管中荧光强度达到阈 值所需的循环数)与样本初始拷贝数存在正比线性关 系。
b) 以不同稀释倍数的已知模板制备标准曲线。 c) 实时监测未知样本的Ct值,对应标准曲线得到未知
样本的初始拷贝数。(定量分析)
Realtime PCR实验原理与技术
qRT-PCR技术实验操作(优 化)
有研究建议在每一个循环中 PCR 延伸后增加一步,即 将温度提高后再检测反应体系中的荧光。该检测温度 大于引物二聚体的退火温度 Tm,而小于特异性扩增 产物的 Tm值。在此温度下,引物二聚体都变性成单 链,因此只检测到与特异性 PCR 产物结合的 SYBR Green I 所发出的荧光,消除了引物二聚体的干扰,降 低了非特异性荧光,有助于目标基因的准确定量。
Real-time_PCR(从原理到实验方法及数据分析)

•
绝对定量:从荧光到拷贝数
The well contains 400 target copies
Y= mx+b
Ct values
0
Ct‘s
1
2
3
4
5
6
7
Log copy number
相对定量:参照因子 Calibrator
用以比较结果的基准
time t =0 t=12 t=24 t=48
total RNA total RNA
t=0 t=1h
2.0 1 0.1
t=6h t = 24 h
相对定量研究软件
• • • 同时分析多达10块反应板的基因表达数据 – 多至960个数据点的单击分析 – 数据直观 通过ΔΔCT (比较 Ct)法完全自动分析数据 无须将数据导出至电子数据表或多次数据导出
终点检测 终点检测
等位基因分型 等位基因分型 阴性阳性鉴定 阴性阳性鉴定
Workflow
mirVana™ miRNA Isolation Kit
TaqMan® MicroRNA RT kit TaqMan® MicroRNA Assays
TaqMan® Universal Master Mix,No UNG
Five Fully Integrated Systems for Real-Time PCR
•
•
正常与突变探针在同一管里反应的点突变检测
基因分型检测
FAM VIC Homozygote for FAM-specific allele
VIC FAM Homozygote for VIC-specific allele
FAM VIC
Heterozygote for both alleles
Real-time_PCR_原理(非常经典的PCR文档)
Real-time PCR 原理介绍实时荧光定量PCR技术于1996年由美国Applied Biosystems公司推出,由于该技术不仅实现了PCR从定性到定量的飞跃,而且与常规PCR相比,它具有特异性更强、有效解决PCR污染问题、自动化程度高等特点,目前已得到广泛应用。
本文试就其定量原理、方法及参照问题作一介绍。
一.实时荧光定量PCR原理所谓实时荧光定量PCR技术,是指在PCR反应体系中加入荧光基团,利用荧光信号积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。
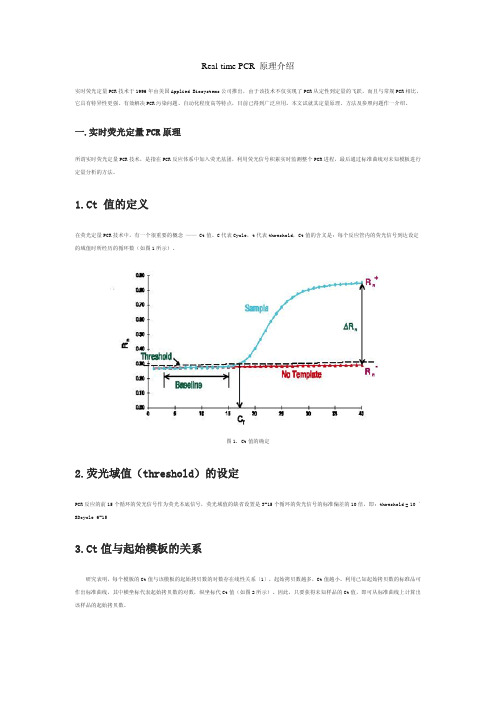
1.Ct 值的定义在荧光定量PCR技术中,有一个很重要的概念 —— Ct值。
C代表Cycle,t代表threshold,Ct值的含义是:每个反应管内的荧光信号到达设定的域值时所经历的循环数(如图1所示)。
图1. Ct值的确定2.荧光域值(threshold)的设定PCR反应的前15个循环的荧光信号作为荧光本底信号,荧光域值的缺省设置是3-15个循环的荧光信号的标准偏差的10倍,即:threshold = 10 ´ SDcycle 6-153.Ct值与起始模板的关系研究表明,每个模板的Ct值与该模板的起始拷贝数的对数存在线性关系〔1〕,起始拷贝数越多,Ct值越小。
利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代Ct值(如图2所示)。
因此,只要获得未知样品的Ct值,即可从标准曲线上计算出该样品的起始拷贝数。
图2. 荧光定量标准曲线4.荧光化学荧光定量PCR所使用的荧光化学可分为两种:荧光探针和荧光染料〔2〕。
现将其原理简述如下:1)TaqMan荧光探针:PCR扩增时在加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团。
探针完整时,报告基团发射的荧光信号被淬灭基团吸收;PCR扩增时,Taq酶的5’-3’外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
SYBR Green I作用机理
数量关系
1. 每形成一个DNA双链,就有一定数量的染料结合上去 2. 染料一结合,就产生荧光信号 3. 信号强度与DNA分子总数目成正比
TaqMan探针的FRET
E
TaqMan® Probe R
E
Q
E
R
E
Q
TaqMan作用机理
数量关系
上游引物
3’ 5’
3’ 5’
线性图谱
对数图谱
基线 阈值 Ct值 [DNA]0
什么是阈值?
1. 基线(空白)信号的产生是由于测量的偶然误差引起的。 2. 偶然误差的结果满足对数分布。 3. 阈值 = 基线(背景)信号标准偏差 x 10。 4. 由于测量的偶然误差而导致测得的荧光信号大于阈值的概率小于10-5。 5. 当荧光信号大于阈值时,可以肯定是由于PCR的扩增使得荧光强度得以测量。
实实时时PPCCRR分分析析
绝绝对对定定量量
相相对对定定量量
根据标准曲线 提供数量测量
提供精确的起始材料 相对数量差异
绝对定量与相对定量的定义
• 绝对定量分析用于确定未知样本中某个核酸序列的绝对量值,即通常 所说的拷贝数。
• 相对定量用于测定一个测试样本中目标核酸序列与校正样本中同一序 列表达的相对变化。校正样本可以是一个未经处理的对照或者是在一 个时程研究中处于零时的样本。
T=24hr
IL-2 18S ΔCt 24 9 15 24 10 14 23 11 12
28 10 18
ΔΔCt 0 -1 -3
3
2-ΔΔCt 1.0 2.0 8.0
0.1
Relative Quantity of Expression
10
8.0
8
6
4
2.0
2
1
0.1
0
ቤተ መጻሕፍቲ ባይዱ
t=0 t=1h t=6h t = 24 h
相对定量研究软件
• 同时分析多达10块反应板的基因表达数据 – 多至960个数据点的单击分析 – 数据直观
• 通过ΔΔCT (比较 Ct)法完全自动分析数据 • 无须将数据导出至电子数据表或多次数据导出
终终点点检检测测
等等位位基基因因分分型型
阴阴性性阳阳性性鉴鉴定定
突变的存在形式
目标序列的有无
等位基因分型
基线 阈值 Ct值 [DNA]0
什么是CT值?
从基线到指数增长的拐点所对应的循环次数
线性图谱
对数图谱
CT值
CT值
为什么CT值 ∝ [DNA]0 ?
N = N0 x (1+e)n
N:产物分子数;N0:起始分子数 e: 扩增效率; n: 循环次数
PCR理论方程只在指数期成立
线性期
lg [DNA]
指数期 y = x(1+e)n
TaqMan 探针
R
Q
5’
3’
下游引物
R
Q
5’
3’
1. 每产生一条DNA链,就切断一条探针
2. 每切断一条探针,就产生一个单位信号
3. 信号强度与结合探针的DNA分子数成正比
Real-time PCR 应用
• 绝对定量(Absolute Quantification,AQ)
• 病原体检测 • 转基因食品检测 • 基因表达研究
基线 阈值 Ct值 [DNA]0
由于PCR扩增效率的差异使得相同的样品 扩增结果存在很大的差异
同时扩增96的相同样品的结果
线性图谱
扩增曲线:四个阶段
平台期
线性增长期 指数增长期 基线期
平台期 线性增长期 指数增长期
基线期
对数图谱
基线 阈值 Ct值
什么是基线?
基线就是扩增曲线中的水平部分。
[DNA]0
cDNA cDNA
cDNA cDNA
相对定量:内对照 Endogenous Control
用以标准化样品操作
time
t =0
t=12
t=24
t=48
total RNA total RNA total RNA total RNA
cDNA cDNA
cDNA cDNA
T=0 (calibrator) T=1hr T=6hr
Real-time PCR
Xiao Jin Applied Specialist Molecular & Cellular Biology
Real-time PCR 原理
数学原理 化学原理
Real-time PCR 应用
绝对定量 相对定量 等位基因分型 阴阳性判定 microRNA
荧光定量PCR数学原理
循环数
为什么CT值 ∝ [DNA]0 ?
Rn = RB + X0 (1+ e)n Rs
第n次PCR循环时的荧光信号强度(Rn)等于背景信号强度(RB)加上每个分 子的荧光强度(即单位荧光强度,RS)与分子数目的乘积。
设n=CT,则:
RCT = RB + X0 (1+ e)CT Rs lg (RCT - RB) = lg X0 + CT lg (1+ e) + lg Rs CT lg (1+ e) = - lg X0 + lg (RCT - RB) – lg Rs
CT
= − log X O log(1 + E X )
+
log(RT − RB ) − log RS log(1 + EX )
即 CT = - k lg X0 + b (线性方程)
标准曲线:CT值对[DNA]0作图
CT值
CT = - k lgX0 + b
lg [起始DNA]
成功的定量PCR
荧光定量PCR化学原理
• 定义:等位基因分型(AD)分析是一种多重(每个反应包括一个以上的 引物和探针对)、终点(在PCR过程的终点收集数据)分析实验,用 于检测某个核酸序列的变异。
• 每个反应中包括两个引物和探针对,允许在一个目标模板序列的单核 苷酸多态性(SNP)位点上出现两个可能的变异基因型。
绝对定量:从荧光到拷贝数
The well contains 400 target copies
Y= mx+b
Ct‘s
Ct values
0
1
2
3
4
5
6
7
Log copy number
相对定量:参照因子 Calibrator
用以比较结果的基准
time
t =0
t=12
t=24
t=48
total RNA total RNA total RNA total RNA
• 相对定量(Relative Quantification,RQ)
• 基因在不同组织中的表达差异 • 药物疗效考核 • 耐药性研究
• 等位基因分型(Allelic Discrimination,AD)
• 基因突变分析 • SNP研究 • 物种鉴定、菌株鉴定
• 阴性阳性鉴定(Plus/Minus with IPC,+/-)
