九年级化学计算题专题复习(提高篇)
初三化学化学方程式的计算单元复习提高测试题

初三化学化学方程式的计算单元复习提高测试题一、初中化学利用化学方程式选择题1.在反应A+3B=2C+2D中,A和B的相对分子质量之比9:11,已知1.8gA与一定量B恰好完全反应成5.1gD,则在此反应中反应物B和生成物C的质量比为?()A.2:1 B.2:3 C.3:1 D.1:22.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
此碳氢化合物可能是( )A.CH4 B.C2H6 C.C2H2 D.C3H83.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量4.Fe和FeO的混合物,测得其中铁元素的质量分数为80%.取该混合物7.0g,加足量稀硫酸完全溶解,生成FeSO4的质量为()A.7.6g B.15.2g C.20.0g D.40.0g5.关于化学反应2X+Y=2Z的叙述正确的是()A.Z可能是单质,也可能是化合物B.反应中X、Y、Z三种物质的质量比是2:1:2C.若X和Y的相对分子质量分别为M和N,则Z的相对分子质量为M+ND.若ag的X完全反应生成bg的Z,则同时消耗(b﹣a)g 的Y6.已知2A+3B==C+3D,用足量的A和49 g B恰好完全反应,生成57 g C和1 g D,若B 的相对分子质量为98,则A的相对分子质量为( )A.16 B.27 C.44 D.567.己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。
又知D的相对分子质量为18,则C的相对分子质量为()A.22 B.44 C.88 D.92CO的混合物10g,测得其中氧元素含量为8.如图所示:在密闭容器中充入CO和264%,再向密闭容器中通入足量的氧气,通电使电火花塞点火让其中的一氧化碳完全燃烧成二氧化碳。
鲁教版初三化学上《化学方程式书写及其计算》习题同步练习(提高篇)含解析

化学方程式书写及其计算(提高篇)【巩固练习】一、选择题(每小题只有一个选项符合题意)1.下列关于化学反应2H2+O22H2O 说法正确的是()A.氧气是一种具有可燃性的物质B.2 g 氢气与2 g 氧气可以恰好反应生成4 g 水C.该反应方程式可以读成:氢气加氧气在点燃的条件下等于水D.2n个氢分子完全反应要消耗n个氧分子2.配平方程式:FeS2+O2-Fe2O3+SO2,其化学计量数正确的一组为()A.4、11、2、8 B.5、11、2、8 C.4、13、2、8 D.4、11、2、93.下列化学方程式正确的是()A.Na+Cl2NaCl B.H2O22H2↑+O2↑C.4P+5O22P2O5D.Fe+CuSO4FeSO4+Cu4.10 g细铁丝在足够的氧气中完全燃烧,生成物的质量是()A.肯定小于10 g B.肯定等于10 g C.肯定大于10 g D.约等于10 g5.红磷在氧气中燃烧生成五氧化二磷。
该反应中磷、氧气、五氧化二磷的质量比是()A.4∶5∶2 B.31∶24∶47 C.31∶32∶142 D.124∶160∶2846.下列化学方程式①~④中书写错误的有()①在空气中点燃镁带:2Mg+O22MgO②用稀盐酸除铁锈:FeO+2HCl=FeCl2+H2O。
③用锌粒和稀盐酸制氢气:Zn+2HC1=ZnCl2+H2↑④将主要成分为碳酸钙的贝壳投入稀盐酸:CaCO3+HCl=CaCl2+CO2↑+ H2OA.①②B.③④C.①③ D.②④7.A物质和B物质在肯定条件下发生化合反应生成C,m gA和n gB发生反应,生成C的质量是()A.等于(m+n)g B.小于或等于(m+n)g C.小于(m+n)g D.大于(m+n)g物质X Y Z Q 反应前质量/g 4 10 1 21反应后质量/g 0 12 15 待测已知x的相对分子质量为n,Q的相对分子质量为2n,则下列推断正确的是()A.反应后Q的质量为10 gB.反应中Y与Q发生变更的质量比为1∶1C.反应后生成15 gZD.该反应方程式中X与Q的化学计量数之比为2∶39.二氧化钛(TiO2)是一种用途广泛的化工原料。
初三化学化学方程式的计算提高强化练习含答案解析

初三化学化学方程式的计算提高强化练习含答案解析一、初中化学利用化学方程式选择题1.含碳元素36%的一氧化碳和二氧化碳的混合气体10g通过足量的灼热碳层,再通过足量的灼热氧化铜,将得到的气体再通入足量的石灰水,最终得到的沉淀的质量是()A.40g B.60g C.30g D.50g2.宏观世界是五彩缤纷的,微观世界更是充满了神奇色彩。
微观思维是化学思维的重要组成部分。
已知某反应的微观示意图如下所示,下列说法错误的是A.甲和乙两种物质参加反应的分子个数比为1:1B.化学反应前后原子个数没有改变C.该反应属于氧化反应D.丙物质中所含碳、氧元素的质量比为3:83.下图为某化学反应的微观粒子示意图,关于该反应说法错误的是A.参加反应的物质分子个数比为1:1B.该反应为置换反应C.生成物的质量比为7:22D.反应物均为氧化物且该反应遵循质量守恒定律4.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量5.甲和乙在一定条件下反应生成丙和丁的微观示意图如下,结论正确的是()A.丁的式量为18g B.生成物都是氧化物C.参与反应的甲和乙的质量比为22:3D.反应前后分子个数不变6.Fe和FeO的混合物,测得其中铁元素的质量分数为80%.取该混合物7.0g,加足量稀硫酸完全溶解,生成FeSO4的质量为()A.7.6g B.15.2g C.20.0g D.40.0g7.已知2A+3B==C+3D,用足量的A和49 g B恰好完全反应,生成57 g C和1 g D,若B 的相对分子质量为98,则A的相对分子质量为( )A.16 B.27 C.44 D.568.己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。
初三化学化学方程式的计算提高单元测试题含答案解析

初三化学化学方程式的计算提高单元测试题含答案解析一、初中化学利用化学方程式选择题1.元素钴有多种化合价。
将11.9gCoCO3在纯净氧气中加热可得到8.3g钴的氧化物,则CoCO3在纯氧中受强热发生的反应化学方程式是A.CoCO3+O2强热CoO3+CO2B.2CoCO3+O2强热2CoO2+CO2C.4CoCO3+3O2强热2CoO3+4CO2D.4CoCO3+O2强热2Co2O3+4CO22.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
此碳氢化合物可能是( )A.CH4 B.C2H6 C.C2H2 D.C3H83.对化学反应:M+H2SO4=CaSO4↓+2N的认识,错误的是()A.N中一定含有氢元素B.相对分子质量:M>NC.M可能是CaO D.N可能是HNO34.己知A+3B=2C+3D中,已知2.3gA跟4.8gB恰好完全反应生成4.4gC。
又知D的相对分子质量为18,则C的相对分子质量为()A.22 B.44 C.88 D.925.如图所示:在密闭容器中充入CO和2CO的混合物10g,测得其中氧元素含量为64%,再向密闭容器中通入足量的氧气,通电使电火花塞点火让其中的一氧化碳完全燃烧成二氧化碳。
则完全反应后密闭容器中二氧化碳的质量为()A.13.2g B.17.6g C.15.4g D.11.0g6.实验时有一块未知质量的石灰石样品(含杂质20%,杂质不含钙元素,不溶于水,也不参加反应),高温煅烧一段时间后,称得固体质量为10.3g,向固体中加入100g稀盐酸,恰好完全反应,过滤,所得滤液质量为105.6g,则与稀盐酸反应的碳酸钙在样品质量分数为() A.20% B.40% C.50% D.80%7.取NaCl、NaOH、Na2CO3固体混合物28.6g于烧杯中,向其中加入过量的稀盐酸至充分反应后,共生成二氧化碳气体4.4g,将溶液蒸干,得无水固体33.4g,则原混合物中氯化钠质量为A.8.4g B.10.0g C.11.7g D.13.6g8.如图是某反应的微观示意图。
九年级化学化学计算题提高训练含解析
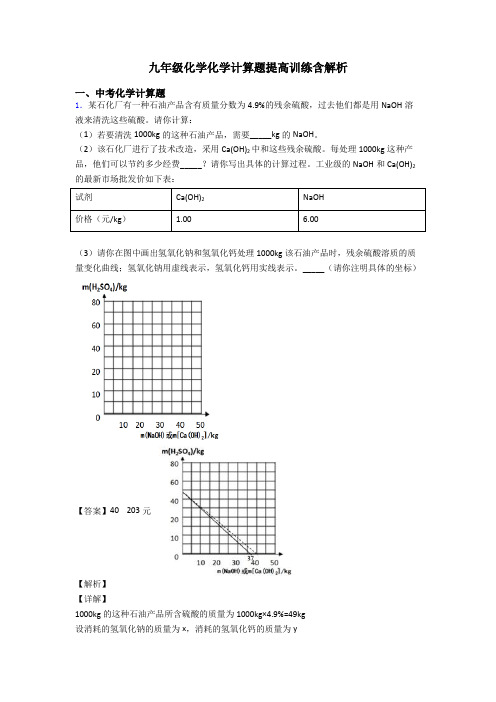
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约203元经费。
(3)残余硫酸溶质的质量变化曲线;氢氧化钠用虚线“…”表示,氢氧化钙用实线“一”表示,
2.小王同学为了测定某Na2CO3溶液中溶质的质量分数,取10g该溶液于烧杯中,然后将400g澄清石灰水分四次加入,烧杯中沉淀的质量与每次加入澄清石灰水的质量关系如表。请计算:
(3)氢氧化钡既能与稀硫酸反应,也能与硫酸镁反应,利用化学方程式,根据硫酸和硫酸镁的质量即可计算出产生的沉淀的质量。
【详解】
解:(1)设与2.4g镁反应的H2SO4的质量为x,生成硫酸镁的质量为y;
x=9.8g
y=12g
(2)由图可知加入的氢氧化钠的质量为80g时才开始形成沉淀;
设参加反应的氢氧化钠的质量为z;
试剂
Ca(OH)2
NaOH
价格(元/kg)
1.00
6.00
(3)请你在图中画出氢氧化钠和氢氧化钙处理1000kg该石油产品时,残余硫酸溶质的质量变化曲线;氢氧化钠用虚线表示,氢氧化钙用实线表示。_____(请你注明具体的坐标)
【答案】40203元
【解析】
【详解】
1000kg的这种石油产品所含硫酸的质量为1000kg×4.9%=49kg
九年级化学化学计算题提高训练含解析
一、中考化学计算题
1.某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。请你计算:
(1)若要清洗1000kg的这种石油产品,需要_____kg的NaOH。
(2)该石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理1000kg这种产品,他们可以节约多少经费_____?请你写出具体的计算过程。工业级的NaOH和Ca(OH)2的最新市场批发价如下表:
中考化学提高题专题复习计算题练习题及详细答案

一、中考初中化学计算题1.硫酸铜溶液对过氧化氢的分解有催化作用。
取一定质量8.5%的过氧化氢溶液倒入烧杯中,加入一定质量15%的硫酸铜溶液,过氧化氢完全分解。
有关实验数据如下表所示(不考虑气体在水中的溶解)。
请计算:(1)生成氧气的质量为___________g。
(2)反应后烧杯中溶液溶质的质量分数为____________。
(写出计算过程,结果精确到0.1%)【答案】0.8 2.2%【解析】【分析】【详解】(1)根据质量守恒定律,氧气的质量=(60g+3.3g)﹣62.5g=0.8g;(2)根据题意,过氧化氢完全分解后,溶液中的溶质是硫酸铜,因为硫酸铜是催化剂,反应前后质量不变,所以溶液中硫酸铜的质量=3.3g×15%=0.495g,只要求出反应后溶液的质量就可求出反应后溶液中溶质的质量分数。
设过氧化氢溶液中含H2O2的质量为x22222H O=2H O+O6832x0.8g↑68x=320.8g解得x=1.7g,则过氧化氢溶液的质量=1.7g÷8.5%=20g,反应后烧杯中溶液溶质的质量分数=0.495g100%20g+3.3g-0.8g⨯=2.2%。
答:(1)生成氧气的质量为0.8g。
(2)反应后烧杯中溶液溶质的质量分数为2.2%。
2.某碳酸钠样品中含有少量氯化钠。
现称量11 g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体。
计算:(1)碳酸钠样品中碳酸钠的质量______________(2)反应后所得溶液中溶质的质量分数。
(结果精确到0.1%)_____________【答案】10.6g 21.4%【解析】【分析】【详解】设样品中氯化钠的质量为x,则生成的氯化钠质量为12.1g-x,样品中碳酸钠的质量为11g-x,生成的二氧化碳质量为y,反应中消耗的盐酸质量为z。
2322 Na CO+2HCl=2NaCl+H O+CO106731174411g-x z14.6%12.1g-x y ↑⨯1067311744 === 11g-x z14.6%12.1g-x y⨯解得x=0.4g;y=4.4g;z=50g则样品中碳酸钠的质量为10.6g反应后所得溶液中溶质质量分数为:12.1g100%11g+50g-4.4g⨯≈ 21.4%答:碳酸钠样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质的质量分数为21.4%。
初三化学化学方程式的计算提高训练题含答案解析
初三化学化学方程式的计算提高训练题含答案解析一、初中化学利用化学方程式选择题1.现有10.6g碳酸钠和8.4g碳酸氢钠,分别与过量盐酸反应,其中( )A.碳酸钠消耗的氯化氢多B.碳酸氢钠生成的二氧化碳少C.碳酸氢钠消耗的氯化氢多D.碳酸氢钠生成的二氧化碳多2.下图为某化学反应的微观粒子示意图,关于该反应说法错误的是A.参加反应的物质分子个数比为1:1B.该反应为置换反应C.生成物的质量比为7:22D.反应物均为氧化物且该反应遵循质量守恒定律3.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法不正确的是A.X的值为165.6B.该反应可能为复分解反应C.反应过程中,B与D的质量比为36∶142D.若A与C的相对分子质量之比为98∶40,则A与C的化学计量数比为2∶14.质量守恒定律是帮助我们学习认识化学反应实质的重要理论,在化学反应aA+bB═cC+dD中,下列说法正确的是A.化学计量数a与b之和一定等于c与d之和B.若A和C都是盐,则该反应一定是复分解反应C.反应物A和B的质量比一定等于生成物C和D的质量比D.若取xgA和xgB反应,生成C和D的质量总和不一定是2xg5.科学家最新发现,可以将树木纤维素转变为超级储能装置,该反应的微观示意图如下。
下列说法正确的是A.反应前后分子总数不变B.反应中 X、Z 两种物质的质量比为 3:7C.反应中 Y 和 W 的物质的量之比为 4:5D.参加反应的 Y 中氮元素的质量一定等于生成 Z 的质量6.对化学反应:M+H2SO4=CaSO4↓+2N的认识,错误的是()A.N中一定含有氢元素B.相对分子质量:M>NC.M可能是CaO D.N可能是HNO37.如图是某反应的微观示意图,下列说法不正确的是()A.反应物中有单质B.该反应为置换反应C.生成物的分子个数比为1:1D.参加反应的和的质量比为17:248.物质X的化学式为H2C2O4,可发生如下反应:aH2C2O4 bH2O↑+cCO2↑+dY↑取45g X,在t℃完全分解,产物通过足量浓硫酸,浓硫酸增重9g,另取45gX,在t℃完全分解,产物通过足量碱石灰(CaO和NaOH的固体混合物),碱石灰增重31g,则下列说法错误的是(已知气体Y不与浓硫酸或碱石灰发生反应)()A.CO2的质量为22g B.气体Y的质量为14gC.化学方程式中b∶c=1∶1D.气体Y可能为甲烷9.偏二甲肼(C2H8N2)与N2O4反应能放出巨大的能量,化学方程式为C2H8N2+2N2O4═2X↑+3N2↑+4H2O↑,下列说法正确的是()A.该反应属于化合反应B.X的化学式为COC.偏二甲肼中氮的质量分数最大D.生成N2和H2O的质量比14:110.已知:在650℃时,CuSO4分解为CuO与气体,在1400℃时,CuO受热发生如下分解反应:4CuO2Cu2O+O2↑.现将16gCuSO4高温加热一段时间,冷却后称量剩余固体为7.6g.下列说法错误的是()A.剩余固体为混合物B.产生的气体中,硫、氧的质量比为8∶26 C.剩余固体中含6.4g铜元素D.剩余固体用足量CO还原,可产生CO23.3g11.实验时有一块未知质量的石灰石样品(含杂质20%,杂质不含钙元素,不溶于水,也不参加反应),高温煅烧一段时间后,称得固体质量为10.3g,向固体中加入100g稀盐酸,恰好完全反应,过滤,所得滤液质量为105.6g,则与稀盐酸反应的碳酸钙在样品质量分数为() A.20% B.40% C.50% D.80%12.在化学反应A+B2=AB2中,A与B2反应的质量关系如图所示,现将8gA和5gB2充分反应,则生成AB2的质量是()A.10g B.13g C.16g D.18g13.在反应A+2B═C+D中,7.6gA与5.3gB恰好完全反应生成12.7gC,现要得到0.6gD,则需要A的质量为()A.5.6g B.16.8g C.22.8g D.无法计算14.Fe2O3、CuO的固体混合粉末a g,在加热条件下用足量CO还原,得到金属混合物2.41g,将生成的CO2气体用足量的澄清石灰水吸收后,产生0.05mol白色沉淀。
中考化学提高题专题复习计算题练习题附答案解析
一、中考初中化学计算题1.工业生产的纯碱中常含有少量氯化钠杂质,现称取12 g 纯碱样品于烧杯中,加入水使其完全溶解,逐渐加入氯化钙溶液至过量,测得加入氯化钙溶液的质量与生成沉淀的关系如下图所示。
(反应的化学方程式:CaCl 2+Na 2CO 3=CaCO 3↓+2NaCl)(1)计算样品中碳酸钠的质量分数________(要求写出计算过程,精确到0.1%)。
(2)若要计算氯化钙溶液中溶质的质量分数,可使用上图中_____点的一组数据(填标号)。
【答案】(1)88.3%;(2)a (或 b ) 【解析】由图可以看出生成的碳酸钙的质量为10g ,设碳酸钠的质量为x2233CaCl +Na CO ==CaCO 2NaCl ↓+106 100 x 10g10610010x g = x =10.6g样品中碳酸钠的质量分数为10.6100%88.3%12.0gg⨯≈,当求算氯化钙溶液中质量分数时,由于50g 氯化钙溶液对应的沉淀为4g ,125g 氯化钙溶液对应的沉淀为10g 都是氯化钙完全反应,所以可以根据a 点或者b 点数据计算。
答:(1)计算样品中碳酸钠的质量分数约为88.3%;(2)若要计算氯化钙溶液中溶质的质量分数,可使用图中曲线上示出的点a 或者b 所对应的数据。
2.某化学兴趣小组取部分变质的Ca(OH)2(含杂质CaCO 3)样品4.0g 投入200.0g 水中,充分搅拌,通入足量CO 2,溶液质量与反应的CO 2质量的关系如图所示.则:(l)以Ca(OH)2全部转化为CaCO3时消耗的CO2质量为_______g;(2) 4.0g样品中杂质CaCO3的质量为_________?(写出计算过程)(3)通入m3gCO2时,溶液中生成物的溶质的质量分数为__________(精确到0.1%)。
若所取样品中的Ca(OH)2没有完全溶于水,对最后的计算结果_______(填“有”、“没有”)影响。
【化学】九年级化学化学计算题提高训练
【化学】九年级化学化学计算题提高训练一、中考化学计算题1.下图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器。
试根据题目要求,回答下列问题:⑴请写出能用装置A制备的一种气体的化学反应方程式_____,该气体可选用装置_____来收集(填装置序号),其选择依据是_____。
⑵小颖同学欲用干燥..、纯净..的一氧化碳气体还原某氧化铜样品(杂质只有铜),并测定其纯度。
(查阅资料)将草酸(H2C2O4)晶体与浓硫酸混合加热,会产生一氧化碳等气体,其反应原理为:H2C2O4浓硫酸CO↑+CO2↑+H2O。
①若小颖同学选用草酸来制取CO,其发生装置她应选择_____(填装置序号)。
(定量实验)②小颖同学先用电子秤称取了1.00g氧化铜样品,放入装置C中的玻璃管内并组装好所有相关仪器,再将草酸分解得到的气体产物按照以下仪器的连接顺序进行实验:混合气体→D→C→E→H,最后,通过测量反应前后装置E的质量变化进行计算。
(已知:CO+CuO ΔCu+CO2)实验过程中,在装置C的大玻璃管内可观察到的现象是_____。
③请你分析上述实验方案存在的不足之处及.对应的改进方法_____。
④实验改进后,小颖同学对实验所得的正确数据进行分析处理(设所发生的反应均完全进行):通过测定,当装置C中的氧化铜全部被还原后,装置E的质量增加了0.33g,则该样品中氧化铜的质量分数为_____(结果精确至0.1%)。
⑤小黄同学提出了异议,他认为若②中实验方案不加以改进,也能正确测算出该样品中氧化铜的纯度,他的计算依据或方法为:_____。
【答案】CaCO3 + 2HCl == CaCl2 + H2O + CO2↑ F 二氧化碳密度比空气大 B 黑色固体变成红色应该装置D前连接装置一个装置E,吸收混合气体中的二氧化碳 60.0% 根据H2C2O4浓硫酸CO↑+CO2↑+H2O,生成的一氧化碳和二氧化碳的分子个数比为1:1的关系,装置E增加的质量的一半就是氧化铜和一氧化碳反应生成的二氧化碳的质量,再根据步骤④的计算方法计算出氧化铜的质量即可 【解析】 【分析】 【详解】⑴装置A 为固液不加热型,可用于实验室制取二氧化碳,化学反应方程式为:CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑;该气体可选用装置F 来收集,选择依据是二氧化碳密度比空气大。
初三化学提高题专题复习利用化学方程式的简单计算练习题及解析
初三化学提高题专题复习利用化学方程式的简单计算练习题及解析一、选择题1.用镁和铝分别同稀硫酸反应,若要各制得10克氢气,则需要用去的镁和铝的质量比是A.4∶3 B.8∶9 C.3∶1 D.1∶3解析:A【解析】根据镁与酸反应时化合价为+2价、铝与酸反应时的化合价为+3价,利用一定量金属完全反应产生氢气质量=金属的化合价金属相对原子质量×金属质量,可以较简单地计算出产生相同质量氢气时,消耗掉镁和铝的质量比。
设消耗镁的质量为M,消耗铝的质量为A。
则2 24×M=327×A ,M:A=4:3,故选A。
2.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:下列说法不正确的是A.X的值为165.6B.该反应可能为复分解反应C.反应过程中,B与D的质量比为36∶142D.若A与C的相对分子质量之比为98∶40,则A与C的化学计量数比为2∶1解析:D【解析】试题分析:从反应的质量看AC的质量减少属于反应物,且分别有9.8克和8克参加了反应,D的质量增加属于生成物,且产生的质量为14.2克,根据质量守恒定律得出B是生成物,且有3.6克的B物质生成,反应过程中,B与D的质量比为36∶142;则X的值是162g+3.6g=165.6g;因为反应物和生成物都是两种说明该反应可能为复分解反应;若A与C 的相对分子质量之比为98∶36,则A与C的化学计量数比为1∶1,D错误,故选D.考点:质量守恒定律反应中物质的质量关系3.25℃时,某气态碳氢化合物与氧气混合后装入密闭容器中,经充分反应后,又恢复25℃,此时容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
此碳氢化合物可能是( )A.CH4 B.C2H6 C.C2H2 D.C3H8解析:D【解析】容器内气体分子是反应前的一半。
再经足量的氢氧化钠溶液吸收后,容器内几乎成真空。
由定组成定律和化学方程式知,此碳氢化合物可能是D. C3H8。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
九年级化学——计算专题可能用到的相对原子质量:—55;—24;—56;—65;—27;—40;—35.5;K—39;—64;H—1;O—16;C—12;—23;S—32;N—14;—28;—137一、平均值型计算选择题:例1:两种金属粉末的混合物30克,与足量的稀硫酸反应,只生成氢气1克,则这种混合物中的两种金属可能是()A.B.C.D.【同题链接】1、一种不纯的铁,已知它含有铜、钙、镁的一种或几种金属杂质,5.6g这样的铁跟足量的稀H24反应时,生成H20.2g,则该铁样品中一定含有的金属杂质是()A.铜B.镁C.铝D.钙2、把含有某一种氯化物杂质的氯化镁粉末95g溶于水后加入足量的3溶液,完全反应后生成白色沉淀300g,则氯化镁中的杂质可能是()A.B.3C.D.23、在某铁的样品中可能含有、、、等杂质金属中的2种,取5.6g样品跟足量稀硫酸反应,得到0.202,则此铁的样品中不可能含有的杂质金属组是()A. 和B. 和C. 和D. 和4、某不纯的氯化铵样品中,测得其中氮元素的质量分数为28%,则混主的一种杂质可能是①43②(4)24③43④(2)2()A.只有①B.①③C.②③D.无法确定二、估算型选择题例2:20g20%的溶液与20g20%的H24溶液充分反应后,滴入紫色石蕊试液是()A.蓝色B.紫色C.红D.无色【同题链接】1、相同质量的下列的物质中,铁的质量分数最高的是()A.B.3C.2O3D.3O42、由二氧化硫和三氧化硫组成的混合气体中,硫元素与氧元素的质量比可能是()A. 1∶1B. 1∶1.25C. 1∶1.5D. 1∶23、由碳和氧两种元素组成的气体,经测定碳与氧两种元素的质量比为3:5,该气体是()A.混合物B.纯净物C.化合物D.有机物三、特殊规律型选择题例3:某甲醛()溶液中氢元素的质量分数为10%,则碳元素的质量分数正确的是()A.12% B.10% C.8% D.6%【同题链接】1、已知、4、和3由组成的混合物中硫元素的质量分数为20%,则氧元素的质量分数为()A.35%B.25%C.65%D.无法计算2、将、、分别放入盐酸溶液中,反应结束后,放出氢气质量相同,其原因是()A.放入、、的质量相同B.放入、、的质量比是23:12:9和足量盐酸反应C.放入过量的、、,而盐酸为同质量分数、同体积、同质量。
D .放入、、的质量比为3:2:1 四、溶质的质量分数计算1、已知20℃硝酸钾的溶解度为31.6g 。
在该温度下将20g 硝酸钾放入50g 水中,充分搅拌,则所得溶液中溶质的质量分数约为( )A .24.0%B .28.6%C .31.6%D .40.0%2、对100g 溶质质量分数为10%的某物质的溶液,分别进行如下操作:①蒸发掉10g 水,无晶体析出 ②加入溶质质量分数为10%的同种溶质的溶液10g ③加入10g 同种溶质,且完全溶解 ④加入10g 水。
操作后的四种溶液的溶质质量分数由小到大的顺序是( )A. ①②③④B.④②①③C.④③②①D.④②③①3、足量的下列固体物质分别与质量相等、溶质质量分数相同的盐酸混合,若盐酸均完全反应,所得2溶液中溶质的质量分数最小的是( )A .B .C .()2D .3 五、图像分析型选择题 例4:现有一种23和3的混合物,某同学为测定其含量,取一定量的该样品溶于水,逐滴加入稀盐酸并不断振荡,首先发生反应:23 + = 3 + ,然后才发生反应:3+ = + 2↑+ H 2O 。
已知:该温度下2密度为1.98g ,实验测得产生的2的与加入稀盐酸的数据如右图。
(1)当加入 g 盐酸时,才开始产生2;图中 。
(2)请计算:①所加入盐酸中的质量分数为多少?②原样品中23和3的质量各是多少?(百分数精确到0.1%,质量精确到0.01g ) 【同题链接】 1、实验室用03制取氧气时下图各图象中能正确表示反应中2在混合物中质量分数随时间t 变化的是( )2、质量相同的、、分别与足量的稀盐酸反应,其反应速度与产生氢气的质量的关系正确的是( )3、足量的与与质量相同的稀盐酸完全反应后,生成氢气的质量(m )与时间(t )的关系正确的是()tttCO 2mL 的体积盐酸的质量/g AH C HB Ht D Hmm45、某课外兴趣小组的同学绘制四种实验操作的变化趋势图像,其中正确的是( )A B C DA.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体B.向硫酸和硫酸铜的混合溶液中加入过量的氢氧化钠溶液C.向稀盐酸中滴加过量的氢氧化钠溶液D.将等质量的金属镁和铝分别加入足量且质量分数相等的稀硫酸6、向由40g盐酸和一定质量的氯化铜溶液组成的混合溶液中慢慢滴入20%的氢氧化钠溶液并振荡,所加氢氧化钠溶液的质量与生成沉淀的质量的如图所示,下列判断正确的是()A.最终生成沉淀的质量是9.8gB.40g盐酸的溶质质量分数是27.375%C.生成沉淀的质量随氢氧化钠溶液的滴加而逐渐增加D.当加入氢氧化钠溶液为20g时,反应所得溶液为氯化钠溶液。
沉淀质量0 20 60 溶液质量tAtCBtDA B2C D7、(济南市)在一烧杯中盛有1002和的混合溶液,向其中逐渐滴加溶质质量分数为10%的23溶液,混合溶液的质量与所滴入23溶液的质量关系曲线如图所示: 请根据题意回答问题: (1)在实验过程中,有气体放出,还可以看到的明显实验现象是。
(2)在实验过程中放出气体的总质量为 g 。
(3)当滴入23溶液至图中B 点时,通过计算求此所得不饱和溶液中溶质质量分数是多少?(计算结果精确到0.1%) 8、普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。
现有一块50.00g 黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中的质量分数。
有关数据如下图。
问:(1)黄铜中的质量分数。
(2)样品完全反应产生的H 2的质量。
(3)稀盐酸的溶质质量分数。
六、实验数据型计算题根据该同学的实验,试回答以下问题:(1)上表三次实验中,合金里的铁恰好完全反应时,消耗稀硫酸溶液的质量是。
(2)该铜铁合金中铁的质量分数是多少?(3)第三次实验所得溶液溶质质量分数为(结果保留至0.1%)。
【同题链接】1求:⑴该石灰石样品中碳酸钙的质量分数。
⑵盐酸中溶质的质量分数。
2、石灰厂为了测定一批石灰石样品中碳酸钙的质量分数,取用4 g石灰石样品,把20 g稀盐酸分4次加入样品中(样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水),充分反应后经过滤、干燥等操作,最后称量,得实验数据如下表:(1)该石灰石样品中碳酸钙的质量分数是;(2)计算该稀盐酸的溶质质量分数(写出计算过程,结果精确到0.1%)。
3、人工养殖海产品需要大量的海水,1海水中含钠离子的质量约为10.76g ,镁离子的质量约为1.29g ,还含有大量氯离子和硫酸根离子等。
请根据计算,从下表中选择两种盐,配制一种最简)选择的两种盐是 。
(2)计算配制1t “人工海水”所需盐的成本(写出计算式即可)。
七、天平平衡1、天平两端分别放置盛有足量稀盐酸的烧杯,把天平调到平衡,向其中一只烧杯中投入5.6g 氧化钙,向另一只烧杯中投入适量的镁片,要使天平最终保持平衡,需投入镁片的质量为( )A .5.61gB .8.00gC .4.2gD .6.11g2、在天平的两盘分别放入质量相等的烧杯,烧杯中各盛100g9.8%的硫酸溶液,向两个烧中同时加入哪组金属,反应终止时天平仍保持平衡( )A .锌、铁各7gB .锌、铁各5gC .锌、铁各4gD .锌、铁各3g 3、在天平的两个找盘里分别放上等重的两个烧杯,分别加入等质量的足量稀H 24,往左杯里放入0.44,要使天平重新达到平衡,可以往右边烧杯中加入的适宜物质是( )A .1003B .0.48粉C .0.9243D .0.44·合金4、在托盘天平两盘上各放一只烧杯,两烧杯中盛有等质量、等质量分数的足量的盐酸,使两边保持平衡。
此时向左边烧杯中加入11.2,若要使两边再次保持平衡,需向右边烧杯中加入03的质量是( )A .11.2g B.17.6g C.20g D.22.4g 八、综合分析型选择题例6:取一定质量的和2的混合气体,通入足量的()2溶液中,充分反应后过滤,发现生成的沉淀和所取的混合气体质量相等,则混合气体中,碳原子与氧原子的个数比为( ) A .1:1 B .1:2 C .28:44 D .181:209 【同题链接】1、在、2的混合气体中氧元素的质量分数元素为64%,将10g 混合气体先通过足量灼热的氧化铜充分反应后,所得气体再通入到足量的石灰水中,最多可得到白色沉淀( )A .10 gB .20gC .30gD .40 g 2、在实验室里用铁屑、氧化铜、稀硫酸为原料制取铜,有下列两个途径: (1) H 2 (2) 4若用这两种方法制得质量相同的铜,则下列有关说法:①消耗相同质量的氧化铜②消耗相同质量的铁③消耗相同质量的硫酸④生成硫酸亚铁的质量不同。
其中符合实际情况的是( ) A.①② B.①②③ C.①④ D.①②③④硫酸△ 硫酸参考答案一、平均值型计算选择题:例1:B 【同题链接】1、A 2、B 3、C 、D 4、D 二、估算型选择题例2:A 【同题链接】1、D 2、B 3、A 三、 特殊规律型选择题例3:B 【同题链接】1、C 2、B C 四、溶质的质量分数计算1、A 2、B 3、C 五、图像分析型选择题 例4:(1)5 444(2)解:① 444 2的质量为:设产生0.882时,消耗的质量为x g 3+ = 2↑+ H 2O36.5 44 x 0.88g解得:x = 0.73g 0.73÷(15-5)×100% = 7.3%(方法有多种,合理均给分) ②设加入5g 盐酸时,有 23转化为3。
23 + 3 +106 36.5 84 y 5g ×7.3% z解得: y =1.06g. z =0.84g. 5562的质量为:[556 ÷(1000)] ×1.98g1.10g 设放出5562时反应的3质量为m 。
则: 3+ = 2↑+ H 2O84 44m 1.10g 解得:m = 2.10g则原样品中3的质量为:2.1g -0.84g= 1.26g答:①盐酸中的质量分数为7.3%;②原样品中有231.06g.、3 1.26g 。
【同题链接】1、B 2、A 3、C 4、B 5、B 6、A 7、有白色沉淀生成;4.4g 8.1%8解:(1)33.75gCu 100%67.5%50.00g =⨯=黄铜中的质量分数(2)设样品恰好完全反应生成的H 2的质量为x ,消耗的质量为y 。
