Western-Blotting技术
western blotting(蛋白免疫印迹)

7
蛋白样品的制备
① SDS是一种很强的阴离子表面活性剂,它可以断开分子内和分
子间的氢键,破坏蛋白质分子的二级和三级结构。
② 强还原剂巯基乙醇(或二硫苏糖醇,DTT)可以断开 二硫键,破坏蛋白质的四级结构。使蛋白质分子被解 聚成肽链形成单链分子。解聚后的侧链与SDS充分结 合形成带负电荷的蛋白质-SDS 胶束。 ③ 蛋白质的电泳迁移率主要决定于亚基的相对分子质量 ,而与其形状及所带电荷的性质无关。
电泳缓冲液:pH8.3 Tris- 甘氨酸系统
12
PAGE:聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶(polyacrylamide gel,简称PAG): 单体 丙烯酰胺(acrylamide,简称Acr) 交联剂 N,N-甲叉双丙烯酰胺 加速剂 N,N,N,N-四甲基乙二胺(TEMED) 催化剂 过硫酸铵 三维网状结构的凝胶,该凝胶化学惰性强,具有 一定的机械强度和透明度,是良好的电泳介质, 以此凝胶为支持物的电泳称为聚丙烯酰胺凝胶电 泳(polyacrylamide gel electrophoresis,简称 PAGE)。
对 策
5. 抗体浓度过高
35
Thanks!
36
压太高。转膜过程注意降温
34
四、SDS-PAGE常见问题
背景太高
原因
1. 2. 3. 4. 膜没有均匀浸湿 膜或者缓冲液污染 封闭不充分 抗体与封闭剂出现交叉 反应
1. 转膜前用100%甲醇将膜完 全浸湿 2. 拿取膜与吸水纸时要戴手 套,更换新鲜转膜缓冲液 3. 检测一抗、二抗与封闭剂 是否有交叉反应 4. 杂交前检测一抗、二抗的 工作浓度
蛋白质免疫印迹技术详解
1
主要内容
一、Western Blot 简介 二、Western Blot 一般流程
Western blotting

Western BlottingWestern Blotting,即免疫印迹,是在蛋白质电泳分离和抗原抗体检测的基础上发展起来的一项检测蛋白质的技术,它结合了SDS聚丙烯酰胺凝胶电泳的高分辨率与抗原抗体反应的特异性。
其基本原理是:通过电泳将蛋白组分分开,然后将电泳后凝胶上的蛋白质转移至载体膜上,用封闭试剂封闭载体膜上未吸附蛋白质的区域,最后通过免疫学检测来分析特定的蛋白质表达水平。
免疫印迹克服了聚丙烯酰胺凝胶电泳后直接在凝胶上进行免疫学分析的弊端,极大地提高了其分辨率和灵敏度,广泛地应用于检测特定基因表达产物的正确性,或者比较表达产物的相对变化量。
实验前准备实验开始前,需准备好实验所需的各种试剂和耗材,主要包括:各种凝胶配置液、各种缓冲液、相关抗体、PVDF膜,赛默飞公司的QSP盒装吸头及Nunc 冰盒,芬兰百得的各个量程单通道移液器等。
主要仪器有:Thermo Scientific 全波长扫描式多功能读数仪、离心机、电泳仪等。
接下来进入实验部分,本实验操作流程为:首先制备蛋白样品,然后进行SDS聚丙烯酰胺凝胶电泳,将电泳后凝胶上的蛋白质转移至PVDF膜上,接着对含有蛋白质的PVDF膜进行免疫学检测,X-胶片显影定影后,扫描图片,最后用IPWIN6.0软件分析结果。
蛋白样品的制备按1ml裂解液加10 μl的100mmol PMSF,混匀后置于冰上待用。
注意:PMSF 要摇匀至无结晶时才可与裂解液混合,PMSF是剧毒物质,操作时要谨慎。
蛋白样品一般来源于基因工程菌或特定的真核细胞,本实验以单层贴壁细胞总蛋白的提取为例。
倒掉离心管中的上清,用移液枪吸去残余培养液,注意不要吸走细胞。
每管细胞加400 μl含PMSF的裂解液,于冰上裂解30min,为使细胞充分裂解,要经常上下颠倒离心管。
然后于4℃10000×g离心力离心5min。
将离心后的上清分装转移至干净的离心管中,分装至少两份,放于-80℃保存。
simple western 原理

simple western 原理Western blotting(Western blot)是一种常用的蛋白质检测技术,它可以通过印迹将蛋白质从复杂的样品中分离出来,并在膜上进行检测和分析。
Western blotting有多种不同的实施方法,其中simple western是一种简单且实用的方法,它通常用于研究微量蛋白质的表达水平。
简单西方的原理主要基于蛋白质的固相放射自显影技术。
在此过程中,蛋白质样品首先被印迹到支持物(如硝酸纤维素膜)上,然后与标记的抗体结合,形成免疫复合物。
接着,这些复合物会在支持物上形成可见的放射性图像,从而显示出蛋白质的存在和位置。
具体步骤如下:1. 样品制备:首先,需要从样品中提取蛋白质,并进行定量。
样品可以是组织、细胞、血清或其他生物样本。
2. 印迹:将蛋白质样品印迹到硝酸纤维素膜或其他支持物上。
这一步通常使用湿法转印或干法转印技术。
3. 标记:将放射性标记的抗体与印迹在支持物上的蛋白质复合物结合,标记的抗体可以与蛋白质上的抗原表位特异性结合。
4. 结合和检测:将支持物放入暗盒中,加入标记的抗体和适当的垫圈液进行结合。
通过放射自显影技术,可以检测到放射性标记的蛋白质复合物。
5. 分析:通过观察和分析自显影图像,可以确定蛋白质的存在、相对丰度、位置和相对表达水平。
简单西方的优点在于其简单、快速、成本低廉和可扩展性。
此外,由于不需要使用复杂的化学发光或荧光检测方法,simple western适用于研究微量蛋白质的表达水平,特别是对于那些难以制备大量标准品的蛋白质样品。
然而,simple western也存在一些局限性。
首先,其检测灵敏度受到放射性标记的限制,对于低丰度蛋白质的检测可能存在难度。
其次,由于依赖于放射性物质,simple western可能存在潜在的辐射危害和废物处理问题。
此外,由于需要人工分析自显影图像,simple western在自动化和标准化方面可能存在挑战。
试述western blot技术的原理、方法、注意事项及其在医学科研中的应用。

试述western blot技术的原理、方法、注意事项及其在医学科研中的应用。
1. 引言1.1 概述Western blot技术是一种常用的分子生物学实验方法,用于检测、定量和分析特定蛋白质在复杂混合物中的表达和相互作用。
它具有高灵敏度、高特异性和较为准确的测量能力,因此在医学科研领域中得到广泛应用。
1.2 文章结构本文将详细介绍Western blot技术的原理、方法、注意事项以及在医学科研中的应用。
首先,我们将阐述免疫检测原理、蛋白质分离与转移原理以及免疫染色与检测原理,帮助读者全面了解该技术的基本原理。
其次,我们将描述样品制备与电泳条件设置、蛋白质转移与固定方法以及免疫染色及可视化方法,为读者提供详细的实验步骤。
随后,我们将介绍实验室操作要求及安全措施、样品处理和保存注意事项以及技术参数调整和结果解读注意事项,以保证实验的准确性和可重复性。
最后,在医学科研领域中的应用方面,我们将以蛋白质表达水平检测、蛋白质亚细胞定位分析以及蛋白质相互作用和功能分析为例,展示Western blot技术在疾病诊断和药物研发等方面的重要应用。
1.3 目的本文的目的是为读者提供对Western blot技术全面了解,并指导其在医学科研中正确应用该技术。
通过详细介绍该技术的原理、方法和注意事项,读者将能够准确地进行实验操作并正确解读结果,同时也能够认识到其在医学科研中的重要性和广泛应用价值。
2. Western blot技术原理2.1 免疫检测原理Western blot技术是一种常用于检测特定蛋白质的免疫学方法。
它基于抗原与抗体的特异性结合关系,通过将蛋白质溶液经过电泳分离、转移到固体载体上,并使用特异性抗体识别目标蛋白质,从而实现对目标蛋白质的定性和定量检测。
在Western blot中,首先需要将待检测的蛋白样品进行SDS-PAGE电泳分离。
然后,通过将蛋白质转移到聚丙烯酰胺凝胶或其他固体载体上,在固相载体上形成一个被称为“Western blotting”的蛋白质模式。
western-blotting

western blotting的原理、操作步骤及意义一。
免疫印迹法免疫印迹法(immunoblotting test,IBT)亦称酶联免疫电转移印斑法(enzyme linked immunoelectrotransfer blot,EITB),因与Southen早先建立的检测核酸的印迹方法Southen blot相类似,亦被称为Western blot。
免疫印迹(western blotting)是在蛋白质电泳分离和抗原抗体检测的基础上发展起来一项检测蛋白质的技术。
它将SDS聚丙烯酰胺凝胶电泳的高分辨力与抗原抗体反应的特异性相结合。
典型的印迹实验包括三个步骤①蛋白质的电泳分离;②将电泳后凝胶上的蛋白质转移至固体膜上,用非特异性,非反应活性分子封闭固体膜上未吸附蛋白质区域;③免疫学检测。
免疫印迹克服了聚丙烯酰胺凝胶电泳后直接在凝胶上进行免疫学分析的弊端,极大地提高了其利用率、分辨率和灵敏度,使其成为使用最广泛的免疫化学方法之一。
第一阶段为SDS—聚丙烯酰胺凝胶电泳(SDS-PAGE)。
抗原等蛋白样品经SDS处理后带阴电荷,在聚丙烯酰膪凝胶中从阴极向阳极泳动,分子量越小,泳动速度就越快。
此阶段分离效果肉眼不可见(只有在染色后才显出电泳区带)。
第二阶段为电转移。
将在凝胶中已经分离的条带转移至硝酸纤维素膜上,选用低电压(100V)和大电流(1~2A),通电45min 转移即可完成。
此阶段分离的蛋白质条带肉眼仍不可见。
第三阶段为酶免疫定位。
将印有蛋白质条带的硝酸纤维素膜(相当于包被了抗原的固相载体)依次与特异性抗体和酶标第二抗体作用后,加入能形成不溶性显色物的酶反应底物,使区带染色。
常用的HRP底物为3,3,—二氨基联苯胺(呈棕色)和4-氯-1-萘酚(呈蓝紫色)。
阳性反应的条带清晰可辨,并可根据SDS-PAGE时加人的分子量标准,确定各组分的分子量。
本法综合了SDS-PAGE的高分辨力和ELISA法的高特异性和敏感性,是一个有效的分析手段,不仅广泛应用于分析抗原组分及其免疫活性,并可用于疾病的诊断。
Western-blotting
定义:
印迹法(blotting)是指将样品转移到固相载体上,而后利用相应的探测 反应来检测样品的一种方法。
1975年,Southern建立了将DNA转移到硝酸纤维素膜(NC膜)上,并利 用DNA-RNA杂交检测特定的DNA片段的方法,称为Southern印迹法。
电泳要点
上样电泳:
贪多嚼不烂 不要过多重复使用电泳Buffer 最佳分辨区——分离胶的2/3
电泳结果检查:
同样的样品跑2块胶 丽春红S SYPRO Tangerine
转膜
膜的选择 转膜方法 转膜后确认 特殊处理
2021/6/7
15
膜的选择
硝酸纤 维素膜
价格便宜
简单快速封闭非特异性抗体结合
预染分子量标准
单色预染 多色预染
修饰分子量标准
预混分子量标准
高分子量标准 低分子量标准 宽分子量标准
预染分子量标准
单色预染 多色预染
修饰分子量标准
糖基化 磷酸化 荧光标记
不可不加--内参的选择
原因:校正蛋白质定量、上 样过程中存在的实验误差
种类:GAPDH、beta-actin、 beta-tubulin
位点) 3. 多种标记的二抗可供选择
缺点:
1. 交叉反应引起的非特异性条带 2. 额外的二抗孵育以及条件优化
间接Western Blotting操作流程:
Western Blot一般流程
蛋白样品的制备 SDS聚丙烯酰胺
凝胶电泳
转膜 封闭 一抗杂交 二抗杂交 底物显色
电泳
蛋白样品的制备 上样样品的定量 电泳凝胶成分 注意事项
而后人们用类似的方法,对RNA和蛋白质进行印迹分析,对RNA的印迹 分析称为Northern印迹法,对单向电泳后的蛋白质分子的印迹分析称为 Western印迹法,对双向电泳后蛋白质分子的印迹分析称为Eastern印迹法
western blotting实验操作步骤讲解

蛋白免疫印迹杂交(Western Blot, WB)WB是将蛋白样本通过聚丙烯酰胺电泳按分子量大小分离,再转移到杂交膜上,然后通过一抗/二抗复合物对靶蛋白进行特异性检测的方法。
WB 是进行微量蛋白质分析比较成熟的技术之一。
以下是总结Western Blot 操作方法及常见问题分析,有助于成功完成WB。
A第一部分:蛋白样本提取制备蛋白样品制备是Western Blotting的第一步,更是决定WB成败的关键步骤,总体原则和注意事项:1.尽可能提取完全或降低样本复杂度只集中于提取目的蛋白(通过采用不同提取方法或选择不同的试剂盒产品);2.保持蛋白处于溶解状态(通过裂解液的pH 、盐浓度、表面活性剂、还原剂等的选择);3.提取过程防止蛋白降解、聚集、沉淀、修饰等,(低温操作,加入合适的蛋白酶和磷酸酶抑制剂);4.尽量去除核酸,多糖,脂类等干扰分子(通过加入核酸酶或采取不同提取策略);5.样品分装,长期于-80℃中保存,避免反复冻融。
方法的选择◆自行配制抽提试剂,根据文献方法或经验提取;◆购买商品化试剂盒,按其说明书的方法提取。
Example 1:实验中提取肾脏总蛋白,具体实验过程如下:1.提前一天4℃解冻RIPA,一定要完全融化;配PBS(用于细胞试验则需高压);2.配制裂解液:PMSF:RIPA=1:99,PMSF终浓度为100mM(根据样本数配制所需的量,临用临配);3.裂解组织:每个样品称取100mg,加1ml裂解液,匀浆后4℃静置2h使其充分裂解,14000g,4℃离心10min,取上清。
4.蛋白定量:取少量上清稀释30倍蛋白定量,然后计算出各样本原液蛋白浓度。
注意由于裂解液里含有较高浓度的洗涤剂,蛋白定量不能选用Bradford法,可以选用改良的Lowry’s法或者BCA法。
5.样品蛋白浓度均一化:根据蛋白定量计算的结果将各样品蛋白浓度调整一致。
具体方法为加入PBS稀释至样品浓度一致,本次蛋白浓度为3mg/ml。
Western-Blotting实验报告
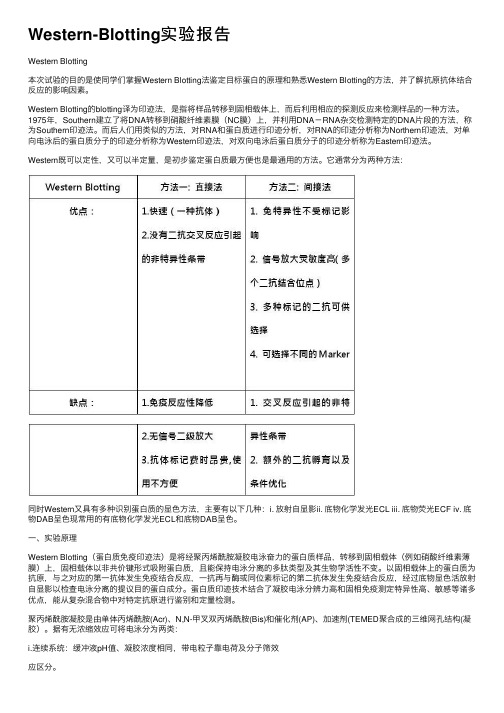
Western-Blotting实验报告Western Blotting本次试验的⽬的是使同学们掌握Western Blotting法鉴定⽬标蛋⽩的原理和熟悉Western Blotting的⽅法,并了解抗原抗体结合反应的影响因素。
Western Blotting的blotting译为印迹法,是指将样品转移到固相载体上,⽽后利⽤相应的探测反应来检测样品的⼀种⽅法。
1975年,Southern建⽴了将DNA转移到硝酸纤维素膜(NC膜)上,并利⽤DNA-RNA杂交检测特定的DNA⽚段的⽅法,称为Southern印迹法。
⽽后⼈们⽤类似的⽅法,对RNA和蛋⽩质进⾏印迹分析,对RNA的印迹分析称为Northern印迹法,对单向电泳后的蛋⽩质分⼦的印迹分析称为Western印迹法,对双向电泳后蛋⽩质分⼦的印迹分析称为Eastern印迹法。
Western既可以定性,⼜可以半定量,是初步鉴定蛋⽩质最⽅便也是最通⽤的⽅法。
它通常分为两种⽅法:同时Western⼜具有多种识别蛋⽩质的显⾊⽅法,主要有以下⼏种:i. 放射⾃显影ii. 底物化学发光ECL iii. 底物荧光ECF iv. 底物DAB呈⾊现常⽤的有底物化学发光ECL和底物DAB呈⾊。
⼀、实验原理Western Blotting(蛋⽩质免疫印迹法)是将经聚丙烯酰胺凝胶电泳奋⼒的蛋⽩质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以⾮共价键形式吸附蛋⽩质,且能保持电泳分离的多肽类型及其⽣物学活性不变。
以固相载体上的蛋⽩质为抗原,与之对应的第⼀抗体发⽣免疫结合反应,⼀抗再与酶或同位素标记的第⼆抗体发⽣免疫结合反应,经过底物显⾊活放射⾃显影以检查电泳分离的提议⽬的蛋⽩成分。
蛋⽩质印迹技术结合了凝胶电泳分辨⼒⾼和固相免疫测定特异性⾼、敏感等诸多优点,能从复杂混合物中对特定抗原进⾏鉴别和定量检测。
聚丙烯酰胺凝胶是由单体丙烯酰胺(Acr)、N,N-甲叉双丙烯酰胺(Bis)和催化剂(AP)、加速剂(TEMED聚合成的三维⽹孔结构(凝胶)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
样品的印迹
转膜
膜的选择
硝酸纤 维素膜
价格便宜
根据蛋白分子量选择不 同孔径的膜:
易封闭,背景低 >20 kDa:0.45μm膜
<20 kDa:0.2μm膜 易破脆,不易操作
PVDF膜
信噪比高 极强的蛋白结合能力
尼龙膜
多用于核酸的转移,封闭较困难,背景高
转膜方法
毛细管印迹法 滤纸、凝胶、膜、滤纸 重物压住 毛细作用使缓冲液流过凝胶,将蛋白质带到膜上 效率低(10%~20%)
基本流程
蛋白样品的制备 SDS聚丙烯酰胺凝胶电
泳
转膜 封闭 一抗杂交 二抗杂交 底物显色
基本流程
(电泳凝胶)
蛋白样品的制备
制备流程
天然蛋白:细胞总蛋白、组织总蛋白、膜蛋白、核蛋白 用细菌或酵母人工表达的蛋白
破碎细胞
液氮研磨 匀浆 超声波处理 反复冻融
提取蛋白
高速离心
显色
酶联法: HRP(辣根过氧化物酶):底物为DAB,产生红褐色。 AP(碱性磷酸酶):底物为NBT/BCIP,产生蓝紫色。
底物化学发光ECL: 二抗中的HRP或AP与发光底物作用使其发光,然后经底片 曝光显影记录下来。
生物素标记 地高辛标记 荧光标记
显色步骤
化学发光(ECL),显影和定影
转膜步骤(湿转法)
1、电泳完毕后,将膜和滤纸裁至与胶相同大小,并在胶上裁去一角做 标记;
2、将胶、膜、滤纸浸泡在转移缓冲液中平衡15min-30min(PVDF需先 在100%甲醇中浸泡数秒钟);
3、打开夹板使黑的一面保持水平,按海绵垫、滤纸、凝胶、膜、滤纸 、海绵垫的顺序叠放;
4、赶走气泡后合起夹子。(膜两边的滤纸不能相互接触,接触后会发 生短路)将夹子放入转移槽中,夹子的黑面对槽的黑面,夹子的白面 对槽的红面。
Eastern Blot
DNA印迹
RNA印迹
单向电泳后的 蛋白印迹
双向电泳后的 蛋白印迹
实验目的
检测一个基因的表达产物是否正确 -- 定性 比较表达产物量的相对变化 -- 半定量
基本原理
与Southern或Northern杂交方法类似,但Western Blot采用 的是聚丙烯酰胺凝胶电泳,被检测物是蛋白质,“探针”是 抗体,“显色”用标记的二抗。经过PAGE分离的蛋白质样 品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体 以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型 及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗 原,与对应的抗体起免疫反应,再与酶或同位素标记的第二 抗体起反应,经过底物显色或放射自显影以检测电泳分离的 特异性目的基因表达的蛋白成分。该技术也广泛应用于检测 蛋白水平的表达。
细胞壁可用纤维素酶处理。
蛋白提取
水溶液提取法 稀盐和缓冲系统的水溶液对蛋白质稳定性好、溶解度大、是提取蛋白 质最常用的溶剂。
细胞裂解液(RIPA): 50 mmol/L Tris-HCl,150 mmol/L NaCl,5 mmol/L EDTA,0.1% SDS,1%NP-40,0.5% 去氧胆酸钠,1 mmol/L PMSF,2μg/mL Aprotinin,2μg/mL Leupeptin(使用前加),pH7.5
2. Bradford法 考马氏亮蓝G-250具有红色和青色两种色调、在酸性溶液中游离 状度下为棕红色,当它通过疏水作用与蛋白质结合后,变成蓝色, 最大吸收波长从465nm转移到595nm处。
3. Lowry法 蛋白质中含有酚基的酪氨酸,可与酚试剂中的磷钼钨酸作用产生蓝 色化合物,颜色深浅与蛋白含量成正比。
5、冰上 100V 350mA转膜1h,或30V 90mA转膜过夜。
小型Trans-Blot 转印槽
半干转印仪
间
影响转膜效率的因素
SDS
SDS有助于蛋白迁移到膜上,但过量的SDS会抑制蛋白与膜的结合 ,转印缓冲液中加入0.1%会促进转印
建议的步骤在转印缓冲液中不含有SDS,但凝胶在电泳后不需要浸 泡在转印缓冲液中;凝胶中残留的SDS对于有效的转印已经足够。
兔
小鼠
人NGF
抗原
二抗 一抗
一抗二抗孵育
把膜放在密闭塑料袋或者培养皿中,加入 一抗溶液与膜温育。室温孵育1-2h,或 4℃过夜。
倒掉一抗(用封闭液稀释),用1×TBST 洗膜3次,每次10min。
加入二抗(用封闭液稀释),室温孵育 60-80min。
倒掉二抗溶液,用1×TBST洗膜3次,每 次10min。
电泳时通常推荐在上层胶时使用低电压恒压电泳(50-60V), 而在溴酚蓝进入下层胶时使用高电压恒压电泳(100-120V) 。
SDS聚丙烯酰胺凝胶电泳
原理:
浓缩效应:样品中蛋白质被 浓缩在浓缩胶和分离胶的界 面。
电荷效应:等电点不同,所 带电荷量不同,在电场中所 受引力亦不同。
分子筛效应:分子量大小或 分子形状不同的蛋白质通过 分离胶时,所受阻滞的程度 不同。
甲醇
甲醇通过在蛋白上剥离SDS促进蛋白和膜的疏水接合。活化PVDF 膜上面的正电基团,使它更容易跟带负电的蛋白质结合;可降低蛋 白质洗脱效率,增加蛋白质和NC膜的结合能力。
影响转膜效率的因素
凝胶浓度:丙烯酰胺浓度越低,蛋白越容易转移。 电压或电流 膜的选择
免疫学检测
封闭
封闭未吸附蛋白的疏水结合位点,以减少非特异性结合背景 的影响。
将A和B两种试剂等体积混合,把膜移至一保鲜膜上,将混合液滴 于膜上,室温孵育2min后把膜放到另一保鲜膜上,去尽残液,包 好,放入X-光片夹中。
暗室中,红灯下取出X-光片,切纸刀剪裁适当大小。打开X-光片 夹,把X-光片放在膜上,关上。根据信号的强弱适当调整曝光时 间。曝光完成后,取出X-光片迅速浸入显影液中显影,待出现明 显条带后终止显影。把X-光片放入定影液中定影至胶片透明为止 。
细胞裂解液 冰上裂解30min
4℃12000rpm 离心10min
取上清
蛋白定量
BCA法 Bradford法 Lowry法
细胞破碎
1、液氮研磨法 2、机械匀浆法 3、超声波处理法 4、反复冻融法:由于细胞内冰粒形成和剩余细胞液的盐
浓度增高引起溶胀,使细胞结构破碎。 5、化学裂解法:去氧胆酸钠、SDS 6、酶解法:细菌细胞壁较厚,可采用溶菌酶处理;植物
蛋白定量原理
4. 双缩脲法 当需要快速,但不很准确的测定中,常使用双缩脲法。原理是Cu2+ 与蛋白质的肽键,以及酪氨酸残基络合,形成紫蓝色络合物,此 物在540nm波长处有最大吸收。
5. 紫外吸收法 蛋白质溶液在280nm附近有强烈的吸收,这是由于蛋白质中酪氨 酸、色氨酸残基而引起的。另外核蛋白或提取过程中杂有的核酸 对测定结果引起极大误差,其最大吸收在260nm。所以同时测定 280及260nm两种波长的吸光度,通过计算可得较为正确的蛋白 质含量。
基本流程
蛋白样品的制备 SDS聚丙烯酰胺凝胶电
泳
转膜 封闭 一抗杂交 二抗杂交 底物显色
SDS聚丙烯酰胺凝胶电泳
(1)SDS-PAGE凝胶配制 (2)样品处理: 在收集的蛋白样品中加入适量浓缩的SDS-PAGE蛋白上
样缓冲液,沸水浴加热3-5分钟,以充分变性蛋白。 (3)上样与电泳 冷却到室温后,把蛋白样品直接上样到胶加样孔内即可。
电泳印迹法 用有孔的塑料或有机玻璃板将凝胶和膜夹成“三明治”形 状 湿转法、半干法
转膜
湿转法:
将膜、胶叠层浸入缓冲液槽中然后 加电压;
胶在负极,膜在正极; 慢,需要大体积冰预冷缓冲液; 适用于分子量较大的蛋白;
半干法:
用浸透缓冲液的多层滤纸代替缓冲 液槽;
胶在负极,膜在正极; 快(15~45min); 适用与小分子量蛋白;
室温封闭1h-2h。
5%-7%脱脂奶粉(不适用于生物素-亲和素检 测和碱性磷酸酶底物检测系统) 1%-3%BSA 血清 公司提供的WB封闭液
一抗二抗孵育
一抗:一般是用待测蛋白免疫动物A( 如兔、鼠),获得的多克隆或单克隆抗 体,如小鼠抗人NGF
二抗:另一种动物(如羊)的抗动物A 的免疫球蛋白抗体(放射性标记或酶标 记),如羊抗小鼠IgG/HRP
定义
印迹法(blotting):是指将样品转移到固相载体上,而后利用相应的探 针反应来检测样品的一种方法。
Southern Blot :1975年,Southern建立了将DNA转移到硝酸纤维素膜 (NC膜)上,并利用DNA-RNA杂交检测特定的DNA片段的方法。
Southern Blot Northern Blot Western Blot
有机溶剂提取法 对于分子中非极性侧链较多的蛋白质可用有机溶剂提取,包括乙醇、 丙酮和丁醇等。
冰上操作
蛋白定量
蛋白上样量需达到一定的范围 保证开始实验的总蛋白量是一致的
蛋白定量原理
1. BCA( bicinchoninic acid )法 在碱性条件下,蛋白将Cu2+还原为Cu+,Cu+与BCA试剂形成紫色的 络合物,此物在562nm波长处有最大吸收,颜色深浅与蛋白含量 成正比。
