大学物理5_热力学习题课 课件
大学物理热力学PPT课件

02
对应态原理
不同物质在相同的对应状态下具有相同 的热力学性质。对应态参数包括对比压 强、对比体积和对比温度。
03
范德华方程与对应态 原理的应用
预测真实气体的性质,如液化温度、临 界参数等。
真实气体行为描述
压缩因子
描述真实气体与理想气体偏差程度的物理量,定义为Z = pV/nRT。对于理想气体,Z = 1;对于真实气体,Z ≠ 1。
细管电泳等。
固体熔化与升华过程分析
固体熔化
升华过程
熔化与升华的应用
固体在加热过程中,当温度达到 熔点时开始熔化,由固态转变为 液态。熔化过程中吸收热量,温 度保持不变。
某些物质在固态时可以直接升华 为气态,而无需经过液态阶段。 升华过程中也吸收热量,但温度 同样保持不变。
熔化与升华是物质相变的重要过 程,对于理解物质的热力学性质 和相变规律具有重要意义。同时, 在实际应用中也具有广泛用途, 如金属冶炼、材料制备等领域。
阿马伽分体积定律
混合气体的总体积等于各组分气体分体积之和,即V_total = V_1 + V_2 + ... + V_n。
理想气体混合物的性质
各组分气体遵守理想气体状态方程,且相互之间无化学反应。
范德华方程与对应态原理
01
范德华方程
对真实气体行为的描述,考虑了分子体 积和分子间相互作用力,形式为(p + a/V^2)(V - b) = RT,其中a、b为与物 质特性相关的常数。
维里方程
描述真实气体行为的另一种方程形式,考虑了高阶分子间 相互作用项,形式为pV = nRT(1 + B/V + C/V^2 + ...), 其中B、C等为维里系数。
大学物理化学经典课件-3-热力学第二定律

05 热力学第二定律在工程技 术中应用
工程技术中不可逆过程分析
不可逆过程定义
在工程技术中,不可逆过 程指的是系统与环境之间 进行的无法自发逆转的能 量转换过程。
不可逆过程分类
根据能量转换形式,不可 逆过程可分为热传导、热 辐射、摩擦生热、化学反 应等多种类型。
不可逆过程影响
不可逆过程导致能量损失 和熵增加,降低系统能量 利用效率,并对环境造成 负面影响。
06 总结与展望
热力学第二定律重要性总结
热力学第二定律是自然界普遍适用的基本规律之一,它揭示了热现象的方向性和不可逆性,为热力学 的研究和应用提供了重要的理论基础。
热力学第二定律在能源转换和利用、环境保护、生态平衡等领域具有广泛的应用价值,对于推动可持续 发展和生态文明建设具有重要意义。
热力学第二定律的研究不仅深入到了热学、力学、电磁学等物理学各个领域,还拓展到了化学、生物学、 医学等其他自然科学领域,为多学科交叉研究提供了重要的桥梁和纽带。
提供了判断热过程进行方向的标准
根据热力学第二定律,可以判断一个热过程是否能够自发进行。如果一个热过程能够自发进行,那么它必须满足热力 学第二定律的要求。
为热力学的发展奠定了基础
热力学第二定律是热力学的基本定律之一,为热力学的发展奠定了基础。它揭示了热现象的本质和规律, 为热力学的研究和应用提供了重要的理论支持。
应用举例
在化学反应中,如果反应物和生成物处于同 一温度,则自发进行的反应总是向着熵增加 的方向进行。例如,氢气和氧气在点燃条件 下可以自发反应生成水,该反应的熵变小于
零,因此是一个自发进行的反应。
熵产生原因及影响因素
要点一
熵产生原因
熵的产生与系统的不可逆性密切相关。在不可逆过程中, 系统内部的微观状态数增加,导致系统的无序程度增加, 即熵增加。
大学物理热力学基础PPT课件

d Q 微小热量 :
> 0 表示系统从外界吸热; < 0 表示系统向外界放热。
等价
2
精选PPT课件
上页 下页 返回 退出
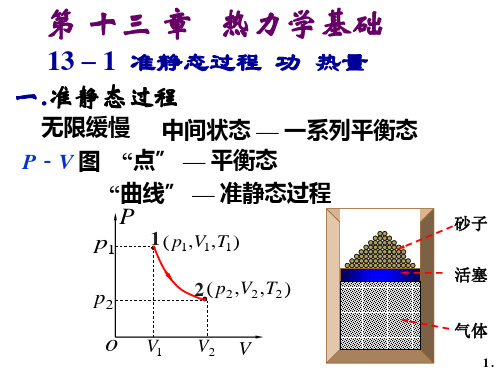
二、热力学第一定律 (The first law of thermodynamics)
某一过程,系统从外界吸热 Q,对外界做功 W,系 统内能从初始态 E1变为 E2,则由能量守恒:
循环过程
V
1. 热力学第一定律适用于任何系统(固、液、气);
2. 热力学第一定律适用于任何过程(非准静态过程亦 成立)。
6
精选PPT课件
上页 下页 返回 退出
四、 W、Q、E的计算
1.W的计算(准静态过程,体积功)
F
(1)直接计算法(由定义)
系统对外作功,
2
W=1
Fdx
=
2
1
PS
dx
V2
W = PdV
W = 1 P dV =
RT
2
1
dV V
W
RTl nV( 2 ) V1
P1V1
ln(V2 V1
)
P1V1
ln(P1 P2
)
系统吸热全部用来对外做功。
思考:CT ( 等温摩尔热容量)应为多大?
15
精选PPT课件
上页 下页 返回 退出
§7.4 理想气体的绝热过程 (Adiabatic process of the ideal gas)
吸热一部分用于对外做功,其余用于增加系统内能。
14
精选PPT课件
上页 下页 返回 退出
三.等温过程(isothermal process) P
《大学物理》课件-热力学第一定律

21
例1 理想气体准静态等温膨胀做的功。并思考如何实现这 一准静态过程。
22
假设缸中由v mol气体,等温膨胀的温度为T,体积
变化为:
V1 →V2
则
V2
A=
V1
pdV
= V2RT
绝热壁
C
向真空中自由膨胀。测量 膨胀前后水温的变化。
气体
真空 水
实验结果:水温不变,
验证了理想气体的内能与体积无关。为什么?
dQ = 0,dA = 0 dE = 0 (V1 →V2 )
但水的热容比气体的大得多,焦耳实验中气体温度变化不 易测出。实验进一步改进。1852年焦耳和汤姆逊用节流方法重 新做了实验。
11
4.热力学第一定律 机械能守恒: Aex + Ain,n-cons = EB - EA 对保守系统: Aex = EB - EA = ΔE 质心参考系下:Aex = Ein,B - Ein,A
对单一组分的热力学系统(保守系统),外界对系统做 功可分为:①与系统的边界具有宏观位移相联系的宏观功; ②没有宏观位移的热传递型微观功。
Aex = A + Q 则机械能守恒在热力学系统的新形式: A + Q = ΔE
12
对于任何宏观系统的任何过程,系统从外界吸收的热
量等于系统内能的增量和系统对外做的功之和。
Q = E2-E1 + A
A = -A表示系统对外界做功。对初、末态为平衡态的无
限小过程
dQ = dE + dA
——涉及热现象的能量守恒定律的表述。 ——不需要能量输入而能继续做功的“第一类永动机”不 存在。
大学物理-热力学基础-课件
Wa
CV m (T2
T1)
p1V1 p2V2
1
本题用 Wa E 计算较方便
关键用绝热方程
T2
T1
( V1 V2
)
1
先求出 T2
p
p2
2 T2
T2' T1
Q0
p2'
2'
p1
TC
T1
1
o V2 V2' V1 10 V1 V
18.
*四. 多方过程 — 实际过程( 满足 PV n C)
绝热 n = ( CPm / CVm )
等温 n = 1 等压 n = 0
W p1V1 p2V2 n 1
满足 E CV (T2 T1)
Q Cn (T2 T1)
等体 n = ∞
p
可以证明
n= n=∞
n=1
Cn
(
n
n 1
)CV
n=0
o
V
19.
13 – 5 循环过程 卡诺循环
一. 循环过程
1. 特点 E 0 W = Q ( 热功转换 )
1
2
W
(2)热一定律 dQP dE PdV
o V1
V2 V
QP
E
V2 PdV
V1
v
i 2
R(T2
T1 )
P(V2
V1 )
7.
2.摩尔定压热容 CPm
1mol
:
CPm
dQp dT
理论值:
CPm
dE pdV dT
CVm
R
i2R 2
(近似)
实验值:查表 (精确)
QP
dQP
2024版《大学物理》全套教学课件(共11章完整版)

01课程介绍与教学目标Chapter《大学物理》课程简介0102教学目标与要求教学目标教学要求教材及参考书目教材参考书目《普通物理学教程》(力学、热学、电磁学、光学、近代物理学),高等教育出版社;《费曼物理学讲义》,上海科学技术出版社等。
02力学基础Chapter质点运动学位置矢量与位移运动学方程位置矢量的定义、位移的计算、标量与矢量一维运动学方程、二维运动学方程、三维运动学方程质点的基本概念速度与加速度圆周运动定义、特点、适用条件速度的定义、加速度的定义、速度与加速度的关系圆周运动的描述、角速度、线速度、向心加速度01020304惯性定律、惯性系与非惯性系牛顿第一定律动量定理的推导、质点系的牛顿第二定律牛顿第二定律作用力和反作用力、牛顿第三定律的应用牛顿第三定律万有引力定律的表述、引力常量的测定万有引力定律牛顿运动定律动量定理角动量定理碰撞030201动量定理与角动量定理功和能功的定义及计算动能定理势能机械能守恒定律03热学基础Chapter1 2 3温度的定义和单位热量与内能热力学第零定律温度与热量热力学第一定律的表述功与热量的关系热力学第一定律的应用热力学第二定律的表述01熵的概念02热力学第二定律的应用03熵与熵增原理熵增原理的表述熵与热力学第二定律的关系熵增原理的应用04电磁学基础Chapter静电场电荷与库仑定律电场与电场强度电势与电势差静电场中的导体与电介质01020304电流与电流密度磁场对电流的作用力磁场与磁感应强度磁介质与磁化强度稳恒电流与磁场阐述法拉第电磁感应定律的表达式和应用,分析感应电动势的产生条件和计算方法。
法拉第电磁感应定律楞次定律与自感现象互感与变压器电磁感应的能量守恒与转化解释楞次定律的含义和应用,分析自感现象的产生原因和影响因素。
介绍互感的概念、计算方法以及变压器的工作原理和应用。
分析电磁感应过程中的能量守恒与转化关系,以及焦耳热的计算方法。
电磁感应现象电磁波的产生与传播麦克斯韦方程组电磁波的辐射与散射电磁波谱与光子概念麦克斯韦电磁场理论05光学基础Chapter01光线、光束和波面的概念020304光的直线传播定律光的反射定律和折射定律透镜成像原理及作图方法几何光学基本原理波动光学基础概念01020304干涉现象及其应用薄膜干涉及其应用(如牛顿环、劈尖干涉等)01020304惠更斯-菲涅尔原理单缝衍射和圆孔衍射光栅衍射及其应用X射线衍射及晶体结构分析衍射现象及其应用06量子物理基础Chapter02030401黑体辐射与普朗克量子假设黑体辐射实验与经典物理的矛盾普朗克量子假设的提普朗克公式及其物理意义量子化概念在解决黑体辐射问题中的应用010204光电效应与爱因斯坦光子理论光电效应实验现象与经典理论的矛盾爱因斯坦光子理论的提光电效应方程及其物理意义光子概念在解释光电效应中的应用03康普顿效应及德布罗意波概念康普顿散射实验现象与经德布罗意波概念的提典理论的矛盾测不准关系及量子力学简介测不准关系的提出及其物理量子力学的基本概念与原理意义07相对论基础Chapter狭义相对论基本原理相对性原理光速不变原理质能关系广义相对论简介等效原理在局部区域内,无法区分均匀引力场和加速参照系。
大学物理热学习题课

dN m 32 4 ( ) e Ndv 2kT
v2
对于刚性分子自由度 单原子 双原子 多原子
i tr
(1)最概然速率
2kT 2 RT RT vp 1.41 m
(2)平均速率
i=t=3 i = t+r = 3+2 = 5 i = t+r = 3+3 =6
6、能均分定理
8kT 8 RT RT v 1.60 m
M V RT ln 2 M mol V1
QA
绝热过程
PV 常量
M E CV T M mol
(2)由两条等温线和两条绝热线 组成的循环叫做 卡诺循环。 •卡诺热机的效率
Q0
Q2 T2 卡诺 1 1 Q1 T1
M P1V1 P2V2 A CV T M mol 1
E 0
•热机效率
A Q1 Q2
M E CV T M mol M Q C P T M mol
A Q1 Q2 Q2 1 Q1 Q1 Q1
A=P(V2-V1) 等温过程
A
E 0
Q1 Q2 •致冷系数 e W Q1 Q2
热机效率总是小于1的, 而致冷系数e可以大于1。
定压摩尔热容
比热容比
CP ( dQ )P dT i2 i
8、平均碰撞次数 平均自由程
z
2d v n
2
CV •对于理想气体:
Cp
v z
1.热力学第一定律
1 2 2d n
二、热 力 学 基 础
Q ( E2 E1 ) A dQ dE dA
准静态过程的情况下
4. 摩尔数相同的两种理想气体 一种是氦气,一种是氢气,都从 相同的初态开始经等压膨胀为原 来体积的2倍,则两种气体( A ) (A) 对外做功相同,吸收的热量 不同. (B) 对外做功不同,吸收的热量 相同. (C) 对外做功和吸收的热量都不 同. (D) 对外做功和吸收的热量都相 同. A=P(V2-V1)
第六章-热力学第二定律PPT课件

力学中称为方向性问题。
.
2
3,第二类永动机是不可能实现的
4,热力学第二定律与第一定律 相互独立互相补充
二,热力学第二定律的克劳修斯表述
克劳修斯(Rudolf Clausius,1822-1888),德国物理学家,对热力
学理论有杰出的贡献,曾提出热力学第二定律的克劳修斯表述和熵
的概念,并得出孤立系统的熵增加原理。他还是气体动理论和热力
.
4
3,更简单的克劳修斯表述:热量不可能自发地从低温热源传向高温热源。
通过以上内容,我们来判断以下说法正确与否:
① 功可变成热,热不能变成功。(若 对,举一例说明)
② 功可完全变成热,热不能完全变成功。(若不对,举一反例)
③ 功不能完全变成热,热能完全变成功。
④ 功可完全变成热,但要在外界作用下,热能完全变成功。
2,两种表述将的都是热和功的问题,功不仅限于机械功的广义 功,每一种功热转换过程也可以作为热力学第二定律的表述。
热力学第二定律不是若干典型热学事例的堆积仓库,物理定律也 不能停留在具体的表面描述,真正的热力学定律应当是对物理本 质的描述,不同的表述应当有共同的物理本质,热力学第二定律 应该有更好的叙述。
第六章,热力学第二定律
问题的引入:
1,焦耳理论与卡诺热机理论的矛盾:同属能量转换, 有用功变热可以全部实现,为什么反过来就不能全部 实现,能量转换与守恒定律可没有这样的限制。
2,热机效率始终小于1并不全是技术原因
3,大量与热有关的自然过程仅靠热力学第一定律是不 足以解释的:1)热传递是不可逆的;2)电影散场后, 观众自发离开影院走向各方,却不能自发地重新聚集在 原来的电影院; 3)空气自由膨胀不能自发收缩等。
小结:上述三个不可逆过程,在推理过程中,很容易找到使系统 复原的方法,但这种情况并不多见,并且花费很多精力时间去寻 找系统复原的方法,很不经济。所以,我们必须借助其他方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
W2 2 1.0132102 4.04 2102 J 4.85103 J
过程II气体内能增量为
p
( p2 ,V2 )
E2
5 2
R
T3
T2
5 2
p3V3
p2V2
5
1.0132102 4.04 2102
J
( p1,V1)
O
2
p3 p1
V
6.06103 J
过程II气体吸热
Q2 W2 E2 4.85103 J 6.06103 J 1.09104 J
(约80亿次)
第13章 提要
1、热力学第一定律及其应用 (1)准静态过程的功
V2
W = ò PdV V1
(2)热力学第一定律 Q = DE + W 微变过程 dQ = dE + dW 迈耶公式 CP,m = CV ,m + R
2、循环过程和卡诺循环
(1) 循环过程的特点 E 0
热机效率h =
W Q1
请看例题
练习. 一定质量的理想气体,进行如图所示的循环过程
已知气体在状态A的温度为 300K,求:
(1)气体在状态B、C的温度
(2)各过程气体对外作的功
(3)经过整个循环过程,气体 从外界吸收的总热量
解:由图知 PA 300Pa ; PB Pc 100Pa ;
VB 3m3
VA Vc 1m3
8.单原子分子的理想气体,其自由度i= 3 ,定
容摩尔热容Cv,m= 3 2 R,定压摩尔热容Cp,m= 5 2 R。
9、一定量的理想气体,从相同状态开始分别经过等压、 等体及等温过程,若气体在上述各过程中吸收的热量 相同,则气体对外界作功最多的过程为___等__温_______。
10. 下图为同一种气体,处于不同温度状态下的速率
热习 力题 学课
第12章 提要
掌握两方面内容:
一、理想气体状态方程;二、理想气体的压强、能量计算
1、气态方程; 2、气体的压强
pV m RT M
(
K
=
R NA
)
n N V
P nKT
p
=
1 3
nmv 2
=
2 3
nεk
3、能量按自由度均分原理
在平衡态下,分子每个自由度平均分得能量 1 KT 2
一个分子的平均平动动能
(B)T1 T2,1 2 / 2
1 KT 2d 2n 2d 2 P
(C)T1 2T2,1 2
(D)T1 2T2,1 2 / 2
[B]
2.同温度、同物质的量的H2和He两种气体,它们的 ()
A、分子的平均动能相等; B、分子的平均平动动能相等; C、总动能相等;
εk
=
3 2
KT
D、内能相等。
3 .理想气体的温度( )
[B]
(A)与分子的平均动能成正比;
(B)与气体的内能成正比;
(C)与分子的平均平动动能成正比;
(D)与分子的平均速度成正比。
[C]
4.下面各图所示的速率分布曲线,哪一图中的两条曲线能 是同一温度下氨气和氦气的分子速率分布曲线?
[B]
5.理想气体的定压摩尔热容大于定容摩尔热容,是因为在等压 过程中( )
W W1 W2 W3 200J
对整个循环过程:
E 0
Q W E 200J
2. 1mol刚性双原子分子的理想气体,开始时处于
p1 1.01105 Pa, V1 103 m3 的状态,然后经如图所示的
直线过程I变到 p2 4.04105 Pa , 状V2态 2.1后03又m3经过方程
为
RT
0
M mol
用于计算分子的平均平动动能
5、平均自由程、平均碰撞频率:
1 KT 2d 2n 2d 2 P
z = vv λ
练习
1.理想气体绝热地向真空自由膨胀,体积增大为原
来的两倍,则始、末两态的温度T1与T2和始、末两态
气体分子的平均自由程 与1 的2 关系为
( A)T1 T2,1 2
(常量)p的V 1过2 程C II变到
压强 p3 p1 1.01的1状05态Pa.求:
(1) 在过程I中气体吸的热量;
(2) 整个过程气体吸的热量.
解:(1) 在过程Ⅰ中气体对外做
功为:
W1
1 2
p1
p2
V2
V1
p
( p2 ,V2 )
( p1,V1)
O
p3 p1
V
内能增量为:
E1
m M
CV
(1)C—A为等容过程:
PA TA Pc Tc
Tc
PcTA PA
= 100K
C—B为等压过程:
VB TB Vc Tc
TB
TcVB Vc
300K
(2)各过程中气体作的功:
A—B: W1
1 2
PA
PB VB
Vc
400J
B—C:W2 PB Vc VB 200J
C—A: W3 0
(3)整个过程中气体作的总功:
ቤተ መጻሕፍቲ ባይዱ
3
2
mv2
e 2KT
v2dv
f
v dV
f v : 麦克斯韦速率分布函数
dN f v NdV 速率在v~v+dv区间内的分子数
v2
f vdv
dN
速率在v1~v2区间内的分子数占分子
v1
N 总数的百分比
4、三种速率 (1)最概然速率(对应速率分布曲线中f(v)的最大值)
VP 1.41
=
Q1 - Q2 Q1
=
1-
Q2 Q1
致冷系数 e = Q1 = Q2 W Q1 - Q2
提醒:
热机效率总是小于1的,而致冷系数e可以大于1。
(2)由两条等温线和两条绝热线组成的循环叫做 卡诺循环。
卡诺热机的效率
卡诺
1
Q2 Q1
1 T2 T1
3、热力学第二定律
(1)热力学第二定律的开尔文表述和克劳修斯表述 是等价的,它揭示了一切与热现象有关的实际宏 观过程都是不可逆的。
(2)整个过程气体吸收热量
Q Q1 Q2 2.02103 J1.09104 J 1.29104 J
A、膨胀系数不同;
B、膨胀时气体对外作功;
C、分子间吸引力大;
[B]
D、分子本身膨胀。
6.对于室温下的双原子分子理想气体,在等压膨胀的情况下, 系统对外界作的功与从外界吸收的热量之比等于
(A)1/3 (B)1/4
[D]
(C)2/5 (D)2/7
W= Q
Q- DE = Q
R i+ 2 R
=
2 7
2
7.理想气体的压强仅与下列哪项有关( D) A、气体的分子数密度; B、气体的温度; C、气体分子的平均速率; D、气体的分子数密度与温度的乘积.
(2) 在过程II中气体对外做功为:
W2
V3 pdV
V2
p
( p2 ,V2 )
p2
V2
V3 dV 2 V V2
p3V3 p2V2
( p1,V1)
O
p3 p1
V
又
V3
V2
p2 p3
2
2 103
4.04 1.01
2
m3
1
pV 2 C
32103 m3
1
1
1 1
p2V22 pV 2 , p p2V22V 2
一个分子的平均动能 εk =
kt
i 2
KT
3 2
KT
一个系统的内能
E=
m¢ M mol
i RT 2
=
m¢ M mol Cv,mT
一个系统内能的改变量 DE = m¢ i RDT
4、麦克斯韦速率分布率
M mol 2
在平衡态下,速率在v~v + dv区间内的分子数占分
子总数的百分比
dN N
4
m
2 KT
(已知分子直径d = 210-10m )
(z v )
解:
v
8RT
M mol
88.31 273 2103 π
m s1
1.70103 m s1
n
p kT
1.013105 1.381023 273
m3
2.691025 m3
1 2.14107 m
2π d 2n
z v 7.95109 s1
分布曲线,试问(1)哪一条曲线对应的温度高?
(2)如果这两条曲线分别对应的是同一温度下氧气
和氢气的分布曲线,问哪条曲线对应的是氧气,哪条
对应的是氢气?
解:
vp
2kT M
f(v) T1
(1) T1 < T2
(2) 绿:氧 黑:氢
T2
v v p1 p2
v
11. 求氢在标准状态下一秒内分子的平均碰撞次数。
,mT
5 2
R
T2
T1
p
( p2 ,V2 )
5 2
p2V2
p1V1
( p1,V1)
O
p3 p1
V
由热力学第一定律,此过程气体吸收的热量为:
Q1
W1
E1
1 2
p1
p2
V2
V1
5 2
p2V2
p1V1
1 1.01105 4.04105 2103 103 J
2
5 4.04 2102 1.01102 J 2.02103 J 2
RT M mol
物理意义:表示分布在VP附近小区 间内的分子数最多。
