有机化学-第四章
合集下载
有机化学-芳香烃

CH3
HNO3
HOAc
CH3
CH3 CH3
NO2 +
+
NO2
NO2
63% 34% 3%
Cl
Cl
Cl
Cl
HNO3
H2SO4
NO2 +
+ NO2
30%
NO2
69% 1%
(2) 第二类定位基─间位定位基
使新进入苯环的取代基主要进入它的 间位,并使苯环致钝。
例如: −CF3, −N(CH3)3+, −NO2, −CN, −SO3H, −CHO, −COCH3, −COOH, −COOCH3, −CONH2, −NH3+。
NO2
NO2
CH3 C CH3 CH3 无 α-H
KMnO4 H+
COOH
氧化剂: KMnO4 铬酸等
4.2.4 苯环上亲电取代反应的定位规则
Y
一取代苯:
芳环上的取代基既影响亲电 取代反应的速率又决定着亲电试 剂进入芳环的位置。
1. 两类定位基
芳环上的取代基分为两类:
(1)第一类定位基 ─ 邻、对位定位基 使得新进入苯环的取代基主要进入它的
均化,闭合共轭
苯
苯的分子结构 体系(环状大π键)
6 个C–C σ键: sp2–sp2相互交盖,6 个C –H σ键: sp2–1s 相互交盖。 6 个2p 轨道的对称轴垂直于环所在平面, 彼此相互平行,两侧进行侧面交盖,形成闭合的π轨道。 6个π电子离域在六个C原子上。由此形成一个闭合的
共轭体系。
2. 苯的构性相关分析
CH3
CH3
CH3
CH3
1,2-二甲苯 邻二甲苯 o-二甲苯
有机化学 第四章
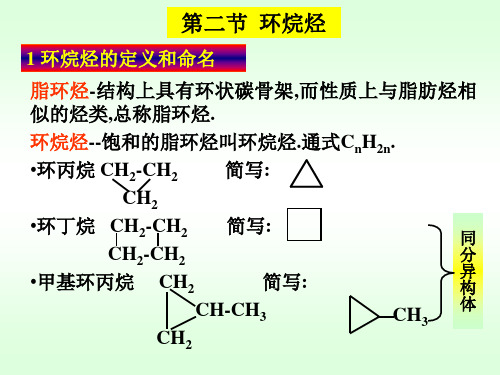
2.4.1 环丙烷的结构 • C-C键的形成
交盖较好
交盖较差 键轨道的交盖
•这样的键与一般的键不 一样,它的电子云没有轨道 轴对称,而是分布在一条曲 线上,故常称弯曲键.
内角60°
•弯曲键比一般的 键弱,并且具有较高的能量. •这种因键角偏离正常键角而引起的张力叫角张力. •由于构象是重叠式而引起的张力叫扭转张力.
CH3CHCH2CH3 Br
•四碳环不易开环,在常温下与卤素,卤化氢不反应。
(3) 氧化反应:
•
在常 应;
温下
,环
烷烃
与一
般氧
化剂
(KMnO4,O3)
不反
思考:如何鉴别环丙烷与烯烃 ?
• 在加热,强氧化剂作用或催化剂存在时,可用空气
氧化成各种氧化产物:
例:
O
HNO3
CH2CH2COOH Ba(OH)2 CH2CH2COOH Δ
5.3 环烷烃的环张力和稳定性
(1) 烷烃每增加一个CH2,燃烧热增值基本一定,平均为 658.6 kJ/mol.
(2) 环烷烃的通式为:每增加一个 CH2,燃烧热增加,平均 每个 CH2 的燃烧热为Hc/n.
张力能 --环丙烷的 Hc/n 为697.1 kJ/mol,比烷烃的
每个 CH2高38.5 kJ/mol.这个差值就是环丙烷分子中 每个 CH2的张力能.
(e) 编号的顺序以取代基位置号码加和数为较小.
例4:
例5:
6-甲基双环[3.2.2]壬烷 1,7-二甲基双环[3.2.2]壬烷
例6: 8,8-二甲基双环[3.2.1]辛烷
例7: 双环[2.2.2]-2,5,7-辛三烯
2.2 脂环烃的性质
(一) 物理性质
交盖较好
交盖较差 键轨道的交盖
•这样的键与一般的键不 一样,它的电子云没有轨道 轴对称,而是分布在一条曲 线上,故常称弯曲键.
内角60°
•弯曲键比一般的 键弱,并且具有较高的能量. •这种因键角偏离正常键角而引起的张力叫角张力. •由于构象是重叠式而引起的张力叫扭转张力.
CH3CHCH2CH3 Br
•四碳环不易开环,在常温下与卤素,卤化氢不反应。
(3) 氧化反应:
•
在常 应;
温下
,环
烷烃
与一
般氧
化剂
(KMnO4,O3)
不反
思考:如何鉴别环丙烷与烯烃 ?
• 在加热,强氧化剂作用或催化剂存在时,可用空气
氧化成各种氧化产物:
例:
O
HNO3
CH2CH2COOH Ba(OH)2 CH2CH2COOH Δ
5.3 环烷烃的环张力和稳定性
(1) 烷烃每增加一个CH2,燃烧热增值基本一定,平均为 658.6 kJ/mol.
(2) 环烷烃的通式为:每增加一个 CH2,燃烧热增加,平均 每个 CH2 的燃烧热为Hc/n.
张力能 --环丙烷的 Hc/n 为697.1 kJ/mol,比烷烃的
每个 CH2高38.5 kJ/mol.这个差值就是环丙烷分子中 每个 CH2的张力能.
(e) 编号的顺序以取代基位置号码加和数为较小.
例4:
例5:
6-甲基双环[3.2.2]壬烷 1,7-二甲基双环[3.2.2]壬烷
例6: 8,8-二甲基双环[3.2.1]辛烷
例7: 双环[2.2.2]-2,5,7-辛三烯
2.2 脂环烃的性质
(一) 物理性质
有机化学第4章 烯烃

4.1.3 烯烃的异构和Z/E标记法
•构造异构由于双键的位置不同引起同分异构现象。 构造异构由于双键的位置不同引起同分异构现象。 构造异构由于双键的位置不同引起同分异构现象 例1:丁烯有三个同分异构体 丁烯有三个同分异构体 (1) CH3-CH2-CH=CH2 1-丁烯 丁烯 (2) CH3-CH=CH-CH3 2-丁烯 丁烯 (3) CH3-C=CH2 2-甲基丙烯 异丁烯 甲基丙烯(异丁烯 甲基丙烯 异丁烯) CH3
HX=HCl,HBr,HI 烯烃 卤烷
加成反应历程 + 第一步: -C=C- + H X → -C-C- + X第一步 •生成碳正离子 H 生成碳正离子 第二步:碳正离子迅速与 结合生成卤烷. 第二步 碳正离子迅速与 X- 结合生成卤烷 -C-C- + X- → -C-C+ H HX
σ+ → σ-
4.2 烯烃的物理性质
自
学!!
4.3 烯烃的化学性质 •碳碳双键 碳碳双键 •断裂乙烷 断裂乙烷C-C σ 单键需要 单键需要347kJ/mol 断裂乙烷 •断裂双键需要 断裂双键需要611kJ/mol; 断裂双键需要 •说明碳碳 π 键断裂需要 说明碳碳 键断裂需要264kJ/mol •双键使烯烃有较大的活性 双键使烯烃有较大的活性. 双键使烯烃有较大的活性 • 烯烃的加成反应 --- 烯烃在起化学反应时往往 随着π 键的断裂又生成两个新的 σ 键,即在双键 即在双键 碳上各加一个原子或基团. 碳上各加一个原子或基团 >C=C< + Y-Z → -C-C(σ sp2) σ
4.1.1 烯烃的命名 命名规则(系统命名 命名规则 系统命名): 系统命名 • • • • (1)选择含碳碳双键的最长碳链为主链 母体 选择含碳碳双键的最长碳链为主链(母体 选择含碳碳双键的最长碳链为主链 母体); (2)碳链编号时 应从靠近双键的一端开始 碳链编号时,应从靠近双键的一端开始 碳链编号时 应从靠近双键的一端开始; (3)烯前要冠以官能团位置的数字 编号最小 烯前要冠以官能团位置的数字(编号最小 烯前要冠以官能团位置的数字 编号最小); (4)其它同烷烃的命名规则 其它同烷烃的命名规则. 其它同烷烃的命名规则 CH2﹦ –CH2CH3 C ︱ CH2CH2CH3
有机化学-第四章 环烃
环戊烷分子中,碳碳键的夹角为108°,接近sp3杂化轨 道间夹角,角张力很小,是比较稳定的环。
环己烷分子中6个碳原子不在同一平面上,碳原子之间的 键角为109°28′,分子中没有张力。
大环原子在不同的平面内,键角接近正常的键角,为
无张力环。
环三十烷
三、环己烷的构象
1 椅式构象和船式构象
六个碳原子均为sp3杂化,在保持键角109°28′不变的情况
H2SO4
NO2 NO2
甲苯硝化比苯容易,主要产物为邻位和对位取代产物。
CH3
HNO3 , H2SO4 30℃
CH3 NO2 +
CH3
NO2
(3) 磺化反应 苯与浓硫酸加热,或与发烟硫酸在室温下作用,生 成苯磺酸。苯磺酸也是强酸,酸性与硫酸接近。
浓 H2SO4 , 80℃ or H2SO4(SO3) , 室温
2 直立键和平伏键
椅式构象中的碳氢键可以分为两类,6个碳氢键与分
子的对称轴平行,叫做直立键或a键。
另外6个碳氢键指向环外,与直立键成109°28′的角, 平伏着向环外伸展,叫做平伏键或e键。
一个椅式构象的环己烷,可以通过碳碳单键的旋转变成 另一种椅式构象,叫做转环作用。
X
X
当环己烷上的氢原子被其它基团取代后,由于其它基团 都比氢原子大,所以取代基以e键和环相连占优势。
环己烷以上的环烷烃则很难发生加氢反应。
2 与溴的作用
环丙烷在室温下可以和溴进行亲电加成反应,生成开
链化合物。环丁烷要在加热条件下才能和溴加成。
+ Br2
BrCH2CH2CH2Br
1,3-二溴丙烷
+ Br2
Δ
BrCH2CH2CH2CH2Br
有机化学4第四章芳香烃

(1)、闭合离域体系
(2)、具有平面结构或接近平 面
(3)、参与共轭的π电子数符合 4n+2
轮烯
[8]轮 烯
HH
[10]轮 烯
HHHH
[14]轮 烯
[18]轮 烯
盆形
不共平面
π电子数8 不符合4n+2
π电子数10 符合4n+2
无芳香性 无芳香性
不共平面
π电子数12 不符合4n+2
无芳香性
共平面
π电子数18 符合4n+2
COCH3
HO
COOH
COOH NH2
HO
CH3CH2CCH2CHCHO O Cl
3-丁烯-2-醇 4-氧代-2-氯乙醛
4-羟基环己烷甲酸
4-羟基-3-甲氧基苯甲醛 2-氨基-5-羟基苯甲酸
3-硝基-4-羟基苯乙酮
官能团的优先顺序 见教材P93
1
α
891
7
2β
6
3
5
10
5
4
α
SO3H
2β
萘 1,5-二甲基萘 2-萘磺酸 或 β-萘磺酸
―O-, ―NH2,―NR2, ―OH(强烈活化) > ―OR,―OCOCH3, ―NHCOCH3(中等活化) > ―R, ―C6H5 >(弱活化) ― F, ―Cl, ―Br, ―I(弱钝化)
2、第二类定位基(间位定位基)
-N+R3, -NO2,-CN, -SO3H, -CF3,-CHO,COCH3,-COOH,-COOCH3, -CONH2(强烈钝化)
Cl
H
Cl
Cl
E
O
δδ
N
有机化学 第四章 立体异构

和溶液的浓度、样品管的长度、温度、 光的波长都有关系。
(二)、旋光仪和比旋光度
Nicol棱镜
旋光仪的工作原理
WXG-4圆盘旋光仪
t: 比旋光度 [ α ]λ
测定温度
比旋光度
[α] t λ=
波长
α
旋光度(旋光仪上的读数)
l × ρ
溶液的浓度(g/ml) 盛液管长度(dm)
质量浓度ρB = 1g/ml的旋光物质溶液,放在l = 1dm长的盛液管中测得的旋光度为这个物质的比
CHO H OH CH2OH COOH [O] HgO H OH CH2OH
D-(+)-甘油醛
D-(-)-甘油酸
If the —OH or —NH2 which attaches to the
chiral carbon atom lies on the right,the
molecule is called ―D‖;if on the left,i H H Cl F H
有对称中心的分子能和它的镜像重合,没有手性
一般来讲,一种分子不能重叠镜像的条件是这 种分子没有对称面,也没有对称中心。
Plane of Symmetry
对映异构体
对映体的物理性质和化学性质一般 都相同,比旋光度的数值相等,但旋光 方向相反;等量对映体的混合物称为外 消旋体(Racemate) ,用dl或(± ) 表示。 Racemic Mixtures
手性分子
Amino acid possesses a carbon with four different attached groups (R, NH2, H, COOH); there is no such carbon in propanoic acid.
(二)、旋光仪和比旋光度
Nicol棱镜
旋光仪的工作原理
WXG-4圆盘旋光仪
t: 比旋光度 [ α ]λ
测定温度
比旋光度
[α] t λ=
波长
α
旋光度(旋光仪上的读数)
l × ρ
溶液的浓度(g/ml) 盛液管长度(dm)
质量浓度ρB = 1g/ml的旋光物质溶液,放在l = 1dm长的盛液管中测得的旋光度为这个物质的比
CHO H OH CH2OH COOH [O] HgO H OH CH2OH
D-(+)-甘油醛
D-(-)-甘油酸
If the —OH or —NH2 which attaches to the
chiral carbon atom lies on the right,the
molecule is called ―D‖;if on the left,i H H Cl F H
有对称中心的分子能和它的镜像重合,没有手性
一般来讲,一种分子不能重叠镜像的条件是这 种分子没有对称面,也没有对称中心。
Plane of Symmetry
对映异构体
对映体的物理性质和化学性质一般 都相同,比旋光度的数值相等,但旋光 方向相反;等量对映体的混合物称为外 消旋体(Racemate) ,用dl或(± ) 表示。 Racemic Mixtures
手性分子
Amino acid possesses a carbon with four different attached groups (R, NH2, H, COOH); there is no such carbon in propanoic acid.
有机化学第四章 芳香烃

7
1 价键理论
此时每个碳原子上剩有一 H 个未参与杂化 参与杂化的 轨道, 个未 参与杂化 的 p 轨道 , H120° 其对称轴垂直碳环所在 平面,并彼此平行,于 两侧相互交盖重叠,形 H H 成一个闭合的π 成一个闭合的 π键 , 这样 处于该 π 键中的 π 电子能 高度离域, 够 高度离域 , 使 π 电子云 完全平均化。分子整体 能量降低,分子稳定。 能量降低,分子稳定。
CH3
CH3 甲苯
CH2CH3 乙苯
CH2CH2CH2CH3
CH3
CH3
CH3CH2
对二甲苯
邻甲乙苯
13
苯同系物的命名
• 3 苯环上连有三个相同基团时,用连、偏、均来 表示相对位置。 表示相对位置。 • 要求必须是三个相同基团才能用连、偏、均来表 才能用连 示此三基团的相对位置。
CH3 CH3 CH3
H H
0.110nm
0.140nm
8
• 由于苯形成了一个环状π键,使6个碳-碳键、6 个碳-氢键都相同,其碳-碳键较烷烃中短,比 烯烃中碳-碳双键长,导致其性质与烷烃、烯烃 都有较大区别,苯的这种难加成、难氧化、易取 难加成、难氧化、 代的性质,就被称为芳香性。 现在一般用
表示苯,以示苯中 个碳 个碳- 表示苯,以示苯中6个碳-碳键并无
3 芳烃衍生物的命名
当苯环上连有-OH、-CHO、-COOH、- 当苯环上连有-OH、-CHO、-COOH、- 、-CHO、-COOH 、-NO 、-SO 、-X NH2、-NO2、-SO3H、-X等基团时我们又该 如何命名这样的化合物呢? 如何命名这样的化合物呢? 首先仍然是选择一个母体。 首先仍然是选择一个母体。 一般我们按一定的次序选择一个最优先的基团 选择一个最优先的基团, 一般我们按一定的次序选择一个最优先的基团, 并将它与苯一起作为一个完整的母体。 并将它与苯一起作为一个完整的母体。其它都作 为取代基来看。 为取代基来看。 这一次序我们称为“ 优先次序 ”,它与在烯烃一 完全没有任何关系。 章中介绍的“ 次序规则 ”完全没有任何关系。 一些常见基团的优先次序如下: 一些常见基团的优先次序如下:
1 价键理论
此时每个碳原子上剩有一 H 个未参与杂化 参与杂化的 轨道, 个未 参与杂化 的 p 轨道 , H120° 其对称轴垂直碳环所在 平面,并彼此平行,于 两侧相互交盖重叠,形 H H 成一个闭合的π 成一个闭合的 π键 , 这样 处于该 π 键中的 π 电子能 高度离域, 够 高度离域 , 使 π 电子云 完全平均化。分子整体 能量降低,分子稳定。 能量降低,分子稳定。
CH3
CH3 甲苯
CH2CH3 乙苯
CH2CH2CH2CH3
CH3
CH3
CH3CH2
对二甲苯
邻甲乙苯
13
苯同系物的命名
• 3 苯环上连有三个相同基团时,用连、偏、均来 表示相对位置。 表示相对位置。 • 要求必须是三个相同基团才能用连、偏、均来表 才能用连 示此三基团的相对位置。
CH3 CH3 CH3
H H
0.110nm
0.140nm
8
• 由于苯形成了一个环状π键,使6个碳-碳键、6 个碳-氢键都相同,其碳-碳键较烷烃中短,比 烯烃中碳-碳双键长,导致其性质与烷烃、烯烃 都有较大区别,苯的这种难加成、难氧化、易取 难加成、难氧化、 代的性质,就被称为芳香性。 现在一般用
表示苯,以示苯中 个碳 个碳- 表示苯,以示苯中6个碳-碳键并无
3 芳烃衍生物的命名
当苯环上连有-OH、-CHO、-COOH、- 当苯环上连有-OH、-CHO、-COOH、- 、-CHO、-COOH 、-NO 、-SO 、-X NH2、-NO2、-SO3H、-X等基团时我们又该 如何命名这样的化合物呢? 如何命名这样的化合物呢? 首先仍然是选择一个母体。 首先仍然是选择一个母体。 一般我们按一定的次序选择一个最优先的基团 选择一个最优先的基团, 一般我们按一定的次序选择一个最优先的基团, 并将它与苯一起作为一个完整的母体。 并将它与苯一起作为一个完整的母体。其它都作 为取代基来看。 为取代基来看。 这一次序我们称为“ 优先次序 ”,它与在烯烃一 完全没有任何关系。 章中介绍的“ 次序规则 ”完全没有任何关系。 一些常见基团的优先次序如下: 一些常见基团的优先次序如下:
有机化学课件--第四章脂环烃

有机化学课件--第四章脂 环烃
欢迎来到有机化学的世界。今天我们将探索脂环烃这一组合物,了解其定义、 特点、结构、化学反应以及在实际生活中的应用。
什么是脂环烃?
定义
脂环烃是一类具有环状结构且含有脂肪基团的有机化合物。
特点
脂环烃的骨架为碳环,不含杂原子,烷基称为脂基,环状结构导致化学性质独特。
类脂环烃的结构与示例
3
卤代烷环化
通过卤代烷的环化反应得到,如环丙烷环化为环丙基甲苯。
脂环烃的化学性质与反应
• 烷基脂环烃在氧化条件下易发生环内氧化作用,生成含有羟基或羰基的环状化合物。 • 类脂环烃可通过环内位阻、立体特异性、芳香性质等发生不同的化学反应。 • 环硅烷和环硅氧烷等特殊的脂环烃具有独特的缩合反应、断裂反应和环硅氧烷积分反应。
被广泛应用
脂环烃在工业、医药、生物学 等领域有着不可替代的作用, 是当今社会发展的重要支撑。
环保意义重大
研究和发展低排放、环保型新 材料和新工艺,是未来脂环烃 的发展方向。
与人工智能技术结合
结合人工智能技术,不断探索 新型催化剂、反应机制。
பைடு நூலகம்
脂环烃在生活中的应用
食品加工
如脂环烷代表食品添加剂:植物脂环酸、硬 脂环酸等,用于增加食品的稠度、保持柔软 度。
化学品制造
如环己烷广泛用于工业合成甲基环己烷,也 用于人工味料制造。
医药领域
如肝素和阿司匹林等药物的成分中含有脂环 烷结构。
生物学研究
如脂环烷、类固醇在生物学研究中有一定的 作用。
脂环烃的重要性及未来发展
萜类化合物
包括环烷类萜、环烯类萜、环 戊基萜等,常见于天然植物与 动物中。
类固醇
具有四环骨架中的三个6元环 和一个5元环,包括胆固醇、 睾酮、雌激素等。
欢迎来到有机化学的世界。今天我们将探索脂环烃这一组合物,了解其定义、 特点、结构、化学反应以及在实际生活中的应用。
什么是脂环烃?
定义
脂环烃是一类具有环状结构且含有脂肪基团的有机化合物。
特点
脂环烃的骨架为碳环,不含杂原子,烷基称为脂基,环状结构导致化学性质独特。
类脂环烃的结构与示例
3
卤代烷环化
通过卤代烷的环化反应得到,如环丙烷环化为环丙基甲苯。
脂环烃的化学性质与反应
• 烷基脂环烃在氧化条件下易发生环内氧化作用,生成含有羟基或羰基的环状化合物。 • 类脂环烃可通过环内位阻、立体特异性、芳香性质等发生不同的化学反应。 • 环硅烷和环硅氧烷等特殊的脂环烃具有独特的缩合反应、断裂反应和环硅氧烷积分反应。
被广泛应用
脂环烃在工业、医药、生物学 等领域有着不可替代的作用, 是当今社会发展的重要支撑。
环保意义重大
研究和发展低排放、环保型新 材料和新工艺,是未来脂环烃 的发展方向。
与人工智能技术结合
结合人工智能技术,不断探索 新型催化剂、反应机制。
பைடு நூலகம்
脂环烃在生活中的应用
食品加工
如脂环烷代表食品添加剂:植物脂环酸、硬 脂环酸等,用于增加食品的稠度、保持柔软 度。
化学品制造
如环己烷广泛用于工业合成甲基环己烷,也 用于人工味料制造。
医药领域
如肝素和阿司匹林等药物的成分中含有脂环 烷结构。
生物学研究
如脂环烷、类固醇在生物学研究中有一定的 作用。
脂环烃的重要性及未来发展
萜类化合物
包括环烷类萜、环烯类萜、环 戊基萜等,常见于天然植物与 动物中。
类固醇
具有四环骨架中的三个6元环 和一个5元环,包括胆固醇、 睾酮、雌激素等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CC13- -CC24ππ键 键
2p–2p 交盖
C2-C3: 2p–2p 部分交盖
4个π电子离域在4个C原
子,π电子的离域降低了体
图 4.3 1,3–丁二烯
系的轭体系 共振论
7
1,3–丁二烯两种可能的平面构象:
s–顺式 构象
s–反式 构象
s-cis-conformation s-trans-conformation
反应结果: 1,4–加成,关环
37
CH3 +
CH3
O H
H
30 °C
H
CH3 CHO H
CH3
图 4有.机1化0学D第四ie章l二s烯–烃A共l轭d体e系r共反振论 应机理
38
AB
A B
+
XY
Y X
双烯体 亲双烯体 加成物
(diene) (dienophile) (adduct)
反应特点:
• 可逆反应 • 双烯体:供电基; 亲双烯体:吸电基
δ+
H2C CH
δ+
CH CH3 + Br
1,2–加成 H2C CH CH CH2
Br H 1,4–加成 CH2 CH CH CH2
Br
H
E1,4
E1,2
CH3
CH
CH3 CH3
BrCH2 CH CH CH3
H2C CH CH CH3 Br
反应进程
1,2–加成与1,4–加成势能图
有机化学 第四章 二烯烃 共轭体系 共振论
有机化学 第四章 二烯烃 共轭体系 共振论
8
共轭 键与键的重叠,使电子离域体系稳定。
有机化学 第四章 二烯烃 共轭体系 共振论
11
4.3 电子离域与共轭体系
4.3.1 π,π–共轭 4.3.2 p,π–共轭 4.3.3 超共轭 ( hyperconjugation )
共轭效应(conjugated effects): 在共轭体系中电子离域的作用。
有机化学 第四章 二烯烃 共轭体系 共振论
18
σ,π–超共轭
当C-Hσ键与π键相邻时,两者进行侧面交 盖,σ电子离域——σ,π–超共轭效应
参与超共轭的C-Hσ键越多,超共轭效应越强 。
H
δ
R C CH
R
H
< δ
CH2
δ
H C CH
R
H
< δ
CH2
δ
H C CH
H
δ
CH2
超共轭效应依次增大
有机化学 第四章 二烯烃 共轭体系 共振论
COCH3 HO
• 双烯合成反应的应用: (a) 鉴定共轭二烯烃 (b) 通过生成C-C键关环
有机化学 第四章 二烯烃 共轭体系 共振论
41
本章学目的和要求以及重点和难点
教学目的和要求:了解二烯烃的分类、结构特
征和命名;掌握电子离域与共轭体系共轭的基本概念; 掌握不共轭二烯的共轭加成及机理及热力学控制和动 力学控制、Diels-Alder 反应。
教学重点和难点:共轭二烯的共轭加成及机理
及热力学控制和动力学控制、Diels-Alder 反应。
有机化学 第四章 二烯烃 共轭体系 共振论
54
作业
P147 习题(一)、习题(三 )(1)(4)
P148 习题(七) 、习题(十三)(1)(3)
有机化学 第四章 二烯烃 共轭体系 共振论
55
有机化学 第四章 二烯烃 共轭体系 共振论
1,4–戊二烯
二烯烃
累积双键二烯烃
( Cumulative diene )
两个双键连接在同一个碳 原子上
H2C C CH2
丙二烯(allene)
共轭双键二烯烃 两个双键被一个单键隔开
( Conjugated diene )
CH2 CH CH CH2
1,3–丁二烯
有机化学 第四章 二烯烃 共轭体系 共振论
反应机理
第一步: 烯丙基型碳正离子的生成
H2C CH CH CH2 HBr H2C CH CH CH2H
H2C CH CH CH2H (I)
(I)
CH2 CH CH CH2H (II)
(I): 仲碳正离子; (II): 伯碳正离子
有机稳化学 定第四章性二烯: 烃(I共)轭体>系(共I振I论)
33
第二步: 正负离子的结合
离域能
1,4–戊二烯
有机化学 第四章 二烯烃 共轭体系 共振论
28 kJ.mol-
1 14
π,π–共轭效应: 由于π电子离域的共轭效应。
δ
δ
O
O
δ
CH3
δ
CH
Cδ
H或
δ
CH3
CH
C
H
• 所有原子共平面; • 正、负电荷交替; • 共轭效应的传递不受传递距离的影响。
有机化学 第四章 二烯烃 共轭体系 共振论
CH2 CH CH CH2 Br Br
CH2 CH CH CH2
Br
Br
有机化学 第四章 二烯烃 共轭体系 共振论
31
溶剂的性质:极性溶剂利于1,4–加成反应
正己烷 (62%)
(38%)
CH2 CH CH CH2 + Br2-15°C 1,2–加成产物 + 1,4–加成产物
氯仿
(37%) (63%)
第四章 二烯烃 共轭体系 共振论
4.1 二烯烃的分类和命名 4.2 二烯烃的结构 4.3 电子离域与共轭体系 4.4 共振论 (略) 4.5 共轭二烯烃的化学性质 4.6 重要共轭二烯烃的工业制法(略) 4.7 环戊二烯(略)
有机化学 第四章 二烯烃 共轭体系 共振论
1
4.1 二烯烃的分类和命名
二烯烃(alkadiene) : 分子中含有2个双键的不饱和烃。
15
4.3.2 p,π–共轭
CH2 CH CH2
+
烯丙基正离子 的 p,π–共轭
碳正离子的稳定性:
CH3
CH3
H
CH3CH CH CHCH3 > CH3 C > H2C CH CH2 > CH3 C > CH3 C > CH2 CH
CH3
H
H
烯丙型2° > 3° > 烯丙基1° > 2° > 1° > 乙烯型
56
有机化学 第四章 二烯烃 共轭体系 共振论
4
4.2 二烯烃的结构
丙二烯的结构
118.4°
H C
H
sp2 0.131 nm
C CH2
sp
线形非
平面分
子
H C C CH2 H
有机化学 第四章 二烯烃 共轭体系 共振论
6
4.2.2 1,3–丁二烯的结构
图 4.2 1,3–丁二烯的 结构示意图
4个 C 原子都是 sp2 杂化, C-Cσ键: sp2–sp2 交盖, C-Hσ键: sp2–1s 交盖, 所有的原子共平面。 键角:120°。
反应温度
H2C CH CH CH2 + HBr
H2C CH CH CH3 + CH2 CH CH CH3
-80℃
Br
(80%)
Br
(20%)
H2C CH CH CH3 + CH2 CH CH CH3
40℃
Br
Br
(20%)
(80%)
有机化学 第四章 二烯烃 共轭体系 共振论
32
4.5.2 1,4–加成的理论解释
3
4.1.2 二烯烃的命名
主链:两个双键在内。命名为“某二烯”
H3C CH3
2,3–二甲基–1,3–丁二烯
CH2 C C CH2
二烯烃的顺反异构体的命名:
H
H
H3C C
C C
C CH3
H
H
H
CH3
H3C C
C C
C H
H
H
顺,顺–2,4–己二烯 (2Z,4Z)–2,4–己二烯
顺,反–2,4–己二烯 (2Z,4E)–2,4–己二烯
活化能: E1,4 > E1,2
稳定性: 产物1,2 < 产物1,4
34
4.5.4 双烯合成
HHDCCieCClHHs+–22 AHHlCCderCCO反O 应马1来0苯0酐°C
O
CHO 甲苯
+
△
O
C
CH CH
O
C
O
CHO
反应条件: 1) 共轭二烯、
2) 含 C C、C C 化合物
有机化学 第四章 二烯烃 共轭体系 共振论
CH2 CH CH CH2
1,3–丁二烯
1,4–环己二烯
1,3–环辛二烯
直链二烯烃的通式:CnH2n-2
环二烯烃的通式:CnH2n-4
有机化学 第四章 二烯烃 共轭体系 共振论
2
4.1.1 二烯烃的分类
隔离双键二烯烃
( Isolated diene )
两个双键被两个或两个以 上的单键隔开
CH2 CH CH2 CH CH2
稳定性依次减弱
有机化学 第四章 二烯烃 共轭体系 共振论
21
4.5 共轭二烯烃的化学性质
1,4–加成反应
电环化反应 双烯合成
周环反应
有机化学 第四章 二烯烃 共轭体系 共振论
30
4.5.1 1,4–加成反应
1,2 – 加成 CH2 CH CH CH2 + Br2 1,4 – 加成
影响加成方式的因素: 反应物的结构; 试剂和溶剂的性质; 产物的稳定性; 反应温度。
