第四章 取代基效应
取代基效应

在21世纪,物理有机化学家将会在更广阔的范围内,在相关的前沿交叉领域中寻找新的学科生长点,运用自己在理论、方法、概念和思维方式方面的特长和优势,研究新问题,发现新规律,为有机化学乃至整个科学事业的发展作出贡献。
其中主要包括生命过程中的化学问题,分子聚集体化学中的结构/活性关系和反应规律,新分子和新材料的分子设计、合成和构效关系,计算化学和理论有机化学,自由基化学,有机光化学等领域。
内容提要§1-1 诱导效应一、共价键的极性与静态诱导效应 二、静态诱导效应的强度 三、静态诱导效应的强度比较 四、烷基的诱导效应 五、动态诱导效应 六、诱导效应对反应活性的影响 §1-2 共轭效应一、电子离域与共轭效应 二、静态共轭效应 三、动态共轭效应 四、共轭体系 五、共轭效应与反应性 §1-3 超共轭效应一、超共轭效应的特点和方向 二、超共轭效应的表现和作用 §1-4 场效应和空间效应 一、场效应 二、空间效应第一章 取代基效应(Substituent Effects)反应的本质: 有机化合物的反应本质是旧键的断裂,新键的生成,这直接或间接与共价键的极性,即共价键上电子云的分布有关。
例:C C C O1234取代基效应 分子中的某个原子或原子团对整个分子或分子中其它部分产生的影响(包括对共价键极性及整个分子物理性质和化学的影响)。
取代基效应的分类 取代基效应电子效应: 诱导效应 共轭效应 超共轭效应 场效应: 空间传递空间效应:空助效应 位阻效应 §1-1 诱导效应(Inductive effect) 一、共价键的极性与静态诱导效应C CH CH 21.定义CCCl ddd取代基的影响→分子链传递Cl d→电子云密度分布不均匀CCl d取代基性质→分子链传递方向δCH 3 CH CH 2 +→转移的结果存在于未发生反应的分子中——IS2.特点结构特征 单、双、叁键 传递方式沿价键链传递诱导效应的相对强度 取决于取代基中心原子电负性的大小;取代基的个数——加和性传递强度 距离越大,强度越弱 3.方向CZC H Z -I标准+I二、静态诱导效应的强度1.根据中心原子在元素周期表中的位置判断同周期 -IFOHNH 2CH 3OR 2NR 3 +IONR同主族 -I —F > —Cl > —Br > —IPR 2NR 3+IOS2.带正电荷取代基的-I 强,带负电荷取代基的 +I 强-I NR 2NR3NO 2+IOOR3. 中心原子相同 不饱和度越大,-I 效应越强 -ICCRCHCHROORN NRNR 2三、静态诱导效应的强度比较 相对次序比较 1.根据酸碱的强度比较测定取代乙酸的电离常数,诱导效应强度次序如下:-I 效应NO 2N(CH 3)3CNFClBrIOHOCH3C 6H 5CH CH 2H+I 效应C(CH 3)3HCH(CH 3)2CH 2CH 3CH 32.根据偶极矩比较测定甲烷一取代物和溴代烷的偶极矩,诱导效应强度次序如下: -I 效应NO2CNFCl BrIH+I 效应C(CH 3)3CH 2CH(CH 3)2CHCH 2CH 3CH 3CH 2(CH 2)2CH 33.根据1H NMR 化学位移比较测定X -CH3中甲基的 值,比较取代基的诱导效应强度。
取代基电子效应

3 脂肪族亲核取代反应
(Nucleophilic Substitution)
给电子能力强,可极化性大,试剂亲核性强,如I-
2021/8/8
4
亲电试剂的活泼性
异构产物 比例,%
反应类型
表 亲电试剂活泼性的影响
CH3
5 9 .8
CH3
1 .1 7
0 .5 3 9 .7
1 .2 5 9 7 .6
氯化
C-酰化
亲核试剂——带有孤对电子或负电荷,对原子核 或正电荷有亲和力的试剂,用Nu:或Nu-表示。
常见的亲核试剂: OH-、 OR-、CN-、NH3、 H2O等。
2021/8/8
22
2.3 脂肪族亲核取代反应 (Nucleophilic Substitution)
反应历程
反应的影响因素
2021/8/8
23
Nu-
C
δ
δ
Nu … C… L
Nu C + L -
2021/8/8
25
(2) 构型翻转
❖ (产物的构型与底物的构型相反,即瓦尔登 Walden 转化)
C6H13
HO +
C Br
SN2
H
C H3
C6H13
HO C
+ Br
H CH3
( )-2-溴溴溴
( )-2-溴溴
α = 34.2
α = 9.9
❖ 结论:按SN2反应历程进行亲核取代反应,
外消旋体 构型转化
C+HCH3 83-98% 2-17%
CH3CH2CH2CH2CH2CH2 C+HCH3
34% 66%
❖ 结论:SN1历程通过生成碳正离子进行取代反 应时,在发生消旋化的同时,通常还伴随着 部分构型转化
亲电取代反应取代基的定位效应

(二)难点
1.对芳香性的理解。
2.取代基定位效应的判断和应用及其原理。
第四章 芳 香 烃
目录△
第四章 芳香烃
一、苯型芳烃
1. 单环芳烃:分子中含一个苯环的芳烃,例: 2. 多环芳烃:
CH3 CH CH2
(1)联苯
(2)多苯代脂肪烃 (Ph)3CH
萘 蒽
(3)稠环芳烃
二、非苯型芳烃
第四章 芳 香 烃
第四章 芳 香烃 ☆
第一节 第二节 第三节 第四节 第五节 苯的结构 ☆ 苯的同系物的异构现象和命名 ☆ 苯及其同系物的性质 ☆ 苯环上亲电取代反应历程 ☆ 苯的亲电取代定位规律 ☆
第六节 重要的单环芳烃 ☆ 第七节 多环芳烃、稠环芳烃和非苯芳烃 ☆
(一)重点
1.亲电取代反应。
2.取代基的定位效应。
第四章 芳 香 烃
目录△
但还是存在未能说明的一些现象,例: 氢化热
E
240
231
208
稳定性: 苯 > 1,3—环己二烯 > 1,4—环己二烯
第四章 芳 香 烃
目录△
二、 苯分子结构的价键观点
通过x 射线,光谱法测定,苯是一个平面正六边形构型:
H H 120o H H
0.1397nm
H H
C-C (sp2-sp2 ) ; C-H (sp2-s )
NO2
99 %
Cl Cl + HNO3 H2SO4 Cl Cl NO2 + Cl
1%
NO2 Cl
第四章 芳 香 烃
目录△
2. 若二个取代基是同类时,第三个引入位置受强定位基支配。
CH3
NH2
HOOC Cl
高等有机化学 取代基效应自PPT课件
4、诱导效应强弱
诱导效应的相对强度:取决于取代基的中心原子 的电
负性 (Electronegativeties)
比氢原子相对电负性愈大,则-I效应愈强, 比氢原子相对电负性愈小,则+I效应愈强。
第12页/共94页
(1)与碳原子直接相连的原子
➢同周期的元素自左到右电负性增大,-I 增强:
第16页/共94页
例如:以乙酸为参考酸,具有X—CH2COOH通式, 由
于取代X基诱导效应pk的a 方向和X 强度不同,其pk酸a 性强弱不
同一NO2
1.68
一+N(CH3)3 1.83
一I —OH
3.12 3.83
一CN
2.46 —H
4.76
—F
2.66 —CH
4.88
—C1
2.86 一C(CH3)3 5.05
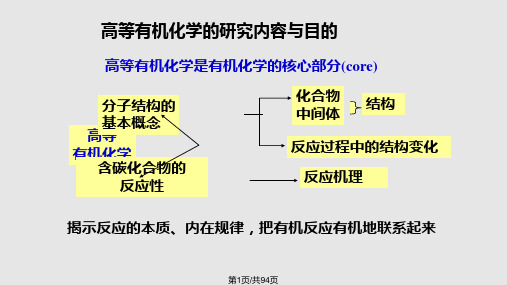
高等有机化学的研究内容与目的
高等有机化学是有机化学的核心部分(core)
分子结构的 基本概念 高等 有机化学 含碳化合物的
反应性
化合物 中间体
结构
反应过程中的结构变化
反应机理
揭示反应的本质、内在规律,把有机反应有机地联系起来
第1页/共94页
目录
第一章 取代基效应 第二章 有机反应活性中间体 第三章 饱和碳原子上的亲核取代反应 第四章 芳环上的取代反应 第五章 碳碳重键的加成反应 第六章 碳杂重键的加成反应 第七章 消除反应
但卤代烷的亲核取代反应活性却恰恰相反,实际其相 对活
性为: R—I>R—Br>R—C1 > C—F
原因:是动态诱导效应的影响。因为在同族元素中, 随原
子序数的增大电负性降低,其电子云受到核的约束也 第35页/共94页
第四章 取代基效应

O N+ O
H H H
4.6.2 自由基的稳定性 一、超共轭效应对自由基的影响 在简单烷基自由基中,人们已经发现它们的相对稳定性次序为: 叔丁基自由基 > 异丙基自由基 > 乙基自由基 > 甲基自由基。
H3C . CH3 H3C H3C H . CH3 H3C H H . H H . H
二、共轭效应对自由基的影响 与饱和碳氢化合物相比,一些具有-H的不饱和烃,如丙烯、 甲苯等,更易与卤素发生自由基取代反应。烯丙基自由基和苄基自由 基分子内存在有效的p-共轭,自由基更稳定。
2.p-π 共轭是指某一个带有孤电子对或者p电子的原子与π 轨道间进 行离域运动。
.. N N
+
X+ -
N
.. N
X+
X -
X+
X = 卤素、RO、R2N等
另一种类型的p-π共轭在碳正离子或自由基化学中经常出现。
. . . + . .
H C H H C C
+
. . . .
H C+ H C C H H H H H H
H2C CH2 + Br2 BrCH2CH2Br
+
Br2
BrH2C 1,4-加成
Br
Br
+ Br
CH2Br
1,2-加成
+
Br2
Fe
+
HBr
共轭效应可分为:1) π -π 共轭效应,2)p-π 共轭效应,3)pp共轭效应。 1.π -π 共轭是指双键(或三键)之间所发生的π 电子的离域。
H C C C O H H H H C C C+ OH H H C+ C C OH H H C C C O H H H
取代基效应.张巧燕

2.4共轭效应的相对强度
1.6动态诱导效应的比较
动态诱导效应是一种暂时的效应,不一定反映在分子的物理性质上,不能由偶极矩等物理性质的测定来比较强弱次序。比较科学、可靠的方法是根据元素在周期表中所在的位置来进行比较。
(1)在同一族元素,由上到下原子序数增加,电负性减小,电子受核的约束减小,电子的活动性、可极化性增加,动态诱导效应增强。如:
表[1–3]X—CH3中甲基的δ值:
X
δ
X
δ
—NO2
4.28
—N(CH3)2
2.20
—F
4.26
—I
2.16
—OH
3.47
—COCH3
2.10
—Cl
3.05
—COOH
2.07
—Br
2.68
—CN
2.00
—SH
2.44
—CH3
0.90
C6H5
2.30
H
0.23
1.4动态诱导效应
静态诱导效应,是分子本身所固有的性质,是与键的极性及其基态时的永久极性有关的。当某个外来的极性核心接近分子时,能够改变共价键电子云的分布。由于外来因素的影响引起分子中电子云分布状态的暂时改变,称为动态诱导效应,用Id表示。
(3)对反应速率的影响
[例]羰基的亲核加成反应,羰基碳原子的电子云密度越低,就越容易和亲核试剂发生加成反应,在这种情况下,分子所需要的活化能就比较小,容易进入活化状态,因而反应速率较大。故取代基的–I效应愈强,愈有利于亲核加成;取代基的+I效应愈强,对亲核加成愈不利。
1取代基效应精讲

SN1
F-张力:两者在相互接近过程中,基团位阻导致相 R' 互排斥作用 Face strainR CH3
R R N B R' R'
N
CH3
I-张力:来自于分子内部的牵制力,导致反应过程受 阻,Internal strain
60°
109 °28′
R X R
60°
120 °
2.1 取代基效应
Substituent Effects
有机化学反应的本质 旧键的断裂,新键的生成。
H HCH 共价键:电子对的共用 原子间由于 H covalent bond
H H C H
H 成键电子的 原子轨道重 叠而形成的 本质是通过电子将原子核联系在一起的力。 化学键 H H
H C Br + OH H
pKa
4.82
CH3COOH
2.84
ClCH2COOH
4.06
Cl2CHCOOH Cl3COOH
4.52
pKa
4.76
2.86
1.29
0.65
加和性 B:电子是定域的 电子就在两个原子之间
3. 诱导效应的相对强度
中心原子电负性的大小
中心原子在元素周期表中的位置
规则 -I periodic table of elements
O N O
CH3 NO2
pKa
8.24
7.16
O C OH
× √
O C OH CH3 C CH3 CH3 pKa1 >
CH3
pKa2
当甲基在邻位时,把硝基 挤出了与苯环所在平面, 硝基的 -C效应消失。
2. 反应活性的解释
构象翻转
R EtOH + H C Br H
有机化学基础知识点有机物的取代基效应和共振效应

有机化学基础知识点有机物的取代基效应和共振效应有机化学是研究含碳的化合物及其反应的一门学科。
在有机化学中,有机物的取代基效应和共振效应是两个重要的基础知识点。
本文将详细介绍这两个效应及其在有机化学中的应用。
一、取代基效应取代基效应指的是有机物中取代基对反应速率、反应路径和产物稳定性的影响。
取代基的性质和位置对有机物的物理性质和化学性质都有很大影响。
1. 取代基的电子效应取代基的电子效应可以分为两类:正电子效应和负电子效应。
正电子效应是指取代基释放电子,使体系具有更大的正电荷。
常见的正电子效应有烷基效应和烯基效应。
相反,负电子效应是指取代基吸引电子,使体系具有更大的负电荷。
常见的负电子效应有氨基效应和亚硝基效应。
2. 取代基的空间位阻效应取代基的空间位阻效应主要体现在反应速率和反应路径上。
空间位阻较大的取代基会阻碍反应物的接近,从而减慢反应速率。
此外,取代基的位置也会影响反应路径,导致不同的产物生成。
3. 取代基的共轭效应取代基通过π-电子共轭作用可以影响有机物的电荷分布和稳定性。
共轭效应可以加强或减弱有机物的碳碳双键或碳碳单键的稳定性。
常见的共轭效应有芳香性和共轭酮效应。
二、共振效应共振效应是指有机物中通过共振作用在不同结构之间分配电子密度,从而影响其物理性质和化学性质。
共振效应可以使某些分子更稳定,同时也可以调整反应的速率和产物的选择。
1. 共振结构的形成共振结构是通过共振现象形成的不同电子排布的结构。
共振结构之间仅仅是电子排布的不同,而分子实际上并不是在这些结构之间跳跃。
共振结构的形成可以通过共振杂化来解释。
2. 共振效应的作用共振效应可以调整有机物的稳定性和极性。
共振结构中的不同电荷分布会影响分子的稳定性,使其更耐高温和高压。
共振效应还会影响有机物的酸碱性和亲核性,从而改变其反应性质。
三、应用示例1. 取代基效应在药物研发中的应用药物研发中常常需要调整药物的活性和毒性。
通过在药物结构中引入不同的取代基,可以改变药物的性质,提高其生物利用度和靶向性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C2H5O-
+ RBr
ROC2H5
+
NaBr
4.6 取代基效应对有机化合物性质的影响 4.6.1 酸碱性 根据Bronsted酸碱定义,能提供质子的物质为酸,能接受质子 的物质为碱。酸碱强度取决于它们提供或接受质子的能力。 一、诱导效应对酸碱的影响
乙酸是弱酸(pKa=4.76),当乙酸分子中的α -H被电负性比氢 强的氯原子取代后,会使整个分子的电子云向氯原子偏移,结果引起 羟基中氢原子周围电子云密度下降,酸性增强。事实上,氯乙酸的pK a为2.86,酸性明显比乙酸强。
有强拉电子诱导效应的代表性取代基包括三氟甲基和三氯甲基。 氯甲基、甲氧基甲基等属于有弱拉电子诱导效应的取代基。 仅有诱导效应的给电子取代基较少,主要是一些电负性小于氢 原子的原子团,如三烷基硅基等。
二、共轭效应对碳正离子的影响 对乙烯基和苯基型不饱和基团,它们与碳正离子相连接的碳原 子属于sp2杂化,电负性高于sp3杂化的饱和碳原子,因此会显示出弱 的拉电子诱导效应。另一方面,这些基团的体系与碳正离子的p轨道 间会产生强给电子的p-共轭效应。
H2C CH2 + Br2 BrCH2CH2Br
+
Br2
BrH2C 1,4-加成
Br
Br
+ Br
CH2Br
1,2-加成
+
Br2
Fe
+
HBr
共轭效应可分为:1) π -π 共轭效应,2)p-π 共轭效应,3)pp共轭效应。 1.π -π 共轭是指双键(或三键)之间所发生的π 电子的离域。
H C C C O H H H H C C C+ OH H H C+ C C OH H H C C C O H H H
-
O N+ -
-
O N+
O
O
-
O
此外,一些价电子层存在空轨道的原子,如硼(2p)、硅(3 d),与碳负离子直接连接,也可以发生负电荷的离域作用,使碳负 离子稳定性增加。
本章总结
取代基主要通过电子诱导效应、电子共轭效应以及立体效应对分子的结 构和性能施加影响。诱导效应和共轭效应是重点,共轭效应是难点。 诱导效应 特点:沿着键传递,离得越远影响越小。 吸电子诱导效应:电负性比碳原子电负性大的取代原子和基团,如卤素 -X、-OH、-OR、-NH2、-NR2、-NO2、-CN、-CO、-COOR、 -C=C、-C≡C、苯基等均具有吸电子的诱导效应。 给电子的诱导效应:电负性比碳原子电负性大,常见的有-SiR3、-BR2 等。
O H3C H + Br Br O H3C H Br Br
OH + Br2 Br
OH + HBr
4.5 立体效应 由于分子内各个原子或基团的空间体积,使分子的结构和性能 产生变化的效应称为立体效应。
4.5.1 立体效应对分子本身结构的影响
二个苯环直接相连时,通常会处于同一分子平面中,这样有利 于相互间产生共轭作用。但是,一旦苯环邻位上的氢原子被其它体积 较大的基团取代后,为了避开这些基团间的立体排挤作用,二个苯环 常处于不同平面中。
. H H . H H
4.6.3 碳正离子稳定性 一、诱导效应对碳正离子的影响 以甲基正离子为参照物,氢原子被其它拉电子的取代基替代后, 碳正离子的稳定性降低,反之亦然。例如,稳定性的大小次序为:
H + Si(CH3)3 H > H H + H > ClH2C ClH2C + CH2Cl > F F + F
二、共轭效应对碳负离子的影响 共轭效应对碳负离子的稳定性影响很大。一般来说,碳负离子 与不饱和基团相连时,因两者间存在强烈的p-共轭作用,分子内负 电荷可以产生有效的离域,稳定性明显提高。缺电子的不饱和基团, 如硝基、羰基和氰基等,对负电荷的稳定化作用要明显高于富电子的 苯基和乙烯基。
R O
-
R
+
H
C
C
C H
H
H
CH2+
+
CH2
+
CH2
+
CH2
CH2
3. p-p共轭是指一个缺电子的p轨道与含有一对电子(n电子)的p轨 道间产生的共轭离域作用。
O H3C
CH2+
+O H3C
CH2 H3C
O
CH2
O H3 C
..
+
事实上,碳正离子与N,O和S等含有孤电子对的原子相连时,稳定 性明显会提高。
2.p-π 共轭是指某一个带有孤电子对或者p电子的原子与π 轨道间进 行离域运动。
.. N N
+
X+ -
N
.. N
X+
X -
X+
X = 卤素、RO、R2N等
另一种类型的p-π共轭在碳正离子或自由基化学中经常出现。
. . . + . .
H C H H C C
+
. . . .
H C+ H C C H H H H H H
H3C + CH3 H3C > H3C H3C + H > H H + CH3 > H H + H
4.6.4 碳负离子稳定性 一、诱导效应对碳负离子的影响 电负性原子或原子团与碳负离子相连,可以使碳原子上的负电 荷密度有所降低,热稳定性提高。例如:
CHCl3
+
NaOH
Na+ CCl3 - +
H2O
《清明》 [唐] 杜牧 清明时节雨纷纷, 路上行人欲断魂。 借问酒家何处有?
牧童遥指杏花村。
《取代基》 Байду номын сангаас21世纪] 郑炎松
取代基团乱纷纷,
电子效应是其魂。
给吸电子何处有?
共轭诱导两效应。
2.共轭效应
特点:极性沿着共轭键相隔一个碳原子传递,距离对极性大小没有影响。
π -π 双键共轭效应。
p-π 共轭效应,双键π 轨道和p轨道的共轭, p轨道是孤电子对、正电 荷、负电荷或者自由基(未配对电子)所在的轨道。 p-p共轭效应。一个P轨道为孤电子对所在的轨道,另一个p轨道为正电 荷、负电荷或者自由基所在的轨道。 超共轭效应,是轨道和p轨道的共轭,用于解释按甲基、乙基、异丙基、 叔丁基顺序,其正离子、自由基、甚至负离子越来越稳定,解释按照上 述顺序给电子效应越来越强。 当共轭效应与诱导效应的给吸电子相反时,一般由共轭效应决定。
H H H H H H C+
H H H H
H C+ H H
H H H H
H C+ H H H H + C H H
H H H
+ C H H H H
H H H
H
H + C H H H H H H
+ C H
H
+ H C H
H
H
4.4 动态诱导极化效应 当非极性分子与具有永久偶极矩的极性分子相互接近时,会发生 诱导极化,形成瞬时诱导偶极, 所以这种现象被称为动态诱导极化。 原子半径较大的原子易发生动态诱导极化。 分子间的诱导极化产生的瞬时偶极矩,会引起原来不带电荷的 原子的反应性产生显著变化,这种作用称为动态诱导极化效应。例如, 溴与苯酚的反应在非极性的四氯化碳中十分缓慢,但在极性的水或甲 醇中很快进行。
Br Si(CH3)3
4.2
电子的离域与共轭效应 乙烯分子而言,π 键的两个p电子的运动范围局限在两个碳原子 之间,这叫做电子的定域运动。对1,3-丁二烯而言,两个π 键以单 键相连接后,一个经典π 轨道中的电子就会运动到另一个经典的π 轨 道中去,这种现象叫做电子的离域(delocalization)。
H H COOH H3C
H2N H H COOH
4.5.2 立体效应对分子的稳定构象的影响 当一个有机分子中的各基团绕C-C 单键旋转时,两个碳原子上的三个基 团间的空间距离会发生显著变化,这就产生了所谓的最低能量构像的问题。 对简单分子而言,其最低能量状态可以由构像分析来确认。例如,反-1,4二甲基环己烷的最低能量状态为(I)而不是(II)。
H H H H
+
+
同样,对于其他基团要看两种效应的叠加结果 :
Cl
+
H Br H +C < -I
+
H H
O R
+
OR H O H
+
H H
N
+
H H
N
+
H S H
+
H H
O
+
H H
+C < -I
+C > -I
三、超共轭效应对碳正离子的影响
对一些简单的烷基碳正离子,其稳定性与中心碳原子所连接的 烷基的性质和数目有关。叔丁基正离子的稳定性高于甲基正离子的稳 定性的主要影响因素是空p轨道与位C-H 键间的超共轭效应。
4.3 超共轭效应 超共轭效应(hyperconjugation)又称 σ -π 或σ -p共轭,主 要是指由一个碳氢σ 成键轨道与邻近的π 轨道或空p轨道互相重叠而 产生电子部分离域的一种共轭现象。
H + H 甲基正离子 H H H + .. H H H
乙基正离子
简单碳正离子的稳定性顺序为:
叔丁基正离子 > 异丙基正离子 > 乙基正离子 > 甲基正离子。
Cl O O H
