10原子吸收法
原子吸收光谱法

低温原子化法:低温原子化法也称为化学原子化法 ,包括冷原子化法和氢化物发生法。
一般冷原子化法与氢化物发生法可以使用同一装置 。
冷原子化法:直接测量Hg 氢化物发生法:氢化物发生器生成金属或类金属元
素氢化物,进入原子化器。
第四节 干扰及其消除方法
物理干扰:由于溶液的物理性质(如粘度、表面张力、密度和蒸 气压等)的变化引起的试液抽吸过程、雾化过程和蒸发过程的比 例不同。消除物理干扰的主要方法是配制与被测试样相似组成的 标准溶液,或采用标准加入法。
电离干扰:在高温下,原子电离成离子,而使基态原子数目减少 ,导致测定结果偏低,此种干扰称电离干扰。消除办法是向试液 中加入过量比待测元素电离电位低的其他元素(通常为碱金属元 素)。例如,测钙时可加入过量的KCl溶液消除电离干扰。钙的 电离电位为6.1eV,钾的电离电位为4.3eV。由于K电离使钙离子 得到电子而生成原子。
{ C2H2:空气
> ¼ 富燃火焰 ≈¼ 中性火焰 化学计量火焰
< ¼ 贫燃火焰
根据燃气和助燃气的种类不同常用的有以下火焰:
乙炔-空气火焰; 氢-空气火焰; 乙炔-氧化亚氮火焰。
① Al,Ti,Ta,Zr等易形成难解离氧化物,不宜使用
② As 193.64,197.20nm;Se 196.09nm 不易使用 乙炔—空气火焰 是原子吸收测定中最常用的火焰,该火焰 燃烧稳定,重现性好,温度较高,可达23000C ,对大多数元
化学干扰:被测元素与共存组分发生化学反应,生成更稳定的 化合物,影响被测元素的原子化。由于PO43-的存在,钙与其形 成了磷酸钙、焦磷酸钙等化合物,这些化合物其键能很高,在 火焰中不易分解产生钙原子,结果偏低。消除方法:加入干扰 抑制剂的方法,如加入锶盐后Sr与PO43-反应生成比磷酸钙更加 稳定的化合物,从而释放出钙原子,消除了磷酸根离子对钙的 干扰。
原子吸收光谱法
15:35
(2)谱线的热变宽 又称多普勒( Doppler )变宽,它是由于原子在空间 作热运动而引起的。
从物理学原理可知,从一个运动的原子发出的光,如果运动方 向离开观察者,则在观察者看来,其频率要比静止原子所发出 的光频率低,反之,如果原子向着观察者运动,则其频率要比 静止原子发出的光的频率高,这就是多普勒效应。 原子吸收分析法中,气体中的原子是处于无规则热运动中,有 的向着检测器方向运动,使光能增大,波长变短一点。有的背 向检测器运动,光能减弱,波长变长一点,一长一短,使谱线 变宽。这种频率分布和气体中原子的热运动的速度分布相符。
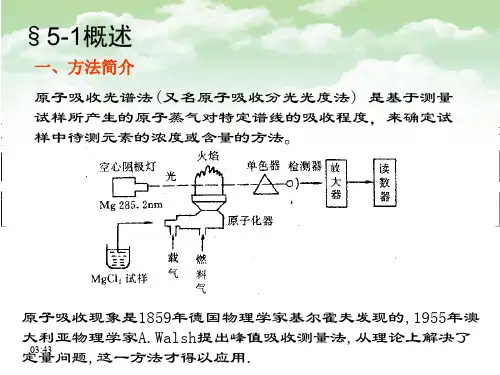
§5-1概述
一、方法简介 原子吸收光谱法 (又名原子吸收分光光度法 ) 是基于测量 试样所产生的原子蒸气对特定谱线的吸收程度,来确定试 样中待测元素的浓度或含量的方法。
原子吸收现象是1859年德国物理学家基尔霍夫发现的,1955年澳 大利亚物理学家A.Walsh提出峰值吸收测量法,从理论上解决了 15:35 定量问题,这一方法才得以应用.
1.14 10 4
从以上计算可以看出,与基态原子数相比,激发态原子数可忽 略不计。
即 N0≈N总
由此我们可以得到结论: (1)基态原子数等于总原子数。
15:35 ( 2)原子吸收法受温度影响不大。
二、吸收轮廓及变宽原因 1.吸收轮廓 从能级跃迁的观点看,吸收线与发射线应是一条严格的几何线, 但实际上是有一定宽度的。我们把吸收线或发射线的强度按频 率的分布叫谱线轮廓。如图5-2所示。 图中最大吸收对应的 频率 ν 0 称为峰值吸收
15:35
§5-2 原子吸收法的基本原理 一、基态原子数与火焰温度的关系 根据热力学原理,在一定温度下达到热力学平衡状态时,基态 和激发态的原子数之比与热力学温度的关系,可以用玻尔茨曼公 式描述: E j E0
原子吸收光谱法(AAS)

局限性:测不同的元素需不同的元 素灯,不能同时测多元素,难熔元 素、非金属元素测定困难。
原子吸收光谱法基本原理
1.原子的能级与跃迁
基态第一激发态,吸收一定频率的辐射能量。 产生共振吸收线(简称共振线) 吸收光谱 激发态基态,发射出一定频率的辐射。 产生共振吸收线(也简称共振线) 发射光谱
原子吸收光谱法基本原理
A kc
原子吸收分光度计
原子吸收分光度计
原子吸收分光度计
光源
原子化器
单色器
检测系统
思考:光学系统(单色器)为什么在原子化器和检 测系统之间?
光 源
提供待测元素的特征光谱。获得较高的 灵敏度和准确度。 光源应满足如下要求; (1)能发射待测元素的共振线; (2)能发射锐线; (3)辐射光强度大,稳定性好。
2.元素的特征谱线
(1)各种元素的原子结构和外层电子排布不同 基态第一激发态:
跃迁吸收能量不同——具有特征性。
(2)各种元素的基态第一激发态
最易发生,吸收最强,最灵敏线。特征谱线。
(3)利用原子蒸气对特征谱线的吸收可以进行定量分析
原子吸收光谱法基本原理
从光源发射出具有待测元素特征 谱线的光,通过试样蒸气时,被蒸气 中待测元素的基态原子所吸收,吸收 的程度与被测元素的含量成正比。故 可根据测得的吸光度,求得试样中被 测元素的含量。
将待测试样在专门的氢化物生成器中产生氢
化物,送入原子化器中检测。
单色器
•作用:将待测元素的吸收线与邻近线分开
•组件:色散元件 ( 棱镜、光栅 ) ,凹凸镜、 狭缝等
检测系统
•作用: 将待测元素光信号转换为电信号, 经放大数据处理显示结果。 •组件: 检测器、放大器、对数变换器、显 示记录装置。
原子吸收光谱法

影响吸收谱线轮廓的主要因素
• 自然变宽N:与原子发生能级跃迁时激发态原 子的寿命有关, N一般情况下约10-5 nm。 • 多普勒变宽(热变宽)D: 由原子在空间作 无规热运动引致的, D约为10-3 nm。
D 7.16 10 0
7
T Ar
• 碰撞变宽(压力变宽) C 洛伦兹变宽L :由待测原子与其他共存元素
• 富燃火焰(还原火焰)
燃助比大于化学计量数, 如燃助比为
1:3的乙炔-空气。 此类火焰中有大量燃气未燃烧完全, 而含有较多的C-、CH-基等。因此火焰 温度较低, 且具有还原性, 适于有些易 形成难离解氧化物的元素的测定。
• 贫燃火焰(氧化火焰)
燃助比小于化学计量数, 如燃助比为 1:6的乙炔-空气。 此类火焰氧化性强, 温度较低, 适于 易离解、易电离的元素的测定, 如碱 金属。
• 石墨管
长约50mm,内径5mm, 管中央有一小孔,用以放臵试 样。
K0 2 D ln 2 e
2
mc
fN 0
• 吸收线半宽度: 一般在0.01~0.1Å • 发射线半宽度: 一般在0.005~0.02
Å
实际测量(测量吸光度)
• 根据光吸收定律
A lg T lg I I0 A为 吸 光 度 ; T 为 透 光 率 ; I 为 透 射 光 强 度 ; I 0为 入 射 光 强 度 ; K 为 吸 收 系 数 ; l为 蒸 气 厚 度 将 K 用 K 0代 替 , 可 得 A lg e 又 K0 2 D
仪器组成系统
• • • • 光源 原子化系统 单色器 检测系统和数据处理与控制系统
光源
• 要求 (1)能发射待测元素的共振线; (2)能发射锐线; (3)辐射光强度大、稳定性好且谱线背景小; (4) 操作方便、经久耐用。 • 原子吸收分光光度计的光源通常是空心阴 极灯。
原子吸收法的基本原理

原子吸收法的基本原理
原子吸收法是一种常用的分析化学技术,用于测定样品中金属元素的含量。
其基本原理是利用金属元素在特定波长的光线照射下的吸收特性来进行分析。
该方法的基本步骤包括样品的预处理、原子化和光谱测量。
首先,样品需要经过适当的预处理方法,如溶解、转化或分离,以得到含金属元素的溶液。
然后,通过使用特定的设备,将溶液中的金属元素原子化,使其转变为自由态的金属原子。
这可以通过火焰、石墨炉或冷原子化等方法来实现。
接下来,选择特定波长的光线照射原子化后的金属元素。
这些光线被称为谱线,每种金属元素都有与之相关的特定谱线。
当这些谱线通过样品溶液时,金属元素原子会吸收特定波长的光线,而非金属元素不会吸收这些光线。
最后,通过光谱仪器测量通过样品溶液的光线强度的变化。
测量结果显示出金属元素吸收光线的特征峰,其强度与金属元素的含量成正比。
通过与已知浓度的标准溶液比较,可以确定样品中金属元素的含量。
原子吸收法的优点包括高灵敏度、良好的选择性和准确性。
然而,该方法要求样品溶液中金属元素的浓度在分析范围内,且不受其他成分的干扰。
因此,在使用原子吸收法进行分析时,需要对样品进行适当的前处理和分离。
原子吸收法基本原理

原子吸收法基本原理
原子吸收法是一种常用的分析技术,用于测定溶液中特定元素的浓度。
其基本原理是利用原子吸收光谱仪测量样品中原子的吸收光强度,从而推断出元素的浓度。
在原子吸收方法中,首先将待测样品溶解或稀释成适当的浓度。
然后,通过火焰或电热等方法将样品中的元素原子化,使其转化为气态。
接下来,通过将光源传递的特定波长的光束通过原子化的样品中,测量经过样品的光传输前后的光强度变化。
当特定波长的光束通过样品时,如果样品中存在测定元素的原子,在特定波长的吸收线上,原子会吸收光束的能量。
这导致光束透射过程中的光强度发生变化。
利用光电倍增管或其他探测器,可以测量光强度的变化,并转化为浓度的数值。
为了实现准确测量,需要进行校正并控制样品中其他干扰物的影响。
校正可以通过使用标准参考物质,即已知浓度的标准溶液,制备一系列已知浓度的标准曲线。
通过比较待测样品对吸收光强度的测量值与标准曲线上对应浓度的光强度,可以计算出待测样品中元素的浓度。
此外,在一些特殊情况下,也可以采用其他技术和仪器进行原子吸收的分析,例如非火焰原子吸收光谱法、射频等离子体发射光谱法等。
总之,原子吸收法通过测量待测样品中元素原子对特定波长光束的吸收能力,来推测样品中元素的浓度。
通过校正和比对标
准曲线,可以实现精确测定。
这是一种常用且有效的分析技术,广泛应用于环境监测、食品安全、冶金等领域。
原子吸收法的定量关系式
原子吸收法的定量关系式原子吸收法是一种常被用于测定痕量金属元素浓度的分析技术。
它基于原子吸收光谱原理,并且可以利用光的吸收强度与待测物质浓度之间的定量关系。
在原子吸收法中,首先需要将样品原子化,通常使用火焰或电弧进行原子化。
然后,通过光源(通常是一束白炽灯或者是一束特定的原子发射光谱的气体放电灯)照射样品原子化的区域。
原子化的样品吸收光源中特定波长的光,发生吸收现象。
被吸收的光强度与待测金属元素的浓度成正比。
原子吸收光谱仪通常由光源、样品室和光探测器组成。
光源发出特定波长的光进入样品室,经过样品原子化后进入光探测器。
光探测器测量光的强度,然后将结果转化为浓度值。
原子吸收法的定量关系可以通过比尔—朗伯定律来描述。
比尔—朗伯定律表达了光强度与浓度之间的关系,它可以表示为下面的公式:A = εbc其中,A是吸光度,表示被吸收的光与入射光之间的相对减小,ε是摩尔吸光度(molar absorptivity),c是物质的浓度,b是光程(样品的物质相对于光来源之间的距离)。
摩尔吸光度(molar absorptivity)是一个常数,它表示每摩尔物质对特定波长的光的吸收程度。
是一个取决于特定物质和特定波长的常数。
根据比尔—朗伯定律,我们可以得到下面的关系式:c = A /( εb)也就是说,物质的浓度可以通过测量吸光度,并将其除以摩尔吸光度和光程来计算。
在实际应用中,我们通常使用标准曲线法来测量待测物质的浓度。
标准曲线法是通过测量一系列已知浓度的标准溶液的吸光度,构建吸光度与浓度之间的曲线。
然后,通过测量待测样品的吸光度,可以根据标准曲线找到相应的浓度值。
这样,我们可以通过测量吸光度来定量分析待测样品中金属元素的浓度。
总结起来,原子吸收法的定量关系式可以通过比尔—朗伯定律来描述。
比尔—朗伯定律表达了光强度与物质浓度之间的关系,其中摩尔吸光度是一个常数,表示每摩尔物质对特定波长的光的吸收程度。
实际应用中,我们通常使用标准曲线法来测量待测物质浓度,通过测量吸光度并利用标准曲线求取浓度值。
原子吸收法测定
原子吸收法测定原子吸收法是一种常用的分析方法,用于测定样品中的金属元素含量。
该方法具有灵敏度高、准确度高、抗干扰能力强等优点,被广泛应用于地质、环境、食品等领域。
本文将介绍原子吸收法测定样品的过程,包括样品制备、仪器调整、标准曲线制作、样品测定、结果计算、数据处理和报告等方面。
一、样品制备在进行原子吸收测定前,需要对样品进行制备。
制备过程包括样品粉碎、称重、溶解等步骤。
样品制备的目的是将待测元素从样品中分离出来,并转化为适合原子吸收仪测定的溶液形式。
在制备过程中,需要注意避免样品污染和损失,确保样品的代表性和准确性。
二、仪器调整在进行样品测定前,需要对原子吸收仪进行调整和校准。
调整内容包括燃烧器高度、光路对中、背景校正等。
校准过程中需要使用标准参考物质,对仪器进行线性校准,确保仪器测定的准确性和可靠性。
此外,还需要对仪器进行日常维护和保养,确保仪器的正常运行和使用寿命。
三、标准曲线制作标准曲线是原子吸收测定中非常重要的环节之一。
通过制作标准曲线,可以确定待测元素的线性关系,为后续的样品测定提供参考依据。
标准曲线的制作方法是,将已知浓度的标准溶液分别进行测定,得到相应的吸光度值,然后绘制吸光度值与浓度之间的关系图,得到标准曲线。
四、样品测定在样品制备和仪器调整完成后,可以进行样品测定。
将制备好的样品溶液放入原子吸收仪中,按照仪器操作规程进行测定。
在测定过程中需要注意控制试样浓度、干扰物质的影响等因素,以确保测定结果的准确性和可靠性。
五、结果计算通过对样品测定得到的吸光度值进行计算,可以得到待测元素的含量。
具体计算方法是,根据标准曲线得到的线性关系方程式,将样品溶液的吸光度值代入方程式中,计算得到待测元素的浓度值。
六、数据处理和报告在得到待测元素的浓度值后,需要进行数据处理和报告整理。
数据处理包括数据的统计、误差分析、方法比较等方面。
通过对数据的处理和分析,可以进一步评估原子吸收法测定结果的可靠性和准确性。
第十章原子吸收光谱
原子吸收与分光光度法的比较
项目 原子吸收法 分光光度法
分析原理
相 同 能级
吸收原理
电子跃迁
吸收原理
电子跃迁
定量分析的依据
光谱
A=kbc
原子光谱
A=kNb(A=KC)
分子光谱
不 同
光源
单色器位置
锐线光源
原子化器和 检测器之间
连续光源
光源和吸收池 之间
光 谱 法
按能量交换方向分
按作用结果不同分
吸收光谱法 发射光谱法 原子光谱→线状光谱 分子光谱→带状光谱
电磁波谱区
波谱区
Γ射线区 X 射线区 远紫外区 近紫外区 可见光区 近红外区
波长范围
<0.005nm 0.005-10nm 10-200nm 200-400nm 400-780nm 0.78-2.5µ m
试 样 预混合室 废液排放口
雾化器
非火焰原子化装置 (1)石墨炉原子化器 测定过程:①干燥阶段,②灰化阶段, ③原子化阶段,④烧净阶段
(2)氢化物原子化器
分光系统
组成: 分光系统:由色散元件、凹面镜和狭缝组成 作用: 将待测元素的共振线与邻近谱线分开 单色器的位置: 放在原子化器后的光路中
检测系统
10-2原子吸收光谱法的基本原理
共振线和吸收线: 共振线吸收线:
电子从基态跃迁到能量最低的激发态为共振跃迁, 所产生的谱线
共振线发射线:
当电子从第一激发态跃会基态时,则发射出同 样频率的谱线
特征谱线:
各种元素的原子结构和外层电子排步不同,不同元素 的原子从基态 第一激发态时,吸收和发射的能量 不同,其共振线不同,各有其特征性.
D 7.162 10 0
原子吸收光谱法
返回
36
续前
应用:As、Sb、Bi、Sn、Ge、Se、Pb、Ti等
原理:在酸性介质中,与强还原剂硼氢化钠 反应生成气态氢化物。例 AsCl3 +4NaBH4 + HCl +8H2O = AsH3 +4NaCl +4HBO2+13H2 将待测试样在专门的氢化物生成器中产生氢 化物,送入原子化器中检测。 特点:原子化温度低 ;灵敏度高(对砷、硒 可达10-9g);基体干扰和化学干扰小
e
E kT
Pj P0
e
h kT
上式中Pj和 PO分别为激发态和基态的统计权重,激发态原子数 Nj 与基态原子数 No 之比较小 ,<1%. 可以用基态原子数代表待测元素 的原子总数。公式右边除温度T外,都是常数。T一定,比值一定。
三、原子吸收法的测量
(一) 积分吸收测量法
钨丝灯光源和氘灯,经分光后,光谱通带0.2mm。而原子 吸收线半宽度:10-3mm。如图: 若用一般光源 照射时, 吸 收光的强度变化仅为 0.5% 。灵 敏度极差。 理论上:
2 . 峰值吸收测量
I0 A lg I
I0
e
0
I 0 d ;
e
I
e
0
I d
将 It=I0e-Kvb 代入上式:
则: A lg
I
0
I 0 e-K Ld
e
e
0
I 0 d
0
I 0 e -K Ld
采用锐线光源进行测量,则
I0 2 π ln 2 e 2 A lg 0.434 K 0 b 0.434 N0 f b I v D mc 峰值吸收系数: 2 π ln 2 e 2 K 0 0.434 N0 f v D mc A = k N0 b N0 ∝N∝c ( N0吸收辐射的基态原子数,N原子数,c 待测元素浓度)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
注意! 目前尚不能准确测定半宽度较小的积分值。
2020/3/22
青岛理工大学
11
2、峰值吸收:
条件:仅考虑多普勒变宽。
K0
2
ln D
2
e2 mc
N
f
意义 若测定温度不变,D为常数,对一定待测元素,
f亦为常数。
因此,在T<3000K时,K0∝N(正比关系)。
关键 测出K0值。 必须使用“锐线光源”。
青岛理工大学
9
表:10-1 列出几种元素的共振线的Nj∕N0值。
物理意义 Nj/N0值是比较小的【小于1%】, 可认为基态原子数实际代表待测元素的原子总数。
2020/3/22
青岛理工大学
10
三、原子吸收光谱法的定量基础
1、积分吸收
条件:原子蒸气所吸收的全部能量 (吸收线下所包括的整个面积。)
e2
表示 火焰蒸发和分解不同化合物的能力
(1)air-C2H2(常用)
火焰的类型 (2)N2O-C2H2(常用)
(3)air-H2
注 意
(1)火焰的类型关系到测定的灵敏度、 稳定性、干扰等;
(2)对不同的元素应选用不同的恰当的火焰。
2020/3/22
第十章 原子吸收分光光度法
2020/3/22
青岛理工大学
1
原子吸收光谱法
又名原子吸收分光光度法,简称原子吸收分 析法。基于测量蒸气中基态原子对特征电磁辐射 的吸收,以测定化学元素的方法。
关键
① 空心阴极灯发射特征谱线; ② 试样蒸气吸收特征谱线而使其减弱; ③ 测定特征谱线减弱程度。
2020/3/22
2020/3/22
青岛理工大学
15
1. 光源 :
作用
发射待测元素可吸收的特征谱线,供吸收测量用。
材料
用不同元素作阴极材料的空心阴极灯作光源。
要求
(1)能发射待测元素的共振线; (2)能发射锐线; (3)辐射光强度要足够大,稳定性要好。
2020/3/22
青岛理工大学
16
空心阴极灯
2020/3/22
E3
1、共振线
E2
(1)定义:
E1
共振发射线
E0
电子从基态跃迁到能量最低的激发态(称为第 一激发态)时要吸收一定频率的辐射,它再跃 回基态时,则发射出同样频率的辐射,对应的 谱线称为共振发射线(简称共振线) 。
共振吸收线
电子从基态跃迁至第一激发态所产生的吸收谱线
称为共振吸收线(简称共振线) 。
2020/3/22
玻茨曼分布定律: N0 P0
e Nj Pj
kT
Ej E0
物理意义
在一定温度下,当处于热力学平衡时,激发态 原子数与基态原子数之比服从玻茨曼分布定律。
玻茨曼分布定律在AAS中的应用:
对共振线来说,电子从基态(E0=0)跃迁到第一激发态, 因此可得到激发态原子数和基态原子数之比,即:
2020/3/22
青岛理工大学
4
(2)特点: 元素的特征谱线。
(3)共振线是元素所有谱线中最灵敏的谱线。
(基态 ←-→ 第一激发态跃迁较易。)
2020/3/22
青岛理工大学
5
2、共振吸收的朗伯定律:
同有色溶液吸收电磁辐射的相似
b
Itr I0 eK b
I0
Itr
原子蒸气
图10—2 原子吸收示意图
其中:Kν:原子蒸气对频率为ν的电磁辐射的吸收系数; I0:入射光强度; Itr:透射光强度; b:电磁辐射通过原子蒸气的吸收程长度;
青岛理工大学
2
§10-1 原子吸收光谱法的基本原理
基本原理:
原子(n=1)
(基态)
吸收能量 辐射能量
激发态(n >1)
原子吸收光谱法就是利用从光源发射出的共振发射线, 被待测元素所吸收,根据发射线被吸收后减弱的程度来 确定待测元素含量。 A = K´C
2020/3/22
青岛理工大学
3
一、共振线和吸收线
2020/3/22
青岛理工大学
12
使用“锐线光源”的原 因
为了测量K0值,必须: (1)使光源的发射线的中心频率与吸收线的中心频率一致;
(2)发射线的半宽度必须比吸收线的半宽度小得多。
必须使用“锐线光源”。
2020/3/22
青岛理工大学
13
3、实际测量方法:
条 件
(1)基态原子数实际代表待测元素的原子总数。 (玻茨曼分布定律)。
(2)由“锐线光源”,元素一定,一定,则K0 ~
K
∴
A
lg Itr I0
0.434K 0
b
= 0.434 2 ln2 e2 N f b
D m c
=K.N(C).b
=K′.C
2020/3/22
青岛理工大学
14
§10-2 原子吸收分光光度计
光源 原子化系统 分光系统 光电倍增管 读数系统
2020/3/22
青岛理工大学
6
吸收线轮廓:
常用吸收系数Kν随频 率(或波长)的变化
曲线。
表征吸收线轮廓的值
①吸收线的中心频率(或中心波长);
②吸收线的半宽度。
2020/3/22
青岛理工大学
7
吸收线宽度的影响因素:
在通常的原子吸收光谱法的条件下:
(1)吸收线的轮廓主要受多普勒变宽和劳伦兹变 宽的影响。
2020/3/22
青岛理工大学
19
2、燃烧器:
2020/3/22
青岛理工大学
20
预混合型燃烧器的优、缺点:
优点 缺点
(1)产生的原子蒸气多; (2)火焰稳定; (3)背景较小且比较安全。
雾化效率低。
3、火焰:
作用
提供一定的能量,促使试液雾滴蒸发、 干燥并经过热离解或还原作用,产生 大量的基态原子。
(2)当共存元素原子浓度很小时,吸收线变宽主 要受多普勒变宽的影响。
多普勒变宽:
D 7.162 107 0
T Ar
待测元素原子的相对原子质量(Ar)越小, 温度(T)越高,则吸收线轮廓变宽越显著。
即: Ar , T ,则吸收线轮廓变宽越显著。
2020/3/22
青岛理工大学
8
二、基态原子数和激发态原子数的关系
青岛理工大学
17
2. 原子化系统:
作用:
将待测溶液在高温下气化为原子蒸气(基态 原子), 吸收光源发射出的特征谱线。 原子化方法
火焰法: 无火焰法(石墨炉法):
2020/3/22青岛理工大学18来自(一)火焰原子化装置:
1. 雾化器: 作用:将试液雾化 要求:喷雾稳定、雾滴小而均匀、雾化效率高。
仪器:同心型雾化器
2020/3/22
青岛理工大学
21
火焰温度
只要能够使待测元素解离成游离基态原子 即可。
使用规律
(1)低温:易挥发,电离电位较低的元素; Eg. Pb、Cd、Zn、Sn、碱金属
(2)高温:与O2生成耐高温氧化物或难解离元素。 Eg. Al、V、Mo、Ti、W等
2020/3/22
青岛理工大学
22
火焰温度
