杆状病毒表达系统简介
昆虫表达系统

➢ 识别受体 ➢ 假病毒颗粒
• 杆状病毒及其基因组模型
此时您正浏览在第7页,共19页。
昆虫杆状表达系统简介
• 杆状病毒是已知昆虫病毒中最大的类群 ,发现最早 、研
究最多且实用意义很大的昆虫病毒。20世纪80年代以来由
于杆状病毒表达载体系统(baculovirus expression vector system,BEVS)的建立 ,已被公认为是当今 基因工程四大表达系统之一 。该系统具有许多优点, 如多角体启动子控制下的高效表达 ,完善的转译后 加工修饰 ,较易从无血清培养上清中纯化的蛋白,无 内毒素污染等。 • 杆状病毒载体系统主要分为两大类,一类是用于表达单 个外源基因的载体,另一类是多元表达载体,用于插人 并表达2个或多个外源基因
➢ 荧光显微镜法——表位标记的抗体与
直接抗体进行荧光标记——免疫学 方法
• Western印迹法 ➢ 蛋白样品制备→ SDS-PAGE(按分子
量大小)→电转移→一抗(特异性) →二抗→显色
➢ 敏感度:1-5ng
此时您正浏览在第14页,共19页。
杆状病毒-昆虫表达系统技术路线
• BEVS通常由转移载体、亲本病毒和重组介质三部分组成,其技术 路线分以下几步:先将外源片段克隆到载体质粒中, 置于杆状病毒启 动子控制之下, 上下游各有一段与亲本病毒DNA 相匹配的侧翼序 列, 构建成转移载体; 然后把转移载体和野生型病毒共转染入昆虫 细胞,通过同源重组将外源片段插入到病毒基因组,再以特定的筛选 标记和方法获得重组病毒。由于病毒原来的非必需区段被外源片 段取代, 当重组病毒在受体细胞内复制时,外源片段也得到了表达。 最后空斑纯化重组病毒, 扩大培养,分离、 纯化所表达的外源蛋白 。
昆虫杆状病毒表达系统(BEVS)

姓名:宋志瑞 专业:生物工程 学号: 2015304120207
NO.1
BEVS 简介
BEVS简介
昆虫杆状病毒表达载体系统(BEVS)是基于昆虫杆状病 毒及其宿主细胞建立起来的表达体系;是继大肠杆菌, 酵母,哺乳动物细胞表达系统建立起来的,始于上世纪 80年代。
NO.2
BEVS 优点
2
Bac-to-Bac
3
BaculoDirect源自BacPAKBac-to-Bac
BaculoDirect
三大体系的区别
NO.5
BEVS常用宿主
常用宿主
Thanks
√
√ √ Sometimes Sometimes
Glycosylation
Acylation
√
√
表达高
加工 修饰
安全
B E VS
高效
容量大
NO.3
BEVS 原件
BEVS原件
1. 转移载体 2. 杆状病毒(AcNPV) 3. 宿主(培养细胞或虫体)
NO.4
BEVS三大系统
BEVS三大系统
1
BacPAK
BEVS优点
Features Simple to use Protein size Multiple gene expression Signal peptide cleavage BEVS √ unlimited √ √ Bacterial √ <100kD
Intron splicing
Functional protein Phosphorylation
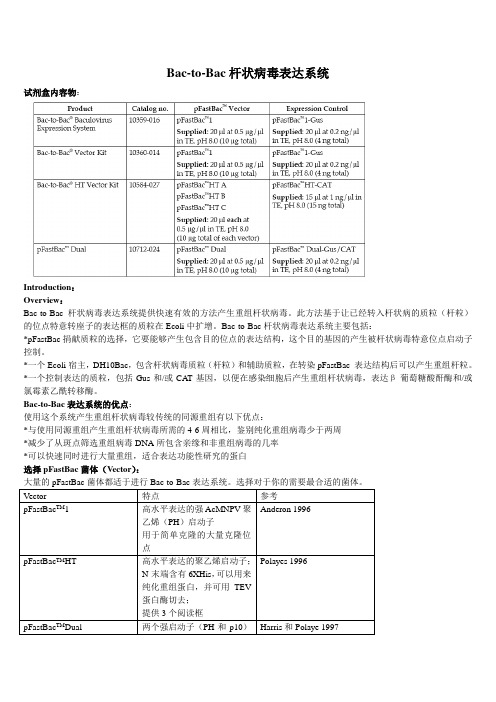
Bac-to-Bac杆状病毒表达系统

Bac-to-Bac杆状病毒表达系统试剂盒内容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方法产生重组杆状病毒。
此方法基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统主要包括:*pFastBac捐献质粒的选择,它要能够产生包含目的位点的表达结构,这个目的基因的产生被杆状病毒特意位点启动子控制。
*一个Ecoli宿主,DH10Bac,包含杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后可以产生重组杆粒。
*一个控制表达的质粒,包括Gus和/或CA T基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优点:使用这个系统产生重组杆状病毒较传统的同源重组有以下优点:*与使用同源重组产生重组杆状病毒所需的4-6周相比,鉴别纯化重组病毒少于两周*减少了从斑点筛选重组病毒DNA所包含亲缘和非重组病毒的几率*可以快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):大量的pFastBac菌体都适于进行Bac-to-Bac表达系统。
选择对于你的需要最合适的菌体。
指南用途:指南提供了一个对于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,使用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮助你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他可以帮助你很容易的产生杆状病毒表达你的重组蛋白,但是使用这系统更倾向于有杆状病毒生物学和昆虫表达背景的使用者。
杆状病毒表达系统简介-9页精选文档

体外基因表达系统包括原核细胞系统和真核细胞系统。
原核细胞系统主要是大肠杆菌细胞,它操作简便、周期短收益大及表达产物稳定,但是表达基因的相对分子质量有限,不宜过大,且不能对表达产物进行一些翻译后加工、修饰。
真核细胞系统包括 CHO等哺乳动物细胞、酵母细胞和昆虫细胞等。
昆虫细胞表达系统(即杆状病毒表达系统)具有独特的生物学特性,日益受到人们的重视。
1、杆状病毒的生物学特性杆状病毒只来源于无脊椎动物,虽然已发现600多种杆状病毒,但进行分子生物学研究的不到20种。
杆状病毒的基因组为单一闭合环状双链DNA分子,大小为80~160 kb,其基因组可在昆虫细胞核复制和转录。
DNA复制后组装在杆状病毒的核衣内,后者具有较大的柔韧性,可容纳较大片段的外源DNA插入,因此是表达大片段DNA的理想载体。
其中,用作外源基因表达载体的杆状病毒,目前仅限于核型多角体病毒(nuclear polyhedrosis virus,NPV)。
该病毒颗粒在细胞内可由多角体蛋白包裹形成长度约1~5 m 的包含体病毒,呈多角体形状。
核型多角体病毒有两种形式:一种为包含体病毒(occluded virus,OV),另一种则为细胞外芽生病毒(budded virus,BV)。
它们在病毒感染中扮演的角色不同,包含体病毒是昆虫间水平感染的病毒形式,昆虫往往是食入污染OV的食物后引起感染。
包含体病毒外层裹了一层蛋白晶体,即为29 000的多角体蛋白,它对病毒的水平感染起以下作用:①保护病毒颗粒在外界传播过程中免遭环境因素的破坏而失活。
②保证病毒颗粒在适当的位置释放,引起感染。
昆虫中肠上皮局部的强碱性环境(pH=10.5),可使病毒颗粒释放蛋白酶溶解多角体。
BV病毒是个体内细胞间的感染形式,由细胞芽生出BV,进入血淋巴系统中感染其它部位的细胞或直接在临近细胞内感染。
近几十年,有关杆状病毒基因结构、功能和表达调节的研究进展迅速,其中研究最深入的是苜蓿银蚊夜蛾(autogra— phacalifornica)多核型多角体病毒(multiple nuclear polyhedro-sis virus,MNPV),简称AcMNPV或AcNPV。
杆状病毒表达系统 杆状病毒滴度测定 全攻略

细胞因子的ELISA检测:
(1)于24孔板中加入适量的相关刺激原(based on in vitro dose-response studies),然后将浓度为4×106 cells/ml的细 胞悬液加至各孔内,每孔1 ml。 (2)臵37 ℃,5 % CO2温箱中培养72 h后,收取细胞上清。 (3)详细阅读说明书的实验步骤(不同牌子试剂盒稍有不 同),严格按要求操作。 标准曲线是判定实验的质量。
外周血单核细胞的分离 :
细胞因子的定量PCR检测:
(1)于24孔板中加入适量的相关刺激原(based on in vitro dose-response studies),然后将浓度为4×106 cells/ml的细 胞悬液加至各孔内,每孔1 ml。 (2)臵37 ℃,5 % CO2温箱中培养20 h,提取细胞总RNA并 测定 RNA浓度和纯度。 (3)取0.5 µ g RNA进行逆转录(TOYOBO反转录试剂)。 (4)定量PCR:
供体质粒pFastBac:靶基因位于杆状病毒特异启动子下游 DH10Bac:杆状病毒穿梭载体Bacmid + 辅助质粒
Bac-to-Bac 表达系统的组成和工作原理
Bac-to-Bac 表达系统的组成和工作原理
Expermiantal outline
昆虫细胞的培养
Insect Cell Lines:
杆状病毒滴度测定
两种病毒滴度测定方法的比较: 空斑实验法测定滴度依赖于病毒在感染细胞中的复制以及感染 周边细胞形成局灶型病变;而免疫染色法只需要病毒感染靶细 胞并表达病毒所编码的蛋白。因此,免疫染色法(infectious units per ml, or IFU/ml)测定病毒滴度需要的时间比空斑法 (PFU/ml)更短。
Bac-to-bac中文说明书
Bac-to-Bac杆状病毒表达系统试剂盒内容物:Introduction:Overview:Bac-to-Bac杆状病毒表达系统提供快速有效的方法产生重组杆状病毒。
此方法基于让已经转入杆状病的质粒(杆粒)的位点特意转座子的表达框的质粒在Ecoli中扩增。
Bac-to-Bac杆状病毒表达系统主要包括:*pFastBac捐献质粒的选择,它要能够产生包含目的位点的表达结构,这个目的基因的产生被杆状病毒特意位点启动子控制。
*一个Ecoli宿主,DH10Bac,包含杆状病毒质粒(杆粒)和辅助质粒,在转染pFastBac 表达结构后可以产生重组杆粒。
*一个控制表达的质粒,包括Gus和/或CAT基因,以便在感染细胞后产生重组杆状病毒,表达β-葡萄糖酸酐酶和/或氯霉素乙酰转移酶。
Bac-to-Bac表达系统的优点:使用这个系统产生重组杆状病毒较传统的同源重组有以下优点:*与使用同源重组产生重组杆状病毒所需的4-6周相比,鉴别纯化重组病毒少于两周*减少了从斑点筛选重组病毒DNA所包含亲缘和非重组病毒的几率*可以快速同时进行大量重组,适合表达功能性研究的蛋白选择pFastBac菌体(Vector):大量的pFastBac菌体都适于进行Bac-to-Bac表达系统。
选择对于你的需要最合适的菌体。
指南用途:指南提供了一个对于Bac-to-Bac表达系统的概述,并对以下提供指导:1、克隆目的基因到pFastBac TM供体质粒的选择2、转化pFastBac TM 结构到最高效的DH10Bac TM产生重组质粒3、转染重组质粒DNA到昆虫细胞产生重组杆状病毒4、扩增滴定(Amplify and titer)杆状病毒株,使用病毒株感染昆虫细胞表达目的重组蛋白重要的:Bac-to-Bac杆状病毒表达系统是用来帮助你产生重组杆状病毒,在昆虫细胞中进行高水平表达目的基因的系统。
虽然他可以帮助你很容易的产生杆状病毒表达你的重组蛋白,但是使用这系统更倾向于有杆状病毒生物学和昆虫表达背景的使用者。
杆状病毒表达系统00000001

昆虫杆状病毒系统高效表达重组蛋白●杆状病毒表达系统介绍●杆状病毒蛋白表达系统的优势●杆状病毒表达载体系统(BEVS)●杆状病毒表达宿主细胞●表达优化条件●翻译后修饰对蛋白表达的影响●高通量表达●总结杆状病毒介绍1.杆状病毒是一类具有囊膜包裹的双链环状DNA病毒。
2.杆状病毒在其生命周期中有两种不同的形态:一种为出芽型病毒(budded virus, BV),另一种为包含体病毒(Occlusion‐derived virus, OV)。
3. BV由糖蛋白GP64包裹的单一囊膜蛋白和膜蛋白构成。
4. OV由蛋白结晶基体包裹的多囊膜病毒粒子。
5. 研究最多的杆状病毒株为苜蓿银蚊夜蛾(autogra—phacalifornica)多核型多角体病毒(multiple nuclearpolyhedro‐sis virus,MNPV),简称AcMNPV或AcNPV。
6. AcMNPV只侵染鳞翅类幼虫。
杆状病毒生命周期●早期(0‐6h PI)•核衣壳迁移到细胞核•病毒DNA释放•开始早期基因表达●晚期(6‐24h PI)•更多DNA复制•新产生的核衣壳离开细胞核,随后在离开细胞质•的过程中得到囊膜蛋白•产生新的出芽病毒●极晚期Courtesy: Dr. Linda Lua, The University of Queensland, Australia •出芽病毒减少•核衣壳在细胞核内得到囊膜蛋白形成MNPVs•MNPVs以多晶体形式出芽,主要是多角体蛋白,形成包含体病毒。
多角体启动子是杆状病毒表达载体系统的主要元件。
优点缺点大肠杆菌成本低、表达量高。
缺乏蛋白质翻译后加工机制;目的蛋白不可溶,蛋白生物活性低。
酵母表达量高,可以翻译后加工,易实现高密度发酵。
蛋白质量不理想。
哺乳动物细胞重组蛋白生物活性高。
成本高;表达水平低,技术和环境要求高。
昆虫细胞重组蛋白生物学活性高;表达水平高;能同时表达多个基因。
重组蛋白糖基化程度低。
Bac to Bac

Bac-to-Bac杆状病毒表达系统是一种快速、高效产生重组苜蓿银纹夜蛾核型多角体病毒(AcNPV)的技术(Luckow et al., 1993),利用细菌转座子原理,在大肠杆菌内就能完成重组病毒的构建,取名为Bac-to-Bac表达系统,意即从细菌(bacterium)到杆状病毒(baculovirus),革命性地改变了重组昆虫杆状病毒的构建方法。
其基本原理为:将一个改造后的AcNPV基因组转化入大肠杆菌,使它像普通质粒一样能在细菌中复制(由于太大,只限单拷贝),将其称之为杆状病毒穿梭载体(baculovirus shuttle vector,又称病毒质粒baculovirus plasmid,将其首尾合写而成为Bacmid),通过位点特异性转座,在大肠杆菌内完成病毒基因组的重组。
杆状病毒穿梭载体Bacmid含有细菌单拷贝数mini-F复制子、卡那霉素抗性选择标记基因及编码β-半乳糖苷酶α肽的部分DNA片段。
在lacZα基因的N氨基末端插入一小段含有细菌转座子Tn7整合所需的靶位点(mini-att Tn7),但它的插入不影响lacZα基因的表达阅读框。
将杆状病毒穿梭载体(130kb)转化入大肠杆菌DH10β,获得转化子将其命名为DH10Bac。
因此,杆状病毒穿梭载体像一个大质粒一样,可以在大肠杆菌中增殖并使细菌细胞获得卡那霉素抗性,且与存在与受体菌染色体上的lacZα缺失产生互补,在IPTG诱导和X-gal或Blue-gal生色底物存在下转化体产生蓝斑(lacZ+)。
重组Bacmid通过pFASTBAC供体质粒(donor plasmid)上的mini-Tn7转座子,在另一个辅助质粒(helper plasmid,13.2kb)的功能作用下将外源目的基因插入到Bacmid中来完成。
Helper plasmid表达转座酶并含有四环素(tetracycline)抗性基因。
pFASTBAC系列供体质粒具有共同的特征:每个质粒都含有杆状病毒启动子(polh或p10启动子),在mini-Tn7左右臂间由一个完整的表达框,包括庆大霉素(gentamincin)抗性基因、杆状病毒启动子、多克隆位点及SV40 poly(A)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
体外基因表达系统包括原核细胞系统和真核细胞系统。
原核细胞系统主要是大肠杆菌细胞,它操作简便、周期短收益大及表达产物稳定,但是表达基因的相对分子质量有限,不宜过大,且不能对表达产物进行一些翻译后加工、修饰。
真核细胞系统包括 CHO等哺乳动物细胞、酵母细胞和昆虫细胞等。
昆虫细胞表达系统(即杆状病毒表达系统)具有独特的生物学特性,日益受到人们的重视。
1、杆状病毒的生物学特性杆状病毒只来源于无脊椎动物,虽然已发现600多种杆状病毒,但进行分子生物学研究的不到20种。
杆状病毒的基因组为单一闭合环状双链DNA分子,大小为80~160 kb,其基因组可在昆虫细胞核复制和转录。
DNA复制后组装在杆状病毒的核衣内,后者具有较大的柔韧性,可容纳较大片段的外源DNA插入,因此是表达大片段DNA的理想载体。
其中,用作外源基因表达载体的杆状病毒,目前仅限于核型多角体病毒(nuclear polyhedrosis virus,NPV)。
该病毒颗粒在细胞内可由多角体蛋白包裹形成长度约1~5 m的包含体病毒,呈多角体形状。
核型多角体病毒有两种形式:一种为包含体病毒(occluded virus,OV),另一种则为细胞外芽生病毒(budded virus,BV)。
它们在病毒感染中扮演的角色不同,包含体病毒是昆虫间水平感染的病毒形式,昆虫往往是食入污染OV的食物后引起感染。
包含体病毒外层裹了一层蛋白晶体,即为29 000的多角体蛋白,它对病毒的水平感染起以下作用:①保护病毒颗粒在外界传播过程中免遭环境因素的破坏而失活。
②保证病毒颗粒在适当的位置释放,引起感染。
昆虫中肠上皮局部的强碱性环境(pH=10.5),可使病毒颗粒释放蛋白酶溶解多角体。
BV病毒是个体内细胞间的感染形式,由细胞芽生出BV,进入血淋巴系统中感染其它部位的细胞或直接在临近细胞内感染。
近几十年,有关杆状病毒基因结构、功能和表达调节的研究进展迅速,其中研究最深入的是苜蓿银蚊夜蛾(autogra—phacalifornica)多核型多角体病毒(multiple nuclear polyhedro-sis virus,MNPV),简称AcMNPV或AcNPV。
该病毒是杆状病毒科 Baculoviridae 的原型,是一种大的、带外壳的双链DNA病毒,能感染30多种鳞翅目昆虫,被广泛用作基因表达系统载体。
其它作为表达载体的杆状病毒,主要是来自家蚕的NP~(bombyx moil,BmNP~)。
由于家蚕幼虫体内系统适合大规模地制备生产外源蛋白,且成本低,显示出良好的应用前景。
本文主要介绍 AcNPV病毒,BmNPV在许多方面与其具有共同的特征。
AcNPV的基因表达分为4个阶段:立即早期基因表达、早期基因表达、晚期基因表达和极晚期基因表达。
前两个阶段的基因表达早于DNA复制,而后两个阶段的基因表达则伴随着一系列的病毒DNA合成。
其中在极晚期基因表达过程中,有两种高效表达的蛋白,它们是多角体蛋白和P10蛋白:多角体蛋白是形成包含体的主要成分,感染后期在细胞中的积累可高达30%~50%,是病毒复制非必需成分,但对病毒粒子却有保护作用,可使之保持稳定和感染能力另一类高效表达的极晚期蛋白为P10蛋白,也是一类病毒复制非必需成分,可在细胞中形成纤维状物质,可能与细胞溶解有关。
多角体基因和P10基因现在都已被定位和克隆这两个基因的启动子具有较强的启动能力,因此这两个基因位点成为杆状病毒表达载体系统理想的外源基因插入位点。
杆状病毒基因组的结构和功能研究杆状病毒基因组为双链环状 DNA分子。
DNA以超螺旋方式被压缩包装在杆状核衣壳(rod.shaped nueleocapsid)内,核衣壳包被脂质蛋白囊膜(envelope)后形成病毒粒子。
核衣壳包括衣壳(capsid)蛋白和髓核(COle)。
其中衣壳蛋白是杆状病毒粒子的主要结构蛋白;髓核由病毒DNA分子和与其密切相关的碱性蛋白构成。
碱性蛋白同DNA紧密结合以维持其复杂有序的超螺旋结构。
目前已知基因组全序列的杆状病毒有苜蓿丫纹夜蛾核型多角体病毒(AcMNPV)b]、家蚕核多角体病毒(BmNPV) 、黄杉毒蛾多核衣壳核多角体病毒(OpMNPV)、舞毒蛾多核衣壳核多角体病毒(LdMNPV) 、甜菜夜蛾多核衣壳核多角体病毒(SeMNPV)、棉铃虫核型多角体病毒(HaNPV),以及斜纹夜蛾核型多角体病毒(SphMNPV)。
目前AcMNPV基因组的研究最为深入,它是双链超螺旋大分子环状DNA,其大小为90~160kb,约编码154个基因。
AcMNPV基因组的基因组织(gene organization)较为复杂,基因组的不同区域具有功能分化,基因的分布尚无规律可循,但AcMNPV基因组含有8个同源区,每区含有不等的重复或倒置重复序列,这些重复序列由位于中间的不完整回文序列及其两侧各约20bp的序列构成。
同源区是杆状病毒基因组普通存在的功能域结构,对于基因表达的调节具有增强作用,同时也是 DNA复制的原点。
杆状病毒中现已鉴定的基因近70种,可分为结构蛋白基因和非结构蛋白基因两大类。
结构蛋白基因如 polh、P10、gp64、p6.9、gp41、vp39等基因。
非结构基因中,与DNA复制相关的重要基因有helicase基因(he1)、 dnapol、lef-1、lef-2、lef-3、ie-1、/ie-2、p35、pe-38等;起表达调节作用的基因主要有 ie-1、ie-2、lef类基因、p35、pe38等。
这些代表性基因与其功能的关系见表1。
2、杆状病毒载体表达系统的特点AcNPV病毒用作外源基因的表达载体,通常是通过体内同源重组的方法,用外源基因替代多角体蛋白基因而构建重组病毒。
由于多角体基因启动子在感染后18~24h开始转录和翻译,一直持续到70 h。
外源基因置换掉多角体基因后,并不影响后代病毒的感染与复制,意味着重组病毒不需要辅助病毒的功能。
杆状病毒表达系统自从第一次用来表达干扰素以后在许多重组蛋白的表达中得到广泛应用,例如用于表达白介素(IL)一2,3、BMP及多种病毒蛋白等。
相对其他表达系统它具有以下几个方面的特点:①重组蛋白具有完整的生物学功能:杆状病毒表达系统可为高表达的外源蛋白在细胞内进行正确折叠、二硫键的搭配及寡聚物的形成提供良好的环境,可使表达产物在结构及功能上接近天然蛋白。
②能进行翻译后的加工修饰:杆状病毒表达系统具有对蛋白质完整的翻译后加工能力,包括糖基化、磷酸化、酰基化、信号肽切除及肽段的切割和分解等,修饰的位点与天然蛋白在细胞内的情况完全一致:对比实验证明,在昆虫细胞发生的糖基化位点与哺乳动物细胞中完全一致,但修饰的寡糖种类却不完全一样。
这种不一致对不同目的蛋白的活性影响不同,所以昆虫表达系统还可作为一个研究糖基化对蛋白质结构与功能影响方面的理想模型。
③表达水平高:与其它真核表达系统相比较,此系统最突出的特点就是能获得重组蛋白高水平的表达,最高可使目的蛋白的量达到细胞总蛋白的50%。
④能容纳大分子的插入片段:杆状病毒毒粒可以扩大,并能包装大的基因片段,但目前尚不知杆状病毒所能容纳的外源基因长度的上限。
⑤能同时表达多个基因:杆状病毒表达系统具有在同一细胞内同时表达多个基因的能力。
既可采用不同的重组病毒同时感染细胞的形式,也可在同一转移载体上同时克隆两个外源基因,表达产物可加工形成具有活性的异源二聚体或多聚体。
另外,昆虫杆状病毒表达系统具有剪切的功能,能表达基因组DNA;还有对重组蛋白进行定位的功能,如将核蛋白转送到细胞核上,膜蛋白则定位在膜上,分泌蛋白则可分泌到细胞外等。
最后,杆状病毒对脊椎动物无感染性,现有研究也表明其启动子在N-%动物细胞中没有活性,因此在表达癌基因或有潜在毒性的蛋白时可能优于其它系统。
3、杆状病毒载体的重组与筛选杆状病毒由于基因组庞大,外源基因的克隆不能通过酶切连接的方式直接插入,必须通过转移载体的介导.即将极晚期基因(如多角体基因及其边界区)克隆入细菌的质粒中,消除其编码区和不合适的酶切位点,保留其5’端对高效表达必需的调控区,并在其下游引入合适的酶切位点供外源基因的插入,即得到转移载体。
将要表达的外源基因插入其启动子下游,再与野生型AcNPV DNA共转染昆虫细胞,通过两侧同源边界区在体内发生同源重组,使多角体蛋白基因被外源基因取代。
而将外源基因整合到病毒基因组的相应位置,由于多角体基因被破坏,则不能形成多角体。
这种表型在进行常规空斑测定时,可同野生型具有多角体的病毒空斑区别开来,这就是最初的筛选重组病毒的方式。
但由于重组效率较低(0.1%-1%),表型差别不显著,应用上有一定的困难。
为此,经过不断探索,在重组杆状病毒的筛选与鉴定方面取得了很大改进,具体方法有以下几种。
(1)半乳糖苷酶的蓝白筛选1990年,Vialard等在多角体基因的上游,利用pl0基因启动子带动LacZ基因构建了转移载体pJVNheI。
将其共转染sf细胞后,重组病毒可表达B-半乳糖苷酶,通过加入x-gal使之形成蓝色空斑,便可进行重组病毒的筛选。
1990年,Kins提出了线形化技术,其原理是线形化的杆状病毒基因组感染性很低,但仍具有与引入细胞内的同源序列进行同源重组的能力。
如果同源序列位于线形化杆状病毒的两端,则基因组即可环化恢复完整的感染性,使阳性重组率大大提高。
(2)体外酶促定位重组Cre-Loxp系统最早由Sternberg等最早建立,噬菌体Pl含有1个重组位点Lox(1ocus of(rossover)和1个Cre酶基因,其产物(Cre酶)为重组所必需:Cre酶已被克隆纯化;Lox 序列已被测定由34个核苷酸组成,其两端为 13 bp的反转重复序列。
中间为8 bp的非回文序列。
将此序列引入AcNPV基因组即得vAclox,转移载体引入lox后可获得plox。
vAclox 和 plox在Cre酶存在条件下,两者即可发生体外定点重组,而将载体上的相应序列转到病毒的基因组中(这是1个可逆酶促反应),将反应混合物转染草地夜蛾(spodoptera frugiperda)sf细胞中,即可得到高比例的重组子代病毒。
这个方法的特点是体外重组,通过控制反应的条件可达到很高的重组率。
但由于重组是位点特异性的,反应产物往往是转移载体多次插入亲代病毒的结果,因而要进行多轮空斑实验纯化病毒。
(3)Bacmid后来Luckow等又发明了一种新的杆状病毒重组技术。
他们根据 F因子载体原理,用类似于酵母体内重组的方法,构建了一种新杆状病毒穿梭载体Bacmid。
该载体可像质粒一样在大肠杆菌中生长,又对鳞翅目昆虫细胞具有感染性。
Bacmid含有F因子复制子(可在大肠杆菌中复制)、卡那霉素抗性基因及Tn7转座位点attTn7。
