CD34阳性细胞绝对计数的流式细胞术测定指南(完整版)
应用流式细胞仪检测脐血CD34^+细胞的绝对值计数

应用流式细胞仪检测脐血CD34^+细胞的绝对值计数周沫;韩凤珍【期刊名称】《中山大学学报:医学科学版》【年(卷),期】2003(24)B03【摘要】【目的】应用流式细胞仪技术(FCM)精确测定 CD34^+细胞的绝对值计数,以指导脐血输注标本的选择,评价脐血的造血潜能。
【方法】收集脐血100份,应用 FCM 测定 CD34^+细胞的绝对值计数,统计分析其与脐血常规、分娩方式及新生儿体重的关系。
【结果】脐血 CD34^+细胞的绝对值均数为(48.5±27.9)/μL,与脐血白细胞有显著相关性,与红细胞、血小板无相关性。
与新生儿体重有显著相关性。
各分娩方式之间 CD34^+细胞的绝对值均散无差异。
【结论】选择脐血白细胞计数较高、高出生体重儿及 CD34^+细胞绝对值计数高(>100/μL)的脐血进行输注或移植将更有效。
【总页数】3页(P67-69)【关键词】流式细胞仪;脐血;CD34^+细胞;绝对值计数【作者】周沫;韩凤珍【作者单位】广东省人民医院妇产科【正文语种】中文【中图分类】R446.113【相关文献】1.应用流式细胞仪检测脐血CD34+细胞的绝对值计数 [J], 周沫;韩凤珍2.应用流式细胞仪检测脐血CD34+细胞的绝对值计数 [J], 周沫;韩凤珍3.脐血抗—HPCA—2和Tuk3标记的CD34阳性细胞的流式细胞仪比较分析 [J], 蓝丰硕;丁训杰4.脐血抗—HPCA—2和Tük3标记的CD34阳性细胞的流式细胞仪比较分析 [J], 蓝丰硕;丁训杰;谢毅;王益5.不同标记方法及去红细胞法对检测微量脐血CD34^+细胞含量的影响 [J],因版权原因,仅展示原文概要,查看原文内容请购买。
人体流式细胞术参数的正常参考值
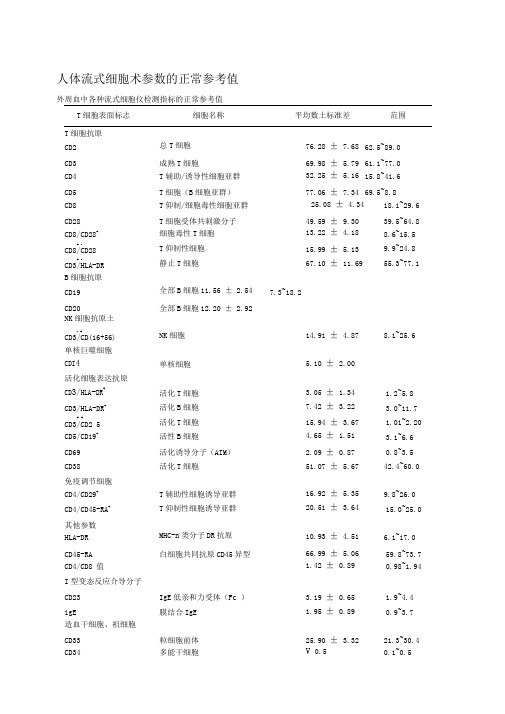
人体流式细胞术参数的正常参考值外周血中各种流式细胞仪检测指标的正常参考值T细胞表面标志细胞名称平均数土标准差范围T细胞抗原CD2 总T细胞76.28 ± 7.68 62.5~89.0CD3 成熟T细胞69.98 ± 5.79 61.1~77.0CD4 T辅助/诱导性细胞亚群32.25 ± 5.16 15.8~41.6CD5 T细胞(B细胞亚群)77.06 ± 7.34 69.5~8.8CD8 T仰制/细胞毒性细胞亚群25.08 ± 4.34 18.1~29.6 CD28 T细胞受体共刺激分子49.59 ± 9.30 39.5~64.8 CD8/CD28+细胞毒性T细胞13.22 ± 4.18 8.6~15.5 + -CD8/CD28 T仰制性细胞15.99 ± 5.13 9.9~24.8+ -CD3/HLA-DR 静止T细胞67.10 ± 11.69 55.3~77.1 B细胞抗原CD19 全部B细胞11.56 ± 2.54 7.3~18.2CD20 全部B细胞12.20 ± 2.92NK细胞抗原土- +CD3/CD(16+56) NK细胞14.91 ± 4.87 8.1~25.6 单核巨噬细胞CDI4 单核细胞 5.10 ± 2.00活化细胞表达抗原CD3/HLA-DR+活化T细胞 3.05 ± 1.34 1.2~5.8 CD3/HLA-DR+活化B细胞7.42 ± 3.22 3.0~11.7+ +CD3/CD2 5 活化T细胞15.94 ± 3.67 1.01~2.20 CD5/CD19+活性B细胞 4.65 ± 1.51 3.1~6.6 CD69 活化诱导分子(AIM) 2.09 ± 0.87 0.8~3.5 CD38 活化T细胞51.07 ± 5.67 42.4~60.0 免疫调节细胞CD4/CD29+T辅助性细胞诱导亚群16.92 ± 5.35 9.8~26.0 CD4/CD45-RA+T仰制性细胞诱导亚群20.51 ± 3.64 15.0~25.0 其他参数HLA-DR MHC-n类分子DR抗原10.93 ± 4.51 6.1~17.0 CD45-RA 白细胞共同抗原CD45异型66.99 ± 5.06 59.8~73.7 CD4/CD8 值 1.42 ± 0.89 0.98~1.94 I型变态反应介导分子CD23 IgE低亲和力受体(Fc ) 3.19 ± 0.65 1.9~4.4 igE 膜结合IgE 1.95 ± 0.89 0.9~3.7 造血干细胞、祖细胞CD33 粒细胞前体25.90 ± 3.32 21.3~30.4 CD34 多能干细胞V 0.5 0.1~0.5黏附分子CD18 整合素53.42 ± 13.35 34.5~75.7CD29 57.63 ± 8.87 40.8~69.0CD44 细胞外表基质受体川98.33 ± 2.39 93.8~99.9CD49b 95.22 ± 6.39 92.6~97.8CD49c 3.80 ± 0.48 3.3~4.7CD49d 84.42 ± 7.89 72.6~93.8CD49e 342.0 ± 4.47 20.8~53.5CD49f 37.50 ± 2.48 32.6~40.9CD50 细胞间黏附分子3 (ICAM-3) 89.9 ± 5.49 80.1~96.9CD54 细胞间黏附分子1 (ICAM-1) 14.49 ± 2.47 9.2~20.2CD56 神经细胞黏附分子(NCAM-1 10.84 ± 1.84 7.4~14.4调亡相关蛋白CD95 (Apo/FAS) 20.59 ± 5.49 13.0~28.9 FasL Fas配体0.55 ± 0.17 0.3~0.8细胞动力学参数SPF S-期细胞比率0.15 ± 0.13Apo (DNA含量法)细胞调亡指数0.33 ± 0.26Apo2.7 细胞调亡指数0.84 ± 0.44某些基因编码蛋白表达CD44V5 黏附分子突变体5 6.19 ± 1.21CD44V6 黏附因子突变体6 5.98 ± 1.53CerbB-2 4.07 ± 3.00nm23 肿瘤转移仰制基因85.89 ± 7.99DCC 80.31 ± 10.11p16 抗多肿瘤基因41.32 ± 9.34p53(V) 突变型p53 0.80 ± 0.37双色直接免疫荧光染色分析正常人血淋巴细胞对数的参考范围细胞表面标志百分比(% 绝对计数(个/ ul )总T细胞+ -CD3/CD19 50~84 955~2860总B细胞- +CD3/CD19 5~18 90~560辅助/诱导性T细胞CD3/CD4+27~51 550~1440仰制/细胞毒性T细胞CD3/CD8+15~4 320~1250辅助/仰制性T细胞比值CD3 +/CD4+/CD8-/CD3+/CD8+/CD4-0.71~2.78NK细胞- + +CD3/CD16/CD56 7~40 150~1100T细胞+B细胞+NK细胞95~105 1530~3700三色直接免疫荧光染色分析正常人外周血淋巴细胞亚群绝对数的参考范围细胞表面标志百分比(% 绝对计数(个/ ul)总T细胞CD3 770~2041辅助/诱导性T细胞+ + -CD3/CD4 /CD8 34.0~70.0 414~1123仰制/细胞毒性T细胞+ + -CD3/CD8 /CD4 25.0~54.0 238~874双阳性细胞CD3/CD4+/CD8" 卜0.5~4.0 6~56辅助/仰制性T细胞比值CD3 +CD4/CD3+/CD8+0.68~2.47人体各种正常组织DI、倍体、SPF和PI组织n DI 倍性SPF ()PI(食管21 1.00 ± 0 D 10.4 ± 3.0 16.5 ± 4.8 肝13 1.00 ± 0 D 12.0 ± 4.2 16.5 ± 4.2 组织n DI 倍性SPF ()PI(肠39 1.00 ± 0 D 10.6 ± 4.9 15.5 ± 4.0 胃16 1.00 ± 0 D 12.4 ± 5.4 17.7 ± 5.9 肺26 1.00 ± 0 D 9.4 ± 3.4 16.0 ± 4.4乳腺14 1.00 ± 0 D 12.3 ± 4.9 13.6 ± 4.9 脑17 1.00 ± 0 D 8.9 ± 5.4 13.4 ± 5.4腮腺9 1.00 ± 0 D 6.0 ± 3.9 11.9 ± 5.0骨髓15 1.00 ± 0 D 7.0 ± 4.2 11.8 ± 5.2正常人体组织某些基因编码蛋白的表达水平及其他参数细胞标志名称平均值土标准差()CD44S 黏附分子37.27 ± 10.61CD44V5 黏附分子突变体5 14.46 ± 8.05CD44V6 黏附分子突变体6 21.3 ± 13.40CerbB-2 8.14 ± 3.72nm23 肿瘤转移仰制基因87.00 ± 9.10DCC 72.00 ± 8.57P16 多肿瘤仰制基因86.27 ± 12.86P53 (V) 突变型P53 1.70 ± 1.29Apo 细胞调亡指数 2.66 ± 2.49SPF S-期细胞比率 5.21 ± 4.58CD14 巨噬细胞18.70 ± 5.00CTL 细胞毒性T细胞11.90 ± 3.80。
应用流式细胞仪检测CD34+细胞方法学评价(全文)

应用流式细胞仪检测CD34+细胞方法学评价(全文)应用流式细胞术(FACS)测定动员后的外周血及采集的自体外周血造血干细胞(APBSC)中的CD34+细胞及其亚群,操作简单、快速、重复性好,对及时掌握最佳采集时机,准确判断采集的干/祖细胞数量具有重要指导意义。
为准确检测外周血及APBSC中的CD34+细胞,本文比较了几种FACS检测CD34+细胞方法的异同。
1 材料与方法1.1 外周血造血干细胞APBSC采集自经环磷酰胺(CTX)+重组人粒细胞集落刺激因子(rhG-CSF)动员后的实体瘤患者(淋巴瘤、乳腺癌),采集使用CS3000-Plus血细胞分离机(Baxter公司,美国)。
1.2 CD34+细胞的标记对10份APBSC分别进行2种不同再处理与CD34标记。
1.2.1 溶血法APBSC与CD34-PE荧光单克隆抗体(Immunotec,法国)室温暗处反应15min,然后用细胞裂解液溶解红细胞,待测。
1.2.2 分离单个核细胞法经Ficoll(相对密度1.007)梯度离心,收集界面层单个核细胞,与CD34-PE标记的单抗室温孵育15min,待测。
1.3 FACS检测CD34+细胞上述标记细胞悬液分为2管,其中一管6h内使用流式细胞仪(EPICSELITEESP,COULTER公司)测定CD34+细胞占单个核细胞(淋巴细胞和单核细胞)的百分率,另一管经1%多聚甲醛固定,4℃冰箱保存72h后,FACS测定CD34+细胞数。
1.4 荧光标记的CD34单克隆抗体33份APBSC同时分别用表达第2类抗原表位QBEnd10(ClassⅡ,Immunotec)和表达第3类抗原表位8G12(HPCA2,classⅢ,BectonDickinson)的单抗进行标记,比较2组CD34+细胞百分率之间的差异。
1.5 双标记CD34/CD45 APBSC中同时加入抗CD45-FITC(J33)和抗CD34-PE(HPCA2),用溶血法处理细胞,FACS测定CD34+细胞。
FCM在血液学中应用

(3)上FCM分析,并计算各类CD34+ 细胞,包括内 参照及全血标本。
( 4 ) StemTrol 结 果 经 标 准 化 因 子 ( 100 ul/20 ul=5)校正,与StemTrol提供的标准值比较,差异 在15%以内通过。这样Tube2测得的CD34+ 细胞数为 待检标本的绝对CD34+ 细胞数。Tube1的计数值包括 StemTrol+HSPCS+碎片,Tube2的计数值包括HSPCS+ 碎片,Tube3的计数值为碎片。(Tube1—Tube2) 的 计 数 值 × 标 准 化 因 子 为 StemTrol 的 质 控 值 , (Tube2-Tube3)的计数值×标准化因子为HSPCS。
成人白血病P-gp表达与预后的关系 成人ALL P-gp表达与形态学、免疫表型 的关系 AML P-gp表达与免疫分型的关系
FCM检测白血病微小残留病变(MRD):
•急性白血病经治疗后达临床完全缓解,但此时 体内仍残留106~108白血病细胞,这些细胞是白 血病复发的根源。 •检测骨髓或外周血细胞两种抗原的表达,如 CD19/TdT, CD22/TdT, CD10/TdT, CD7/TdT, CD5/TdT, CD13/TdT, CD33/TdT CD34/TdT。
Flow Cell
Injector Tip
Sheath fluid
Fluorescence signals
Focused laser beam
FCM检测信号
散射光信号 前向散射光(foword scatter, FS):在激光束正前方 的检测器,用于检测细胞或其他粒子物体的表面属性 ,如大小、形状等。 侧向散射光(side scatter, SS):与激光束垂直方向 的检测器为侧向检测器,主要用于检测细胞内部结构 属性,可获得细胞内超微结构和颗粒性质的参数。 荧光信号
CyFlow Space流式细胞仪CD34 +细胞绝对计数分析

Yan Yu o g c ng , Che i l Ch n W e Yo anyi, u ng X ao i, e i, u Yu LiX
( b r tr / M oe ua e cn ,h r t fiitd H opia , dia La o a o y0 lc lrM dii e teFis Af l e s tl Me c l a S h o , X a i oo g Un v riy, a 1 0 1 C ia col o nJ a tn ie st X n 7 0 6 , h n ) Abta tObe t e To c mp r h i ee c fCD3 cl o n sd tce yPatcCy lw p c lw yo er sn sr c : jci v o aet edf rn eo f 4 el c u t ee td b re Fo S a ef s o c tm ty u ig
关 键 词 : 式 细 胞 术 ; CD3 流 4细 胞 计 数 ; I SHAGE 方案 ,
D :0 3 6 /.s n 1 7 — 1 0 2 1 . 3 0 l OI 1 . 9 9 j i . 6 3 4 3 . 0 1 1 . 3 s
文献标识码 : A
文 章 编 号 : 6 34 3 ( 0 1 1 4 10 1 7 — 1 0 2 1 ) 3 1 7 3
同型 对 照 设 门 法 ( P< 0 0 ) 回 收 试 验 显 示 ,SHAGE设 门 法计 数 不 同 细胞 浓 度 标 本 的 预 期 值 与 回 收 值 的相 关 系数 为 0 9 8 9 .5 。 I . 9 ;
对 3种 细 胞 浓 度 重 复 检 测 的 变 异 系数 为 2 2 ~3 8 。结 论 两 种 设 门 法计 数 C 3 细 胞 的 相 关 性 较 好 , I HA . . D4 但 S GE设 门 法 更 能 反 映 造 血 干 细胞 的特 点 , 有 良好 的 准确 度和 精 密 度 , 无 需 同 型对 照抗 体 , 约 试 剂 , 适 合 临 床 常 规使 用 。 具 且 e e um e a i n f CD3 c ls de e t d b Fl w a e fo c t m e r s a c n a s ut n r to o 4 e l t c e y Cy o Sp c l w y o ty
流式细胞术三色分析调查成年人外周血CD34 +造血干细胞绝对计数参考范围

1研究对象及分组 13名健康成人 , 龄 l 一帅 岁 , 6 年 8 无 现病史 , 无吸烟史 ; 体格检 查健康 ; 无免 疫系统疾 病 、 血液系
球 的绝 对 计 数 管 ( m O N 管 ) 均 为 美 国 B T C UT . D公 司 产 品 。
血干细胞计数十分重要 在早期 , 临床医生们通过有棱细 胞 计数 , 集落形 成单 位( o n o m gUm, F ) Cl yFr i i C U 来计 算输人 病 o n 人体内的造血干细胞 , 由于 C U实 验变异 性太大 , 但 F 耗时 太 长, 其临床实用性 被 大大削弱 2 0世纪 8 0年代 , D 4分 子 C3
2 标 本 采 集 : D A真 空 采 血 管 ( 国 B 公 司 产 品 ) ET 美 D 采
集静脉血 2I , 鲜样 本 6h之 内进行样本处理。 -新 I l
3 免 疫 荧 光 染 色 : 1 P C U T试 剂 组 成 : 括 核 酸 染 () ̄ O N 包 料/ D 4P / D 5 PrP 测 定 管 ) 核 酸 染 料 / ] lP / C 3 E C 4 e ( C 和 M E
外 周 血 标 本 造 血 干 细胞 绝对 计数 宴 例见 囤 2 。
院组成 的北京市临床漉式 细胞 分析协作组 , 统一使用 流式细 胞仪和 P C U T方 法, 13名 健康成 年人进行 了外周血  ̄ON 对 6 C3 D"  ̄ 干细臆 的绝 对计数 , 建立 了健 康 中 国成 年人 外 周血
被 发 现 ,D 4 C 3 造 血 干 细 胞 在 正 常 骨 髓 单 十 核 细 胞 中 的 相 对
流式细胞项目参考值和意义

【参考范围】CD34+细胞在正常外周血中占有核细胞的0.00001~0.0001(0.001%~0.01%),骨髓0.005~0.015(0.5%~1.5%),脐血0.005~0.035(0.5%~3.5%)。
【影响因素】骨髓或外周血白细胞要用PBS稀释至1×10^6/ml后进行免疫标记,并注意设立相应的同型对照。
【临床意义】1.外周血造血干细胞(PBSC)采集前CD34阳性细胞动员有效性的监测可以指导临床制定采集计划。
一般来说,外周静脉血有核细胞中CD34+细胞达到0.001(0.10%)以上时,可以考虑行PBSC单采术。
否则,应继续动员。
2.各种造血干细胞移植物的CD34+细胞剂量控制BMT、PBSCT的CD34+细胞剂量>2×10^6/kg,脐血干细胞移植时,CD34+细胞剂量可少至BMT成PBSC的1/10,即2×10^5/kg。
3.化疗强弱的掌握化疗后血象的恢复快慢取决于对造血干/祖细胞损伤的强度。
CD34+细胞的测定可以判断化疗的强度。
要求化疗强度控制在杀伤一定比例而非所有CD34+细胞为度。
4.贫血的鉴别(如再障、缺铁性贫血)如果再障的原因属于细胞受累,则CD34+细胞可以明显降低(<0.01),缺铁性贫血时,CD34+细胞数量应在正常范围之内。
5.基因治疗CD34+的HSC作为缺陷基因的靶细胞有它独特的优点,因为HSC具有自我更新的能力,因此,缺陷基因导入此类细胞后能维持终身,从而彻底治愈疾病。
显然,CD34+HSC 的精确测定显得非常重要。
【参考范围】CD19+:0.10~0.15(10%~15%)。
【影响因素】1.标本最好用EDTA抗凝,其次用肝素。
2.标本要新鲜采集,不能发生凝血。
3.制备细胞悬液时,使用标准溶血剂以使红细胞充分溶解。
4.血液采集后,应尽快进行免疫荧光染色和固定,最迟不能超过6h。
5.标记后的细胞应尽快上机检测,最迟不能超过72h。
外周血CD34+细胞计数指导MOZOBIL+G-CSF动员、采集自体造血干细胞

0.001 / 0.001
/ 0.02 / 0.02
# CTX: 3g/m2;*惠尔血:300ug/q12h
第二次动员:G-CSF + Mozobil
日期 外周血细胞 产品 WBC CD34+ CD34+绝 MNC(x CD34+(x (%) 对数(/ul) 108/kg) 106/kg) (x109/L) 3.5 / / / /
• D-2 1.3
• D 0 1.5
Mel 140mg/m2
造血干细胞输注
ANC植入D+11;血小板植入:D+37
病例(2)
• 男性,27岁 • T淋母9月
• 2009.5胸闷、胸痛伴发热,影像学提示纵隔巨大 肿块伴右侧胸腔积液 • 病理提示T淋母:LCA+,CD20-,Ki-67+80%
• Hyper-CVAD A+B方案共6疗程+腰穿3次 • 纵隔放疗1疗程(具体剂量不详)
第一次动员:CTX + G-CSF
日期 外周血细胞
WBC(x109/L) CD34+ (%) D1# D5* D8*
D9* D10* D11* D12*
CD34+绝对数(/ul) 0.06 / /
0.12 0.12 2.3 1.8
6.1 6.5 6.8
6.9 6.10 6.11 6.12
6.0 4.0 2.4
- 争取单次采集,降低重复采集次数
• 外周CD34+计数指导干细胞动员和采集 • Mozobil+G-CSF动员病例分享
Mozobil作用机制
Mozobil动员的临床效果
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CD34阳性细胞绝对计数的流式细胞术测定指南(完整版)造血干细胞移植(HSCT)是治疗血液系统疾病、自身免疫性疾病、某些实体瘤和基因缺陷疾病的重要手段之一。
在HSCT的过程中,采集足够数量的造血干细胞(HSC)是HSCT成功的关键。
但至今为止,尚无一个与体内重建造血完全吻合的HSC体外检测法。
早期,人们通过有核细胞计数、集落形成单位(CFU)来计算移植物中HSC/造血祖细胞(HPC)数量,但前者与HSC数量一致性差,后者实验变异性大、耗时长,其临床实用性大大减弱。
20世纪80年代,CD34分子在造血祖细胞上表达的发现,为临床HSCT提供了可评估植入最低阈值的强有力工具。
尽管近年来体外研究表明,人类CD34阴性脐血组分也有造血活性,然而大量的临床研究证实用富含CD34+细胞组分移植可安全、持久地获得多系造血重建[1,2]。
因此,目前临床及实验室仍然是应用CD34+细胞进行HSCT、基因转染和HPC扩增,而流式细胞术计数CD34+细胞因具有快速、简便、可定量等特点,已广泛应用于移植物中HSC/HPC数量的检测及确定采集时机等[3,4,5]。
流式细胞术计数CD34+细胞经历了从单参数到多参数分析、从双平台到单平台计数、从各实验室自由抗体组合到商业化试剂盒应用等一系列的演变。
1995年血液病治疗与移植国际联合会(International Society of Hematotherapy and Graft Engineering,ISHAGE)成立了干细胞计数小组,致力于寻求一种快速、简便、敏感、对不同的流式细胞仪都有效的流式细胞术CD34+细胞计数方法。
1996年ISHAGE采纳了Sutherland等提出的CD45/CD34双色标记多参数累积设门的方法,被命名为ISHAGE方案[5]。
ISHAGE方案等双平台计数法先通过流式细胞术分析得出CD34+细胞百分比,再结合血细胞计数仪计数的白细胞数得出CD34+细胞绝对数。
不同实验室间的血细胞计数仪可能存在一定的系统误差,洗涤过程中易造成某些细胞成分的丢失,因此双平台CD34+细胞计数法在不同实验室间存在很大的变异性[6]。
单平台CD34+细胞计数法是在计数管中加入已知数量的荧光微球,采用流式细胞术获取CD34+细胞百分比的同时,根据获取的已知密度的荧光微球数来计算出CD34+细胞绝对数。
单平台计数法裂解红细胞后不需洗涤,不需要采用血细胞计数仪计数白细胞,因此系统误差小,被认为是首选的CD34+细胞计数方法[5,7,8]。
无论是ISHAGE方案还是单平台流式细胞术CD34+细胞计数法都需要多参数累积设门,技术要求高。
国外室间质量评估资料显示各实验室间的CD34+细胞计数仍存在很大的差异,分析其原因包括未按照要求设置各散点图窗口;随意增减散点图的数量和改变散点图的分析参数;未注意设定阈值的参数等[9]。
不同厂家的试剂盒、不同的分析方案、单平台还是双平台、溶血洗涤法还是溶血免洗法以及流式细胞仪的型号等对CD34+细胞计数的结果可能会有一定的影响[10]。
为保证各实验室CD34+细胞计数结果的可靠性和可比性,中国免疫学会血液免疫分会临床流式细胞术学组经过反复讨论,制定符合我国国情的流式细胞术CD34+细胞计数指南,供各实验室参考和采用。
一、标本采集1.患者信息及标本标识:所有检测用标本应及时贴上标签,标签上应注明患者的姓名、唯一的识别码、标本类型、标本采集的日期和时间。
填写检查申请单,申请单应和标本粘贴在一起送检,申请单上应标明患者的姓名、患者唯一的识别码、年龄、性别、标本采集日期和时间、申请医师的姓名和标本类型(如:全血)、检测项目及相关的临床信息,进行双平台检测时还需提供白细胞计数和分类信息。
2.抗凝剂的选择:标本采用不同的抗凝剂抗凝时,其稳定性会不同,乙二胺四乙酸钾盐(EDTA-K2/EDTA-K3)抗凝的标本,常温下可稳定保存12~24 h,超过24 h的EDTA盐抗凝标本中粒细胞可能会减少,肝素钠或枸橼酸钠(ACD)抗凝标本可稳定保存48 h。
如果标本需用血细胞分析仪同时进行白细胞计数和分类,则应该选择EDTA盐作为抗凝剂。
因此外周血标本通常采用EDTA盐抗凝,采集物通常采用ACD抗凝,骨髓和脐带血标本可采用EDTA 盐、肝素钠或ACD抗凝。
3.标本质量:标本处理的步骤越多,细胞丢失就越多。
而这种丢失在不同类型白细胞比例是不均等的。
对于全血标本,溶血后不洗涤,可以使标本处理的步骤减到最少。
(1)标本目视观察:可观察到的问题常见有两种类型:一是变性或损坏的标本,需要立即弃之;二是在标本处理过程中出现错误操作,则需要进一步评估。
错误操作问题需要记录下来,这对标本的处理、分析以及结果的解释都将很有帮助。
(2)溶血:严重溶血的标本应该放弃检测,所有可能破坏标本完整性的异常情况均应密切观察,并且记录下来,以利于后续的处理、分析和结果解释。
(3)凝血:即使是很小的血凝块也会引起血液中某些成分的选择性丢失或改变,凝血的标本应尽可能弃用。
(4)温度极限:如果标本是远距离运送到实验室,标本就有可能暴露在非允许储存温度的环境中,所以接到标本后应确认标本是否过热或过冷。
即使其他所有的鉴定指标都正常,也应记录下来以利于后续的处理、分析和结果解释。
(5)错误标本标签:如果标本没有唯一标识或标本标签与患者信息不符(患者姓名与标识不符),应该拒收标本,并及时与相关医护人员沟通。
(6)标本保存时间及储存条件:可接受的标本最长保存时间取决于抗凝剂的种类、溶血剂、储存条件及细胞密度。
实验室应根据使用的抗凝剂和溶血剂确定可接受的标本最长保存时间。
实验室应选择适当的保存环境以及溶血方法,使保存标本的检测结果与新鲜标本之间没有明显差异。
原则上标本采集后应该立即检测,但是实际操作中往往无法做到。
不能立即检测的标本应该保存于4~8 ℃冰箱中。
后续的标本处理和免疫染色应严格按照试剂说明书进行操作。
4.标本运送:采集标本应在4~8 ℃环境下尽快送检,注意避免标本冻结和过热。
(1)内部送检:同一实验室内转移血液标本,盛放的容器应标有生物危险标志,并且在血液标本管有破损的情况下,仍能够容纳标本,可用具有防漏密封层的塑料袋或带有安全盖的塑料容器等。
(2)外部送检:危险物品运送规定和国际航空运输协会(IATA)危险品规则对含有致病原血液标本的运送均有相关规定。
HIV已被列为UN2814类危险物质,感染级别为6.2。
包装应符合UN 6.2级别高致病菌性病原体的安全运输包装标准,标准包装要求含有三层体系:①防水内容器;②防水并含有吸附材料的第二层内容器;③坚固的外包装。
二、CD34+细胞绝对计数方法CD34+细胞绝对计数分为单平台和双平台两种方法。
单平台方法是首选方法,它减少了室间变异和多台仪器间的系统误差。
1.单平台方法:(1)白细胞密度和抗体用量:通过血细胞计数板或使用血细胞分析仪预先计数标本中的白细胞,并严格按照操作说明书调整细胞和抗体的最佳比例。
白细胞过少的标本应减少单抗用量。
白细胞过多的标本应使用含10 g/L白蛋白或其他蛋白的磷酸盐缓冲液(PBS)稀释到适当密度。
(2)移液量:标本和荧光微球的移液量应精确,为了加入准确体积的已知密度的定量微球和标本,推荐采用反向抽吸法加样。
使用包被有已知数量的荧光微球的标本处理管,只需移液1次;而直接在标本中加入已知密度的荧光微球悬液,需要移液2次。
(3)裂解红细胞:裂解红细胞的时间和方法按照所用溶血素说明书进行操作。
采用含7-氨基放线菌素D (7-AAD)方案时应选择不含固定剂的溶血素,如氯化铵-Tris缓冲液。
(4)离心:为避免荧光微球的丢失,在裂解细胞后不要离心洗涤。
2.双平台方法:CD34+细胞绝对计数由流式细胞仪测得的CD34+细胞百分比和全血细胞分析仪测定的白细胞计数计算得到。
白细胞密度与抗体用量同单平台方法,不需要采用已知数量的荧光微球管或加入荧光微球悬液。
裂解红细胞按照所用溶血素说明书进行操作,裂解红细胞后离心洗涤2次。
三、免疫荧光染色可以采用商品化CD34+细胞计数试剂盒或实验室自己组合的单抗。
实验室自己组合的抗体中每一种抗体都需要分别滴定以明确其阴性与阳性信号的最佳分离滴度,并检测作为组合抗体使用和作为组合抗体的成分之一单独使用时的平均荧光强度和阳性率,其可比性需在±2s之内。
1.抗体组合方案:(1)抗体及荧光微球的选择:①CD34抗体:CD34选择PE直接标记的抗classⅢ的抗体(如:Tuk3、HPCA2、BIRMA-K3、581);②CD45抗体:选择广谱抗CD45抗体(如:anti-HLE-1、J33);③CD34抗体的同型对照:选择与CD34匹配的同一厂家生产的同型对照;④定量荧光微球:推荐使用绝对计数的商品化荧光微球,如Flow-CountTM(美国贝克曼-库尔特公司产品)、FCSC Count StandardTM(FCSC公司产品)和TruCountTM(美国Becton Dickinson 公司产品)等。
(2)含7-AAD的三色方案:抗体组合为CD45、CD34、7-AAD。
(3)不含7-AAD的双色方案:抗体组合为CD45、CD34。
2.免疫荧光染色:按照试剂说明书和注意事项进行操作,一般操作流程如下:(1)标本与抗体孵育:取包含1×106白细胞的全血或稀释标本50~200 μl,加入适量直接标记的抗体(10~20 μl),室温孵育20~30 min。
(2)裂解红细胞:裂解红细胞的方法与使用的溶血素有关,按照所用溶血素说明书进行操作。
采用含7-AAD方案时应选择不含固定剂的溶血素,如氯化铵-Tris 缓冲液。
(3)离心:离心洗涤方法与溶血素有关,按照所用溶血素说明书进行操作。
单平台绝对计数法在裂解红细胞后,不要离心洗涤。
(4)绝对计数的商业化荧光微球:采用冻干的已知数量的荧光微球或按照使用说明书加入一定体积已知密度的荧光微球。
(5)染色后标本保存:制备好的标本在上机分析前在4~10 ℃下避光保存,应在1 h内上机检测,检测前混匀细胞。
四、对照标本通常采用同型对照和阳性对照标本。
采用ISHAGE设门方法时可不需要同型对照,这是因为多重逻辑设门后可去除非特异性抗体结合,商业化的试剂盒常带有同型对照。
检测新批号试剂和当前批号试剂的染色效率是否出现问题时需设阳性对照。
或怀疑试剂出现问题时,采用该试剂与已知可接受性能批号的试剂同时操作进行验证。
阳性对照标本的种类包括新鲜全血、骨髓、商品化标准品等。
五、流式细胞仪的质量控制(质控)包括光学系统的调整、荧光分辨率的调整、荧光补偿的调整、性能评估及比对、仪器保养维护及记录等。
1.验证和调整光路及规范光路设置:在每次开机时,首先采用荧光微球光路质控品验证仪器的光学系统是否处于厂家或实验室根据特定的实验状态所设定的可接受范围内,并且保持每次开机时仪器性能稳定。
