盐水中氯气溶解度表
氯气在饱和氯化钠溶液中的溶解度有多大

有 比 效 清 楚 的认 识 。 关 键 词 氯 气 饱 和 氯化 钠 溶 液 溶 解 度
实验 室制 备 氯气 时 由于 氯 气 中含 有 氯 化 氢 、 水等 杂质 气体 , 我们 必须 除 杂 , 一 般方法 是 先把氯
气通 过饱 和 的氯 化钠 溶 液 除 去 氯 化 氢 , 然 后 再 通
验 所 用器 材 比较 易得 , 也很 便 宜 , 现 象 比较 明显 ,
能 够帮 助学 生加 深 对 氯 气 溶 解 性 的认 识 , 所 得 结
三分 之一 的氯 气 与 水 发 生 了 以 上 反应 , 还 有 三 分 之二 的氯 气剩 余 , 因此 我 们 常 用 的氯 水 是 呈 浅 黄
3 探 究 过 程
a
( 1 ) 氯 气 溶 于 水
-
8 -
,
5 0
= = = ] [ =
1 0 0
【 实验 步骤 】
① 如图 1 a所示 ,
在 1 0 0 m L 的 注 射 器 中吸人 8 O a r L 的 氯
气。
图 2
【 实 验结论 】 往 饱 和 的氯 水 中 加 入 足 量 的 氯
( 2 ) 饱 和 氯 水 中 加 入 氯 化 钠
【 实 验步骤 】
①如 图 2 a所 示 , 在另一支 1 0 0 mL注 射 器 中
过浓 硫酸 溶液 除去 水 , 这 样就 得到 纯净 的氯 气 了。
当学 生 问 到 为什 么 要 用 饱 和 氯 化 钠 溶 液 除 氯 气 呢 ?我们 的 回答是 因为饱 和氯 化钠 溶液 中有 高浓 度 的氯离 子 , 阻碍了氯气的溶解 ( 根 据 平 衡 移 动 原理 ) 。因此 , 可 以 用 饱 和 氯 化 钠 溶 液 来 除 去 氯 气 中的杂 质 。饱和 氯化 钠溶 液对 氯气 的溶解 影 响 有多 大 , 基于此 问题 我 们设 计 了氯 气 的 溶 解 性 实
700种盐水溶解度表
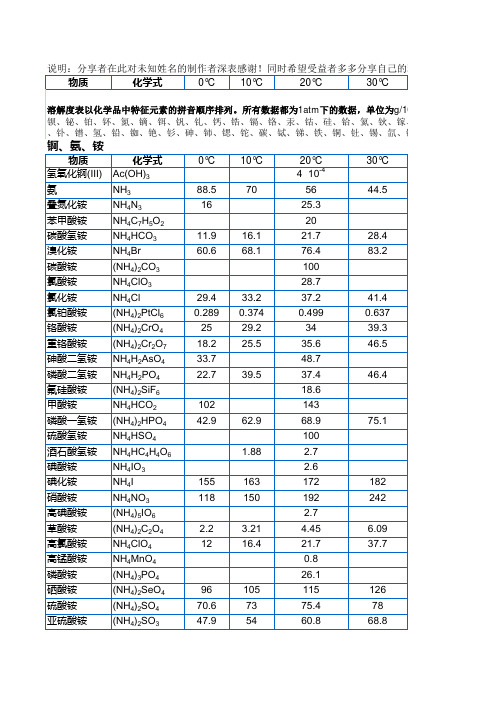
酒石酸铵 硫氰酸铵 硫代硫酸铵 钒酸铵 物质 氢氧化钯(II) 乙酸钡 砷酸钡 叠氮化钡 溴酸钡 溴化钡 碳酸钡 氯酸钡 氯化钡 氯酸钡 铬酸钡 氰化钡 亚铁氰化钡 氟化钡 氟硅酸钡 甲酸钡 磷酸氢钡 亚磷酸氢钡 氢氧化钡 碘酸钡 碘化钡 钼酸钡 硝酸钡 亚硝酸钡 草酸钡 氧化钡 高氯酸钡 高锰酸钡 焦磷酸钡 硒酸钡
100
135
135 2.2×10 4
-2
135
8.736×10-5 8.3 11.1 14.4 2.697×10 78.7 122 180 72.5 75.4 68.4 76 84.7 136 6.046×10 188 6.235×10 64 76.6 1.292×10-12 4.642×10-2 108 104 124 123 130 130 220 2.727×10-2 1.352×10-6 4.351×10-7 3.246×10-5 2.313×10-3 2.266×10-12 282 325 407 4.277×10 25 1.1 0.08 0.3 3.63 0.4 4.82 0.56 25 6.57 9.3 8.34 0.66
锕、氨、铵
物质 氢氧化锕(III) 氨 叠氮化铵 苯甲酸铵 碳酸氢铵 溴化铵 碳酸铵 氯酸铵 氯化铵 氯铂酸铵 铬酸铵 重铬酸铵 砷酸二氢铵 磷酸二氢铵 氟硅酸铵 甲酸铵 磷酸一氢铵 硫酸氢铵 酒石酸氢铵 碘酸铵 碘化铵 硝酸铵 高碘酸铵 草酸铵 高氯酸铵 高锰酸铵 磷酸铵 硒酸铵 硫酸铵 亚硫酸铵 化学式 Ac(OH)3 NH3 NH4N3 NH4C7H5O2 NH4HCO3 NH4Br (NH4)2CO3 NH4ClO3 NH4Cl (NH4)2PtCl6 (NH4)2CrO4 (NH4)2Cr2O7 NH4H2AsO4 NH4H2PO4 (NH4)2SiF6 NH4HCO2 (NH4)2HPO4 NH4HSO4 NH4HC4H4O6 NH4IO3 NH4I NH4NO3 (NH4)5IO6 (NH4)2C2O4 NH4ClO4 NH4MnO4 (NH4)3PO4 (NH4)2SeO4 (NH4)2SO4 (NH4)2SO3 96 70.6 47.9 105 73 54 2.2 12 3.21 16.4 155 118 163 150 1.88 102 42.9 62.9 29.4 0.289 25 18.2 33.7 22.7 39.5 33.2 0.374 29.2 25.5 11.9 60.6 16.1 68.1 0° C 88.5 16 10° C 70 20° C 4×10-4 56 25.3 20 21.7 76.4 100 28.7 37.2 0.499 34 35.6 48.7 37.4 18.6 143 68.9 100 2.7 2.6 172 192 2.7 4.45 21.7 0.8 26.1 115 75.4 60.8 126 78 68.8 6.09 37.7 182 242 75.1 46.4 41.4 0.637 39.3 46.5 28.4 83.2 30° C 44.5
常见酸碱盐溶解表℃

21.5
+溶K
溶112
31.6
溶
11.1
溶
34.7
溶
111.5
+溶Rb
117溶
53
溶
48
溶
91
溶
450
+溶Cs
330溶
23
溶
179
溶
186
溶
﹥500
2+难Be
溶
107
溶
39
溶
﹥500
2+难Mg
0.009溶
70
溶
33
溶
54.2
微
2+微Ca
0.165溶
129
微
0.21
溶
74.5
难
2+微Sr
溶0.8
71
3+In
微
0.04
溶
500﹥
——
——
+Tl
溶
18.6
微
0.05
难
0.0006
3+Tl
——
——
溶
溶
2+Ge
微
0.24
溶
——
——
溶
4+Ge
——
——
——
——
——
——
2+Sn
难
溶
溶
微
0.98
4+Sn
溶
500﹥
——
——
——
——
2+Pb
难
微
0.064
微
0.084
微
0.063
3+As
酸碱盐的溶解性表

说明:此为2(rc时的情况。
"溶"表示那种物质可溶于水, "不"表示不溶于水,"微"表示微溶于水,"挥"表示挥发性,表示那种物质不存在或遇到水就分解了背诵口诀1 •钾钠鞍盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶换不溶硝酸盐遇水影无踪钾钠锁钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:4初中用够了.红褐铁,代表铁盐沉淀为红褐色[fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2•氯化银【不溶酸】,碳酸钙,碳酸换,硫酸顿【不溶酸】,氢氧化铝.氢氧化镁,为白色沉淀。
氢氧化铁〔红褐色〕氢氧化铜〔蓝色〕说明【】内为前一物质的特点2•钾钠镀盐全都溶其他全都不能溶AgCL BaSO4酸也不溶-氧气的性质:4〕单质与氧气的反响:〔化合反响〕1. 镁在空气中燃烧:2Mg + 02点燃2MgO2. 铁在氧气中燃烧:3Fe + 202点燃Fe3O43.铜在空气中受热:2Cu + 02加热2CuO4.铝在空气中燃烧:4A! + 302点燃2AI2O35.氢气中空气中燃烧:2H2 + 02点燃2H2O6•红磷在空气中燃烧〔研究空气组成的实验〕:4P + 502点燃2P2O57. 硫粉在空气中燃烧:S + 02点燃SO28. 碳在氧气中充分燃烧:C+O2点燃CO29. 碳在氧气中不充分燃烧:2C + 02点燃2CO(2)化合物与氧气的反响:10. 一氧化碳在氧气中燃烧:2CO + 02点燃2CO211. 甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O12. 酒精在空气中燃烧:C2H5OH + 302点燃2CO2 +3H2O⑶氧气的来源:13 •玻义耳研究空气的成分实验2HgO加热Hg+ 02 t14 •加热高猛酸钾:2KMnO4协热K2MnO4 + MnO2 + 02 t〔实验室制氧气原理A15 •过氧化氢在二氧化猛作催化剂条件下分解反响:H2O2MnO22H2O+ 02 t〔实验室制氧气原理2]二自然界中的水:电2H2T+ 02 t17. 生石灰溶于水:CaO + H2O == Ca(OH)218. 二氧化碳可溶于水:H2O + CO2==H2CO319.镁在空气中燃烧:2Mg + 02点燃2MgO 21.氢气复原氧化铜:H2 + CuO加热Cu + H2O 22.镁复原氧化铜:Mg + CuO加热Cu + MgO四、碳和碳的氧化物:⑴碳的化学性质23.碳在氧气中充分燃烧:C + 02点燃CO2 24 .木炭复原氧化铜:C+ 2CuO高温2Cu + CO2t 25.焦炭复原氧化铁:3C+ 2Fe203高温4Fe + 3CO2T⑵煤炉中发生的三个反响:〔几个化合反响〕26 •煤炉的底层:C + 02点燃CO2 27.煤炉的中层:CO2 + C高温2CO 28.煤炉的上部蓝色火焰的产生:2CO + 02点燃2CO2⑶二氧化碳的制法与性质:29 •大理石与稀盐酸反响〔实验室制二氧化碳〕:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 30・碳酸不稳定而分解:H2CO3 == H2O + CO2t 31・二氧化碳可溶于水:H2O +CO2== H2CO332 •高温熾烧石灰石〔工业制二氧化碳〕:CaCO3高温CaO + CO2t 33 •石灰水与二氧化碳反响[鉴别二氧化碳〕:Ca(OH)2 + CO2 === CaCO3 1+ H2O⑵金属单质+盐+氢气 〔詈换反⑷一氧化碳的性质:34 . 一氧化碳复原氧化铜:CO + CuO 加热Cu + CO2 35. 一氧化碳的可燃性:2CO + 02点燃2CO2五燃料及其利用:37.甲烷在空气中燃烧:CH4 + 202点燃CO2 + 2H2O 38 •酒精在空气中燃烧:C2H5OH + 302点燃2CO2 + 3H2O 39.氢气中空气中燃烧:2H2 + 02点燃2H2O/u 金属(1)金属与氧气反响:40・镁在空气中燃烧:2Mg + 02点燃2MgO 41・铁在氧气中燃烧:3Fe + 202点燃Fe3O4 42. 铜在空气中受热:2Cu + 02加热2CuO43. 铝在空气中形成氧化膜:4A! + 302 = 2AI2O344. 锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2t 45. 铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2t 46. 镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2t 47. 铝和稀硫酸2AI +3H2SO4 = A!2(SO4)3 +3 H2!其它反响:Na2CO3辖幕醫Zn+ 2HC_n n znc_2+ H2T萍幕醫Fe+ 2HC一n n艮一2+H2T棘幕鬣Mg+ 2HC一n h Mgc_2+ H2T・茄君帝聆嬲2A_+ 6HC一nu2A_C一3+ 3 H2T二的翻般网+即〔两蒔〕..................鬓專+器 B 1B^8 - Fe + CCSO4n n FeSO4 +Cu盘〔匕霍+的a ...即+釧川〔总〔2〕糜+的醫喜....... 弱+为 56・ 咕e2O3+6HC一HH2Fec_3+3H257・$203 + 3H2SO4n n+ 3H2O58・ - a c o+ 2HC_Hucuc一2 + H2O59・ ^s s ss -aco+H2SO4n n CUSO4 + H.〔〕嬲+気弱;s ^s7二一(4)另一种酸61. 盐酸和氢氧化钙反响:2HCI + Ca(OH)2 == CaCI2 + 2H2O62. 氢氧化铝药物治疗胃酸过多:3HCI + AI(OH)3 == A/C/3 + 3H2O63. 硫酸和烧碱反响:H2SO4 + 2NaOH == Na2SO4 + 2H2O 64 .大理石与稀盐酸反响:CaCO3 + 2HC! == CaC!2 + H2O + CO2t 65碳酸钠与稀盐酸反响:Na2CO3 + 2HCI = = 2NaC! + H2O+ CO2t 66 •碳酸氢钠与稀盐酸反响:NaHCO3 + HC!== NaC! + H2O + CO2t67.硫酸和氯化坝溶液反响:H2SO4 + BaCI2== BaSO4 !+ 2HC!2、碱的化学性质⑴碱+非金属氧化物 .............. 盐+水68 •苛性钠暴露在空气中变质:2NaOH + CO2 == Na2CO3 + H2O69 •苛性钠吸收二氧化硫气体:2NaOH + SO2 == Na2SO3 + H2O盐+水74.铁和,铜溶液另一种酸70 •苛性钠吸收三氧化硫气体:2NaOH + SO3 == Na2SO4 + H2O71 •消石灰放在空气中变质:Ca(OH)2 + CO2二二CaCO3 I + H2O72.消石灰吸收二氧化硫:Ca(OH)2 + SO2 == CaSO3 1+ H2O〔3〕碱+盐 ......... 另_种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3l+ 2NaOH 3.盐的化学性质(1)盐〔溶液〕+金属单质・……另一种金属+另一种盐 75碳酸钠与稀盐酸反响:Na2CO3 + 2HCI==2NaCI + H2O + CO2t碳酸氢钠与稀盐酸反响:NaHCO3 + HC/== NaCI + H2O + CO2t⑶盐+碱 ............ 另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 == CaCO3!+ 2NaOH⑷盐+盐两种新盐77•氯化钠溶液和硝酸银溶液:NaCI + AgNO3二二AgClJ +〔2〕碱 +⑵盐+NaNO3 78・硫酸钠和氯化锁:Na2SO4 + BaC/2 == BaSO4l + 2NaC!钾钠硝钱均可溶.盐酸盐不溶AgCI.硫酸盐不溶BaSO4,碳•溶解性口诀一钾钠链盐溶水快,◎硫讎除去坝铅钙。
部分酸、碱和盐的溶解性表(室温)
“-”表示那种物质不存在或遇水就分解了。
'.三、元素周期表有关背诵口诀(1)元素周期表族背诵口诀氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动(2)元素周期表原子序数背诵口诀从前,有一个富裕人家,用鲤鱼皮捧碳,煮熟鸡蛋供养着有福气的奶妈,这家有个很美丽的女儿,叫桂林,不过她有两颗绿色的大门牙(哇,太恐怖了吧),后来只能嫁给了一个叫康太的反革命。
刚嫁入门的那天,就被小姑子号称“铁姑”狠狠地捏了一把,新娘一生气,当时就休克了。
这下不得了,娘家要上告了。
铁姑的老爸和她的哥哥夜入县太爷府,把大印假偷走一直往西跑,跑到一个仙人住的地方。
这里风景优美:彩色贝壳蓝蓝的河,一只乌鸦用一缕长长的白巾牵来一只鹅,因为它们不喜欢冬天,所以要去南方,一路上还相互提醒:南方多雨,要注意防雷啊。
在来把这个故事浓缩一下:第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)(那美女归你)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑(tī) ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧系铪(hā)----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂(bó)金汞铊铅 ---- 一白巾供它牵铋钋(pō)砹氡 ---- 必不爱冬(天)第七周期:钫(fāng)镭锕系 ---- 防雷啊!(3)化合价背诵口诀1. 一价氢氯钾钠银二价氧钙钡镁锌三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见2. 正一铜氢钾钠银正二铜镁钙钡锌三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷3. 正一氢银和钾钠正二钙镁钡锌汞和铜铝正三硅正四亚铁正二铁正三氯在最后负一价氧硫最后负二价'.四、元素周期表规律以下规律不适用于稀有气体。
常见物质溶解度表大全

常见物质溶解度表大全
一些物质的溶解度随温度的升高而增大,也有物质随温度的升高而降低,也有先升高,后降低的,今天小编整理了常见物质溶解度表大全,希望能帮助大家学习溶解度的知识!
1、氯化钠溶解度
2、氢氧化钙溶解度
3、硫酸钠溶解度
4、碳酸钠溶解度
5、碳酸氢钠溶解度
6、氯化钙溶解度
7、硫酸钙溶解度
8、氯化钾溶解度
9、硫酸铵溶解度
10、氯化铵溶解度
12、硫酸铜溶解度
13、氢氧化钾溶解度
以上就是我们常见以及常考到的一些物质的溶解度了,通过溶解度表,大家可以更加直观地判断物质的溶解度随温度升高而发生的变化。
常见酸、碱、盐溶解度表(20℃)[1]
溶解度
溶解性
溶解度
溶解性
溶解度
溶解性
溶解度
H+
溶
548
溶
溶
溶↑
微
NH4+
溶
溶
难
溶↑
溶
Li+
Na+
溶
溶
溶
溶
溶
K+
溶
溶
溶
溶
溶
Rb+
Cs+
Be2+
Mg2+
难
难
溶
难
Ca2+
难
0.002
难
难
难
Sr2+
Ba2+
难
难
难
Al3+
难
——
——
难
Ga3+
In3+
Tl+
Tl3+
Ge2+
Ge4+
Sn2+
——
——
——
——
370
溶
108
溶
97
溶
Be2+
溶
﹥500
溶
——
——
Mg2+
——
——
难
0.008
溶
102
溶
148
溶
Ca2+
——
——
难
0.0016
溶
142
溶
209
溶
Sr2+
微
0.012
溶
100
溶
178
溶
Ba2+
溶解度曲线及溶解度表
溶解度曲线及溶解度表1. 引言溶解度是指单位温度和压力下,溶质在溶剂中达到平衡时的最大溶解量。
溶解度曲线及溶解度表是描述物质在不同温度和压力下的溶解性的重要工具。
通过研究物质的溶解度曲线和制作相应的溶解度表,可以了解物质在不同条件下的溶解特性,为实际应用提供依据。
2. 溶解度曲线2.1 溶解度与温度关系物质的溶解度通常随着温度的升高而增大。
这是因为温度升高会增加分子热运动的速率和能量,使得分子间距离增大,从而有利于固体分子逃离晶格并进入溶液中。
以氯化钠(NaCl)为例,其在水中的溶解度随着温度升高而增大。
以下是氯化钠在不同温度下的溶解度数据:温度(℃)溶解度(g/100g水)0 35.710 38.220 40.730 43.340 45.82.2 溶解度与压力关系对于大部分固体物质来说,压力对其溶解度的影响并不显著。
但是对于气体溶解在液体中的情况,溶解度与压力成正比关系,即亨利定律。
亨利定律可以用来描述气体在液体中的溶解度。
以二氧化碳(CO2)在水中的溶解度为例,以下是二氧化碳在不同压力下的溶解度数据:压力(atm)溶解度(g/100g水)1 0.0392 0.0793 0.1184 0.1575 0.1973. 溶解度表溶解度表是一种将物质在不同温度和压力下的溶解度数据整理并呈现的表格。
通过查阅溶解度表,可以了解某种物质在特定条件下的最大溶解量。
以下是一份简单的氯化钠在不同温度下的溶解度表:温度(℃)溶解度(g/100g水)0 35.710 38.220 40.730 43.340 45.8通过这个溶解度表,我们可以看出在不同温度下氯化钠的溶解度变化情况。
例如,在0℃下,氯化钠的溶解度为35.7g/100g水,而在40℃下,氯化钠的溶解度增加到了45.8g/100g水。
4. 应用4.1 溶解过程控制通过研究物质的溶解度曲线和溶解度表,可以控制物质的溶解过程。
根据所需的溶液浓度和温度条件,可以确定需要加入的物质量,并且通过调整温度来控制物质的最终溶解量。
电解离子膜生产中的淡盐水脱氯
电解离子膜生产中的淡盐水脱氯摘要电解离子膜生产过程中的淡盐水含有游离氯,必须在回到一次盐水之前脱除所含游离氯。
本文就淡盐水脱氯的原理、方法、工艺流程进行了阐述,并讨论了脱氯系统的选用、技术改造及使用效果。
通过改造氯酸盐分解装置,降低了淡盐水中氯酸盐的含量,保证了烧碱产品质量及系统的稳定运行。
关键词:离子膜、淡盐水、脱氯Electrolytic production of caustic salt water dechlorinationAbstractThe membrane electrolysis of salt water in the production process containing free chlorine contained in the free chlorine to be removed once with brine before returning. In this paper, the principle of dilute brine dechlorination, methods, processes are described and discussed the selection, transformation and use of effects dechlorination system. Through the transformation of chlorate decomposition device, reducing the salt water content of chlorate, caustic soda to ensure the stable operation of the quality of products and systems.Kay words: Caustic, salt water, dechlorination目录摘要 (I)Abstract (II)1 文献综述 (1)1.1研究背景 (1)1.2研究现状 (1)2 淡盐水脱氯处理基本研究 (1)2.1 生产原理及工艺流程 (1)2.1.1淡盐水中游离氯的存在形态 (1)2.1.2 生产原理 (1)2.2真空脱氯原理 (2)2.2.1真空脱氯的原理 (2)2.2.2脱氯时加酸、加碱的作用 (3)2.2.3亚硫酸钠除氯 (4)2.3氯酸盐分解的原理 (5)3 脱氯生产工艺 (5)3.1 脱氯工艺 (5)3.2脱氯系统的选用 (5)3.2.1 真空脱氯装置的运行情况 (5)3.2.2 真空脱氯工艺的优缺点 (6)3.2.3 空气吹扫 (6)3.2.4 空气吹除脱氯运行情况 (7)3.2.5 空气吹除脱氯工艺的优缺点 (7)3.2.6 真空脱氯的选用 (7)4 优化脱氯工艺,降低氯酸盐含量 (7)4.1 氯酸盐分解槽的改造 (7)4.2 增设盐酸自动阀 (7)4.3 通过分解槽内底部增设压缩空气管网 (7)6 结论 (8)参考文献 (8)谢辞 (9)1 文献综述1.1研究背景离子膜法电解制烧碱技术是目前世界上最先进电解制烧碱技术。
高中化学盐溶解性表及元素周期表
高中化学盐溶解性表及元素周期表
1、酸碱盐溶解性表(20℃)
−
−
−
−
−
−
溶、挥
溶、挥
溶
溶、挥
+
溶
溶
溶
溶
溶、挥
+
溶
溶
溶
溶
溶
+
溶
溶
溶
溶
溶
+
溶
溶
不
白色
不
白色
溶
&色
不
白色
微
白色
+
溶
溶
溶
微
白色
不
白色
+
溶
溶
溶
---
不
白色
+
溶
溶
溶
不
白色
不
白色
+ 浅绿色
溶
溶
溶
不
白色
不
白色
+ 黄色或棕色
溶
溶
溶
---
不
棕或红褐色絮状
+ 蓝色
溶
溶
溶
---
不
蓝色絮状
溶
不
不
---
+
AgCl↓
常见沉淀
总结
白色
硝酸盐,都可溶
2、元素周期表
氯化物,银不溶
微
白色
↓
